传统泡菜中抗性乳酸菌的筛选及鉴定
刘思雨
肖 菁1,2,3
索化夷1,2,3
(1. 西南大学食品科学学院,重庆 400715;2. 食品科学与工程国家级实验教学示范中心〔西南大学〕,重庆 400715;3. 西南大学重庆市特色食品工程技术研究中心,重庆 400715)
传统泡菜中抗性乳酸菌的筛选及鉴定
刘思雨1,2,3
肖 菁1,2,3
索化夷1,2,3
(1. 西南大学食品科学学院,重庆 400715;2. 食品科学与工程国家级实验教学示范中心〔西南大学〕,重庆 400715;3. 西南大学重庆市特色食品工程技术研究中心,重庆 400715)
以传统泡菜中分离出的40 株乳酸菌为对象,通过耐酸、抗人工胃液和抗胆盐试验,确定传统泡菜中具有良好抗性的乳酸菌,并使用16S rDNA序列和系统发育树分析良好抗性乳酸菌的种属关系。试验结果表明,40 株乳酸菌中编号MFR-28和MFR-30两株菌对人工胃液和胆盐具有较强的耐受能力,其在人工胃液中的存活率分别为85.21%和90.47%,在0.3%胆盐中的生长效率分别为11.84%和7.37%;经16S rDNA序列和系统发育树分析,MFR-28和MFR-30均为干酪乳杆菌(Lactobacilluscasei)。该研究筛选出的2 株抗性干酪乳杆菌,可作为潜在益生菌进一步探索其生理功能,以期用于开发益生菌产品。
泡菜;乳酸菌;耐受能力;人工胃液;胆盐
中国传统发酵食品历经长时间自然发酵,其中含有大量未知、有待开发利用的乳酸菌资源,是筛选益生菌的重要来源[1]。泡菜作为中国传统发酵食品,西南地区居民都有制作泡菜的习惯,而由不同地区、不同工艺、不同蔬菜制成的泡菜,其中蕴含的乳酸菌菌属也各有不同。泡菜发酵过程中优势菌群主要为乳杆菌属和明串珠菌属[2-3]。有研究[4-5]表明,自泡菜中分离的乳酸菌大多数性状优良,能作为潜在益生菌。Yosep Ji等[4]通过研究菌株的功能特征及安全性评价,发现分离自泡菜的5 株植物乳杆菌均能作为潜在益生菌。Lee等[5]自泡菜中分离筛选出一株具有高抗菌活性的植物乳杆菌LHB55,可用于研制一种新型发酵剂。
益生菌是一类能在人体内产生有益作用的活性微生物,具有增强人体免疫力、调节胃肠道菌群、防止生殖系统感染、降低血清胆固醇、抗氧化、抗肿瘤等生理功能[6],常被用于食品[5]、医药[7]和饲料[8]等领域。当前,中国益生菌研究应用起步较晚,益生菌资源开发不足,市场上益生菌产品多依赖于国外菌种[9]。充分利用中国现有资源,筛选优良菌株,开发自主知识产权益生菌菌株和相关产品具有重要意义。益生菌在人体中发挥其益生功能得益于其优良的抗消化道环境胁迫能力,对益生菌株的筛选要优先考虑其克服胃液和胆盐胁迫的能力[10]。本试验通过对传统泡菜中的40 株乳酸菌进行抗人工胃液、抗胆盐能力研究,以期筛选出性能较好的菌株,为后续功能性开发、益生菌研究及应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
40株乳酸菌:从重庆市北碚区传统泡菜中分离,保藏于西南大学食品科学学院;
MRS肉汤培养基、琼脂、琼脂糖、胃蛋白酶1∶10 000、牛胆盐:生化试剂,北京索莱宝科技有限公司;
巯基乙酸钠、盐酸:分析纯,成都市科龙化工试剂厂;
50×TAE工作液(Solarbio)、λDNA/Hind Ⅲ、2×Taq PCR MasterMixAgar、100 bp DNA Ladder、6×DNA Loading Buffer、细菌基因组DNA提取试剂盒:天根生化科技(北京)有限公司;
上游引物(正向引物)27F(5-AGAGTTTGATCCTGGCTCA-3)、下游引物(反向引物)1495R(5-CTACGGCTACCTTGTTACGA-3):由生工生物工程(上海)股份有限公司合成。
1.1.2 主要仪器设备
洁净工作台:SW-CJ-2F型,苏州安泰空气技术有限公司;
恒温培养箱:GHP-9160型,上海齐欣科学仪器有限公司;
生物显微镜:OLYMPUS-BX43型,日本奥林巴斯公司;
高速冷冻式离心机:5810型,德国Eppendorf公司;
紫外分光光度计:BioSpec-Mini型,日本岛津公司;
pH计:PHS-3C型,上海仪电科学仪器股份有限公司;
梯度PCR 仪:S1000 Thermal Cycler型,美国Bio-Rad 公司;
小型水平电泳槽:Mini-Sub Cell GT型,美国Bio-Rad 公司;
凝胶成像系统:Gene Genius型,英国SynGene 公司。
1.2 方法
1.2.1 活化菌株 将-20 ℃、甘油保存的乳酸菌按2%的接种量接种到MRS液体培养基中,37 ℃摇床培养18 h,得到第一代菌液,于MRS固体培养基中进行划线培养,48 h后挑取单菌落进行涂片、革兰氏染色、镜检,初步判断各菌株是否为纯种乳酸菌。活化2次后的菌株放在4 ℃冰箱中备用。
1.2.2 初筛 取5 mL活化好的菌液3 000 r/min离心10 min,获得菌株沉淀,用无菌生理盐水洗涤2 次,再将菌泥重悬于5 mL 的无菌生理盐水中,制成菌浊液。用1 mol/L HCl调节MRS液体培养基至pH 3.0,接种2%活化好的乳酸菌菌悬液,于37 ℃静置培养24 h后,测其吸光值OD600 nm[11],选择在此条件下生长较好的菌株进行下一步试验。
1.2.3 抗人工胃液试验
(1) 人工胃液的配制:取一定量的蒸馏水,加入0.2%NaCl(质量浓度)、0.35%胃蛋白酶(质量浓度),充分溶解后用1 mol/L的盐酸调节溶液酸碱度至pH 3.0,再用0.22 μm微孔滤膜过滤除菌,所得无菌人工胃液需现配现用[12]。
(2) 取活化好的菌液5 mL,离心(3 000 r/min,10 min)获得菌株沉淀,用无菌生理盐水洗涤2 次,重悬于5 mL无菌生理盐水中制成菌浊液。菌浊液与人工胃液按1∶9(体积比)混合,于37 ℃分别处理0,3 h,处理后用生理盐水进行1∶10 倍稀释,采用涂布平板法进行活菌记数(37 ℃恒温培养48 h)。每组做3次平行试验,结果以“平均值±标准方差”来表示,按照式(1)计算菌株对人工胃液的耐受力[13]。

(1)
式中:
R——胃液中的存活率,%;
m1——处理3 h的活菌数,CFU/mL;
m2——处理0 h的活菌数,CFU/mL。
1.2.4 胆盐中生长效率的测定 选用在人工胃液中存活率大于50%的菌株进行该试验,按2%的接种量取活化好的乳酸菌菌液分别接种于含0.0%,0.05%,0.1%,0.2%,0.3%,0.5%,1.0%质量浓度的牛胆盐MRS-THIO液体培养基中(MRS液体培养基加0.2%的巯基乙酸钠),37 ℃摇床培养24 h,以未接种的MRS-THIO液体培养基为对照,对上述不同质量浓度液体培养基的OD600 nm值进行测定。每组做3次平行试验,结果以“平均值±标准方差”来表示,按照式(2)计算菌株对胆盐的耐受力[13-14]。

(2)
式中:
R——生长效率,%;
A1——含胆盐培养基OD600 nm;
A2——不含胆盐培养基OD600 nm。
1.2.5 优良乳酸菌16S rDNA 序列同源性分析 对人工胃液和胆盐耐受能力较强的乳酸菌进行16S rDNA 序列同源性分析,按照细菌基因组DNA提取试剂盒使用说明书提取总DNA。25 μL PCR反应体系为:10 μmol/L引物(1495R和27F)各1 μL、DNA模版1 μL、2×Taq PCR Master mix 12.5 μL、无菌超纯水9.5 μL。PCR反应程序[15]:94 ℃预变性5 min;94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸90 s,共30 次循环;72 ℃继续延伸10 min。反应结束后,取5 μL PCR产物用1.5%~2.0%的琼脂糖凝胶电泳进行检测,再将PCR 产物送华大科技有限公司测序,测序结果用NCBI中的BLAST程序进行同源性比对分析。
1.2.6 构建系统发育树 从GeneBank 中调取与所测乳酸菌16S rDNA序列较为相近的乳酸菌序列作为参考序列,用MEGA 6.0 软件中的Neighbor-Joining 方法构建抗性菌株的同源序列系统发育树[16]。
2 结果与分析
2.1 菌株活化
保藏于甘油(-20 ℃)中的乳酸菌,活化后结果见图1,菌株在平板上的菌落形态单一,可初步判定菌株为纯种。经革兰氏染色,镜检后,其细胞呈紫色且形态均一,表明其为革兰氏阳性菌且为纯种。因此,活化后的菌株可用于后续试验。

图1 菌落形态与菌株镜检图(MFR-38)
2.2 初筛试验
以菌液吸光度值为初筛依据。吸光值OD600 nm<0.050的菌液,认定为不生长(-),吸光值0.050
由表1可知,在pH 3.0的耐酸试验中,有23 株乳酸菌生长良好,7 株生长较差,其余10 株未生长。表明有30 株乳酸菌对酸性环境具有耐受性,因此选择这些菌株进行人工胃液试验。
2.3 人工胃液试验
人体消化道是人体对抗外界病原微生物的生理屏障,通过消化道的食物中绝大多数微生物都会失活。益生菌要想发挥其益生功能,就必须具备通过胃肠道并存活的能力。胃酸是胃液中的主要成分,能通过改变细胞膜的通透性,致使细菌裂解死亡。乳酸菌耐酸机制主要包括双组分信号转导系统,胞内外pH平衡调节,细胞膜脂肪酸成分变化,受损蛋白质、DNA修复能力等[18]。除胃酸之外,胃蛋白酶等物质也具有抗菌性。通过测定益生菌在模拟胃液中的存活率来判断其耐受能力,更符合实际意义。一般情况下,人体胃液pH常为3.0左右,食物通过胃的时间常为1~2 h,以人工胃液pH 3.0和作用时间3 h为筛选依据[13]。
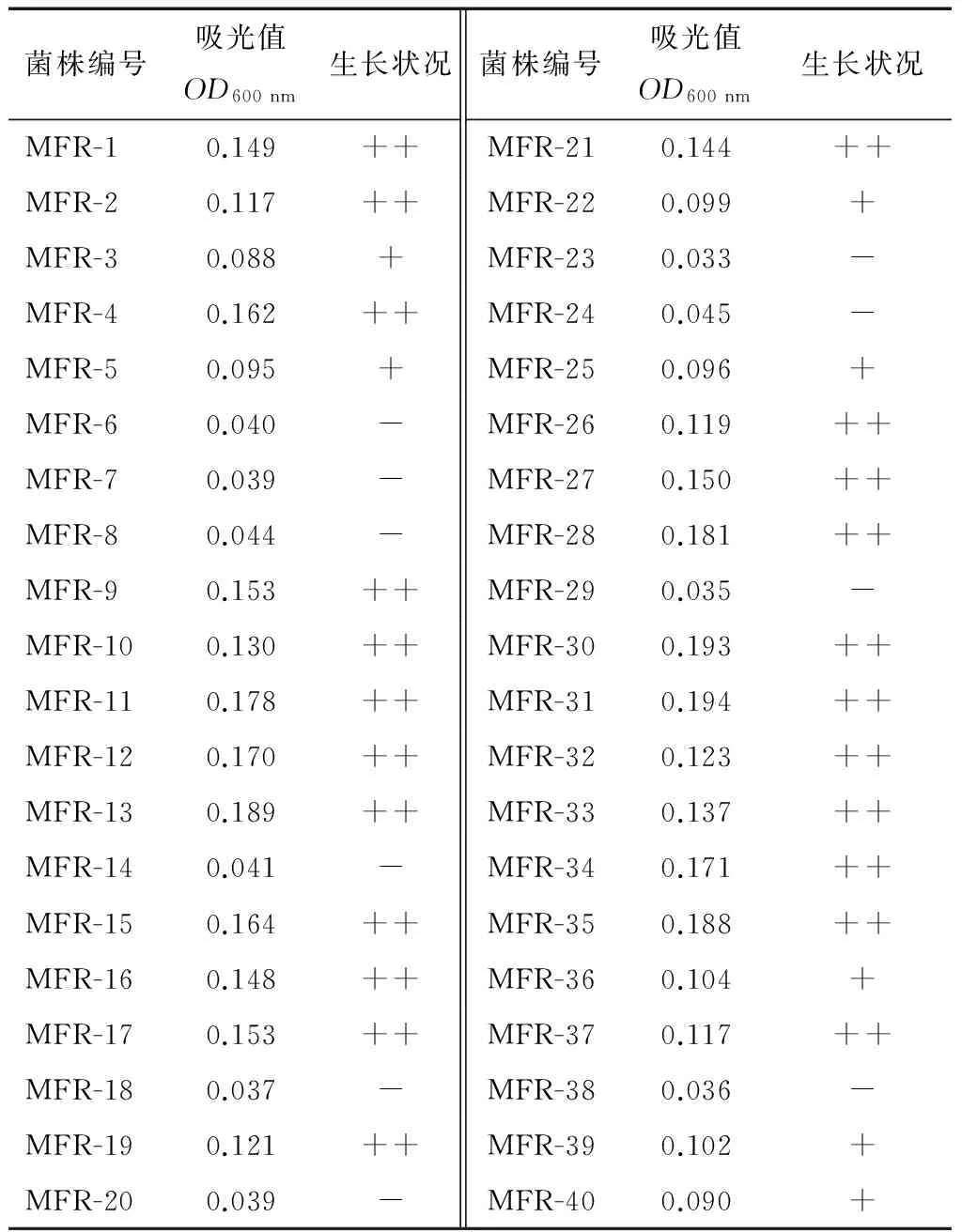
表1 菌液吸光度值的测定结果†
† “++”为生长良好,“+”为生长较差,“-”为不生长。
由表2可知,不同乳酸菌在人工胃液中的存活率是不同的,30 株乳酸菌中除去12 株未能存活,其余18 株的存活率都分别介于0.08%~90.47%,其中存活率>50%的乳酸菌有MFR-1、MFR-2、MFR-9、MFR-13、MFR-17、MFR-21、MFR-28和MFR-30,而存活率>80%的乳酸菌就只有MFR-28和MFR-30。熊强等[19]通过对自制泡菜中分离筛选出的6株植物乳杆菌进行模拟胃液试验,发现有4株菌的存活率在80%以上。Zielińska D等[20]研究泡菜黄瓜和白菜样品中15 株乳酸菌的抗胃液能力,发现所有菌株存活率均在95%左右。赵芳等[21]从健康人肠道和奶豆腐中初筛出8株乳酸菌,进行人工胃液试验,发现其存活率均低于15%,需进一步通过驯化提高其抗胃液能力。与之相比,自传统泡菜中分离筛选出的MFR-28和MFR-30在模拟胃液中的存活率均高于80%,分别为85.21% 和90.47%,具备较高的抗性。

表2 菌株对人工胃液耐受能力的测定结果
2.4 不同胆盐浓度下乳酸菌的生长效率
胆盐是由肝细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而形成的钠盐或钾盐,具有杀菌作用,在十二指肠中的质量浓度一般为0.03%~0.3%。抗胆盐能力是肠道微生物定值和发挥代谢活性的先决条件,能作为筛选益生菌的重要特征。研究表明乳酸菌耐胆盐机制主要与胆盐水解酶、表层蛋白、自身细胞膜等有关[18]。采用胆盐生长效率来评价菌株耐胆盐能力,与测定胆盐存活率和胆盐生长迟滞期等试验相比,更简便省时。本试验设计了0.05%,0.10%,0.20%,0.30%,0.50%,1.00% 6个胆盐浓度。
由表3可知,8 株乳酸菌在高胆盐浓度下,生长效率均受到抑制,可能是高盐环境至乳酸菌破裂死亡。陈孝勇等[13]从传统发酵牛乳中分离筛选出6株优良乳酸菌,其在0.3%胆盐中的生长效率均在20%~35%。南晓芳[22]从豆豉和腐乳样品中筛选出5株耐盐乳酸菌,其在0.3%胆盐中的生长效率均为10%~15%。相比之下,自泡菜中筛选出的菌株MFR-28和MFR-30具备一定的抗胆盐能力,在0.3%胆盐中的生长效率分别为11.84%和7.37%,说明2株菌种可以在该浓度胆盐条件下缓慢生长,可以作为潜在益生菌。为更准确地评价这2株菌的特性,还需进一步进行动物试验。

表3 菌株在胆盐中生长效率的测定结果
2.5 潜在益生菌株16S rDNA 的PCR扩增
经上述体外筛选试验,综合得出抗人工胃液和抗胆盐能力较强的菌株为MFR-28和MFR-30,并对其进行16S rDNA 序列同源性分析。由图2可知,PCR扩增产物在1 500 bp Marker 条带附件出现一条明亮的条带而无拖尾现象,阴性对照未见条带,说明PCR扩增成功,与预期效果相同。
16S rDNA序列分析可以确定微生物菌种之间的亲缘关系。当菌株之间的16S rDNA序列同源性高于97.5%时,认为它们为同种。由表4可知,MFR-28号和MFR-30号乳酸菌均为干酪乳杆菌(Lactobacilluscasei)且同源性都为100%。
2.6 系统发育树
由图3可知,MFR-28和MFR-30与干酪乳杆菌都聚在同一个分支上,同源性为100%,由此可判断出MFR-28和MFR-30均为干酪乳杆菌,乳酸菌菌株系统发育树分析结果与16S rDNA序列同源性分析结果是一致的。

M. 100 bp DNA Ladder 0. 阴性对照 1. MFR-28 2. MFR-30
Figure 2 Gel electrophoresis map of PCR amplification products of probiotics 16S rDNA

表4 抗性菌株的鉴定结果

图3 基于抗性菌株16S rDNA构建的系统发育树
3 结论
在40 株分离自传统泡菜的乳酸菌中筛选出2 株,分别为干酪乳杆菌(Lactobacilluscasei)MFR-28和干酪乳杆菌(Lactobacilluscasei)MFR-30,其对胃液和胆盐均具有良好的抗受性,在pH 3.0人工胃液中存活率分别为85.21%和90.47%,在0.3%的胆盐中生长效率分别为11.84%和7.37%。可作为潜在益生菌进一步对其进行功能评价,为研发益生菌制品提供了依据。
[1] HE Guo-qing, LIU Tong-jie, GU Jing-si, et al. Insights into the microbial diversity and community dynamics of Chinese traditional fermented foods from using high-throughput sequencing approaches[J]. Journal of Zhejiang University-SCIENCE B, 2017, 18(4): 289-302.
[2] 徐丹萍, 蒲彪, 敖晓琳, 等. 传统泡菜中乳酸菌的研究现状[J]. 食品工业科技, 2013(19): 369-372, 377.
[3] 潘晴, 曾小群, 彭刘杨, 等. 四川老坛泡菜中乳酸菌的分离与鉴定[J]. 宁波大学学报: 理工版, 2017, 30(2): 22-28.
[4] JI Y, KIM H, PARK H, et al. Functionality and safety of lactic bacterial strains from Korean kimchi[J]. Food Control, 2013, 31(2): 467-473.
[5] LEE S G, LEE Y J, KIM M K, et al. A study on the yogurt manufacture suitability and antimicrobial activity ofLactobacillusplantarumLHB55 isolated from Kimchi[J]. Journal of Animal Science and Technology, 2010, 52(2): 141-148.
[6] 霍恺. 乳杆菌旳益生特性研究[D]. 济南: 山东大学, 2015: 1-2.
[7] XIN Gan, JUAN Li. Research progress of the application of probiotics in preterm infants[J]. Chinese Journal of Contemporary Pediatrics, 2016, 18(9): 909-914.
[8] MIRBAKHSH M, AKHAVANSEPAHY A, AFSHARNASAB M, et al. Screening and evaluation of indigenous bacteria from the Persian Gulf as a probiotic and biocontrol agent against Vibrio harveyi in Litopenaeus vannamei post larvae[J]. Iranian Journal of Fisheries Sciences, 2013, 12(4): 873-886.
[9] 陈忠秀, 李嘉文, 赵扬, 等. 益生菌的应用现状和发展前景[J]. 中国微生态学杂志, 2016, 28(4): 493-496.
[10] BAO Yan, ZHANG Yan-chao, ZHANG Yong, et al. Screening of potential probiotic properties ofLactobacillusfermentumisolated from traditional dairy products[J]. Food Control, 2010, 21(5): 695-701.
[11] 冯秀娟, 左芳雷, 陈丽丽, 等. 乳酸菌耐酸耐胆盐分析与胆盐水解酶研究[J]. 中国食品学报, 2013(11): 139-147.
[12] 郭飞翔, 陈大卫, 石雪晨, 等. 分离的巴马人群肠道乳酸菌数量及功能性分析[J]. 食品研究与开发, 2015, 36(24): 164-167.
[13] 陈孝勇, 李键, 赵欣, 等. 传统发酵牦牛酸乳中益生性乳酸菌的体外筛选[J]. 食品与发酵工业, 2016(4): 85-90.
[14] 李清, 王英, 刘小莉, 等. 一株广谱抑菌活性乳酸菌的筛选及特性研究[J]. 微生物学通报, 2015, 42(2): 332-339.
[15] 杨吉霞, 张利玲, 蒋厚阳, 等. 眉山泡菜中乳酸菌的分离鉴定[J]. 食品科学, 2015, 36(17): 158-163.
[16] 赵翊, 王艳, 肖积兰, 等. 甘肃省益母草斑枯病病原鉴定[J]. 中药材, 2017(1): 29-31.
[17] 张和平, 孟和, 毕力格, 等. 分离自内蒙古传统发酵酸马奶中L.caseiZhang 潜在益生特性的研究[J]. 中国乳品工业, 2006, 34(4): 4-10.
[18] 胡爱华, 敖晓琳, 陈岑, 等. 乳酸菌耐酸耐胆盐机制的研究进展[J]. 食品工业科技, 2015, 36(8): 380-383.
[19] 熊强, 王凯, 王延斌. 植物乳杆菌的功能评价[J]. 生物加工过程, 2016, 14(6): 46-53.
[20] ZIELINSKA D, RZEPKOWSKA A, RADAWSKA A, et al. In vitro screening of selected probiotic properties ofLactobacillusstrainsisolated from traditional fermented cabbage and cucumber[J]. Current Microbiology, 2015, 70(2): 183-194.
[21] 赵芳, 李艳琴, 李彬春. 模拟人体胃肠道环境筛选益生乳杆菌[J]. 微生物学通报, 2016(6): 1 396-1 403.
[22] 南晓芳. 豆豉和腐乳中耐盐乳酸菌的筛选、鉴定及其功能特性研究[D]. 呼和浩特: 内蒙古农业大学, 2016: 31-32.
Screening and identification of resistant lactobacillus in traditional pickles
LIUSi-yu1,2,3
XIAOJing1,2,3
SUOHua-yi1,2,3
(1.CollegeofFoodScienceinSouthwestUniversity,Chongqing400715,China; 2.NationalDemonstrationCenterforExperimentalFoodScienceandTechnologyEducation,Chongqing400715,China; 3.ChongqingEngineeringResearchCenterofRegionalFood,Chongqing400715,China)
40 strains of actic acid bacteria isolated by traditional pickled cabbage were regarded as the object. Through the tests of acid resistance, anti gastric juice and bile salt resistance, actic acid bacteria with good resistance in traditional pickles were determined, using 16S rDNA sequence and phylogenetic tree to analyze the genus relationship of good resistance of lactic acid bacteria. The experimental results showed that MFR-28 and MFR-30 facing to artificial gastric juice and bile salt had a strong tolerance in 40 strains of actic acid bacteria, and survival rates in the artificial gastric juice were 85.21% and 90.47% respectively, and the growth of efficiency in 0.3% bile salt were 11.84% and 7.37% respectively; through the analysis of 16S rDNA sequence and phylogenetic tree, MFR-28 and MFR-30 wereLactobacilluscasei. In this study, 2 strains of resistantlactobacilluscaseican be used as potential probiotics to further explore their physiological functions and to develop probiotic products.
pickles;lactobacillus; tolerance; artificial gastric juice; bile salt
刘思雨,女,西南大学在读本科生。
索化夷(1978—),男,西南大学副教授,硕士生导师,博士。E-mail:birget@swu.edu.cn
2017—05—11
10.13652/j.issn.1003-5788.2017.07.006

