急性心肌梗死合并室间隔穿孔及并发心原性休克患者的临床特点及外科治疗预后
李汉美,刘燊,许建屏,吕锋,孙寒松,胡盛寿,宋云虎
冠心病研究
急性心肌梗死合并室间隔穿孔及并发心原性休克患者的临床特点及外科治疗预后
李汉美,刘燊*,许建屏,吕锋,孙寒松,胡盛寿,宋云虎
目的:本研究探索急性心肌梗死(AMI)后合并室间隔穿孔(VSR)及并发心原性休克患者的临床特点及外科治疗预后。
方法:回顾性分析我院外科2005-01至2015-05 AMI后VSR接受外科手术的患者77例,将患者分为休克组(52例),非休克组(25例),分析两组患者间临床特点及休克组患者的随访结果。
结果:两组患者均合并室壁瘤多发(73.0%,68.0%),VSR到手术时间分别为(34.4±18.6)天和(8.7±50.3)天,同期行冠状动脉旁路移植术占比分别为73.1%、72.0%;休克组较非休克组患者VSR开口大[(16.16±6.73)mm vs (11.86±4.62)mm],穿孔部位位于后室间隔的患者多(48.0% vs 24.0%),左心室射血分数较低[(45.0±8.8)% vs (47.9±12.3)%];休克组术前使用主动脉球囊反搏者(34.6% vs 0)、 血管活性药物(96.2% vs 28.0% )和急诊手术患者均较多(42.3% vs 8.0%),择期手术的患者少(57.7% vs 92.0%),差异均有统计学意义(P<0.05)。休克组患者住院死亡3例,平均随访(4.5±3.1)年,随访期间死亡2例。
结论:VSR较大及部位在后室间隔的患者易发生休克,外科治疗术后存活患者中期预后好。
心肌梗死,室间隔破裂;休克
(Chinese Circulation Journal, 2017,32:864.)
室间隔穿孔(VSR)是急性心肌梗死(AMI)严重并发症之一,约占AMI患者的1%~2%[1]。内科保守治疗效果差,单纯药物治疗1周、2个月死亡率分别是50%、87%[2]。手术治疗是公认有效的治疗方法,但手术风险和早期死亡率仍较高[3]。研究发现VSR患者合并休克时预后更差[2,4],但此类患者的临床特点文献鲜有报道。本研究探索AMI合并VSR及心原性休克患者的临床特点及外科治疗预后。
1 资料与方法
研究对象:连续入选阜外医院外科2005-01至2015-05期间AMI合并VSR接受修补术治疗的患者77例,男性47例(61.0%),平均年龄(63.0±8.7)岁。所有的患者均在术前或者术中接受冠状动脉造影术检查。
诊断与定义:VSR定义为:(1)AMI后查体发现胸骨左缘3~4肋间新出现的收缩期粗糙吹风样杂音;(2)超声心动图提示室间隔回声脱失,室水平左向右分流;(3)左心室造影发现VSR,造影剂从左心室分流至右心室。
分组:休克组(52例):收缩压低于90 mmHg(12.0 kPa,1 mmHg=0.133 kPa),或者原有高血压者其收缩压下降幅度超过30 mmHg(4.0 kPa);心率增加、脉搏细弱、面色苍白、肢体发凉、皮肤湿冷;有神志障碍;尿量每小时少于30 ml;心脏指数(CI)低于2 L/(min·m2)。非休克组(25例):定义为不符合上述标准的VSR患者。分析两组患者间临床特点及休克组患者的随访结果。
手术方法:所有患者均采用胸部正中切口开胸,常规建立体外循环,低温,阻断升主动脉。大部分患者均采用了经典的穿孔旷置技术,一部分患者因穿孔部位纤维化明显而行VSR直接缝合术。切口平行且远离前降支或者后降支1~2 cm切开左心室,将涤纶片缝合至室间隔未梗死心肌较低的部位及左心室前侧壁未梗死心肌的心内膜,从而将梗死的心肌与左心室隔绝,最后用2块Teflon毡片将左心室切口关闭。
统计学方法:采用SPSS 19.0统计软件进行统计处理。连续变量用平均值±标准差表达,分类变量采用百分比表达。具有正态分布的计量资料组间均值比较采用t检验,率的比较采用卡方检验。以P<0.05为差异有统计学意义。
2 结果
两组患者的临床资料比较(表1):两组患者男性比例、年龄、身高、体重、体重指数(BMI)、吸烟史、饮酒史、既往高血压、糖尿病史及是否既往有冠状动脉缺血史等,差异均无统计学意义(P>0.05)。休克组较非休克组患者VSR-手术的时间长[(34.4±18.6)天 vs (68.7±50.2)天],差异有统计学意义(P=0.026)。
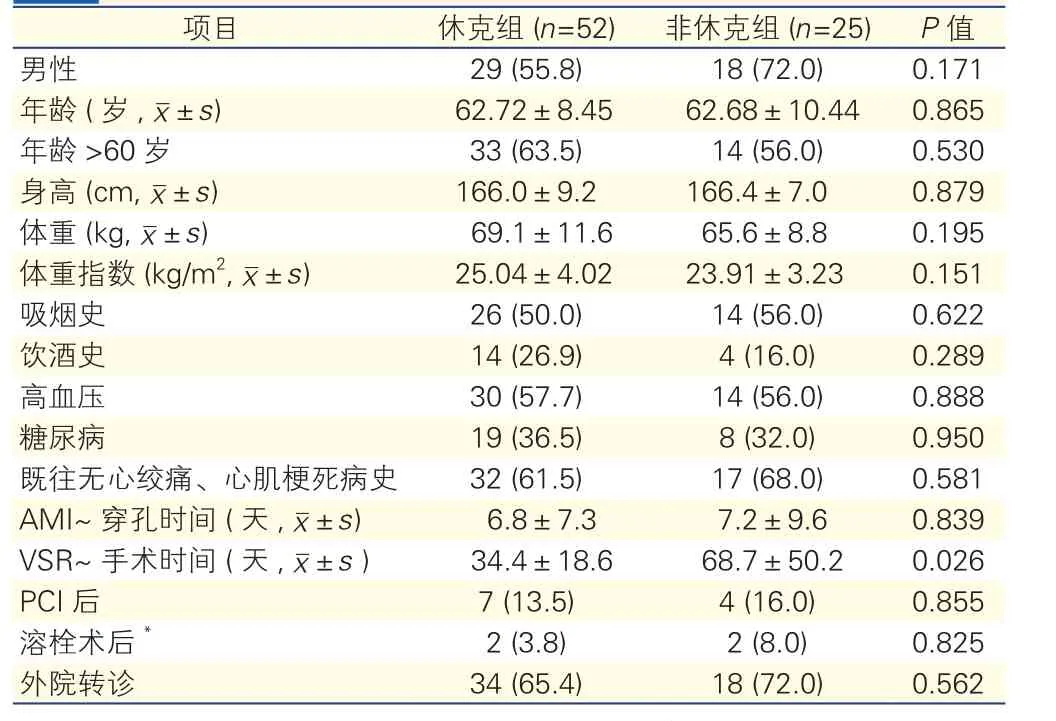
表1 两组患者的临床资料比较[例(%)]
两组患者冠状动脉造影结果的比较(表2):两组患者冠状动脉造影结果均差异无统计学意义(P>0.05),均有冠状动脉造影正常的患者,且100%闭塞较多见。
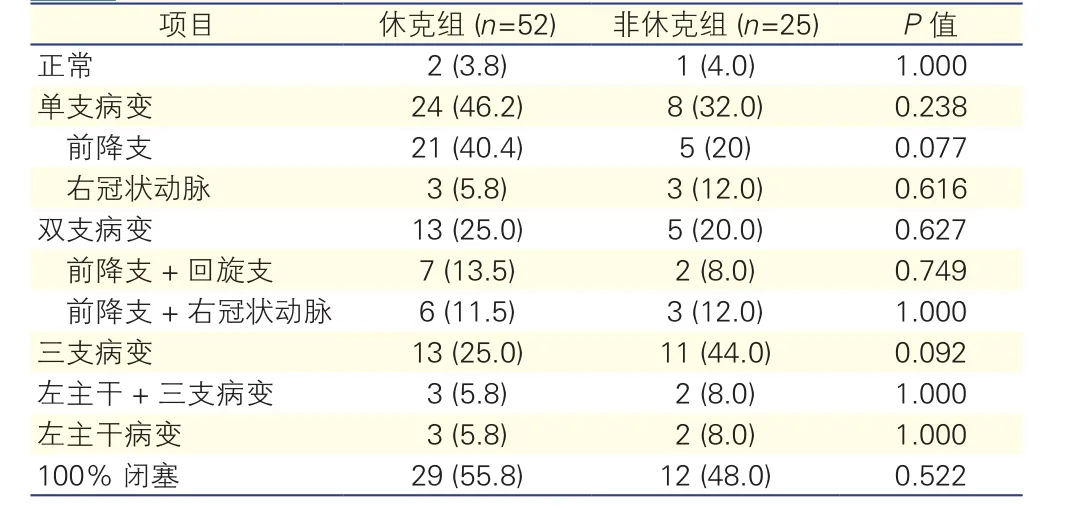
表2 两组患者冠状动脉造影结果的比较[例(%)]
两组患者超声检查结果的比较(表3):两组患者合并室壁瘤多发(73.0%,68.0%),休克组较非休克组穿孔部位位于后室间隔者多发,前室壁间隔少发, VSR开口较大,左心室射血分数较低,差异有统计学意义(P<0.05)。
表3 两组患者超声检查结果的比较[例(%),
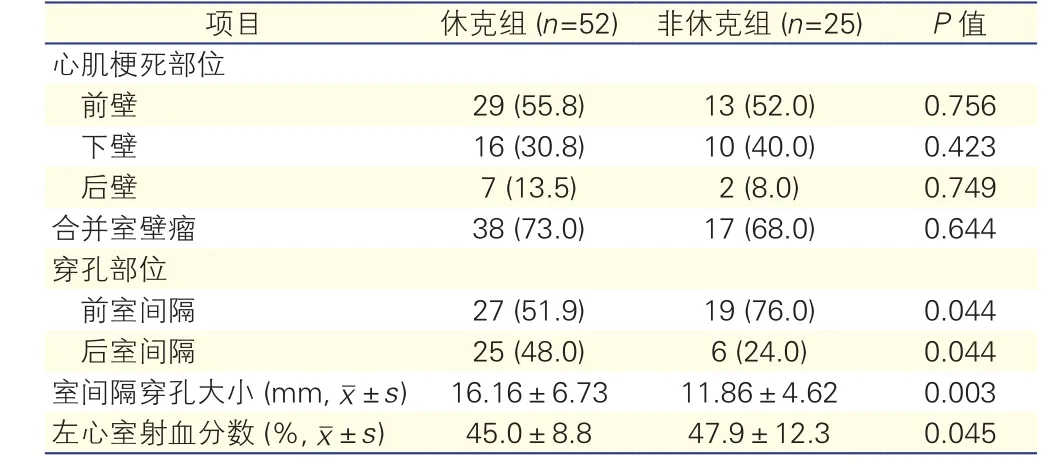
表3 两组患者超声检查结果的比较[例(%),
两组患者术前循环状态的比较(表4):休克组较非休克组术前使用IABP(P=0.001)、 血管活性药物(P=0.0001)和急诊手术患者(P=0.002)多,择期手术的患者少(P=0.002),差异均有统计学意义。
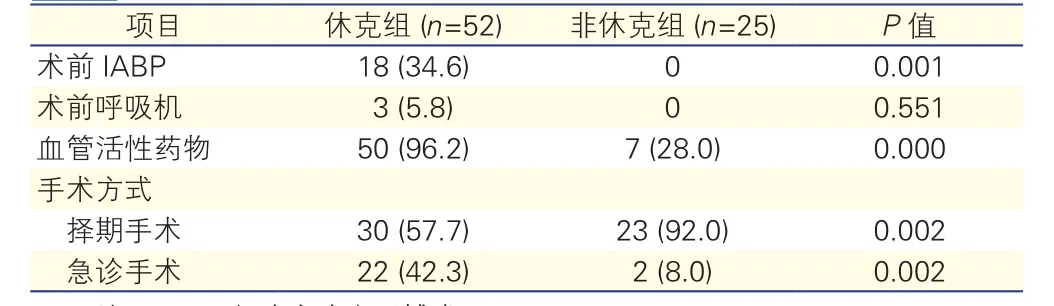
表4 两组患者术前循环状态的比较[例(%)]
两组患者术式的选择:两组患者术中情况的比较差异无统计学意义(表5)。休克组:除1例经右心室假性室壁瘤切口,1例经双心室切口外,其余50例患者均经左心室切口显露VSR,且合并有室壁瘤患者均切开室壁瘤以显露VSR。2例休克患者因穿孔部位室间隔组织脆弱易脱落同期切除坏死室间隔组织,5例患者因穿孔部位纤维化明显而行VSR直接缝合术,其余45例患者均采用了经典的穿孔旷置技术;38例同期行冠状动脉旁路移植术(CABG)。非休克组:4例行VSR直接缝合术,21例行穿孔旷置技术;18例同期行CABG。
表5 两组患者术中情况的比较[例(%),
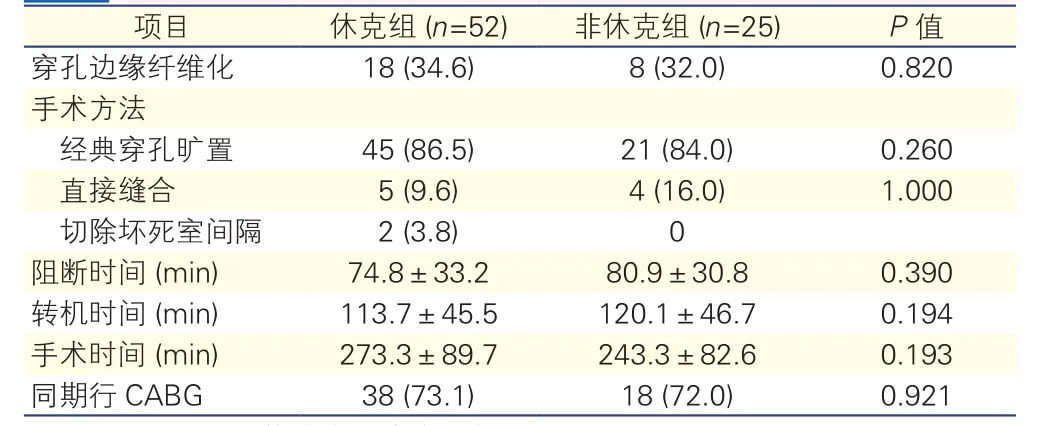
表5 两组患者术中情况的比较[例(%),
注:CABG:冠状动脉旁路移植术
两组患者术后资料比较(表6):休克组患者较非休克组呼吸机使用时间明显延长(P=0.003),ICU时间及住院时间均延长(P=0.021及P=0.017),住院费用也高(P=0.0001),差异均有统计学意义。两组患者术中及术后超声心动图检查,均没有室间隔残余分流发生。休克组患者住院死亡3例,均为IABP支持下循环难以维持而接受急诊手术治疗的患者。死亡患者中2例因VSR部位组织质脆易脱落而切除坏死室间隔组织,1例采用经典的穿孔旷置技术。休克组生存患者49例,失访2例,平均随访(4.5±3.1)年,死亡2例(1例死于妇科肿瘤,1例死于消化道肿瘤),非休克组无死亡病例。
表6 两组患者术后资料比较(
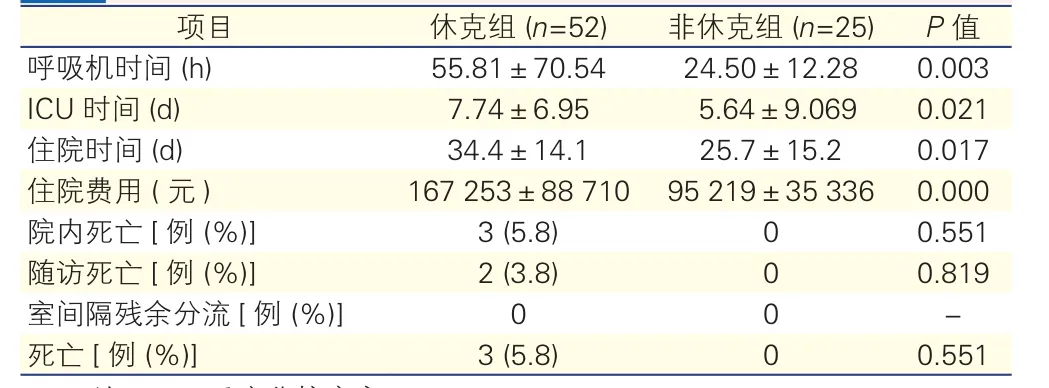
表6 两组患者术后资料比较(
注:ICU:重症监护病房
3 讨论
通过回顾性分析本中心的VSR患者,两组患者性别、年龄、吸烟史、饮酒史、既往高血压、糖尿病史及是否有冠状动脉缺血史等基础资料无明显差异。休克组穿孔-手术的时间明显较非休克组短,这是因为非休克组患者循环稳定,可以等待更长的时间[5]。在心肌再灌注治疗开展以前,穿孔平均发生时间在心肌梗死后的1周左右[1],在开展溶栓治疗之后VSR平均发生时间提前到AMI后的1天左右[4,6]。本研究中两组患者AMI-穿孔时间均为1周左右,可能是由于两组患者接受溶栓或PCI的心肌再灌注治疗较少,只有12例(3例患者先后均接受溶栓及PCI术)。两组患者穿孔-手术时间明显较其他中心报道的时间长[7],可能一是因为相当一部分患者由外院转诊来的有关,二是与我们采用积极的治疗方法尽可能的延长穿孔-手术时间有关[5]。
两组患者均在术前或者术中接受冠状动脉造影术检查,38例患者造影检查时静脉使用血管活性药物即可稳定循环,20例患者虽经血管活性药物的支持循环仍不稳定,为避免造影过程中循环突然恶化需同期行IABP支持治疗,1例循环不稳定患者选择在杂交手术室行术中同期造影术检查。结果显示41例(53.2%)为100%闭塞病变[1,8]。冠状动脉粥样硬化如病变局限且进展缓慢,则病变血管与邻近冠状动脉之间建立有效的侧支循环,受累区域的心肌仍能得到足够的血液供应。若冠状动脉血供突然中断,侧支循环未来得及充分建立.则可导致严重的心肌梗死。大量的嗜中性粒细胞进入坏死区域,凋亡后释放溶解酶,加速梗死心肌的破坏,从而导致VSR的发生[9]。本中心的研究也进一步验证了以前的发现,100%闭塞的病变更易导致VSR的发生。VSR直径大的患者由于分流量多,短期内显著加重心脏负担,导致循环恶化,从而发生休克[10]。本研究提示后室间隔VSR患者更易发生休克,这与目前大部分文献报道相一致[7]。
1956年Cooley首次成功地修补了一例AMI后VSR 9周的患者[11],其后人们对VSR外科治疗的手术方式进行了坚持不懈的探索。传统的手术方式包括坏死组织的彻底清除及室间隔、左右心室的重建,这种技术的缺点是恶化了左右心室功能,从而导致了较高的手术死亡率。从1987年起人们开始应用一种全新的经典的梗死心肌旷置技术,它并不切除梗死组织,而是用心包片使梗死组织与左心室腔相隔离。由于它不损伤右心室,而且恢复了左心室的几何学结构,使手术死亡率降低至13.5%[12]。本研究休克组2例患者因穿孔部位室间隔组织脆弱易脱落同期切除坏死室间隔组织,5例患者因穿孔部位纤维化明显而行VSR直接缝合术,其余45例患者均采用了经典的穿孔旷置技术。2例因VSR部位组织质脆易脱落而切除坏死室间隔组织者术后均死亡,采用经典的穿孔旷置技术仅有1例术后死亡。非休克组患者有4例行VSR直接缝合术,21例行穿孔旷置技术,无手术死亡。两组患者均无室水平残余瘘。这和目前大部分文献报道的手术治疗的效果相比[4,6,7],死亡率明显偏低,可能是因为这两组病例穿孔-手术时间较长,穿孔周围组织纤维化,手术难度降低[5]。另外,经长时间的调整,患者术前循环状态稳定,也降低了手术风险。
美国心脏病学会对于AMI伴VSR治疗的指导标准是:除非患者不愿接受手术治疗或有手术禁忌,否则应对VSR的患者进行急诊手术[13]。考虑到目前IABP等机械辅助的广泛应用可以使相当一部分患者循环稳定,从而延长穿孔-手术时间降低死亡率[5];同时一部分VSR患者可以毫无征兆的循环恶化[13]。所以本中心的治疗策略是采用个体化治疗方案,手术时机根据患者的循环状态而定,尽可能的延长穿孔-手术时间。如患者无休克,则在严密监测的基础上延长手术时间至3~4周或者更长。如患者循环不稳定,则应首先给予血管活性药物甚至IABP支持治疗;如果经IABP等积极治疗后循环趋于稳定,则应延长穿孔-手术时间,择期手术治疗;如果在经IABP等积极治疗后,循环仍不稳定,则应急诊手术治疗。休克组患者急诊手术22例,穿孔-手术时间为(34.4±18.6)天,而非休克组患者有2例急诊手术,穿孔-手术时间为(68.7±50.2)天,两组间具有显著统计学意义。VSR的择期手术治疗效果较急诊手术有明显提高,这是因为择期手术时VSR周围的坏死组织已经纤维化,同时患者的血流动力学一般都较平稳[5,10]。
休克组患者手术死亡3例,这3例患者都是IABP支持下循环难以维持,采用急诊手术治疗。2例术中切除质脆的梗死心肌,1例采用了经典的穿孔旷置技术,这3例术后均死于低心排综合征。非休克组无手术相关死亡。非休克组患者死亡率较休克组低,但并无明显统计学差异,可能是因为样本量偏低,但也可能与两组患者穿孔-手术时间均延长有关。休克组患者术后ICU时间、呼吸机使用时间、住院时间及住院花费均较非休克组低,具有显著统计学差异。
尽管有文献提示VSR患者由于循环不稳定,可以术前不行冠状动脉造影术检查,术中行CABG无明显获益[14]。但本中心所有的患者常规术前或术中行冠状动脉造影术检查,并在术中对冠状动脉病变明显的患者行CABG,用以减少术后冠状动脉相关不良事件的发生,改善中远期预后。本中心平均随访(4.6±3.1)年,两组均无心脏病相关死亡,效果较好,进一步证实了冠状动脉旁路移植术的必要性[5,15]。
有研究显示,VSR后死亡率为41%~81%[4,7]。本研究的死亡率较低,可能存在选择性偏移,即能接受手术的或许是病情相对较轻的患者。而且休克组由外院转诊而来患者所占比较高(65.4%),可能自然筛选了一部分病情偏轻的患者。
综上所述,穿孔较大及后室间隔穿孔患者易发生休克,外科治疗术后存活患者预后好。但由于我们的研究是回顾性研究,难免会存在一定的偏倚,而且样本量较小,统计效力也受到一定影响,未来需要更大样本量更长随访时间来对我们的研究结果加以验证。
参考文献
[1] Topaz O, Taylor AL. Interventricular septul rupture complicating acute myocardial infarction: from pathophysiologic features to the role of invasive and noninvasive diagnostic modalities in current management. Am J Med, 1992, 93: 683-688.
[2] Skillington PD, Davis RH, Luff AD, et al. Surgical treatment for infarct-related ventricular septal defects: improved early results combined with analysis of late functional status. J Thorac Cardiovasc Surg, 1990, 99: 798-808.
[3] Moreyra AE, Huang MS, Wilson AC, et al. Trends in incidence and mortality rates of ventricular septal rupture during acute myocardial infarction. Am J Cardiol, 2010, 106: 1095-1100.
[4] Menon V, Webb JG, Hillis LJ, et a1. Outcome and profile of ventricular septal rupture with cardiogenic shock after myocardial infarction: a report from the Shock Trial Registry. J Am Coll Cardiol, 2000, 36: 1110-1116.
[5] 许建屏, 王立清, 陈雷, 等 . 心肌梗死后室间隔穿孔的外科治疗-附16例临床报告. 中国循环杂志, 2002, 17: 138-140.
[6] Crenshaw BS, Granger CB, Birnbaum Y, et a1. Risk factors, angiographic patterns, and outcomes in patients with ventricular septal defect complicating acute myocardial infarction. Circulation, 2000, 101: 27-32.
[7] Jeppsson A, Liden H, Johnsson P, et al. Surgical repair of post infarction ventricular septal defects: a national experience. Eur J Cardiothorac Surg, 2005, 27: 216-221.
[8] Prêtre R, Rickli H, Ye Q, et al. Frequency of collateral blood flow in the infarct-related coronary artery in rupture of the ventricular septum after acute myocardial infarction. Am J Cardiol, 2000, 85: 497-499.
[9] Birnbaum Y, Fishbein MC, Blanche C, et a1. Ventricular septal rupture after acute myocardial infarction. N Engl J Med, 2002, 347: 1426-1432.
[10] 李汉美, 孙晓刚. 急性心肌梗死后室间隔穿孔. 中国循环杂志, 2009, 24 : 398-400.
[11] Cooley DA, Belmonte BA, Zeis LB, et al. Surgical repair of ruptured interventricular septum following acute myocardial infarction. Surgery, 1957, 41: 930-937.
[12] David TE, Dale L, Sun Z. Postinfarction ventricular septal rupture: repair by endocardial patch with infarct exclusion. J Thorac Cardiovasc Surg, 1995, 110: 1315-1322.
[13] Antman EM, Anbe DT, Armstrong PW, et al. ACC/AHA guidelines for the management of patients with ST-elevation myocardial infarction--executive summary. A report of the American College of Cardiology/ American HeartAssociation Task Force on Practice Guidelines (Writing Committee to revise the 1999guidelines for the management of patients with acute myocardial infarction). J Am Coll Cardiol, 2004, 44: 671-719.
[14] Abu-Omar Y, Bhinda P, Choong CK, et al. Survival after surgical repair of ischemic ventricular septal rupture. Asian Cardiovasc Thorac Ann, 2012, 20: 404-408.
[15] Barker TA, Ramnarine IR, Woo EB, et al. Repair of post-infarct ventricular septal defect with or without coronary artery bypass grafting in the northwest of England: a 5-year multi-institutional experience. Eur J Cardiothorac Surg, 2003, 24: 940-946.
Clinical Features, Surgical Treatment and Prognosis in Acute Myocardial Infarction Patients With Ventricular Septal Rupture Complicating Cardiogenic Shock
LI Han-mei, LIU Shen, XU Jian-ping, LV Feng, SUN Han-song, HU Sheng-shou, SONG Yun-hu.
Department of Cardiac Surgery, Cardiovascular Institute and Fu Wai Hospital, CAMS and PUMC, Beijing (100037), China
Objective: To explore the clinical features, surgical treatment and prognosis in acute myocardial infarction (AMI) patients with ventricular septal rupture (VSR) complicating cardiogenic shock (CS).
surgical repair in our hospital from 2005-01 to 2015-05 were retrospectively studied. The patients were divided into 2 groups: CS group n=52 and Without CS group, n=25. Clinical features were compared between 2 groups and the outcomes in CS group were analyzed.
Results: Both groups showed multiple aneurysm (73.0% vs 68.0%); CS was more occurred in patients with posterior VSR (48.0% vs 24.0%), P=0.044. Compared to Without CS group, CS group had the larger diameter of VSR (16.16±6.73) mm vs (11.86±4.62) mm, P=0.003; lower LVEF (45.0±8.8) % vs (47.9±12.3) %, higher pre-operative application rates of IABP (34.6% vs 0%) and vasoactive drugs (96.2% vs 28.0%), more patients
emergent surgery (42.3% vs 8.0%) and less patients received elective surgery (57.7% vs 92.0%), all P<0.05. In CS group, there were 3 in-hospital death, 49 patients survived with the mean follow-up time at (4.5±3.1) years and 2 patients died during that period.
Conclusion: Larger or posterior VSR were more likely to develop CS, the patients survived after surgical treatment may have good mid-term outcomes.
Myocardial infarction, Ventricular septal rupture; Shock
SONG Yun-hu, Email: heartcenter_song@hotmail.com
2017-05-13)
(编辑: 曹洪红)
100037 北京市,中国医学科学院 北京协和医学院 国家心血管病中心 阜外医院 成人外科中心
李汉美 主治医师 硕士 主要从事心血管外科方面研究 Email: lihanmei123@163.com 通讯作者:宋云虎 heartcenter_song@hotmail.com*共同第一作者
R541
A
1000-3614(2017)09-0864-05
10.3969/j.issn.1000-3614.2017. 09.008

