双胎输血综合征胎儿和生后2天脑损伤的队列研究
唐 英 罗 红 母得志 杨太珠 朱 琦 鲍 珊
·论著·
双胎输血综合征胎儿和生后2天脑损伤的队列研究
唐 英 罗 红 母得志 杨太珠 朱 琦 鲍 珊
目的 验证双胎输血综合征(TTTS)新生儿脑损伤起源于宫内还是宫外。方法 前瞻性队列研究设计,在同一医院以超声作为TTTS、颅内出血和脑室周围白质软化的诊断工具,纳入孕34周前分娩的接受双胎儿颅脑超声和生后2 d内新生儿颅脑超声检查的TTTS孕妇。排除双胎儿均宫内死亡和双胎之一严重结构异常或染色体异常。结果 47例TTTS孕妇的94例胎儿进入本文分析,孕妇中位年龄31 (18~46) 岁,TTTS诊断孕周16~28周,终止妊娠孕周28~33+5周。QuinteroⅠ、Ⅱ、Ⅲ、Ⅳ和Ⅴ期分别为7、9、17、8和6例。Ⅴ期6例胎儿期死亡,6例存活胎儿均发生颅内出血合并脑白质软化。88例胎儿超声发现19例脑损伤(21.6%),受血儿5例,供血儿14例,受血儿26.3%vs供血儿 73.6%,差异有统计学意义(P<0.05)。TTTS的Ⅲ~Ⅴ级脑损伤17例,Ⅰ~Ⅱ级2例,Ⅲ~Ⅴ级30.3%vsⅠ~Ⅱ6.2%,差异有统计学意义(P<0.05)。孕19~28周接受羊水减量术治疗13/47例(27.7%),均未在治疗后新发现脑损伤。88例均为早产儿,胎龄(30.5±4.5)周。受血儿体重(1 607±438)g,供血儿体重(1 257±403)g,生后24 h因新生儿窒息死亡4例。84例早产儿中头颅超声发现24例脑损伤(28.6%),受血儿9例,供血儿15例,受血儿37.5%vs供血儿 62.5%,差异有统计学意义(P<0.05)。颅内出血Ⅰ级5例,均为生后诊断且不合并脑白质软化。颅内出血Ⅱ级中,胎儿阶段11例,新生儿阶段增加了4例颅内出血Ⅱ级,其中1例合并脑白质软化,3例转为颅内出血Ⅲ级伴脑白质软化,无死亡。颅内出血Ⅲ级中,胎儿阶段5例均合并脑白质软化,新生儿阶段5例,3例由颅内出血Ⅱ级进展,死亡1例。颅内出血Ⅳ级中,胎儿阶段3例均合并脑白质软化,新生儿阶段2例均由颅内出血Ⅲ级进展,均死亡。结论 TTTS胎儿产前脑受损已出现,与早产共同造成脑损伤,以脑室出血、脑室白质软化为多见。对于所有存活儿都应该进行产前规范的超声监测及生后及时的新生儿头颅超声筛查。
超声; 双胎输血综合征; 脑损伤; 预后; 早产儿
双胎脑损伤是单胎的7倍,而单绒毛膜双胎发生的脑白质受损、颅内出血以及由此导致的远期脑损伤是双绒毛膜双胎的7倍[1-3]。特别引起广大研究者关注的是双胎输血综合征(TTTS),20%~30%的单绒毛膜双胎会发生TTTS,其中约15%发生宫内死亡,未经适时治疗80%~90%存活儿发生心血管和神经系统致残[4-6]。 TTTS脑损伤的发生机制不明,有学者认为TTTS脑损伤在宫内已经发生,由于双胎胎盘的异常血管吻合,导致双胎间发生异常的血液输送,尤其当一胎宫内死亡,其风险立刻增加18%[7]。然而,TTTS常发生早产,早产本身或低出生体重也会导致新生儿发生颅内损伤或加重颅内损伤。目前,国外对TTTS脑损伤的研究较多[8-10],并且通过早产新生儿阶段影像学检查来推测TTTS宫内损伤状态。有研究报道,TTTS胎儿宫内脑损伤情况,但未连续观察至新生儿阶段。本文连续观察TTTS胎儿宫内及出生后颅脑影像学表现,以了解脑损伤起源和情况。
1 方法
1.1 研究设计 以前瞻性队列研究设计,纳入TTTS孕妇,对宫内胎儿和生后2 d早产儿以超声为检测手段,验证TTTS新生儿脑损伤是起源于宫内还是宫外。
1.2 研究对象纳入标准 ①孕妇于产前在四川大学华西第二医院(我院)接受双胎儿颅脑超声检查、生后2 d内接受新生儿颅脑超声检查;②于孕34周前分娩的TTTS孕妇,产后胎盘检查确诊为TTTS。
1.3 研究对象排除标准 ①双胎儿均宫内死亡;②双胎之一或全部严重结构异常(如严重的开放性神经管缺陷、肢体缺如、严重唇腭裂、严重先天性心脏病等)或染色体异常;③孕18周前引产孕妇;④孕妇合并严重全身脏器疾病或有重大家族遗传病史;⑤失访病例。
1.4 伦理、知情同意 本研究通过了伦理委员会的审核(JS-833),行胎儿和新生儿颅脑超声均与受检孕妇签署书面知情同意书。
1.5 诊断标准
1.5.1 绒毛膜性的判断 孕14周前,超声检查判断双胎为单绒毛膜双羊膜囊。
1.5.2 TTTS诊断和分期 Quintero[6]分期:Ⅰ期:羊水过多或过少(深度>8 cm或<2 cm);Ⅱ期: 供血儿膀胱未显示; Ⅲ期: 多普勒超声检查异常(下列情况之一:①脐动脉舒张末期血流反流或缺失,②静脉导管血流a波反向,③脐静脉出现搏动征);Ⅳ期:胎儿水肿;Ⅴ期:胎儿宫内死亡。
1.5.3 胎儿及新生儿颅内出血(PIVH)诊断和分级 依据Ghi等[11]分级诊断标准:Ⅰ级:出血仅限于室管膜区;Ⅱ级:明显的脑室内出血,但范围≤一侧侧脑室的 50%,不伴脑室扩张,脑室宽度<15 mm;Ⅲ级:脑室内出血范围≥一侧侧脑室的一半或累及双侧脑室,脑室宽度≥15 mm;Ⅳ级:在Ⅰ/Ⅱ/Ⅲ级基础上伴脑室周围实质内出血。
1.5.4 胎儿及新生儿脑室周围白质软化分级(PVL)[12]胎儿期双侧脑室周围局部强回声或囊性回声持续或>7 d,范围可广泛遍布脑部,也可局限在侧脑室旁。新生儿PVL分为 4 级,Ⅰ级:双侧脑室周围局部强回声,持续或>7 d,其后无囊腔出现;Ⅱ级:双侧脑室周围局部强回声,数周后转变为小囊腔改变(多位于顶枕部),不伴神经系统症状;Ⅲ级:双侧脑室周围广泛强回声,数周后转变为广泛囊腔改变;Ⅳ级:双侧脑室周围广泛性强回声,并涉及皮质下浅表白质,转变为脑室周围和皮质下浅表白质弥漫性囊腔改变。
1.5.5 新生儿脑损伤诊断和分度 ①轻度脑损伤包括:Ⅰ、Ⅱ级PIVH和室管膜下假性囊肿。②严重脑损伤:Ⅲ、Ⅳ级PIVH 、脑室旁出血性梗死、PVLⅡ级以上、脑穿通性囊肿、动脉栓塞、侧脑室严重扩张中的一或多项。
1.6 影像学检查 本研究以超声作为胎儿和生后2 d新生儿PIVH、PVL的影像学诊断工具,均在我院进行,异常病例需要2位医生共同诊断。2位医生有异议的可疑病例,行胎儿或新生儿头颅MRI检查。
1.6.1 TTTS胎儿超声检查方法 采用Voluson 730、E8、IU22彩色多普勒超声诊断仪(美国GE 公司和荷兰PHLIPS公司生产)经腹(必要时联合经腔内)超声扫查。包括一般扫查及胎儿器官系统扫查:扫查宫腔,检查胎儿个数、是否存活,测量双胎儿头围、双顶径、腹围和股骨长等生长指标;记录胎盘厚度、实质回声、胎盘下缘位置、羊水量和脐带插入情况。对胎儿各器官系统进行细致扫查,详细记录各器官系统相关情况;注重双胎儿头颅扫查,包括颅骨结构、骨化程度等。脑内结构包括大脑镰、侧脑室、第三脑室、第四脑室、大脑皮质、丘脑、胼胝体、小脑、小脑蚓部和后颅窝池等结构。
1.6.2 TTTS早产新生儿头颅超声检查方法 采用床旁彩超(韩国三星公司麦迪逊M7)。由一位医生专门进行检测,通过新生儿前囟、蝶囟和后囟进行扫查,观察脑室系统、脑实质、沟回、脉络丛、脑室周围白质、外侧裂、小脑、胼胝体、丘脑尾状核沟、基底节、颞叶后部、枕叶、第四脑室、小脑和小脑延髓池等,记录诊断。
1.7 TTTS临床诊疗常规 我院TTTS临床诊疗常规如下:①超声诊断TTTS孕妇,告知孕妇双胎中供血儿和受血儿的可能风险,解释期待治疗(超声密切监测双胎儿宫内情况)和宫内有创治疗(羊水减量术及胎儿镜下阻断胎盘异常血管消融术)的利与弊。②建议进行胎儿染色体检查。③在不违背法律及伦理前提下,由医生和孕妇共同临床决策。④有创或期待治疗均由超声科、产科、新生儿科和病理科医生组成研究小组,进行详细评估及监测后给出意见:每周进行超声检查,监测双胎儿胎心、胎动、羊水量和血流指标(脐动脉血流频谱,脐静脉血流频谱、大脑中动脉血流频谱和静脉导管血流频谱);每2周行双胎儿生长参数测量、头颅和心脏评估;若出现异常情况,随时进行超声评估。
1.8 统计学方法 采用SPSS 22.0 软件包进行统计分析。描述分类资料概况,行chi-square 检验,P<0.05为差异有统计学意义。
2 结果
2.1 TTTS母亲一般情况 2013年1月1日至2016年6月30日我院符合本文纳入和排除标准的47例孕妇(94例胎儿)进入本文分析,纳入和排除流程见图1。阴道分娩3例,剖宫产44例。孕妇中位年龄31 (18~46)岁,孕次1~4次,产次0~3次。TTTS诊断孕周16~28周,终止妊娠孕周28~33+5周。

图1 孕妇筛选流程图
2.2 胎儿脑损伤情况 47例孕妇Quintero[6]分期:Ⅰ期7例(14.9%),Ⅱ期9例(19.1%),Ⅲ期17例(36.2%),Ⅳ期8例(17.0%),Ⅴ期6例(12.8%); 6例胎儿死亡,均为Ⅴ期,其中4例供血儿,2例受血儿。88例胎儿超声发现19例脑损伤(21.6%),其中受血儿5例(26.3%),供血儿14例(73.6%),差异有统计学意义(χ2=9.21,P<0.05)。QuinteroⅤ期6例存活儿均发生PIVH合并PVL。TTTSⅢ~Ⅴ级(晚期)孕妇胎儿脑损伤发生率30.3%(17/56),较Ⅰ~Ⅱ级(早期) [6.2%(2/32)]差异有统计学意义(χ2=12.3,P<0.05)。
2.3 TTTS胎儿干预情况 47例孕妇中,无孕妇选择胎儿镜手术,孕19~28周接受羊水减量术治疗13例(27.7%),期待治疗34例,均未在治疗后新发现胎儿脑损伤。
2.4 TTTS早产儿一般情况 88例胎龄(30.5±4.5)周。受血儿体重(1 607±438) g,供血儿体重(1 257±403)g,Apgar 评分(1 min)≤7 分 13 例, ≤3 分 5 例。生后根据病情需要,予保暖、吸氧、防治出血、抗感染、胃肠内外营养和机械通气等对症支持治疗。生后24 h因新生儿窒息死亡4例。
2.5 TTTS早产儿脑损伤情况 84例早产儿中头颅超声发现24例脑损伤(28.6%),其中受血儿9例(37.5%),供血儿15例(62.5%),差异有统计学意义(χ2=7.32,P<0.05)。
2.6 胎儿和新生儿脑损伤比较情况 ①PIVHⅠ级5例,均为生后诊断且不合并PVL,Quintero Ⅱ期1例,Quintero Ⅲ期4例,无死亡。②PIVHⅡ级中,胎儿阶段11例,Quintero Ⅱ期2例,Quintero Ⅲ期7例,Quintero Ⅳ期2例,无死亡;新生儿阶段受血儿新增3例PIVHⅡ级(Quintero Ⅲ期3例),未合并PVL,1例转为PIVH Ⅲ级伴PVL,无死亡;供血儿新增1例PIVHⅡ级,伴PVL(Quintero Ⅲ期1例);2例胎儿期PIVHⅡ出生后转至PIVH Ⅲ级合并PVL,无死亡。③PIVH Ⅲ级胎儿阶段5例均合并PVL, Quintero Ⅳ期2例,Quintero Ⅴ期3例,无死亡胎儿;新生儿阶段5例,受血儿1例由胎儿期PIVHⅡ级进展而来,供血儿2例由胎儿期PIVHⅡ级进展而来(Quintero Ⅳ期2例);死亡1例为供血儿。④PIVH Ⅳ级胎儿阶段3例均合并PVL,为QuinteroⅤ期3例,家属均放弃治疗;新生儿阶段2例,供血儿、受血儿各1例,均由PIVH Ⅲ级进展(QuinteroⅤ期2例),均死亡。
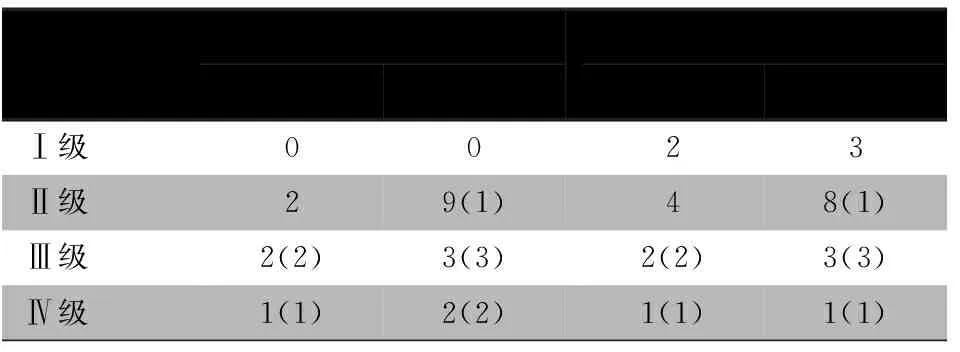
表1 TTTS胎儿及新生儿头颅超声检查比较
注 括号内为例数为诊断合并脑室周围白质软化
2.7 胎儿MRI情况 胎儿期MRI 检查共4例,Quintero Ⅳ期1例,QuinteroⅤ期3例;1例PIVH Ⅲ级合并PVL和2例PIVH Ⅳ级合并PVL,均证实产前超声的诊断;1例PIVH Ⅱ级MRI发现PVL。新生儿PIVH Ⅲ级1例于生后2周内行MRI检查,PIVH Ⅲ级发现PVL,合并胼胝体部分发育异常、大脑皮质发育异常。
3 讨论
目前,不同研究报道的TTTS双胎脑损伤发生率不一致(3%~41%),其原因可能是由于研究的方法、超声检查时间、研究者对脑损伤的定义和超声检查技术的不同[13-15]。大多数研究利用生后48 h内新生儿头颅超声检查来了解TTTS产前发生脑损伤的情况,没有区分是宫内因素还是早产对于脑损伤的影响。了解TTTS围生儿脑损伤,对于早期宫内干预、生后干预及改善神经功能预后至关重要。
2013年,美国辛辛那提儿童医院[16]前瞻性观察22例TTTS胎儿,通过产前超声及MRI发现约23%胎儿发生脑损伤(PIVH和PVL),较客观地报告了产前TTTS脑损伤情况。中国武汉[17]回顾性研究发现,TTTS宫内一胎死亡后另一胎颅脑受损的主要形式是PVL,但没有说明产后存活儿情况。Lopriore团队[8]前瞻性研究观察胎儿镜术后TTTS存活儿神经系统受损情况,存活儿住院期间严重颅脑损伤发生率为14%。匈牙利[18]临床观察发现,新生儿的脑损伤主要受宫内不良因素影响。上述研究忽略了宫内胎儿情况以及出生后48 h这个时间段的影响因素和早产本身的危害。本研究观察TTTS胎儿及早产新生儿阶段脑损伤的情况,发现TTTS 胎儿脑损伤发生率为21.6%,表现为PIVH(主要类型为Ⅱ级)和PVL,与文献[16]报道一致,说明由于TTTS特殊的双胎间异常循环吻合,吻合支动脉侧为供血儿,静脉侧为受血儿,供血儿循环容量减少、极度贫血,受血儿循环容量增加、血液淤滞,都导致颅内血供异常,脑组织损伤在宫内发生并逐渐进展。
PVL是由于脑组织缺血、缺氧,导致少突胶质细胞丢失,轴突断裂 ,软化灶形成并分布于侧脑室的周边,软化灶的形态大小不一致[19]。本研究产前诊断9例PVL,除4例新生儿死亡外,5例存活TTTS新生儿保持和产前超声一致的发现,说明早产儿发生PVL多为宫内已经发生,并且延续至生后。新出现1例PVL,是通过生后MRI诊断,推测可能宫内已经受损,由于多种原因,产前超声未能发现,说明MRI对脑白质损伤更加敏感,是超声检查的有力补充。
Hillman[19]发现,当TTTS发生一胎宫内死亡,存活儿严重颅内受损的发生率(34%,95%CI:28.8~46.1)高于其他双胎存活儿(16%,95%CI:7.8~23.5)。O'Donoghue 等[20]和van Klink等[21]的研究提示,当一胎宫内死亡发生在孕28周前,存活胎儿脑损伤的主要形式是PIVH和PVL。本研究报道6例TTTS发生一胎宫内死亡,均为孕28周前,存活胎儿均出现的PVL且伴PIVH,说明孕28周前脑白质易受不良因素影响,尤其是缺氧,认为TTTS一胎死亡,血压下降为零,存活儿血液一过性流向死亡儿,发生一过性低氧血症,脑血流下降,颅内血液重新分配 , 脑白质血流减少,发生PVL。血栓学说认为,死胎中高凝物质丰富,经胎盘的异常血管吻合流入存活儿体内,形成血栓,造成重要器官损害,尤其是脑,形成PVL[22]。所以TTTS一旦发生一胎宫内死亡,应加强对存活胎的监管,尽早发现可能存在的脑损伤,适时终止妊娠。
Lopriore团队[8]对48例TTTS和60例正常单绒毛膜双胎进行对照研究发现,受血儿和供血儿脑损伤发生风险是一致的(15%vs16%,P=0.51)。另有研究[23]发现,供血儿与受血儿的颅内受损情况是不相同的,供血儿稍高于受血儿,并且Quintero分期愈晚,脑损伤愈严重。本研究中供血儿脑损伤发生率较受血儿明显增高(26.3%vs73.6%,P<0.05),供血儿由于长期的缺氧状态导致其较受血儿颅内受损出现早而严重,而受血儿的高血容量导致高心输出量,在心脏最先受累的基础上,颅内血供逐渐发生改变,脑组织受损相对晚和轻。同时,本研究显示,Quintero分期越晚,TTTS颅内损伤越明显(30.3%vs6%,P<0.05),说明Quintero分期是基于器官受损制定,Ⅲ~Ⅴ期胎儿体内循环系统严重异常,导致器官严重受损甚至胎儿死亡。
本研究在产前未发现孤立的生发层基质的出血,而在新生儿头颅超声检查中发现5例新出现的生发层基质出血,早产儿的Ⅰ级PIVH有增多趋势,说明可能这5例新生儿的出血不是TTTS直接导致,而是早产本身导致生发层基质出血,亦或者TTTS加重了早产儿的不耐受状态,所以观察到更多的Ⅰ级PIVH,提示早产所致的脑损伤是存在的。本研究中有3例Ⅳ级PIVH,1例Ⅲ级PIVH,家属均放弃治疗。新生儿诊断的另2例新增Ⅳ级PIVH,由Ⅲ级进展而来,均生后1 d发生呼吸窘迫综合征。说明宫内循环异常脑损伤联合早产脑损伤导致存活儿不良预后[24]。
TTTS治疗手段包括期待治疗、羊水减量术和胎儿镜激光消融吻合术。用胎儿镜激光消融吻合血管后,仍有残留的血流动力学紊乱,导致近10%存活儿发生神经损伤[25]。Senat等[26]比较了羊水减量术和胎儿镜激光治疗TTTS后胎儿发生颅脑损伤的情况,发现羊水减量术后存活胎儿PVL发生率增加(6%vs14%,P=0.02)。本研究中13例TTTS孕妇在孕19~28周行羊水减量术,术后胎儿脑损伤率和期待治疗无明显差异。
美国胎儿影像指南指出,超声检查是产前胎儿影像学检查的首选和主要筛查方法,MRI作为超声检查的辅助和补充[17,27]。本研究在该指南指导下,结合中国医疗状况,对部分TTTS胎儿及早产儿行联合影像学检查,以尽可能发现脑损伤。1例早产新生儿MRI检查结果为PIVHⅢ级合并PVL,合并胼胝体部分发育异常和大脑皮质发育异常,MRI可以发现超声不能准确诊断的其他颅内发育异常,提供更多信息,有利于临床决策,同文献[17,27,28]研究结果一致。在中国医疗资源相对缺乏的情况下,合理安排早产新生儿MRI检查有待进一步研究。
本研究前瞻性纳入 TTTS,观察了疾病进展、治疗过程以及疾病转归,清晰显示 TTTS宫内脑损伤情况,便于临床医生制定合理的治疗策略;在分娩当日或次日进行新生儿颅脑超声筛查,避免新生儿的选择偏倚;对于低出生体重儿、早产儿和相关高危因素儿直接进入新生儿病房监护,提供了良好的医疗救治模式。本研究发现,TTTS胎儿宫内脑损伤已经出现,同早产共同造成进一步脑损害,供血儿脑损伤发生率高于受血儿。对于TTTS存活儿都应该进行产前规范的超声监测及生后及时的新生儿头颅超声筛查,加强临床随访,MRI检查是超声检查的重要补充。
本研究局限性:样本量较少,纳入病例未全部进行MRI检查,未对PVL进行分级,未比较新生儿出院时颅脑损伤情况及后期神经发育情况等,需要在今后的研究中继续深入,并通过设计大样本量的对照研究更进一步反映TTTS存活儿神经系统实际情况,出生后的神经系统影像学检查及神经系统的长期观察需要更深入研究。
[1]Blickstein I.Cerebral palsy in multifoetal pregnancies. Dev Med Child Neurol,2002, 44(5):352-355 .
[2] Adegbite AL, Castille S, Ward S,et al. Neuromorbidity in preterm twins in relation to chorionicity and discordant birth weight. Am J Obstet Gynecol, 2004, 190(1):156-163 .
[3] Adegbite AL, Castille S, Ward S, et al. Prevalence of cranial scan abnormalities in preterm twins in relation to chorionicity and discordant birth weight. Eur J Obstet Gynecol Reprod Biol, 2005,119(1):47-55 .
[4] Feldstein VA, Filly RA. Complications of monochorionic twins. Radiol Clin North Am, 2003, 41(4):709-727 .
[5] Trevett T, Johnson A. Monochorionic twin pregnancies. Clin Perinatol,2005,32(2):475-494, viii .
[6] Harkness UF, Crombleholme TM. Twin-twin transfusion syndrome: where do we go from here? Semin Perinatol, 2005, 29(5):296-304 .
[7] Ong SS, Zamora J, Khan KS et al. Prognosis for the co-twin following single-twin death: a systematic review. BJOG, 2006, 113(9):992-998 .
[8] Lopriore E, van Wezel-Meijler G, Middeldorp JM,et al. Incidence, origin, and character of cerebral injury in twin-to-twin transfusion syndrome treated with fetoscopic laser surgery. Am J Obstet Gynecol, 2006, 194(5):1215-1220 .
[9] Quarello E, Molho M, Ville Y. Incidence, mechanisms, and patterns of fetal cerebrallesions in twin-to-twin transfusion syndrome. J Matern Fetal Neonatal Med, 2007, 20(8):589-597 .
[10] Denbow ML, Battin MR, Cowan F, et al. Neonatal cranial ultrasonographic findings in preterm twins complicated by severe fetofetal transfusion syndrome. Am J Obstet Gynecol, 1998, 178(3):479-483 .
[11] Ghi T, Simonazzi G, Perolo A, et al. Outcome of antenatally diagnosed intracranial hemorrhage: case series and review of the literature. Ultrasound Obstet Gynecol, 2003, 22(2):121-130 .
[12] de Vries LS, Eken P, Dubowitz LM. The spectrum of leukomalacia using cranial ultrasound. Behav Brain Res,1992, 49(1):1-6 .
[13] Lenclen R, Paupe A, Ciarlo G, et al. Neonatal outcome in preterm monochorionic twins with twin-to-twin transfusion syndrome after intrauterine treatment with amnioreduction or fetoscopic laser surgery: comparison with dichorionic twins. Am J Obstet Gynecol, 2007,196(5):450.e1-7 .
[14] Li X, Morokuma S, Fukushima K, et al. Prognosis and long-term neurodevelopmental outcome in conservatively treated twin-to-twin transfusion syndrome. BMC Pregnancy Childbirth, 2011, 11:32 .
[15] Breysem L, Naulaers G, Deprest J, et al.Postnatal cranial ultrasonographic findings in feto-fetal transfusion syndrome. Eur Radiol, 2002, 12(12):2926-2932 .
[16] Merhar SL, Kline-Fath BM, Meinzen-Derr J,et al. Fetal and postnatal brain MRI in premature infants with twin-twin transfusion syndrome. J Perinatol, 2013, 33(2):112-118 .
[17] 段明娟,黄君红,陈欣林.产前超声诊断双胎妊娠胎儿脑损伤的探讨. 中国产前诊断杂志(电子版) , 2011 , 3 (1) :9-12 .
[18] Gávai M, Hargitai B, Váradi V, et al . Prenatally diagnosed fetal brain injuries with known antenatal etiologies. Fetal Diagn Ther, 2008, 23(1):18-22 .
[19] Hillman SC, Morris RK, Kilby MD. Co-twin prognosis after single fetal death: a systematic review and meta-analysis. Obstet Gynecol, 2011,118(4):928-940 .
[20] O'Donoghue K, Rutherford MA, Engineer N, et al. Transfusional fetal complications after single intrauterine death in monochorionic multiple pregnancy are reduced but not prevented by vascular occlusion. BJOG, 2009,116(6):804-812 .
[21] van Klink JM, van Steenis A, Steggerda SJ, et al. Single fetal demise in monochorionic pregnancies: incidence and patterns of cerebral injury. Ultrasound Obstet Gynecol, 2015, 45(3):294-300 .
[22] Saadani-Makki F, Kannan S, Makki M, et al. Intrauterine endotoxin administration leads to white matter diffusivity changes in newborn rabbits. J Child Neurol, 2009, 24(9):1179-1189 .
[23] Volpe J. Intracranial hemorrhage: germinal matrix-ntraventricular hemorrhage of the premature infant. In: Neurology of the Newborn. WB Saunders: Philadelphia, PA, USA, 2008, pp 517-573 .
[24] Khwaja O, Volpe JJ. Pathogenesis of cerebral white matter injury of prematurity. Arch Dis Child Fetal Neonatal Ed, 2008, 93(2):F153-161 .
[25] Quarello E, Stirnemann J, Nassar M, et al. Outcome of anaemic monochorionic single survivors following early intrauterine rescue transfusion in cases of feto-fetal transfusion syndrome. BJOG, 2008, 115(5):595-601 .
[26] Senat MV, Deprest J, Boulvain M,et al. Endoscopic laser surgery versus serial amnioreduction for severe twin-to-twin transfusion syndrome. N Engl J Med, 2004, 351(2):136-144 .
[27] Reddy UM, Abuhamad AZ, Levine D, et al. Fetal imaging: executive summary of a joint Eunice Kennedy Shriver National Institute of Child Health and Human Development, Society for Maternal-Fetal Medicine, American Institute of Ultrasound in Medicine, American College of Obstetricians and Gynecologists, American College of Radiology, Society for Pediatric Radiology, and Society of Radiologists in Ultrasound Fetal Imaging workshop. Obstet Gynecol, 2014, 123(5):1070-1082 .
[28] Genedi EAS, Osman NM, El-Deeb MT. Magnetic resonance imaging versus transcranial ultrasound in early identification of cerebral injuries in neonatal encephalopathy. Egyptian Journal of Radiology & Nuclear Medicine, 2016, 47(1):297-304
A cohort study on the brain injury of the fetus and the newborn 2 days after birth with twin-twin transfusion syndrome
TANGYing,LUOHong,MUDe-zhi,YANGTai-zhu,ZHUQi,BAOShan
(UltrasonographyDepartment,WestChinaSecondUniversityHospital,Chengdu610041,China)
LUO Hong, E-mail:luohongcd1969@163.com
ObjectiveTo verify the source of brain injury in premature infants with twin-twin transfusion syndrome (TTTS) from fetal period or postnatal factors. MethodsA prospective cohort study with TTTS twins was performed whose mothers
fetal ultrasound before the delivery at 34 weeks, and postnatal brain ultrasound was performed within 2 d at the same hospital by ultrasound to diagnose intracranial hemorrhage and(PIVH) cystic periventricular leukomalacia (PVL). The brain injury was scored on fetal and postnatal ultrasounds. The pregnant women with twins died and chromosomal abnormality of one of the twins were excluded.ResultsA total of 94 fetuses of the 47 pregnant women with TTTS were analyzed in the study. The median age of the pregnant women was 31 (18-46) years old, and the TTTS were diagnosed between 16 and 28 weeks of gestational age, and the gestational age of 28 ~ 33+ 5weeks was terminated. 7, 9, 17, 8 and 6 cases were in Quintero Ⅰ, Ⅱ, Ⅲ, Ⅳ and Ⅴ periods respectively, in stage Ⅴ 6 cases of fetal death happened, the partners of 6 cases occurred PIVH and PVL. In all, 19/88 (21.6%) fetuses had brain injury seen on fetal ultrasound, 5 recipients, 14 donors(26.3%vs73.6 %,P< 0.05). 17 fetuses were with Quintero Ⅲ, Ⅳand Ⅴ brain injury and 2 fetuses with Quintero Ⅰ,Ⅱbrain injury (30.3%vs6.2 %,P< 0.05). Twins of 13/47 cases(27.7%) were not found new patients with brain injury after the treatment of amniotic fluid reduction at 19 ~ 28 weeks of gestation. The gestational age of all 88 cases was (30.5± 4.5) weeks. Recipients weight was (1 607±438) g, donors (1 257±403) g, 4 cases died caused by neonatal asphyxia. In all, 24/84 infants (28.6%) had brain injury seen on postnatal ultrasound. 9 recipients, 15 donors were found (37.5%vs62.5 %,P< 0.05). There were 5 cases with PIVH Ⅰ, all of them were diagnosed without PVL. PIVH Ⅱ, 11 cases involved fetal stage, and in neonatal stage 4 cases were increased ,including 1 case with PVL. 3 cases developed to PIVH Ⅲ with soften cerebral white matter, no death case. During PIVH Ⅲ, 5 cases in fetal stage were combined with PVL, there were 5 cases at neonatal stage, 3 cases developed from PIVH Ⅱ , and 1 case died. All of the 3 fetuses involved PIVH Ⅳ were with PVL, and 2 cases in neonatal stage were caused by PVIH Ⅲ with PVL, and died.Conclusion The risk of cerebral injury and neurologic morbidity increased in fetuses and infants TTTS. Severe cerebral lesions detected in TTTS included cystic periventricular leukomalacia (PVL), severe intraventricular hemorrhage (IVH). In view of the increased risk of cerebral injury, cranial ultrasound scans should be performed routinely in all TTTS survivors at birth.
Ultrasonography; Twin-twin transfusion syndrome; Brain injuries; Prognosis; Premature infants
2017-07-21
2017-08-21)
(本文编辑:张崇凡,孙晋枫)
成都市科技局科技惠民技术研发项目:2014-HM01-00049-SF;四川省应用基础研究项目:2017JY0263
四川大学华西第二医院超声科 四川成都,610041
罗红,E-mail: luohongcd1969@163.com
10.3969/j.issn.1673-5501.2017.04.001

