马克斯克鲁维酵母高密度发酵条件的优化研究
, ,江月,,, ,
(1.江苏大学 食品与生物工程学院,江苏镇江 212013;2.新疆天润生物科技股份有限公司,新疆乌鲁木齐 830088)
马克斯克鲁维酵母高密度发酵条件的优化研究
王亮1,胡曼1,王江月1,巩小芬1,刘朋龙2,詹涛2,李阳2
(1.江苏大学 食品与生物工程学院,江苏镇江 212013;2.新疆天润生物科技股份有限公司,新疆乌鲁木齐 830088)
对影响马克斯克鲁维酵母高密度发酵的培养基营养成分和培养条件展开分析研究。单因素实验发现,YPD作为基础培养基有利于马克斯克鲁维酵母的增殖;培养基成分响应面分析和培养条件正交实验结果表明,当培养基成分为蔗糖67.37 g/L,酵母浸粉29.7 g/L,玉米浆15.61 g/L,KH2PO44.13 g/L,MgSO40.3 g/L,初始pH为6.0、发酵温度为30 ℃、搅拌速度为160 r/min时,发酵培养18 h马克斯克鲁维酵母的生物量最大,为(9.34±0.12) g/L。进一步进行乳饮品发酵实验,优化培养的马克斯克鲁维酵母与乳源培养基培养的马克斯克鲁维酵母,在菌种的生物量和乳饮品的口感风味上无明显差异。因此,优化后的高密度发酵培养基配方和工艺条件适宜于马克斯克鲁维酵母菌的高密度发酵。
马克斯克鲁维酵母,高密度发酵,增殖速率,固相微萃取-气相色谱-质谱法
马克斯克鲁维酵母(Kluyveromycesmarxianus)作为一种广泛存在于发酵乳中的酵母,不仅可以发酵乳糖,更能对半乳糖进行利用,发酵过程中可以单独或与乳酸菌一起用于发酵乳品,赋予了产品独特的风味及营养特性[1],因而备受国内外众多研究者的关注。由于马克斯克鲁维酵母在多种发酵乳中具有产酒精量低、发酵风味好的特点,国内对于马克斯克鲁维酵母菌的应用,主要集中在新型乳饮品的研发上。李新玲等人对马克斯克鲁维酵母生产奶啤和乳清饮料的工艺进行了探讨[2]。陈成等人利用马克斯克鲁维酵母生产乳清酒,并对乳清酒所含的可溶性乳清蛋白肽进行了分析[3]。国外对于马克斯克鲁维酵母的应用,主要集中在利用马克斯克鲁维酵母菌发酵产生某些风味物质和生产乙醇等方面。马克斯克鲁维酵母能发酵乳液中的乳糖,并对蛋白质进行降解[4],生成酯类、羧酸、醇类、乙酸异戊酯等风味物质[5]。Michael Crafack等人利用马克斯克鲁维酵母和毕赤克鲁维酵母增加了可可的风味[6]。Christian Löser等人对如何提高马克斯克鲁维酵母规模化生产乙酸乙酯进行了探讨[7]。因此,马克斯克鲁维酵母在发酵乳制品方面具有广阔的应用前景。
研究者已经认识到马克斯克鲁维酵母的商业化价值,但严重缺乏相关马克斯克鲁维酵母高密度培养的研究。而发酵工艺中的一个重要的任务就是如何尽可能地提高细胞密度,从而降低发酵剂的制备生产成本[8]。因此,为了马克斯克鲁维酵母发酵剂的制备和应用,提高马克斯克鲁维酵母的商业化价值,需要对马克斯克鲁维酵母菌进行高密度培养。
针对影响马克斯克鲁维酵母高密度发酵的营养因素及培养条件进行了研究,寻找出了最佳的马克斯克鲁维酵母增殖培养条件,为将来马克斯克鲁维酵母的扩培以及冻干粉的生产,提供了可靠的研究基础。
1 材料与方法
1.1材料与仪器
马克斯克鲁维酵母菌株,江苏大学食品学院实验室保藏;白砂糖、纯牛奶、复合稳定剂、玉米浆干粉,市售。
YGC琼脂培养基(含氯霉素) 青岛海博生物技术有限公司。用于实验室酵母菌的保存。
YPD液体培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,121 ℃灭菌20 min。用于酵母菌的种子液的活化。
YPD固体培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,琼脂15 g/L,121 ℃灭菌20 min。用于酵母菌发酵的单因素影响实验及菌落计数。
土豆(黄豆芽)培养基:称取200 g土豆(黄豆芽),蒸馏水适量加热煮沸,维持30 min,用双层纱布趁热过滤在量杯中,弃去滤渣,用蒸馏水补齐1 L,加20 g葡萄糖,混匀备用,121 ℃灭菌20 min。
麦芽汁培养基:麦芽浸粉20 g/L,蛋白胨10 g/L,葡萄糖20 g/L,酵母浸膏1 g/L,121 ℃灭菌20 min。
乳源培养基:12%脱脂乳粉,白砂糖7%,115 ℃灭菌15 min。用于正常条件下马克斯克鲁维酵母增殖培养。
乳饮品发酵培养基:酸乳30%,复合稳定剂0.5%,白砂糖7%,95 ℃灭菌5 min。用于乳饮品的发酵制备。
SW-CJ系列洁净工作台 苏州安泰空气技术有限公司;QYC 200全温空气摇床 上海福玛实验设备有限公司;pH计 梅特勒-托利多仪器(上海)有限公司;BPMJ 250F型霉菌培养箱 上海一恒科学仪器有限公司;气相色谱-质谱联用仪HP6890/5973、顶空固相微萃取SPMC-5732 美国Agilent公司。
1.2实验方法
1.2.1 马克斯克鲁维酵母菌菌株的活化 从4 ℃保藏的YGC试管斜面培养基上,挑取一环马克斯克鲁维酵母菌于YPD斜面培养基上,于28 ℃、培养48 h,同样条件下连续活化2次。
1.2.2 种子液的制备 挑取一环活化后的马克斯克鲁维酵母菌,接入50 mL YPD液体培养基中,28 ℃、160 r/min培养16 h,然后用稀释涂布法进行菌落计数。液体培养的酵母菌作为种子液用于培养条件优化研究。
1.2.3 影响马克斯克鲁维酵母增殖的培养基成分分析
1.2.3.1 基础培养基对马克斯克鲁维酵母增殖的影响 酵母菌种子液用无菌水调至1.0×106cfu/mL,按3%(v/v)分别接种于YPD、PDA、黄豆芽、麦芽汁四种备选液体培养基中(250 mL三角瓶中装液量为100 mL),于28 ℃、160 r/min培养24 h,每隔4 h,取0.5 mL样品,600 nm测定其OD600值,绘制菌体生长曲线,实验以未接种的培养基调零。
1.2.3.2 不同浓度碳源对马克斯克鲁维酵母增殖的影响 以不含碳源YPD培养基为基础培养基,添加不同碳源,并测试每种碳源在不同浓度条件下对马克斯克鲁维酵母增殖的影响。实验分别添加蔗糖、葡萄糖、乳糖和麦芽糖四种碳源,每种碳源设置5个浓度梯度,分别为35、45、55、65、75 g/L。以不含有碳源的YPD培养基为对照组。培养液中按3%(v/v)接种马克斯克鲁维酵母种子液,于160 r/min、28 ℃,培养18 h后测定培养的马克斯克鲁维酵母生物量。
1.2.3.3 不同浓度氮源对马克斯克鲁维酵母增殖的影响 以不含氮源YPD培养基为基础培养基,添加不同氮源,并测试每种氮源在不同浓度条件下对马克斯克鲁维酵母增殖的影响。实验分别添加蛋白胨、酵母浸粉、玉米浆、硝酸钾和硫酸铵五种氮源,对于蛋白胨、酵母浸粉、玉米浆,每种氮源设置5个实验浓度梯度,分别为10、15、20、25、30 g/L。对于硝酸钾和硫酸铵,每种无机氮源设置5个实验浓度梯度,分别为1、3、5、10、15 g/L。培养液中按3%(v/v)接种马克斯克鲁维酵母种子液,于160 r/min、28 ℃,培养18 h后测定培养的马克斯克鲁维酵母生物量。
1.2.3.4 不同浓度无机盐对马克斯克鲁维酵母增殖的影响 以YPD培养基为基础培养基,分别添加KH2PO4、CaCl2、MgSO4、NaCl、MnSO4五种无机盐,KH2PO4添加浓度分别为2、4、6、8 g/L;MnSO4的添加浓度分别为0.05、0.1、0.5、1.0 g/L;其余三种无机盐的添加浓度为0.5、1、2、4 g/L。培养液中按3%(v/v)接种马克斯克鲁维酵母种子液,于160 r/min、28 ℃,培养18 h后测定培养的马克斯克鲁维酵母生物量。
1.2.3.5 培养基响应面法优化 根据单因素实验结果,选取碳源、氮源和无机盐离子为考察因素,设计5因素3水平的实验,每个处理设3个重复。应用design expert 8.06进行数据分析和响应面分析,优化培养基配方。
1.2.4 培养条件对马克斯克鲁维酵母增殖的影响
1.2.4.1 培养条件的单因素实验 5个250 mL的三角培养瓶中分别加入100 mL优化后的培养基,按3%(v/v)接种马克斯克鲁维酵母种子液,分别设定培养温度为26、28、30、32、34 ℃,于160 r/min,培养18 h后测定培养的马克斯克鲁维酵母生物量。
5个250 mL的三角培养瓶中分别加入100 mL优化后的培养基,按3%(v/v)接种马克斯克鲁维酵母种子液,摇床转速分别设定为120、140、160、180、200 r/min,于28 ℃培养18 h后测定培养的马克斯克鲁维酵母生物量。
5个250 mL的三角培养瓶中分别加入100 mL优化后的培养基,按3%(v/v)接种马克斯克鲁维酵母种子液,培养基pH分别设定为4.5、5.0、5.5、6.0、6.5,于28 ℃、160 r/min培养18 h后测定培养的马克斯克鲁维酵母生物量。
1.2.4.2 培养条件的正交实验 在单因素实验结果的基础上,选取温度、摇床转速和培养基初始pH为主要因素,设计3因素3水平正交实验。
1.2.5 高密度优化培养的马克斯克鲁维酵母乳饮品发酵鉴定 将高密度优化培养的马克斯克鲁维酵母(A)与乳源培养基正常培养(B)的同一种马克斯克鲁维酵母进行乳饮品发酵平行对比实验[2],发酵培养基:酸乳30%,复合稳定剂0.5%,白砂糖7%,95 ℃灭菌5 min。3%(v/v)接种两种不同培养方式的马克斯克鲁维酵母种子液,于28 ℃培养24 h,即得到马克斯克鲁维酵母发酵乳饮品。
1.3马克斯克鲁维酵母生物量测定、发酵乳饮品感官评定和挥发性成分检测方法
生物量的测定:将培养后的马克斯克鲁维酵母菌摇匀后,取50 mL悬液,于4000 r/min、离心10 min,弃上清,用无菌水离心洗涤沉淀2次,95 ℃烘至恒重。光密度法:将马克斯克鲁维酵母菌悬液,稀释6倍,于600 nm测定其OD600值。感官评定:10名受过培训的成员对发酵乳饮品进行感官评定,主要评定指标参照黄翠姬等人的文献[9];挥发性成分检测:按照SPME-GC/MS分析方法进行检测[10]。
2 结果与讨论
2.1培养基成分对马克斯克鲁维酵母增殖的影响
2.1.1 基础培养基对马克斯克鲁维酵母增殖的影响 由图1生长曲线可知,培养实验中,以YPD、麦芽汁和黄豆芽为发酵基础培养基,马克斯克鲁维酵母菌生长的对数期和稳定期基本相同,分别为4~16 h,16~24 h。以PDA为发酵培养基,马克斯克鲁维酵母菌生长的对数期为4~20 h,稳定期为20~24 h。4种培养基发酵培养一段时间后,酵母菌细胞生长密度分别达到最高值,OD600值测试结果为:YPD(0.89)>PDA(0.729)>麦芽汁培养基(0.702)>黄豆芽培养基(0.605),其中以YPD为发酵基础培养基,酵母菌细胞生长密度最大,培养16 h时后,OD600达到了0.89。因此,选择YPD培养基为最佳基础培养基。
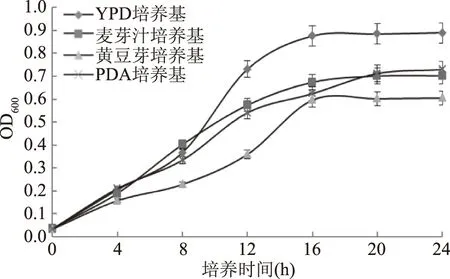
图1 不同基础培养基对马克斯克鲁维酵母的生长影响Fig.1 Effect of culture medium on the growth of Kluyveromyces marxianus yeast
2.1.2 碳源及其不同浓度对马克斯克鲁维酵母增殖的影响 碳源是酵母菌所需的主要营养物质和能量来源[11],发酵过程中必须提供充分的碳源以保障酵母菌的生长和增殖。但是碳源浓度过高,细胞渗透压过大[12],同样也会抑制酵母菌的生长。因此筛选恰当碳源种类及添加浓度,对于马克斯克鲁维酵母的增殖非常关键。
由图2可以看出,将不含碳源的YPD液体培养基作为空白组(不含碳源,改变碳源的添加浓度时空白组数值无变化),添加4种碳源时的马克斯克鲁维酵母菌增殖效果明显。5个浓度梯度中(35、45、55、65、75 g/L),不含碳源的基础YPD培养基分别添加葡萄糖、蔗糖或乳糖作为碳源,当添加浓度为65 g/L时,培养18 h后,三种碳源分别培养的马克斯克鲁维酵母生物量都达到最高值,生物量分别为6.06、6.98、2.4 g/L,其中蔗糖最高为6.98 g/L。当碳源添加浓度超过65 g/L后,随着糖浓度的升高,马克斯克鲁维酵母的生长可能受葡萄糖效应(Crabtree effect)的影响[14],生物量逐渐降低。在以麦芽糖为碳源的培养基中,酵母菌的生物量在5个浓度梯度中(35、45、55、65、75 g/L)呈现递增趋势,当添加浓度为75 g/L时,生物量达到最高值3.48 g/L。因此从四种添加碳源实验结果比较分析来看,蔗糖可作为培养基优选添加碳源。

图2 碳源及其不同浓度对马克斯克鲁维酵母的生长影响Fig.2 Effect of carbon sources and concentration on the growth of Kluyveromyces marxianus yeast
2.1.3 氮源及其不同浓度对马克斯克鲁维酵母增殖的影响 由图3可以看出,以不含氮源的YPD为基础培养基,当培养基中有机氮源更换为无机氮源硫酸铵和硝酸钾时,马克斯克鲁维酵母的生物量均低于2 g/L,说明这两种无机氮源不利于马克思克鲁维酵母的增殖。当培养基分别添加蛋白胨和酵母浸粉作为氮源时,添加浓度为25 g/L时,培养18 h后,马克斯克鲁维酵母生物量都达到最高值,分别为2.13 g/L和2.63 g/L。添加玉米浆作为氮源时,当玉米浆的添加浓度为20 g/L时,马克斯克鲁维酵母生物量达到最高值为2.54 g/L。三种氮源全部达到最高值时的生物量进行比较,酵母浸粉(2.63 g/L)>玉米浆(2.54 g/L)>蛋白胨(2.13 g/L)。酵母浸粉含有的维生素及生长因子能促进酵母细胞的生长。玉米浆是玉米淀粉加工中的主要副产物,富含蛋白质,氨基酸,维生素和微量元素,可作为蛋白胨替代物,常被用于培养基添加物[11]。因此,为了进一步使发酵培养基氮源物质成分更全面,选择酵母浸粉和玉米浆作为氮源物质进行响应面分析。

图3 氮源及其不同浓度对马克斯克鲁维酵母的生长影响Fig.3 Effect of nitrogen sources and concentration on the growth of Kluyveromyces marxianus yeast
2.1.4 无机盐及其不同浓度对马克斯克鲁维酵母增殖的影响 金属离子对酵母细胞生长和发酵十分重要。例如Mg2+能改变糖转化率和辅酶因子的代谢途径[14-16],降低细胞质膜的通透性[17-18],抵抗酵母菌细胞对乙醇代谢压力[19]。

图4 无机盐及其不同浓度对马克斯克鲁维酵母菌的生长影响Fig.4 Effect of inorganic ions and concentration on the growth of Kluyveromyces marxianus yeast
由图4可知,以YPD为基础培养基,分别添加一定浓度的KH2PO4、MgSO4,能够在一定范围内提高马克斯克鲁维酵母菌的生物量。其中,当KH2PO4添加浓度在4 g/L时,培养18 h后,马克斯克鲁维酵母生物量达到最高值3.46 g/L;KH2PO4浓度在4 g/L以上时,马克斯克鲁维酵母的生物量降低,可能是KH2PO4浓度超越马克斯克鲁维酵母代谢所需,对马克斯克鲁维酵母增殖起到了抑制作用[8]。MgSO4的添加浓度在0.5 g/L时,生物量最高达到3.48 g/L。不同于Nahit Aktas等人的研究[20]。MnSO4的添加不利于马克思克鲁维酵母的生长。因此,选择KH2PO4、MgSO4这两种无机盐进行响应面分析。
2.1.5 培养基响应面法优化 响应面分析法是用来寻找最佳反应因素的一种统计方法[21],已逐渐应用于培养基的优化[22]。根据单因素实验结果,选取蔗糖、酵母浸粉、玉米浆、KH2PO4、MgSO4为考察因素,设计5因素3水平的实验,具体的因素水平及其编码见表1,按照Box-Behnken安排实验。用design expert 8.06进行数据分析和响应面分析。

图5 部分因素相互作用对马克斯克鲁维酵母菌生物量的影响Fig.5 Response surface plot of the effects of amount of sucrose,yeast extract and corn steep liquor on biomass
利用design expert软件对表中的实验数据进行回归分析,可得回归方程为Y=7.46+0.51A+0.17B+0.048C+0.019D-0.016E+0.070AB+0.12AC-0.065AD-0.085AE+0.022BC-0.040BD-0.14BE+0.0075CD+0.000CE-0.005DE+0.14A2+0.097B2+0.20C2+0.13D2+0.13E2式中Y为响应值,即酵母菌生物量;A、B、C、D、E分别表示蔗糖、酵母浸粉、玉米浆、KH2PO4、MgSO4。
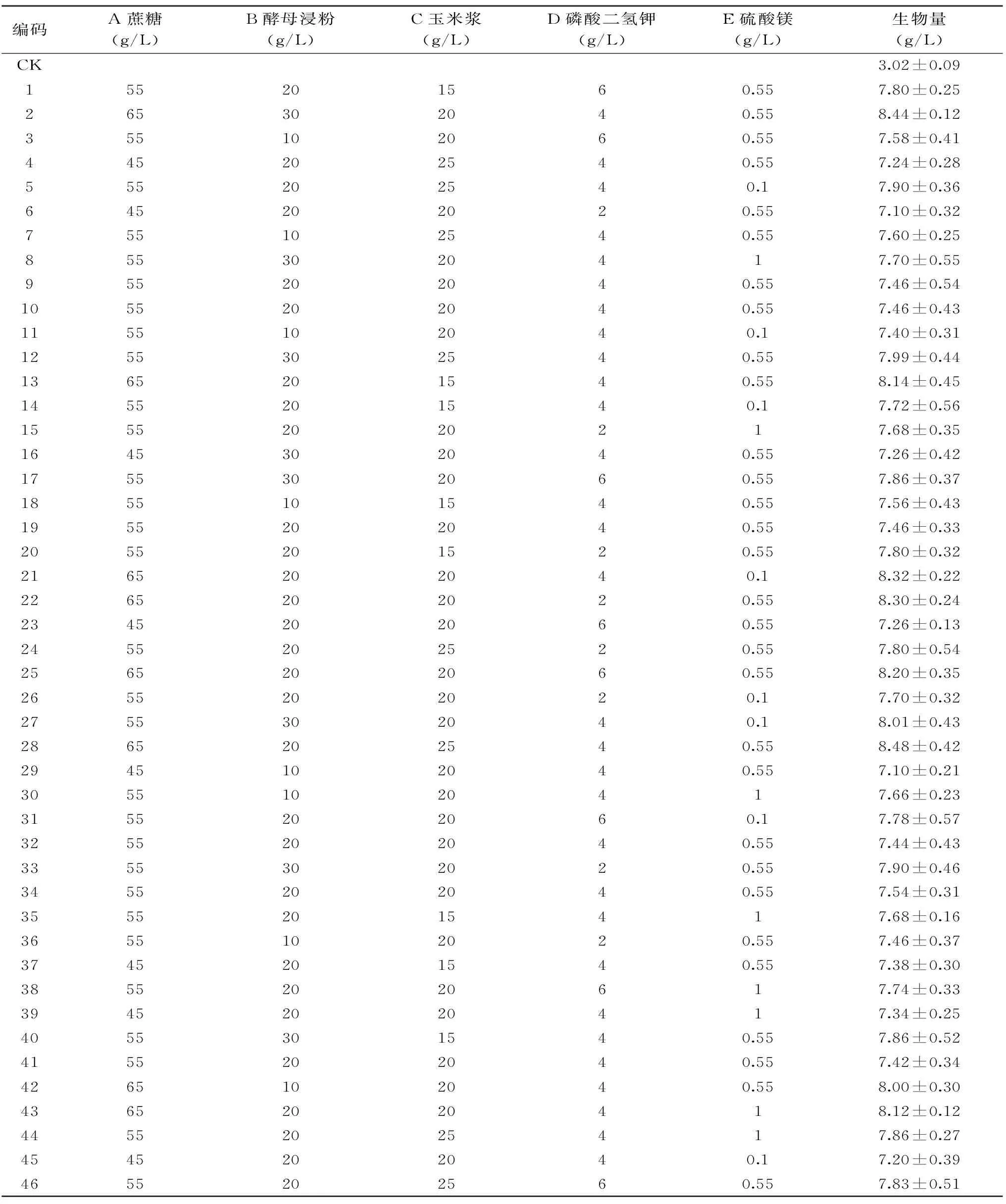
表1 响应面设计方案和实验结果Table 1 Scheme and results of response surface design
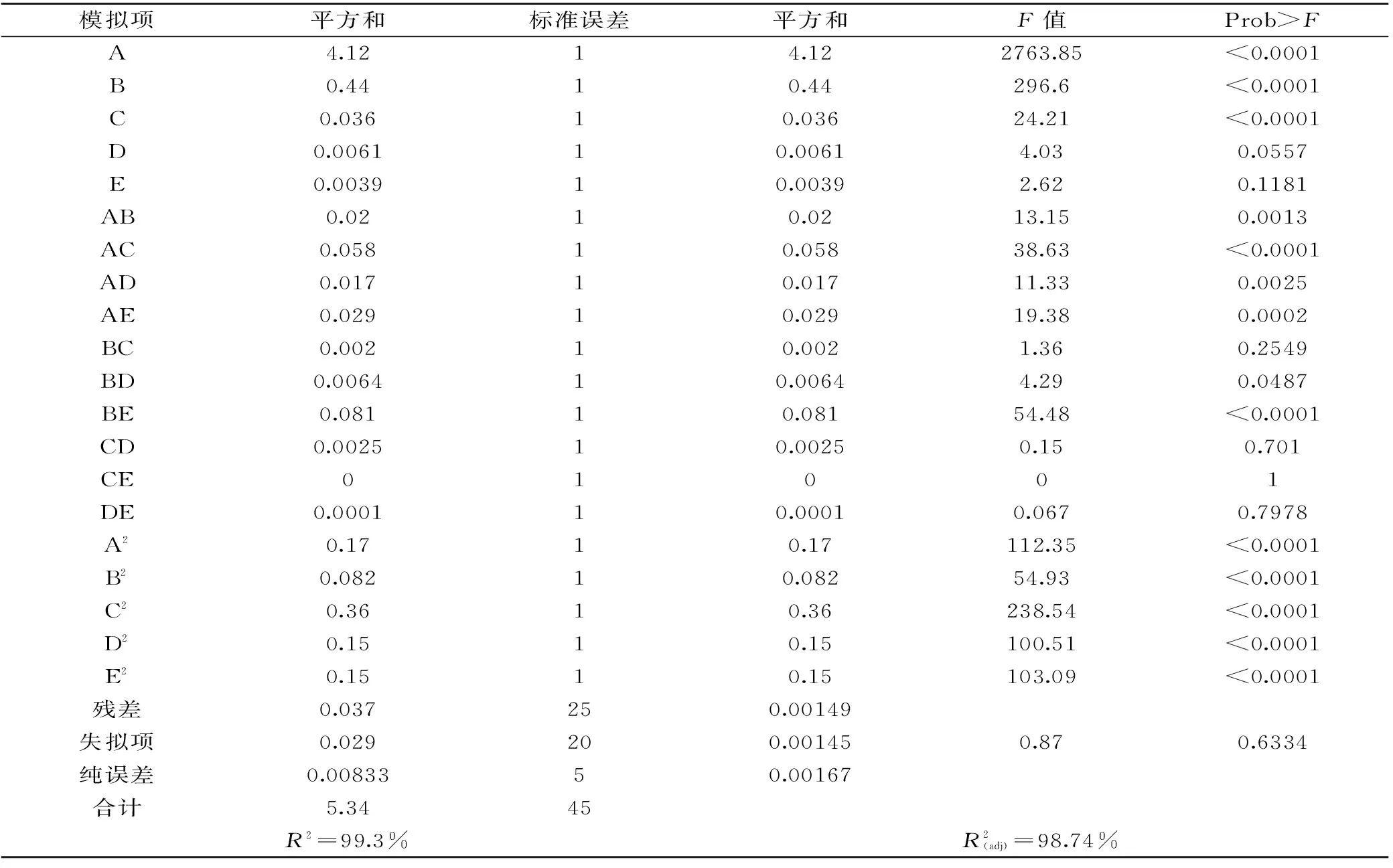
表2 响应面实验的方差分析Table 2 Variance analysis of the established regression equation
由表2的方差分析可以看出,模型Prob>F值小于0.0001表明该模型是极度显著的。模型中的参数A、B、C、AC、BE、A2、B2、C2、D2、E2对马克思克鲁维酵母的增殖影响都显著(Prob>F值小于0.05)。模型失拟项表示模型预测值与实际值不拟合的概率,模型失拟项Prob>F值0.6334>0.05,因此,模型失拟项不显著,不需要引入更高次数的项,模型选择合适。同时模型的校正系数R2=98.74%,说明该模型能解释大约98.74%的响应;相关系数R2=99.3%,说明该实验误差小,模型与实际预测拟合性好。可以使用该模型来分析响应值的变化。
对所得方程进行求解,可得到酵母菌生物量最大时的培养基最优组合为:A蔗糖67.37 g/L,B酵母浸粉29.7 g/L,C玉米浆15.61 g/L,D KH2PO44.13 g/L,E MgSO40.3 g/L,该条件下的酵母干重最大值为9.00 g/L。在该点进行三次重复实验,平均酵母干重8.88±0.08 g/L,是优化前的马克斯克鲁维酵母生物量3.02 g/L的2.94倍。由此可知,响应面法优化得到的培养基成分参数准确可靠。
2.2培养条件对马克斯克鲁维酵母增殖的影响
2.2.1 不同培养温度对马克斯克鲁维酵母增殖的影响 温度是微生物生长的重要因素之一。在一定程度上,升高温度能提高酵母菌胞内酶的活性,提高膜的流动性,增加酵母细胞对酒精毒性作用的敏感性[23]。
由图6可以看出,实验选择优化后的培养基为发酵培养基,培养温度设定为26、28、30、32、34 ℃,于160 r/min,培养18 h后测定培养的马克斯克鲁维酵母生物量。马克斯克鲁维酵母的生物量随着温度的升高呈现先上升后下降趋势,在30 ℃处达到最大值,与Miskiewicz和Borowiak等人[24]的研究一致。
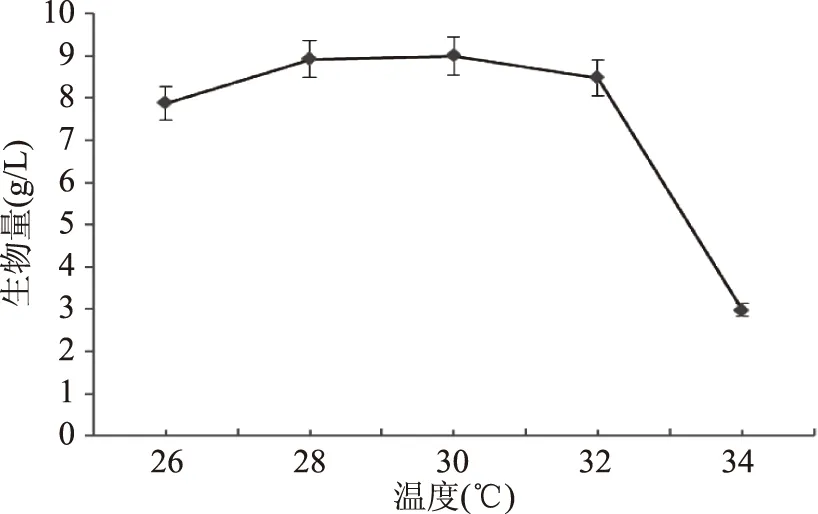
图6 不同温度对马克斯克鲁维酵母生长的影响Fig.6 Effect of temperature on the growth of Kluyveromyces marxianus yeast
2.2.2 不同转速对马克斯克鲁维酵母增殖的影响 转速的大小直接决定了培养基中的供氧水平。由图7可以看出,实验选择优化后的培养基为发酵培养基,马克斯克鲁维酵母的生物量在转速为180 r/min时最大,转速高于或低于这一水平时,其生物量都会有所下降。可能由于转速过高时,培养基流动形成的剪切力过大或者高转速条件下空气氧压过大,导致菌体的破裂和死亡。

图7 转速对马克斯克鲁维酵母生长的影响Fig.7 Effect of agitation speed on the growth of Kluyveromyces marxianus yeast
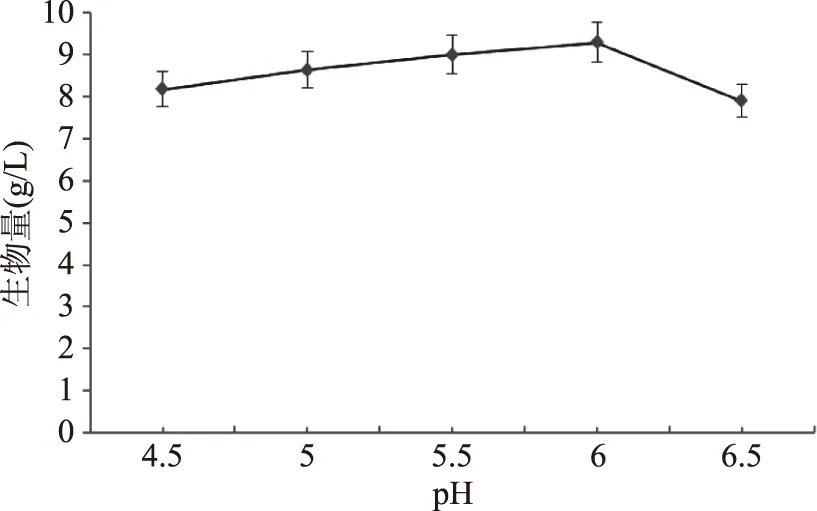
图8 pH对马克斯克鲁维酵母生长的影响Fig.8 Effect of pH on the growth of Kluyveromyces marxianus yeast
2.2.3 不同初始pH对马克斯克鲁维酵母增殖的影响 微生物都有生长最适pH范围,许多酵母菌在pH4.5~6.5范围内长得很好。pH过高或过低都会对酵母菌细胞增殖造成影响[23]。
实验选择优化后的培养基为发酵培养基,为了确定酵母菌最佳pH,分别测定了培养基不同的初始pH时酵母菌的生物量,结果图8所示,酵母菌最佳初始pH为6.0。
2.2.4 培养条件的正交实验 培养条件正交实验结果如表3所示。
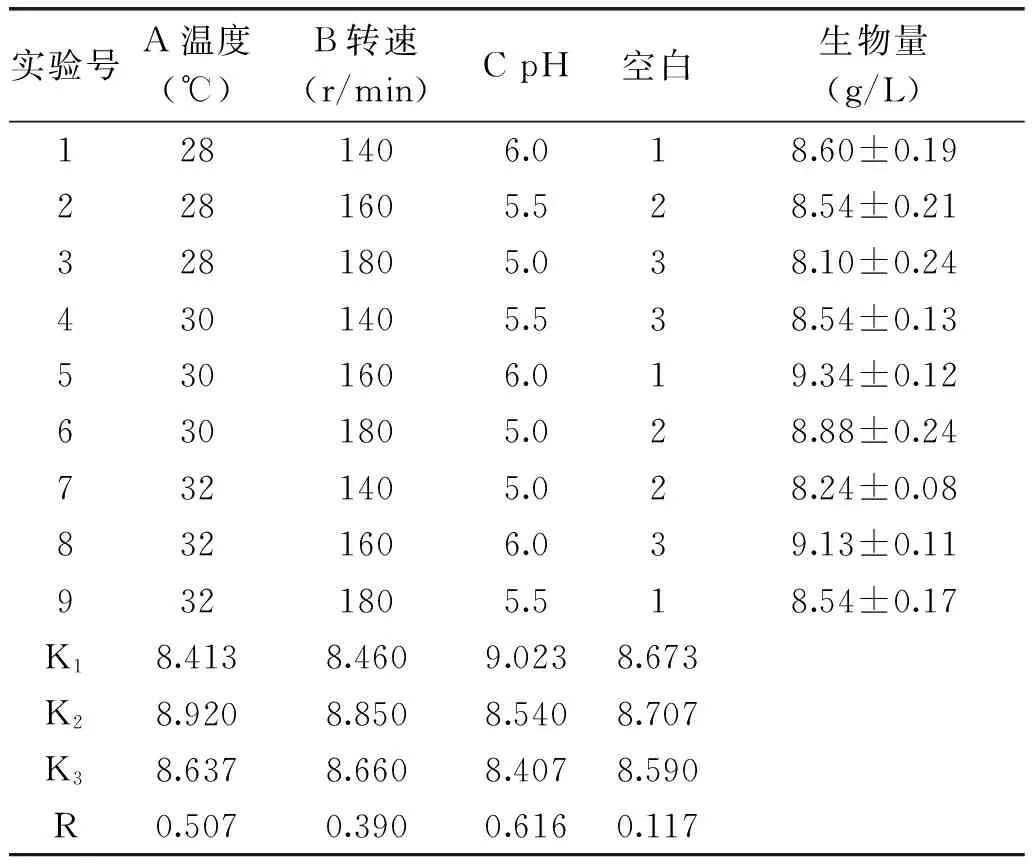
表3 培养条件优化的正交实验结果Table 3 The experimental results of orthogonal test for culture conditions
从表3的极差分析结果看,各因素对于菌体生物量的影响程度由大到小分别是RC>RA>RB,最佳生长组合为A2B2C1。因此,最优组合为温度30 ℃,初始pH6.0,转速160 r/min,此条件下的菌体生物量(9.34±0.12) g/L。
2.3高密度优化培养的马克斯克鲁维酵母乳饮品发酵鉴定
马克斯克鲁维酵母主要用于新型乳饮料的研制及风味物质的制备,利用优化培养基高密度培养马克斯克鲁维酵母是否适应于乳饮品的发酵生产,必须经过实验验证。将高密度优化培养的马克斯克鲁维酵母(A)与乳源培养基正常培养(B)的同一种马克斯克鲁维酵母,进行乳饮品发酵平行对比实验[2]。于28 ℃培养24 h后,发酵期间的生长曲线,发酵结束后酒精含量、最终乳饮品的感官评定和挥发性风味物质分析见图9、表4、表5和表6。
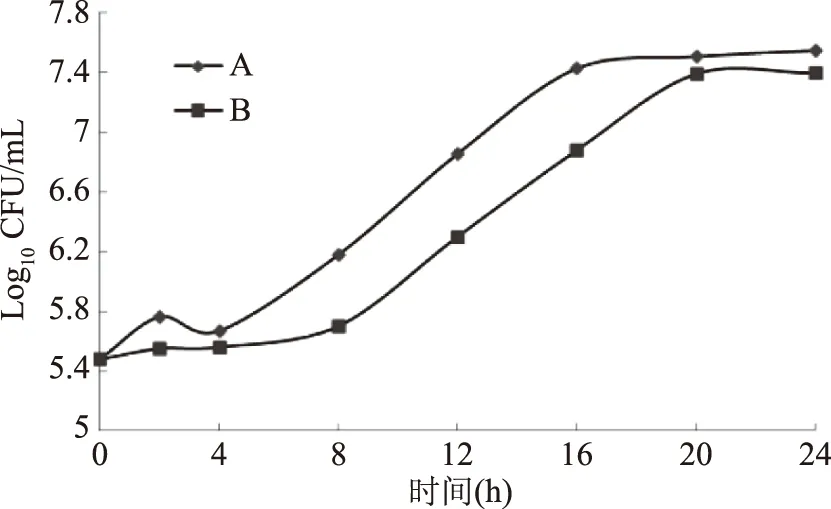
图9 马克斯克鲁维酵母在发酵培养基中生长曲线Fig.9 Growth curves of Kluyveromyces marxianus in fermentation culture medium
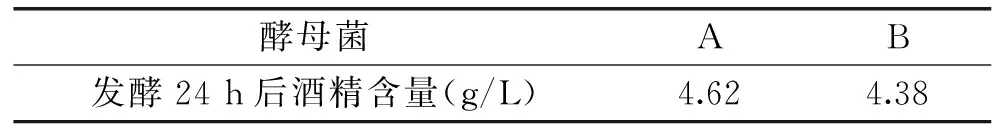
酵母菌AB发酵24h后酒精含量(g/L)4.624.38
由图9和表4可知,在发酵24 h 时间内,乳源培养基培养的马克斯克鲁维酵母B调整期为0~6 h,对数期在6~20 h,20 h活菌数达到最大值(7.39),发酵结束后酒精含量为4.38 g/L;高密度培养的马克斯克鲁维酵母A的调整期为0~4 h,对数期提前为4~16 h,16 h活菌数达到最大值(7.51),发酵结束后酒精含量为4.62 g/L,表明经过高密度培养发酵的马克斯克鲁维酵母发酵活性略高于乳源培养基培养的马克斯克鲁维酵母。
由表5可知,在发酵乳饮品的颜色、味道、组织形态、气味和总体评价方面,A的发酵乳感官分值略高于B的分值,但是差异不显著,表明A与B发酵形成的发酵乳感官评定结果接近,优化培养基高密度培养马克斯克鲁维酵母A适宜于乳饮品发酵生产。

表5 发酵样品感官评定结果Table 5 Evaluating result of sensory analysis of fermented samples
注:同一列中相同字母代表差异不显著(p>0.05)。
乳饮品中的风味化合物主要是由微生物产生的酶类,通过分解乳品中蛋白质、脂肪和糖类等物质而产生的[25]。从表6中可以得知,发酵风味成分主要是醇类、酯类、酸类和醛类等物质。醇类主要有乙醇、丁醇和苯乙醇等;酯类物质有乙酸乙酯、己酸乙酯、辛酸乙酯等;酸类物质有乙酸、辛酸等;醛类物质有乙醛、苯甲醛等。
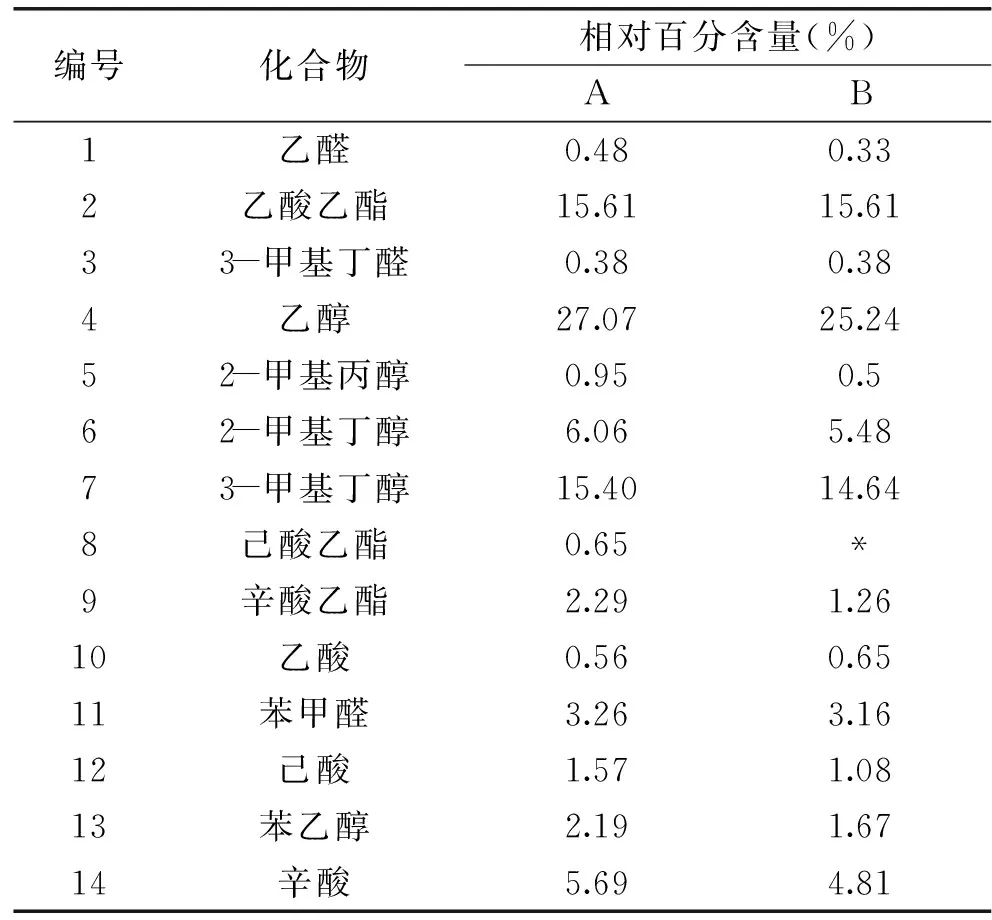
表6 2种发酵样品中挥发性成分的气-质联用分析结果Table 6 GC-MS analysis of volatile components in two fermented samples
注:表中* 为不含有该种物质。
由表6可知,在A和B酵母菌发酵产物中醇类物质种类相同,A产生的醇类物质相对百分含量为51.67%,B产生的醇类物质相对百分含量为47.53%;A酵母菌产生的酯类风味物质比B酵母菌多了己酸乙酯这种中短碳链的脂肪酸乙酯,己酸乙酯具有水果的清香味,是我国食品添加剂使用卫生标准允许使用的食用香料。因此,A酵母菌产生的酯类物质呈现的风味比B产生的风味较丰富。在酸类和醛类挥发性物质方面,A和B产生的这两类风味物质种类相同,各类物质相对百分含量接近。
综上所述,高密度优化培养的马克斯克鲁维酵母与乳源培养基培养的同一马克斯克鲁维酵母发酵乳饮品在感官评定结果方面,两种发酵乳感官分值差异不显著,表明高密度马克斯克鲁维酵母菌适宜于乳饮品发酵。
3 结论
通过对马克斯克鲁维酵母增殖条件优化,结果表明YPD培养基为马克斯克鲁维酵母高密度培养的最佳基础培养基;优化后高密度培养基成分为,蔗糖67.37 g/L,酵母粉29.7 g/L,玉米浆15.61 g/L,KH2PO44.13 g/L,MgSO40.3 g/L;培养条件为30 ℃、160 r/min、初始pH6.0。优化后培养的马克斯克鲁维酵母生物量为(9.34±0.12) g/L,增殖效果明显。利用高密度马克斯克鲁维酵母与乳源培养基培养马克斯克鲁维酵母进行乳饮品发酵对比实验,两者的口感风味无明显差异,为将来马克斯克鲁维酵母扩培、冻干粉的生产和在乳制品的工业化应用,提供了可靠的研究基础。
[1]范维,张咚咚,张彧,等.马克斯克鲁维酵母对发酵乳中糖代谢的影响[J].食品科学,2015,36(15):128-134.
[2]李新玲,顾瑞霞,闫辉,等.马克斯克鲁维酵母的筛选鉴定与应用[J].乳品加工,2013(15):44-46.
[3]陈成.克鲁维酵母发酵乳清蛋白水解液生产乳清营养酒的研究[J].酿酒,2010,37(2):53-55.
[4]LealGA,GomesLH,Efraim P,et al. Fermentation of cacao seeds with a hybridKluyveromycesmarxianusstrain improved product quality attributes[J]. FEMS Yeast Research,2008,8(5):788-798.
[5]Gustavo Graciano Fonseca,Elmar Hein Zle,Christoph Wittmann,et al. The yeastKluyveromycesmarxianusand its biotechnological potential[J]. Microbiol Biotechnol,2008,79(3):339-354.
[6]Michael Crafack,Morten B. Mikkelsen,et al. Influencing cocoa flavour usingPichiakluyveriandKluyveromycesmarxianusin a defined mixed starter culture for cocoa fermentation[J]. International Journal of Food Microbiology,2013,167(1):103-116.
[7]Christian LÖSER,Thanet URIT,Anton STUKERT. Formation of ethyl acetate from whey byKluyveromycesmarxianuson a pilot scale[J]. Journal of Biotechnology,2013,163(1):17-23.
[8]郑苗,邓泽元,任志青,等.东方伊萨酵母高密度培养的研究[J].中国食品学报,2016,16(4):96-103.
[9]黄翠姬,刘昭明,张淑智.含醇发酵乳工艺研究[J].四川食品与发酵,2007,43(5):47-51.
[10]杨红敏.奶啤发酵工艺及其香气成分研究[D].保定:河北农业大学,2007,18-19.
[11]康远军.高耐性鲁氏酵母高密度发酵研究[D].武汉:.湖北工业大学,2015,14-15.
[12]Francisco B. Pereira,Pedro M.R. Guimarães,José A. Teixeira,Optimization of low-cost medium for very high gravity ethanol fermentations bySaccharomycescerevisiaeusing statistical experimental designs[J]. Bioresource Technology,2010(101):7856-7863.
[13]房贤坤,丛伟国,刘德林.布拉酵母高密度培养条件的研究[J].安徽农业科学,2012,40(23):11619-11620
[14]Jorgensen,H. Effect of nutrients on fermentation of pretreated wheat straw at very high dry matter content by Saccharomyces cerevisiae[J]. Biochem. Biotechnol,2009,153(1):44-57.
[15]Xue C,Zhao XQ,Yuan WJ,et al. Improving ethanol tolerance of a self-flocculating yeast by optimization of medium composition. World[J]. Microbial Biotechnology,2008(24):2257-2261.
[16]Zhao XQ,Xue C,Ge XM,et al. Impact of zinc supplementation on the improvement of ethanol tolerance and yield of self-flocculating yeast in continuous ethanol fermentation[J]. Journal of Biotechnol,2009,139(1):55-60.
[17]Palukurty MA,Telgana NK,Bora HSR,et al. Screening and optimization of metal ions to enhance ethanol production using statistical experimental designs[J]. Journal of Microbial,2008,2(4):87-94.
[18]Hu CK,Bai FW,An LJ. Enhancing ethanol tolerance of a self-flocculating fusant ofSchizosaccharomycespombeandSaccharomycescerevisiaeby Mg2+via reduction in plasma membrane permeability[J]. Journal of Biotechnology,2003,25(14):1191-1194.
[19]Birch RM,Walker GM. Influence of magnesium ions on heat shock and ethanol stress responses ofSaccharomycescerevisiae[J]. Enzyme Microbial Technol,2000,26(9):678-687.
[20]Nahit AKTAS,HakkBOYACI,Mehmet MUTLU. Optimization of lactose utilization in deproteinated whey by Kluyveromyces marxianus using response surface methodology(RSM)[J]. Bioresource Technology,2006,97(18):2252-2259.
[21]De Coninck J,Bouquelet S,Dumortier V. Industrial media and fermentation processes for improved growth and protease production by Tetrahymena thermophila[J].Microbiol Biotechnol,2000,24(4):285-290.
[22]Anissa HADDAR,Nahed Fakhfakh-Zouari,Noomen HMIDET,et al. Low-cost fermentation medium for alkaline protease production byBacillusmojavensisA21 using hulled grain of wheat and sardinella peptone[J]. Journal of Bioscience and Bioengineering,2010,110(3):288-294.
[23]LVA. Reddy,OVS Reddy. Effect of fermentation conditions on yeast growth and volatile composition of wine produced from mango(Mangifera indicaL.)fruit juice[J]. Food and Bioproducts Processing,2011,89(4):487-491.
[24]Miskiewicz T,Borowiak D.A logistic feeding profile for a Fed-Batch baker’s yeast process[J]. Electronic Journal of Polish a gricultural University,2005(8):1-13.
[25]Debebe Alemayehu,John A. Hannon,Olivia Mcauliffe. Characterization of plant-derived lactococci on the basis of their volatile compounds profile when grown in milk[J]. International Journal of Food Microbiology,2014(172):57-61.
OptimizationofhighdensityfermentationconditionsofKluyveromycesmarxianus
WANGLiang1,HUMan1,WANGJiang-yue1,GONGXiao-fen1,LIUPeng-long2,ZHANTao2,LIYang2
(1.Jiangsu University,School of Food and Biological Engineering,Zhenjiang 212013,China;2.Xinjiang Tianrun Biotechnology Co. LTD,Urumqi 830088,China)
The effects of high density fermentationKluyveromycesmarxianuson nutritional component and cultivation condition of culture medium was studied. Single factor experiment revealed that YPD as the basic medium for the proliferation ofKluyveromycesmarxianus. When the medium was 67.37 g/L sucrose,yeast extract 29.7 g/L,corn steep 15.61 g/L,KH2PO44.13 g/L,MgSO40.3 g/L,initial pH6,fermentation temperature was 30 ℃,stirring speed was 160 r/min,the fermentation biomass of 18 hKluyveromycesmarxianuswas (9.34±0.12) g/L by response surface analysis and culture condition orthogonal test. Fermented dairy experiments showed that there was no obvious difference in bacterial biomass,taste and flavor of fermented dairy produced by high density and skimmed milk medium cultureKluyveromycesmarxianus. Therefore,the optimized high density fermentation medium formula and process conditions were suitable for the cultivation of the yeastKluyveromycesmarxianus.
Kluyveromycesmarxianus;high-density fermentation;multiplication rate;solid-phase micro-extraction-gas chromatography-mass spectrometry
2017-02-21
王亮(1966-),男,博士,研究员,主要从事食品微生物方面的研究,E-mail:wangliang_2004wl@163.com。
新疆生产建设兵团工业及高新技术科技攻关与成果转换计划项目(2015AB032);江苏大学高级专业人才科研启动基金(12JDG069)。
TS201.3
:A
:1002-0306(2017)17-0111-09
10.13386/j.issn1002-0306.2017.17.022

