乙型脑炎病毒的实时荧光定量逆转录PCR检测方法的建立
孙莉 陈路 王华贵 赵相胜 胡小许 迟洪霞 祁荣 吴伟立★
乙型脑炎病毒的实时荧光定量逆转录PCR检测方法的建立
孙莉1陈路2王华贵3赵相胜2胡小许2迟洪霞4祁荣4吴伟立3★
目的建立一种可以准确、快速、特异检测乙型脑炎病毒(Japanese encephalitis virus,JEV)的一步法实时荧光定量逆转录 PCR(reverse transcription⁃quantitative real time PCR,RT⁃qPCR)体系。方法参照NCBI数据库的乙脑病毒全基因组序列,经过一致性比对分析,在乙脑病毒保守的3′非翻译区(3′untranslated region,3′UTR)区段,设计相应的特异性引物以及Taqman⁃MGB探针,优化检测体系及反应条件,建立一步法RT⁃qPCR方法。利用登革热、森林脑炎病毒、肠道病毒71型(EV71)、柯萨奇病毒A16型(CoxA16)、狂犬病毒培养物和临床诊断为登革热及手足口病人的血清样本检测其交叉反应。选择15例疑似脑炎症状的病人血清样本,以国家食品药品监督管理总局(CFDA)批准的乙脑病毒检测试剂盒作对照试剂盒,检测其临床适用性。结果所建立的乙脑病毒一步法RT⁃qPCR检测方法重复性试验Ct值的变异系数CV在0.46%~0.53%之间,最低可检出5 copies/反应样本。检测体系与登革热、森林脑炎病毒等黄病毒及EV71、CoxA16、狂犬病毒培养物等未发现交叉反应;64份临床诊断为登革热和手足口病人的血清样本检测也均为阴性。15份疑似乙脑感染的病人血清样本的检测结果与国家食品药品监督管理总局批准的乙型脑炎病毒检测试剂盒检测结果一致,但本方法操作步骤更少,检测时间更短。结论本实验建立的乙型脑炎病毒一步法实时荧光RT⁃qPCR检测方法具有较高灵敏度、特异性,可用于乙型脑炎病毒的检测。
乙型脑炎病毒;Taqman⁃MGB;流行性乙型脑炎;RT⁃qPCR
流行性乙型脑炎又称为日本乙型脑炎,简称乙脑,是由日本乙型脑炎病毒(Japanese encephali⁃tis virus,JEV)引起的一种中枢神经系统感染的急性传染病,也是一种人兽共患的自然疫源性疾病,临床上以高热、意识障碍、抽搐、呼吸衰竭及脑膜刺激为特征。乙脑病毒为单股正链RNA黄病毒(Flavivirus)。病毒RNA只含一个开放阅读框(open redaing frame,ORF),编码3个结构蛋白(C蛋白、PrM/M蛋白、E蛋白)和7个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5)。根据E蛋白基因序列的同源性,可将JEV分为进化关系上存在明显差异的5个基因型(Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ),各基因型的分布有一定的区域性[1⁃2]。乙脑是亚洲最常见的一种病毒性脑炎,每年至少50 000例临床病例,其中多数为10岁以下儿童,导致约10 000人死亡,另有约15 000例留有长期的神经⁃精神性后遗症[3]。我国是乙脑流行的高发地区,近年来虽经对儿童实施计划免疫接种,使发病率明显下降,但目前发病人数仍占世界乙脑病例的80%以上。乙脑临床上与近年高发的肠道病毒感染引起的脑炎也难以区分[4]。因此构建快速、灵敏、准确的JEV检测方法对控制JEV引起的急性脑炎具有重要意义。目前比较常见的乙脑诊断方法有病毒分离、血清学诊断和常规逆转录聚合酶链反应(reverse transcription PCR,RT⁃PCR)检测。由于JEV病毒载量低,利用细胞和小鼠来分离培养JEV具有分离困难且工作量大,检测时间长的缺点,临床应用有较大局限性[5⁃6]。血清学诊断则存在灵敏度较低的缺点。实时荧光定量逆转录PCR(re⁃verse transcription⁃quantitative real time PCR,RT⁃qPCR)与上述方法相比具有特异性高、本底低、结果易分析等优点,已经成功应用于病原体检测、等位基因检测、信号传导等研究中[7]。本研究以乙脑病毒基因组保守的3′非翻译区(3′untransla⁃teel region,3′UTR)区设计引物和 Taqman⁃MGB探针,建立了准确、特异的JEV一步法实时检测体系。
1 材料及方法
1.1 毒株与样本
登革病毒1型、2型、3型、4型,森林脑炎病毒,狂犬病毒,肠道病毒71型(enterovirus 71,EV71),柯萨奇病毒A16型(coxsackie virus A16,CoxA16)分离培养株均来自于中国人民解放军军事医学科学院微生物流行病研究所。
37例临床诊断为登革热血清样本由广州疾病预防控制中心提供。27份临床诊断为手足口病的病人血清由华北石油管理局总医院收集。15份发热伴有脑炎症状的病人急性期(发病1~5天)和恢复期血清由华北石油管理局总医院收集。
1.2 主要试剂和仪器
病毒核酸提取试剂盒(QIAamp®Viral RNA Mini Kit)购自德国QIAGEN公司;DH5α感受态细胞、QuantOne Step qRT ⁃PCR Kit(Probe)(FP304)购自天根生化科技(北京)有限公司;PAR⁃1重组表达载体由本实验室自主研发保存。乙型脑炎病毒抗体IgG检测试剂盒(酶联免疫吸附法)、流行性乙型脑炎病毒核酸检测试剂盒(PCR⁃荧光探针法)来自于北京华大吉比爱生物技术有限公司。
StepOnePlusTMPCR荧光仪(ABI,美国),Nano⁃Drop 2000[赛默飞世尔科技(中国)有限公司],超声波细胞粉碎机(JY92⁃II,宁波新芝生物科技股份有限公司)。
1.3 引物探针设计与合成
本研究所用的序列信息来自于NCBI Gen⁃Bank(https://www.ncbi.nlm.nih.gov/),下载所有上传的乙脑序列信息,输入自主研发的一致性分析软件分析得到相对保守的UTR区域序列,利用ABI软件包Primer Express3.0设计的特异引物及Taqman⁃MGB探针均由上海invitrogen公司合成。其序列及标记信息分别为:RT⁃F(5′CCAGTCTATTCCCAGGTGTCAA3′);RT ⁃R(5′GCTGTAGAGGAGGTGGAAGGAC3′);RT⁃P(5′FAM⁃TGCGGGGTCTCCT⁃MGB 3′)。
1.4 参考品的构建与定量
乙脑病毒定量参考品为体外重组构建的乙脑病毒UTR基因假病毒,具体步骤如下:体外合成乙脑病毒UTR基因的保守区域,将该片段与表达载体pAR⁃1连接后转化到大肠杆菌DH5α,筛选阳性克隆,经测序验证序列为乙脑病毒UTR基因序列。然后将阳性菌株37℃培养4 h左右加入终浓度为1 mmol/L IPTG进行诱导4 h以表达假病毒RNA,3 000 r/min离心10min收集菌体,采用超声裂解液重悬,超声破碎(40%振幅,350 W,停5 s,超声5 s,30个循环),8 000 r/min冷冻离心10min,收集上清并加入DNase消化,即为制备的假病毒溶液。
利用Thermo scientific Nano Drop 2000分光光度计,测定其OD值,通过公式(6.02×1023拷贝数/摩尔)×(浓度g/μL)/(MW g/mol)=copies/μL换算为拷贝数。
1.5 病毒核酸提取
采用 QIAamp®Viral RNA Mini Kit试剂盒,按照说明书进行提取RNA,提取的总RNA于-80℃冰箱保存备用。
1.6 一步法RT⁃qPCR
一步法反应体系严格按照QuantOne Step qRT⁃PCR Kit(Probe)使用说明书进行配制,30μL 反应体系包括 2×QuantOne Step Probe RT⁃qPCR Mas⁃ter Mix 15μL,HotMaster Taq Polymerase(2.5 U/μL)1.2μL,Quant Rtase 0.7μL,上、下游引物0.75μL,探针为 0.5μL,模板 4μL,去离子水补充到30μL体系。对RT⁃qPCR反应体系中引物和探针浓度进行筛选,以获得最佳扩增效率和最好的荧光强度。默认设置40个循环,95℃变性15 s,58℃扩增45 s。检测仪器为ABI StepOnePlusTMPCR荧光仪。
1.7 酶联免疫吸附测定(enzyme linked immuno⁃sorbent assay,ELISA)检测
15份发热伴有脑炎症状的血样采用ELISA进行抗体IgG检测,乙型脑炎病毒抗体IgG检测试剂盒(酶联免疫吸附法)来自于北京华大吉比爱生物技术有限公司。双份阳性的样本进行倍比稀释测定滴度变化。
1.8 重复性试验
同一 PCR 板上以 103、104、105copies/μL 的乙脑病毒核酸为模板,各重复测定6孔,计算检测乙脑病毒 Ct的平均值()公式(1)和标准差(SD)公式(2),按如下公式(3)计算变异系数(CV)。

1.9 灵敏度检测
将提取好的标准品RNA从105copies/μL开始进行10 倍系列稀释到 104、103、102、1014 个梯度,并进一步对倍稀释4个梯度(5、2.5、1.25、0.625)后进行荧光检测。
1.10 特异性检测
登革病毒1型、2型、3型、4型,森林脑炎病毒,EV71,CoxA16,狂犬病毒培养物提取RNA后,经荧光PCR检测并统一稀释至1×107copies/μL,检测是否有交叉反应。37份临床诊断为登革热病人的血清样本和27份临床诊断为手足口病人的血清样本分别经核酸提取后,检测是否存在交叉反应。
对来自于华北石油管理局总医院15例发热病人血清样本分别应用北京华大吉比爱生物技术有限公司流行性乙型脑炎病毒核酸检测试剂盒(PCR⁃荧光探针法)、乙型脑炎病毒抗体IgG检测试剂盒(酶联免疫吸附法)和本检测体系同时进行检测。对来自于广州疾病预防控制中心37例临床诊断为登革热血清样本和华北石油管理局总医院收集的27份临床诊断为手足口病的病人血清采用本检测体系进行检测。
2 结果
2.1 一步法荧光检测体系的建立
在30μL的反应体系中,当上下游引物工作浓度为 10 μmol/L 加入 0.75μL,Taqman⁃MGB 探针工作浓度为 10 μmol/L 加入 0.5μL,退火温度为58℃,其余反应成分及程序均按照试剂说明书配置时,能获得最佳荧光吸收信号。建立最佳的检测体系。
2.2 重复性检测结果及分析
将提取定量后的假病毒RNA稀释为103、104、105copies/μL重复测定6次,进行荧光检测。通过计算得到:3个稀释度样品6个重复反应获得的Ct值的变异系数CV在0.46%~0.53%之间,数据详见表1。

表1 一步法RT⁃qPCR重复性测试结果Table 1 The reproducibility test results of one⁃step RT⁃qPCR
2.3 灵敏度验证及最低检测限的分析
将提取定量后的假病毒RNA按10倍梯度从105稀释至101copies/μL,并进一步对比稀释至0.625 copies/μL,经检测发现:从105copies/μL开始标准品稀释到 105、104、103、102、1015 个梯度,进行荧光检测,能得到线性关系良好的扩增曲线,见图1。进一步对比稀释,在浓度为5 copies/μL,重复20次,18次可以获得荧光,见图2,表明可以达到5 copies/μL的最低检测限。
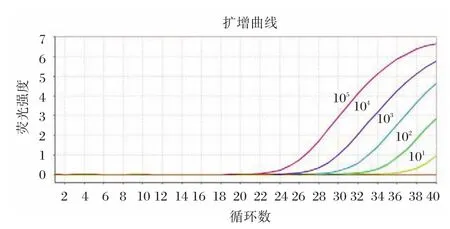
图1 梯度稀释的RNA标准品扩增曲线Figure 1 Serial dilutions RNA standard amplification curve
2.4 一步法RT⁃qPCR的特异性结果及分析
利用该检测体系对登革病毒1型、2型、3型、4型,狂犬病毒,森林脑炎病毒,EV71,CoxA16病毒培养物进行3次重复检测,所有扩增结果显示均为阴性,结果见图3。

图2 5 copies/反应时重复检测20次扩增曲线Figure 2 Amplification curve of 5 copies/reaction for 20 repeats

图3 其它能够引起脑炎的相关病毒分离培养物扩增曲线Figure 3 Amplification curve of other related virus isolation Cultures that can cause encephalitis
来自于广州疾病预防控制中心37例临床诊断为登革热血清样本和华北石油管理局总医院收集的27份临床诊断为手足口病的病人血清样本,本检测体系检测结果均为阴性。
对来自于华北石油管理局总医院15例发热病人血清样本分别应用2种荧光定量逆转录PCR和ELISA方法同时进行检测,检测结果见表2。13例经2种实时荧光PCR检测均为乙脑病毒阳性,其对应的双份血清ELISA抗体检测结果显示9例存在阳转和4例存在4倍升高。2例样本实时荧光PCR检测为阴性,其中一例样本双份血清检测结果均为阴性,一例样本双份血清结果均为阳性,但滴度无显著改变。

表2 15例发热病人3种方法检测结果Table 2 The detection results of 15 fever patients by 3 methods
3 讨论
JEV是一种危害严重的人畜共患的虫媒病毒,主要由蚊子和较小的蜱传播,人类通常是终末宿主,因此对人类的健康及养殖业有较大的威胁。国内尽管通过大规模使用疫苗使发病率大幅度下降,但近年来乙脑疫情出现了重新上升的趋势,部分地区时有暴发或流行且JEV仍是引起病毒性脑炎的主要病原[8]。病毒性脑炎的早期诊断能有效减轻免疫引起的脑组织损伤,降低后遗症发生率及死亡率,也是治疗成功的关键[9]。传统的实验室检测主要采用病毒分离培养、酶联免疫吸附试验、脑电图和影像学检查的方法诊断病毒性脑炎。JEV分离培养是检测的“金标准”,但由于其低通量和低灵敏性的缺点,不适合大规模临床应用。ELISA的方法虽然也可对JEV进行检测,但是会与其他黄病毒属病毒(如登革病毒)出现交叉反应。同时上述检测方法整个过程操作复杂,耗时长,无法起到对病毒快速诊断的作用。与传统检测技术相比,核酸检测方法由于灵敏度和特异性方面的优势,已成为实验和临床诊断常用的检测手段[10]。其中,实时荧光定量PCR技术既保持了传统PCR技术灵敏度高等特点,又克服了传统PCR技术中存在的假阳性和不能准确定量的缺点,并且具有实验重复性好、省时省力、快速、特异性好等特点。实时荧光定量PCR技术已经成熟应用于多种细菌及病毒性疾病的临床诊断[11⁃12]。然而针对JEV 的实时荧光定量PCR 检测方法相对较少。
本研究建立了检测乙脑病毒的一步法RT⁃qP⁃CR检测体系,相比于传统的乙脑病毒实验室检测方法,该检测方法在灵敏度、特异性以及操作方便性、时效性等方面具有极大优势。其重复性试验Ct值的变异系数CV在0.46%~0.53%之间,低于研究报道的CV[13]。本研究建立的JEV检测体系灵敏度更高,最低可以检测到5 copies/反应的假病毒稀释液,低于目前已报道的荧光定量PCR最低检测限(10 copies/反应)[14]。通过检测临床常见的同种属相近的及引起症状相似的其他病原体,相互之间不存在交叉反应。表明本研究建立的检测体系能够特异的对乙脑病毒进行检测。应用本检测体系与北京华大吉比爱生物技术有限公司研制的流行性乙型脑炎病毒核酸检测试剂盒(PCR⁃荧光探针法)、乙型脑炎病毒抗体IgG检测试剂盒(酶联免疫吸附法)分别对15份发热病人样本进行检测,对比本检测体系与同类试剂盒的一致性、灵敏性、实用性等。发现本检测体系与吉比爱PCR⁃荧光探针法检测试剂盒结果一致,检出的13例阳性样本也与ELI⁃SA检测结果吻合。其中,ELISA检测方法较2种PCR⁃荧光探针方法多检出一例阳性,后续临床验证排除乙脑病毒感染。表明ELISA法会出现假阳性结果。而本研究建立的乙脑病毒一步法RT⁃qPCR检测方法可以提高对乙脑病毒的检出率和准确率,相比于ELISA检测方法具有明显优势[15⁃16]。
本研究建立的一步法RT⁃qPCR检测体系结合应用原有RT⁃PCR和实时荧光PCR的优势,使逆转录和荧光定量PCR扩增过程同步进行。相对于传统的逆转录和PCR分开进行,既减少了cDNA二聚体的形成,提高扩增反应效率;同时减少操作步骤,缩短检测时间。本检测体系在85min内可完成对乙脑病毒的快速检测,比吉比爱的PCR⁃荧光探针法检测试剂盒检测时间缩短了近30min。而乙脑病毒感染的早期诊断可以有效减轻免疫引起的脑组织损伤,降低乙脑病毒感染后遗症的发生率及死亡率。
综上所述,本研究建立的乙脑病毒一步法RT⁃qPCR检测体系具有较强的特异性和较高的敏感性,并进一步简化了操作步骤,缩短了检测时间,能够实现对乙脑病毒的早期快速检测。可为乙脑病毒的临床诊断和疫情暴发时的实验室应急诊断提供快速有效的实验室筛查手段。
参考文献
[1]Arroyo J,Guirakhoo F,Fenner S,et al.Molecular ba⁃sis for attenuation of neurovirulence of a yellow fever Virus/Japanese encephalitis virus chimera vaccine(ChimeriVax⁃JE)[J].J Virol,2001,75(2):934⁃942.
[2]张慧艳,高晓艳,崔世恒,等.我国新出现的基因V型乙脑病毒全基因组分子特征[J].中华微生物学和免疫学杂志,2015,35(2):81⁃86.
[3]方挺,郭延波,潘兴强,等.2005⁃2010年浙江省宁波市流行性乙型脑炎流行病学分析[J].疾病监测,2012,27(3):192⁃194.
[4]蔡宝祥.近年来我国流行性乙型脑炎研究进展[J].畜牧与兽医,2009,41(8):1⁃4.
[5]高正琴,岳秉飞,贺争鸣.乙脑病毒RT⁃PCR检测方法的建立及应用[J].药物分析杂志,2010,30(10):1928⁃1931.
[6]孙圣福.日本乙型脑炎实验室诊断方法的研究和应用[D].武汉:华中农业大学,2004.
⑥杜安世《卜算子》(尊前一曲歌):双调46字,上阕4句2仄韵,下阕4句3仄韵。句式:55733。55733。
[7]Kutyavin IV,Afonina IA,Mills A,et al.3′⁃minor groove binder⁃DNA probes increase sequence specifici⁃ty at PCR extension temperatures[J].Nucleic Acids Res,2000,28(2):655⁃661.
[8]赫晓霞,王环宇,付士红,等.2010年福建省流行性乙型脑炎病毒监测[J].中华实验和临床病毒学杂志,2012,26(2):81⁃83.
[9]腾伟禹.单纯疱疹病毒性脑炎的治疗[J].实用药物与临床,2006,9(5):272⁃274.
[10]Mahony JB.Detection of respiratory viruses by molecu⁃lar methods[J].Clin Microbiol Rev,2008,21(4):716⁃747.
[11]管义祥,沈剑虹,居兴云,等.基因学快速检测脑脊液常见细菌感染的方法[J].中华神经科杂志,2012,45(8):586⁃589.
[12]钟菲菲,戴赛飞,刘子音,等.实时荧光PCR检测技术在冷冻禽畜肉类沙门氏菌快速分型检验中的应用[J].食品安全导刊,2017,03X(9):87⁃88.
[13]刘卫滨,付士红,宋宏,等.乙型脑炎病毒TaqMan PCR检测方法的建立及初步应用[J].中华微生物学和免疫学杂志,2005,25(8):656⁃662.
[14]霍红.流行性乙型脑炎病毒TaqMan荧光定量PCR检测方法的建立及应用[D].北京:中国农业科学院,2014:43.
[15]Ravi V,Desai A,Balaji M,et al.Development and evaluation of a rapid IgM capture ELISA(JEV⁃Chex)for the diagnosis of Japanese encephalitis[J].J Clin Virol.2006,35(4):429⁃434.
[16]高晓艳,付士红,王环宇,等.流行性乙型脑炎病毒IgG抗体捕获酶联免疫吸附试验检测方法的建立[J].疾病监测,2010,25(2):107⁃110.
Development of one⁃step RT⁃qPCR for detection of Japanese encephalitis virus infection
SUN Li1,CHEN Lu2,WANG Huagui3,ZHAO Xiangsheng2,HU Xiaoxu2,CHI Hongxia4,QI Rong4,WU Weili3★
(1.Clinical Laboratory of Huabei Oil Field Hospital,Renqiu,Hebei,China,062552;2.Beijing Macro&Micro⁃test Bio⁃Tech Co.,Ltd.Beijing,China,101300;3.Beijing Institute of Genomics,Chinese Academy of Sciences,Beijing,China,100101;4.Gastroenterology Department of Huabei Oil Field Hospital,Renqiu,Hebei,China,062552)
ObjectiveTo establish a sensitive and specific one⁃step reverse transcription⁃quantitative real time PCR(RT⁃qPCR)method for detection of Japanese encephalitis virus(JEV)infection.MethodsBased on the whole genome sequence of the encephalitis virus in the NCBI database,the corresponding specific primers and Taqman⁃MGB Probe were designed in the 3′untranslated region(UTR)of the Japanese encephalitis virus.The detection system and reaction conditions were optimized.The cross⁃reactivity was measured by using dengue fever virus,forest encephalitis virus,enterovirus 71(EV71),coxsackie virus A16(CoxA16),rabies virus cultures and clinical sera samples of clinically diagnosed dengue fever and hand⁃foot⁃mouth patients.15 patients with suspected encephalitis were enrolled in this study.The Japanese encephalitis virus test kit was registered by the China Food and Drug Administration(CFDA)used as a control kit to detect its clinical applicability.ResultsThe repeatability test revealed that coefficient of variation(CV)of Ct value is 0.46%~0.53%.The sensitivity attends to 5 copies/reaction.No cross⁃reactions were found to dengue,forst encephalitis virus,EV71,CoxA16,rabies virus.The test result of 37 dengue fever and 27 hand⁃foot⁃mouth patients were also negative.The results of present developed method to suspended patients are consistent with the CFDA approved kit while with less manual handling steps and shorted operating time.ConclusionThe developed one⁃step RT⁃qPCR method for detection of encephalitis virus infection with high sensitivity and specificity is suitable to the clinical use.
Japanese encephalitis virus;Taqman⁃MGB;Epidemic encephalitis type B;RT⁃qPCR
作者单位:1.华北石油管理局总医院检验科,河北,任丘062552
2.北京宏微特斯生物科技有限公司,北京101300
3.中国科学院北京基因组研究所,北京100101
4.华北石油管理局总医院消化科,河北,任丘062552
★通讯作者:吴伟立,E⁃mail:wuwl@big.ac.cn
注:孙莉和陈路为并列第一作者