检测人IL-37双抗夹心ELISA方法的建立①
贾 岩 高宇驰 黎四平 王 鑫 陈 晨 余诗炎 庄泽岗 张俊爱 陈章权 徐军发
(广东医科大学检验医学研究所临床免疫学研究室,东莞523808)
检测人IL-37双抗夹心ELISA方法的建立①
贾 岩②高宇驰 黎四平③王 鑫 陈 晨 余诗炎 庄泽岗 张俊爱 陈章权 徐军发④
(广东医科大学检验医学研究所临床免疫学研究室,东莞523808)
目的:建立定量检测人血清IL-37的双抗夹心ELISA。方法:以鼠抗人IL-37单抗作为捕获抗体,制备的兔抗人IL-37多抗作为检测抗体,HRP标记山羊抗兔IgG为二抗,重组人IL-37蛋白为标准品,建立检测人IL-37的双抗夹心ELISA方法。并对该方法的工作条件进行优化,对其灵敏度、线性范围、重复性和对登革热非结构蛋白NS1阳性患者血清IL-37的检测效果进行评价。结果:重组IL-37蛋白为标准品建立的双抗夹心ELISA法检测灵敏度为1.465 μg/L,线性范围为1.465~46.875 μg/L,批内和批间变异系数分别为6.6%和11.7%。采用此方法对诊断为登革热的患者血清进行检测,结果显示非结构蛋白NS1阳性患者IL-37水平显著高于健康人对照组。结论:成功建立了双抗夹心ELISA检测方法,可用于人血清中IL-37的检测。
IL-37;双抗夹心法;ELISA;登革热
IL-37属于白细胞介素-1家族成员,是一种免疫负向调控因子,具有抗炎和免疫抑制作用[1-3]。IL-37存在五种不同的剪切异构体[1-3],其中IL-37b是占主导作用的亚型。IL-37前体包含的经典caspase-1识别位点与其向细胞核内转运及其胞内抗炎作用密切相关[4-9]。有研究表明IL-37在人体多种正常组织(如淋巴结、胸腺、骨髓)[10],人类细胞系(如THP-1、A431)以及肿瘤组织(如肺癌、宫颈癌)中均有表达[11,12]。现已证实IL-37参与多种炎症性疾病和免疫性疾病的发生发展,如肠炎、肝脏缺血再灌注、肥胖、腰间盘退行性变、系统性红斑狼疮、强直性脊柱炎等[14-19]。我们发现活动性肺结核患者血清中IL-37水平升高,经化学药物治疗后下降[20]。
鉴于IL-37的生物学特性,其有可能会成为一种新型炎症标志物,因此,建立一种灵敏、快速检测IL-37的免疫学方法对疾病辅助诊断具有重要价值。本研究在成功制备了抗人IL-37单克隆抗体的基础上,采用单抗-多抗配对,建立了检测人IL-37的双抗体夹心ELISA法,为进一步研制检测人IL-37的ELISA试剂盒奠定了基础。
1 材料与方法
1.1材料 雌性新西兰家兔购自南方医科大学实验动物中心(东莞);Ni2+-NTA凝胶层析柱购于GE公司;透析袋、96孔Corning可拆卸酶标板购于Cornig-Coestr公司;弗氏完全佐剂(CFA)、弗氏不完全佐剂(IFA)购自Sigma公司;预染标准蛋白分子量Marker、TMB-H2O2显色液购于Thermo公司;辣根过氧化物酶(HRP)标记山羊抗兔IgG购自北京博奥森生物技术有限公司;ELISA终止液、BCA蛋白浓度检测试剂盒购于上海碧云天公司;重组IL-37蛋白(本实验室自制[21]);鼠抗人IL-37单克隆抗体(本实验室自制,专利申请号:201610604525.5);多功能酶标仪(基因有限公司syneygy2);ELISA初筛非机构蛋白NS1阳性的登革热患者和体检科检测的健康人血清标本,实验所需缓冲液自行配制。
1.2方法
1.2.1兔抗人IL-37多克隆抗体的制备 按文献方法[21],利用IPTG诱导含质粒pET28a/IL-37的大肠杆菌菌株表达重组IL-37蛋白,将诱导后的菌液进行超声破碎,离心后分别取上清和沉淀样品,进行SDS-PAGE电泳,分析目的蛋白的表达情况。然后对菌体裂解上清液进行Ni2+-NTA凝胶层析纯化,制备人IL-37蛋白,对其进行浓度测定,并用PBS将蛋白稀释至1.0 g/L。第1天取1 ml蛋白与等体积CFA研磨乳化后在兔双后腿足跖处注射抗原,每侧0.5 ml。第10天同样取1 ml蛋白与等体积IFA研磨乳化后在兔双后腿腘窝淋巴结处注射抗原,每侧0.5 ml。第17、24天免疫时无需加入佐剂,直接取1 ml 蛋白分别在背部进行多点注射和大腿肌肉注射,共免疫家兔4次。末次免疫后1周,颈总动脉放血,收集抗血清,以半饱和硫酸铵盐析法初步纯化多抗,分装-80℃保存。未免疫之前取少量兔血清分装-80℃保存,作为阴性对照。
1.2.2兔抗人IL-37多克隆抗体的鉴定 Western blot法检测抗血清特异性,质粒pcDNA3.1-IL-37-GFP转染293-T细胞,48 h后收集细胞,裂解获得真核IL-37-GFP融合蛋白,同时未转染质粒的293-T细胞煮沸裂解作为阴性对照,将以上细胞裂解液进行电泳,转膜。然后加入1∶8 000 稀释的兔抗血清,4℃孵育过夜。次日加入1∶5 000稀释的HRP-山羊抗兔IgG,37℃孵育1 h后暗室曝光。间接ELISA法检测抗血清效价,将纯化的重组IL-37蛋白以5 mg/L包被酶标板,加入系列倍比稀释的抗血清,并设置复孔,未免疫家兔血清同时做相应比例稀释作为对照,37℃ 1 h后加入HRP-山羊抗兔IgG ,加底物显色,终止反应后测A450值,结果以A450/阴性孔A450>2.1的稀释度为最终效价。
1.2.3双抗体夹心ELISA方法的建立 采用0.05 mol/L pH9.6的碳酸盐缓冲液为包被液,稀释鼠抗人IL-37单抗以100 μl/孔包被可拆卸酶标板,4℃条件下包被10 h,PBST洗涤5次。50 g/L脱脂奶粉37℃封闭2 h,PBST洗涤5次。在包被好的酶标板中分别加入NS1阳性患者血清标本100 μl/孔和不同稀释度的重组IL-37蛋白标准品,37℃温育1 h后PBST洗涤5次。加入合适浓度的兔抗人IL-37多抗37℃温育1 h后PBST洗涤5次,最后加入合适浓度的HRP标记山羊抗兔IgG,37℃温育1 h后PBST洗涤5次,加入100 μl/孔的显色底物TMB,37℃避光显色15 min,加 50 μl/孔的H2SO4终止反应,酶标仪检测450 nm处的吸光度值。
1.2.4ELISA方法的条件优化 将兔抗IL-37多抗以1∶4 000、1∶6 000、1∶8 000、1∶10 000四种浓度包被酶标板,同时将HRP标记的山羊抗兔IgG抗体以1∶3 000、1∶5 000、1∶6 000、1∶8 000进行稀释,选取A450值接近1.0时的酶标抗体为最佳工作浓度。采用棋盘滴定法将鼠抗人IL-37单克隆抗体以1∶100、1∶200、1∶400倍稀释包被酶标板上,加入强阳性抗原和阴性对照,抗原抗体稀释液选择50 g/L的脱脂奶粉,各梯度抗原均设置复孔,同时将兔抗人IL-37多克隆抗体稀释为1∶6 000、1∶8 000、1∶10 000。选择强阳性抗原A450值在1.0左右,阴性对照A450值小于0.1为捕获抗体和检测抗体的最佳浓度。确定最佳捕获和检测抗体和酶标二抗浓度后,分别用10 ml/L的胎牛血清和50 g/L脱脂奶粉为封闭液,加入等量抗原和阴性对照,设置4个复孔,其他反应条件不变,按夹心ELISA具体步骤进行实验,计算P/N(阳性孔与阴性孔吸光度比值),取P/N值最大为最佳条件。同样以4℃过夜和37℃ 2 h为封闭时间,4℃过夜或37℃ 1 h为抗原抗体反应时间,每次实验仅改变一个条件,确定最佳反应条件。
1.2.5线性范围的确定 将纯化的IL-37蛋白(0.6 μg/μl)1∶200稀释后进一步倍比稀释,如1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800直至1∶409 600,以蛋白标准品的浓度为横坐标,A450为纵坐标,找出线性范围较好的区间,绘制标准曲线,确定最低检测限。
1.2.6重复性检测 批内重复试验即使用同一批包被的酶标板对46.875 μg/L的纯化抗原重复检测20次,测其A450,计算CV值得出批内误差。批间重复试验分5次检测,浓度为46.875 μg/L的纯化抗原,每次设4个复孔,测其A450,计算CV值得出批间误差。
1.2.7标本检测 采用已建立的双抗体夹心ELISA 方法,对本室保存的40例NS1阳性患者血清和40例正常人血清进行检测,每标本设置复孔。
1.3统计学处理 采用Graphpad 软件计算变异系数和标准差,同时分析登革热患者和健康人血清中IL-37含量;采用非配对t检验分析法,以P<0.05 表示差异有统计学意义。
2 结果
2.1兔抗人IL-37多克隆抗体的鉴定 收集转染pcDNA3.1-IL-37-GFP 48 h的293-T细胞,裂解获得真核IL-37-GFP融合蛋白,分子量为42 kD[22],同时以未转染的293-T细胞作为阴性对照, Western blot结果显示多抗与转染后293-T细胞表达的真核蛋白在Mr 42 kD处有条带产生,而未转染质粒则无条带产生,证明该多抗特异性较好,可以结合真核IL-37蛋白。将纯化的重组IL-37蛋白包被酶标板,IL-37多克隆抗体进行系列倍比稀释,间接ELISA检测抗血清效价,其中1号家兔抗血清效价为1∶128 000,2号家兔抗血清效价为1∶32 000(图1)。
2.2双抗体夹心ELISA检测方法最佳反应条件的确定
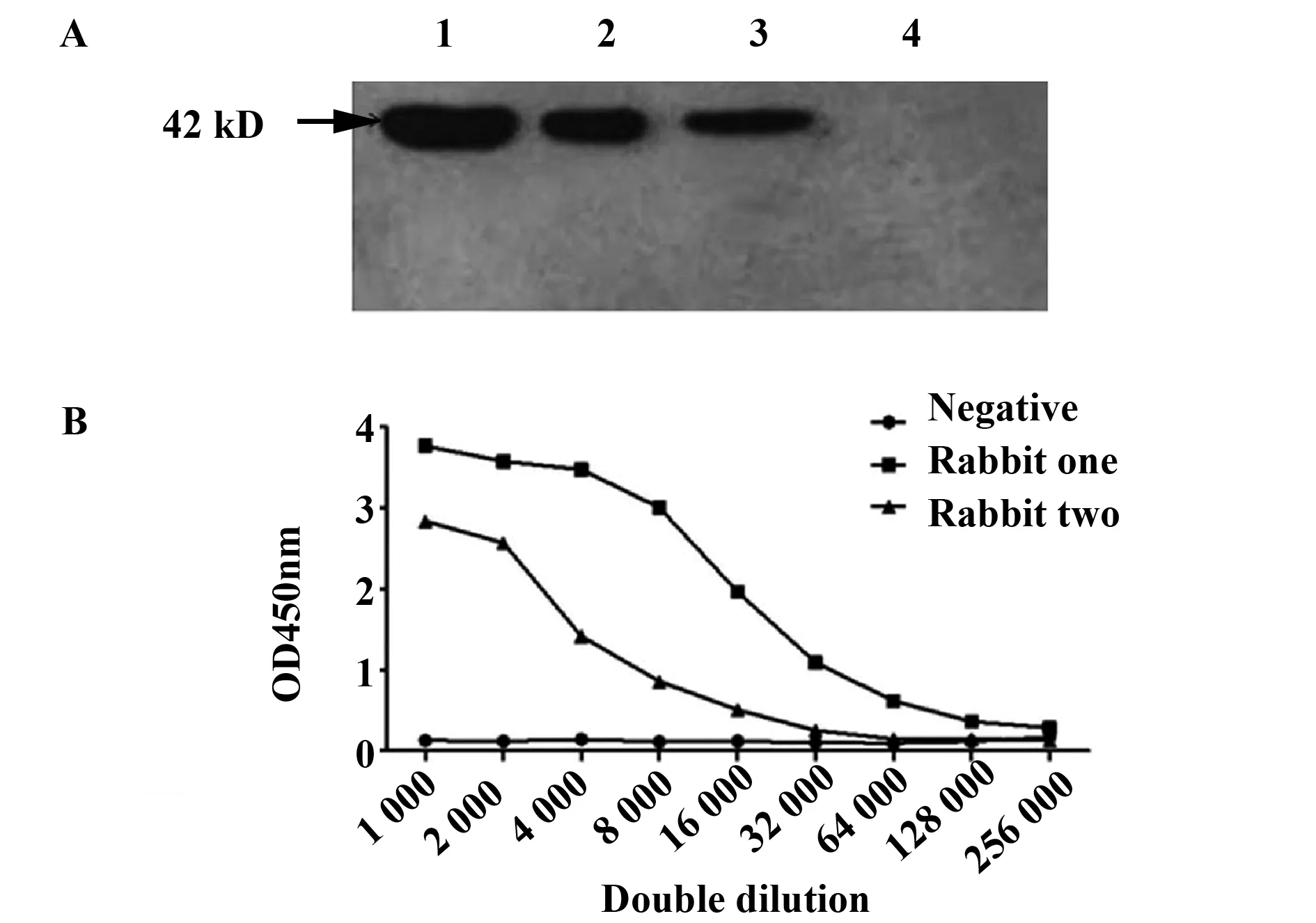
图1 兔抗人IL-37多克隆抗体的鉴定Fig.1 Identification of rabbit anti-human IL-37 polyclonal antibodyNote: 1-3.Eukaryotic protein 20 μl,10 μl,5 μl;4.Empty 293 cell.
2.2.1酶标抗体最佳工作浓度的确定 兔多抗以不同浓度包被酶标板,分别加入1∶3 000、1∶5 000、1∶6 000、1∶8 000稀释的HRP标记的羊抗兔IgG抗体,取A450值接近1.0测定孔的浓度为最佳工作浓度,得出二抗1∶5 000稀释。
2.2.2单抗和多抗最佳工作浓度的确定 根据棋盘滴定法检测结果,取强阳性抗原A450值接近1.0,阴性对照A450值小于0.1测定孔的浓度为最佳工作浓度,得出单抗1∶200稀释,多抗1∶6 000稀释。
2.2.3封闭液、封闭时间、抗原抗体反应时间的确定 1∶200稀释的单抗包板后分别用10 ml/L的胎牛血清和50 g/L脱脂奶粉为封闭液,37℃封闭2 h,加入23.44 μg/L的蛋白标准品和50 g/L脱脂奶粉阴性对照,按夹心ELISA方法进行实验,显色终止反应后检测各孔OD值,结果50 g/L脱脂奶粉的P/N值大于10 ml/L 的胎牛血清,采用50 g/L脱脂奶粉为封闭液。同样方法进行ELISA反应,每次实验控制单个变量,4℃封闭过夜和37℃封闭 2 h的P/N值无明显差异,为节约时间采用37℃ 2 h封闭法。抗原抗体4℃过夜和37℃ 1 h孵育方法相比P/N值也无明显差异,为节约时间采用37℃孵育1 h。
2.2.4线形范围的确定 原浓度为0.6 μg/μl的抗原倍比稀释为1∶200~1∶409 600,分别检测各孔A450值,当标准品浓度在1.465~46.875 μg/L时与A450呈线性相关,回归方程为y=0.041x+0.087 7,R2=0.983 5。标准品浓度为1.465 μg/L时,其A450值/阴性孔A450值>2.1,因此,此方法的最低检出限为1.465 μg/L(见图2)。
根据以上结果,我们确定双抗夹心ELISA方法的最适工作条件为:1∶200稀释的鼠抗人IL-37单抗包被, 50 g/L脱脂奶粉作为封闭液, 以1.465~46.875 μg/L重组IL-37蛋白作为标准品,1∶6 000稀释的兔抗IL-37多抗作为检测抗体,酶标抗体浓度为1∶5 000。

图2 双抗体夹心ELISA的标准曲线Fig.2 Standard curve of double-antibody sandwichELISA
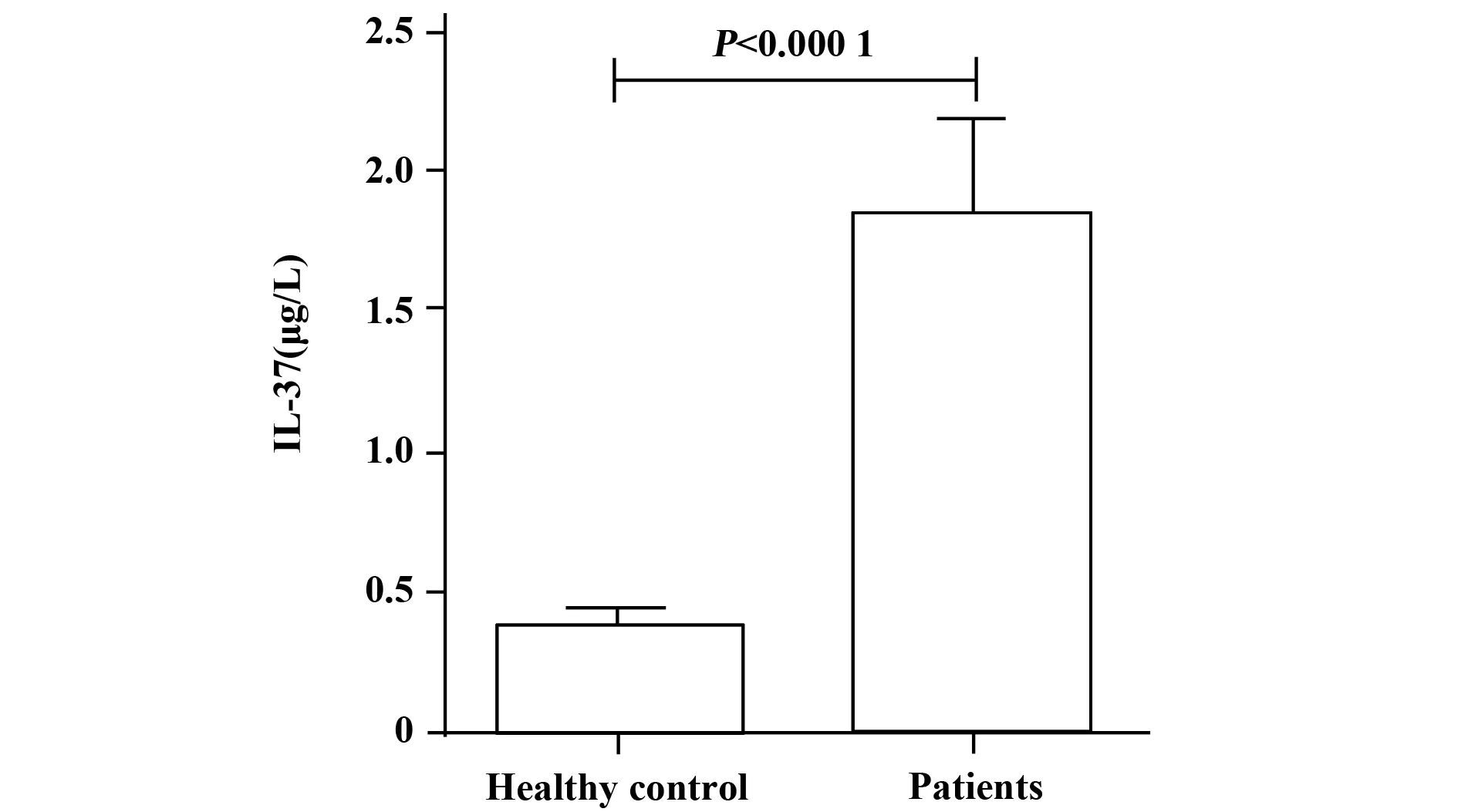
图3 正常人及登革热患者IL-37血清标本检测Fig.3 ELISA of serum samples from healthy control and Dengue patients
2.3重复性检测 批内重复性试验的CV值为6.6%,批间重复性试验的CV值为11.7%,说明本方法的重复性和稳定性均较好。
2.4初步应用 采用本方法对40例ELISA初筛非机构蛋白NS1阳性的登革热患者血清和40例正常人血清进行检测,根据上述直线回归方程式代入各样本OD值,计算出所有样本IL-37浓度,采用Graphpad软件分析,组间比较用t检验,以P<0.05为差异有统计学意义。见图3。
3 讨论
本研究成功制备了高效价的兔抗人IL-37多克隆抗体,并采用单抗-多抗配对建立了检测人IL-37的夹心ELISA方法,并对登革热患者血清进行检测,结果显示该方法可以用于人血清IL-37水平的检测。
IL-37作为一种抑炎因子和免疫抑制因子在炎症反应和免疫调节中起重要作用,有可能会成为一种炎症标志物,检测人血清和血清中IL-37水平已经有报道,目前国际上也有商品ELISA试剂盒供应,但该试剂盒价格昂贵,不利于推广。本研究在制备了鼠抗人IL-37单抗的基础上,成功制备了兔抗人IL-37多抗,利用单抗-多抗配对建立了定量检测IL-37的夹心ELISA方法,结果显示该方法敏感性较高,最低检出限为1.465 μg/L,但线性范围较窄(1.465~46.875 μg/L)。可能是本实验采用大肠埃希菌表达系统,由于原核表达系统进行蛋白表达时在分子修饰方面存在不足,导致与天然存在的蛋白质表位之间存在部分差异。因此,由这种与天然蛋白表位存在差异的蛋白免疫动物后所得抗体其抗原结合表位无法与天然蛋白表位完全吻合,导致抗原抗体之间的亲和力较弱,结合率下降。也有可能是蛋白纯化不足,杂蛋白较多,而与相应单抗结合的目的蛋白较少,因此相应抗原抗体结合率较低,从而导致最低检测限较高,线性范围较窄。结果显示批内CV值为6.6%小于10%,批间CV值为11.7%小于20%,均在可允许范围内,说明本方法的精密度较好。对46.875 μg/L的标准品进行5次重复试验计算得出的样品浓度平均值为48.477 μg/L与真值间的相对误差为99.18%在可允许范围内,说明本方法的准确度较高。同时在建立该方法的过程中,最初我们采用多抗包被作为捕获抗体,HRP标记羊抗鼠IgG为二抗,结果本底偏高,可能是包被的多抗在纯化时存在不足,其他杂蛋白与HRP标记羊抗鼠之间有交叉反应,选择抗人IL-37单抗包被后,阴性对照的A450降至0.05以下,有效地降低了本底,同时本实验选择脱脂奶粉作为反应用稀释液,这样可以在每一步反应中起到再次封闭作用,降低了非特异性结合。
登革热是一种由登革病毒引起的高死亡率急性传染病。其发病机制尚未完全阐明,目前有假说认为与细胞免疫系统有关,在早期登革病毒感染未成熟的朗格汉斯细胞和角化细胞,会引起补体系统和大量非保护T细胞的激活以及炎性细胞因子的过量释放。而IL-37作为一个抑炎因子也会同时升高从而对机体的炎症反应进行免疫调节。我们采用现有的商品试剂盒检测发现初筛登革热非结构蛋白NS1阳性患者血清中 IL-37 水平显著升高(结果待发表)。同样为了验证本研究建立的ELISA方法的可用性,我们对初筛NS1阳性登革热患者和正常对照组血清中IL- 37水平进行检测,结果发现患者血清IL-37水平显著高于健康对照,提示我们建立的ELISA方法可用于临床样本的检测。。
综上所述,本研究建立了检测人IL-37的双抗体ELISA夹心法,并通过初步应用验证了该方法可用于临床样本的检测,为进一步研发试剂盒奠定了基础,但该方法线性范围较窄,检出下限较高,敏感度稍欠,有待进一步优化检测条件。
[1] Banchereau J,Pascual V,O′Garra A.From IL-2 to IL-37:the expanding spectrum of anti-inflammatory cytokines[J].Nat Immunol,2012, 13(10):925-931.
[2] Pan G,Risser P,Mao W,etal.IL-1H,an interleukin 1-related protein that binds IL-18 receptor/IL-1Rrp[J].Cytokine,2001,13(1):1-7.
[3] Taylor SL,Renshaw BR,Garka KE,etal.Genomic organization of the interleukin-1 locus [J].Genomics,2002,79(5):726-733.
[4] Nold MF,Nold-Petry CA,Zepp JA,etal.IL-37 is fundamental inhibitor of innate immunity [J].Nat Immunol,2010,11:1014-1064.
[5] Boraschi D,Lucchesi D,Hainzl S,etal.IL-37:a new anti-inflammatory cytokine of the IL-1 family[J].Eur Cytokine Netw,2011,22:127-147.
[6] Busfield SJ,Comrack CA,Yu G,etal.Identification and gene organization of three novel members of the IL-1 family on human chromosome[J].Genomics,2000,66:213-216.
[7] Kumar S,Hanning CR,Brigham-Burke MR,etal.Interleukin-1F7B (IL-1H4/IL-1F7) is processed by caspase-1 and mature IL-1F7B binds to the IL-18 receptor but does not induce IFN-gamma production[J].Cytokine,2002,18(2):61-71.
[8] Ross R,Grimmel J,Goedicke S,etal.Analysis of nuclear localization of interleukin-1 family cytokines by flow cytometry[J].J Immunol Methods,2013,387(1-2):219-227.
[9] Bulau AM,Nold MF,Li S,etal.Role of caspase-1 in nuclear translocation of IL-37,release of the cytokine,and IL-37 inhibition of innate immune responses[J].Proc Natl Acad Sci U S A,2014,111(7):2650-2655.
[10] Smith DE,Renshaw BR,Ketchem RR,etal.Four new members expand the interleukin-1 superfamily[J].J Biol Chem,2000,275(2):1169-1175.
[11] Akdis M,Burgler S,Crameri R,etal.Interleukins,from 1 to 37,and interferon-γ:receptors,functions,and roles in diseases[J].J Allergy Clin Immunol,2011,127(3):701-721.
[12] Wang S,An W,Yao Y,etal.Interleukin 37 expression inhibits STAT3 to suppress the proliferation and invasion of human cervical cancer cells[J].J Cancer,2015,6(10):962-969.
[13] Dinarello CA,Bufler P.Interleukin-37[J].Semin Immunol,2013,25(6):466-468.
[14] Imaeda H,Takahashi K,Fujimoto T,etal.Epithelial expression of interleukin-37b in inflammatory bowel disease[J].Clin Exp Immunol,2013,172(3):410-416.
[15] Sakai N,Van Sweringen HL,Belizaire RM,etal.Interleukin-37 reduces liver inflammatory injury via effects on hepatocytes and non-parenchymal cells [J].J Gastroenterol Hepatol,2012,27(10):1609-1616.
[16] Ballak DB,van Diepen JA,Moschen AR,etal.IL-37 protects against obesity-induced inflammation and insulin resistance[J].Nat Commun,2014,5:4711.
[17] Wan ZY,Sun Z,Song F,etal.Downregulated interleukin 37 expression associated with aggravation of intervertebral disc degeneration[J].Int J Clin Exp Pathol,2014,7(2):656-662.
[18] Ye L,Ji L,Wen Z,etal.IL-37 inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus:its correlation with disease activity [J].J Transl Med,2014,12:69.
[19] Chen B,Huang K,Ye L,etal.Interleukin-37 is increased in ankylosing spondylitis patients and associated with disease activity [J].J Transl Med,2015,13:36.
[20] 张俊爱,刘淦斌,曾今诚,等.活动性肺结核患者血浆 IL-37的检测及其临床意义[J].细胞与分子免疫学杂志,2015,31(4):520-523.
[21] 赵付前,何素辉,何玲鸽,等.人IL-37在大肠杆菌表达及多克隆抗体的制备与鉴定[J].细胞与分子免疫学杂志,2014,30(5):0513-0516.
[22] 刘 倩,梁庄严,何素辉,等.IL-37融合EGFP真核表达载体的构建及其在293T细胞中的表达[J].实用医学杂志,2015,31(9):1399-1403.
[23] Limon-Flores AY,Perez-Tapia M,Estrada-GarciaI,etal.Dengue virus inoculation to human skin explants:an effective approach to assess in situ the early infection and the effects on cutaneous dendritic cells[J].Int J Exp Pathol, 2005,86(5):323-334.
[收稿2017-03-09 修回2017-05-25]
(编辑 倪 鹏)
EstablishmentofadoubleantibodysandwichELISAfordetectionofhumanIL-37
JIAYan,GAOYu-Chi,LISi-Ping,WANGXin,CHENChen,YUShi-Yan,ZHUANGZe-Gang,ZHANGJun-Ai,CHENZhang-Quan,XUJun-Fa.
DepartmentofClinicalImmunology,InstituteofLaboratoryMedicine,GuangdongMedicalUniversity,Dongguan523808,China
Objective:To establish a double antibody sandwich ELISA assay for detection of human IL-37 in serum.Methods: Mouse anti-human IL-37 monoclonal antibody was used as capturing antibody,rabbit anti-human IL-37 polyclonal antibodies served as detection antibody,HRP labeled goat anti-rabbit IgG employed as second antibody and recombinant human IL-37 protein used as reference standard for the establishment of a doubleantibody sandwich ELISA.The working conditions were optimized,such as sensitivity,linear range,reproducibility and evaluated the serum IL-37 in patients with Dengue fever.Results: The sensitivity of the established ELISA method was 1.465 μg/L approximately.Likewise,the linearity range of this method was about (1.465-46.875) μg/L.Further,the co efficient of variation (CV) of inter-batch and intra-batch in this study were 6.6% and 11.7%,respectively.Notably,this method could be used in the detection of IL-37 in serum of the patients with Dengue fever,showing that the level of IL-37 in Dengue fever patients was much higher than that in healthy controls.Conclusion: The double antibody sandwich ELISA assay for the detection of human IL-37 was successfully established,which can be apply to detect of human IL-37 in clinical samples.
IL-37;Double antibody sandwich;ELISA;Dengue
10.3969/j.issn.1000-484X.2017.09.014
①本文为国家自然科学基金面上项目(81570009,81273237)和广东省自然科学基金面上项目(2015A030313513)。
贾 岩(1991年-),女,硕士,检验技师,主要从事抗体制备及应用方面研究,E-mail:616712591@qq.com。
R392.11R392-33
A
1000-484X(2017)09-1346-05
②佛山市南海区人民医院检验科,佛山528200。
③东莞市第八人民医院检验科,东莞523808。
④通讯作者,E-mail:xujunfa@gdmu.edu.cn。

