体素内不相干运动成像监测脑胶质瘤复发和治疗后反应的初步探讨
, ,效春, ,, ,,
体素内不相干运动成像监测脑胶质瘤复发和治疗后反应的初步探讨
王斌1,张辉2,王效春2,谭艳1,秦江波2,王乐2,李丽娜2,雷颖2
目的探讨磁共振体素内不相干运动成像(IVIM)在监测脑胶质瘤复发和治疗后反应中的应用价值。方法26例脑胶质瘤病人(15例脑胶质瘤复发,11例治疗后反应)在同步放化疗结束2个月内行头部常规MRI扫描、增强扫描及多b值弥散加权扫描,通过IVIM软件的双指数模型,对图像后处理得到standard ADC、slow ADC(D)、fast ADC(D*)、fraction of fast ADC(f)的伪彩图,分别测量病例异常强化区standard ADC值、D值、D*值、f值。采用两样本t检验比较两组各参数值是否存在差异,受试者工作特性曲线(ROC)评估各参数值在脑胶质瘤复发和治疗后反应鉴别诊断的效能。结果复发组强化病灶standard ADC值、D值低于治疗后反应组,差异有统计学意义(P<0.05)。ROC曲线分析,当standard ADC值、D值曲线面积分别为0.703、0.788时,其阈值分别为1.166、0.631,敏感性分别为54.5%、81.8%,特异性分别为86.7%、73.3%;复发组的强化病灶D*值、f值均高于治疗后反应组,差异有统计学意义(P<0.05)。ROC曲线分析,当D*值、f值曲线面积分别为0.752、0.758时,诊断阈值分别为2.642、0.693,敏感性分别为66.7%、81.8%,特异性分别为81.8%、66.7%。结论IVIM可监测脑胶质瘤复发和治疗后反应,为脑胶质瘤病人在临床的进一步治疗提供影像依据。
脑胶质瘤;体素内不相干运动成像放化疗;复发;治疗后反应
脑胶质瘤是颅内常见原发肿瘤,术后易复发,预后差,其治疗以手术切除肿瘤为主,结合放化疗等综合治疗方式[1]。脑胶质瘤复发与治疗后反应的影像学及临床症状相似,但治疗手段不同,因此应用磁共振成像技术监测其预后具有重要临床意义。Le Bihan提出双指数模型的扩散加权成像即体素内不相干运动成像(intravoxel incoherent motion,IVIM),将影响水分子扩散运动的多种因素简化为主要的两种,即膜外水分子扩散和微血管水分子扩散,同时获取扩散和灌注参数。而脑胶质瘤复发与治疗后反应的病理基础不同,前者细胞增殖,细胞密度增高,肿瘤新生血管增多;后者细胞死亡,细胞密度减低,新生血管减少[2]。本研究探讨IVIM在脑胶质瘤复发与治疗后反应监测中的价值。
1 资料与方法
1.1 一般资料 收集2015年10月—2016年12月山西医科大学第一医院术后病理证实为脑胶质瘤且行同步放化疗病人63例,发现新发强化病灶病例26例;通过二次手术病理或超过6个月随访证实,15例脑胶质瘤复发,11例治疗后反应。若同步放化疗结束后6个月内无需变更治疗方案或增强病灶保持稳定或减小,则诊断为治疗后反应;若出现以下情况之一的诊断为肿瘤复发:新病灶出现;除外其他原因引起的临床表现恶化;死亡或病情恶化引起的失随访;明确的不可测量的疾病进展。
1.2 检查方法 MRI扫描采用GE 3.0 T超导型MR扫描仪,采用8通道头线圈。成像参数包括轴位、矢状位T1WI(TR/TE=1 674 ms/20 ms,FOV=24.6 cm),轴位T2WI(TR/TE=6 820 ms/1.6 ms,FOV=22 cm),轴位T2 FLAIR(TR/TE=8 024 ms/126.8 ms,FOV=22 cm),层厚为6.0 mm。增强扫描采用SE-EPI序列,TR=1 500 ms,TE=14.5 ms,FA=90°,激励次数1,视野240×255,矩阵128×128。
IVIM参数采用平面回波成像(EPI)序列,采用0,20,50,100,200,400,800,1 200,1 800,2 500,3 000,3 500,4 000 s/mm2共13个b值,TR=3 000 s,TE=115.5 s,NEX=3,视野24×24,矩阵128×128,层厚为6.0 mm,层间距1.0 mm。
1.3 图像获取与分析 将采集的原始数据导入GE AW4.4后处理工作站,采用Functool软件包处理获得IVIM的standard ADC图、slow ADC图、fast ADC图、fraction of fast ADC图。观察所得各组灌注图,结合常规平扫及增强扫描图像,选肿瘤实性部分强化最明显层面作为分析层面,并在轴位T1WI异常强化区域设置感兴趣区(region of interest,ROI),感兴趣区大小为20 mm2~40 mm2,测量standard ADC值、D值、D*值、f值且避开出血、坏死及囊变区,每处测量3次,求平均值。

2 结 果
2.1 脑胶质瘤术后复发组与治疗后反应组IVIM各参数值比较 脑胶质瘤复发组强化区平均standard ADC值、D值均低于治疗后反应组,差异有统计学意义(P<0.05);脑胶质瘤复发组强化区平均D*值、f值均高于治疗后反应组,差异有统计学意义(P<0.05)。详见表1。
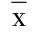
表1 脑胶质瘤复发组和治疗后反应组IVIM各参数值差异比较(±s)
2.2 IVIM各参数值的ROC曲线分析结果(见表2)

表2 IVIM各参数值的ROC曲线分析结果
3 讨 论
脑胶质瘤复发组织学表现与原发肿瘤类似,表现为肿瘤干细胞增殖,包括肿瘤细胞数量增多、密度增加等[3-4],血管内皮细胞增生,肿瘤血管生成,伴随较高的脑血容量及血脑屏障破坏[5-6]。治疗后反应包括假性进展和放射性坏死[7]。假性进展是在肿瘤治疗区可发现一过性强化灶增大或出现新的强化灶,而组织学上无肿瘤细胞存在[8]。放射性坏死病理改变包括出血、水肿、神经细胞死亡,脱髓鞘和血管内皮细胞的损伤和坏死,导致血脑屏障的破坏[7,9-10]。由于肿瘤复发和治疗后反应均可导致血脑屏障破坏,因此常规MRI增强扫描时可在术区及放疗照射视野内出现新的强化病灶,常规磁共振表现难以对二者进行准确监测。与常规MRI不同, IVIM可同时测量组织的灌注和扩散。在生物组织中,不相干运动包括水的分子扩散和血液在毛细管网中的微循环灌注。根据IVIM理论,其成像技术可同时获得毛细管网中的分子扩散和微循环灌注[11]。目前IVIM在中枢神经系统方面主要应用于研究脑胶质瘤术前的诊断和分级[12-13],采用IVIM方法对脑胶质瘤治疗后反应进行评价报道较少。基于脑胶质瘤复发和治疗后反应的病理机制不同,尝试验证IVIM双指数模型得出的灌注和扩散参数两者是否有统计学意义。Shen等[14]认为IVIM同动脉自旋标记及扩散加权成像效果一样,可作为一种新方法评估脑肿瘤的灌注和扩散。Ye等[15]认为IVIM的灌注和扩散参数可鉴别肿瘤复发和治疗后反应,且认为IVIM的灌注和扩散参数的诊断性能较动态磁敏感对比增强MRI(DSC-MRI)更具优势。
本研究结果显示,脑胶质瘤复发组standard ADC值、D值均略低于治疗后反应组,这说明复发组强化病灶的扩散受限程度强于治疗后反应组,其原因为脑胶质瘤复发的强化病灶为肿瘤组织,肿瘤细胞数目增多,密度增加,细胞间隙较小,导致水分子弥散受限,ADC值降低。Zeng等[6]研究发现脑胶质瘤复发组的ADC值明显低于治疗后反应组。Al等[16]研究表明,ADC值可帮助区分肿瘤复发与治疗后反应,肿瘤复发组ADC值明显低于治疗后反应组。
脑胶质瘤复发组强化病灶D*值、f值略高于治疗后反应组,提示脑胶质瘤复发的微循环灌注系数及灌注分数大于治疗后反应,这是由于肿瘤血管生成是一个复杂的多步骤过程,且在形态上表现为血管数量的增加及内皮细胞的增殖,导致组织的血容量及通透性增加。脑胶质瘤复发时血管内皮生长因子(vascular endothelial growth factor,VEGF)表达加强,造成新生血管的生成和代谢活性的增加,肿瘤生长需要大量的毛细血管网供给养份,因此水分子沿血管运动导致的灌注效应更强[17]。Wirestam等[18]证明D*和f的中位值与采用DSC-MRI方法测得的脑血流量值有较好的一致性。
本研究中,脑胶质瘤复发组D*值显著高于反射性损伤组,这说明D*值可反映胶质瘤复发组中血流量的增加,尽管反映血流量的灌注参数D*与实际脑血流量之间关系有待进一步深入研究,但肯定的是D*值可在一定程度上反映脑胶质瘤组织的灌注信息,为监测脑胶质瘤复发和治疗后反应提供有价值信息。Puig等[19]认为f值和D*值与相对脑血流量(rCBF)具有相关性,IVIM可用于测量脑肿瘤灌注,预测胶质母细胞瘤6个月生存率。Kim等[11]研究认为肿瘤复发组灌注的第90百分位数(0.084±0.020)显著高于治疗后反应组(0.040±0.010)(P<0.001)。
IVIM成像用于监测胶质瘤复发和治疗后反应具有几个优点:它可同时获得组织的扩散和灌注信息,且无须图像融合技术即可进行扩散参数和灌注参数的测量;对肾功能受损或对钆造影剂严重过敏的病人,无须静脉注射造影剂IVIM成像即可提供灌注信息;但由于脑胶质瘤浸润性生长特点,通过手术很难完全清除,因此理论上肿瘤残留、复发难以避免,实际上治疗后反应与脑胶质瘤复发在病人的大脑内可能二者并存。因此,可能对本研究结果造成一定程度偏差。由于本研究时间较短,样本量纳入较少,仅得到一个初步比较性结果,因此需要在后续研究中收集更多病例,进行IVIM灌注分数D*值与DSC中灌注参数rCBV的相关性分析,进一步评价IVIM的监测效能。
脑胶质瘤复发和治疗后反应的治疗手段不同,对治疗后反应多采用改善症状等保守治疗,而脑胶质瘤复发则需要放化疗或二次手术。因此探讨监测脑胶质瘤复发及治疗后反应的方法具有重要临床意义。IVIM在监测肿瘤复发与治疗后反应时,可根据其参数值高低将二者加以区分,从而指导临床诊断和治疗。
[1] 《中国中枢神经系统胶质瘤诊断和治疗指南》编写组.中国中枢神经系统胶质瘤诊断与治疗指南(2015)[J].中华医学杂志,2016(7):485-509.
[2] Perez-Torres CJ,Engelbach JA,Cates J,et al.Toward distinguishing recurrent tumor from radiation necrosis:DWI and MTC in a gamma knife-irradiated mouse glioma model[J].International Journal of Radiation Oncology Biology Physics,2014,90(2):446-453.
[3] Stankovic ND,Hoppmann N,Teodorczyk M,et al.No role of IFITM3 in brain tumor formation in vivo[J].Oncotarget,2016,7(52):86388-86405
[4] Feng X,Yu Y,He S,et al.Dying glioma cells establish a proangiogenic microenvironment through a caspase 3 dependent mechanism[J].Cancer Letters,2016,385(1):12-20.
[5] Huang APH,Tsai JC,Kuo LT,et al.Clinical application of perfusion computed tomography in neurosurgery:clinical article[J].Journal of neurosurgery,2014,120(2):473-488.
[6] Zeng QS,Li CF,Liu H,et al.Distinction between recurrent glioma and radiation injury using magnetic resonance spectroscopy in combination with diffusion-weighted imaging[J].International Journal of Radiation Oncology Biology Physics,2007,68(1):151-158.
[7] Siu A,Wind JJ,Iorgulescu JB,et al.Radiation necrosis following treatment of high grade glioma-a review of the literature and current understanding[J].Acta Neurochirurgica,2012,154(2):191-201.
[8] Taal W,Brandsma D,de Bruin HG,et al.Incidence of early pseudo-progression in a cohort of malignant glioma patients treated with chemoirradiation with temozolomide[J].Cancer,2008,113(2):405-410.
[9] Robbins M,Greene-Schloesser D,Peiffer AM,et al.Radiation-induced brain injury:a review[J].Frontiers in oncology,2012,2:73.
[10] Rahmathulla G,Marko NF,Weil RJ.Cerebral radiation necrosis:a review of the pathobiology,diagnosis and management considerations[J].Journal of Clinical Neuroscience,2013,20(4):485-502.
[11] Kim HS,Suh CH,Kim N,et al.Histogram analysis of intravoxel incoherent motion for differentiating recurrent tumor from treatment effect in patients with glioblastoma:initial clinical experience[J].American Journal of Neuroradiology,2014,35(3):490-497.
[12] Togao O,Hiwatashi A,Yamashita K,et al.Differentiation of high-grade and low-grade diffuse gliomas by intravoxel incoherent motion MR imaging[J].Neuro-Oncology,2016,18(1):132-141.
[13] 卫华,张辉,王效春,等.平均峰度在脑星形细胞瘤分级中的应用价值[J].中西医结合心脑血管病杂志,2014,12(5):591-592.
[14] Shen N,Zhao L,Jiang J,et al.Intravoxel incoherent motion diffusion-weighted imaging analysis of diffusion and microperfusion in grading gliomas and comparison with arterial spin labeling for evaluation of tumor perfusion[J].Journal of Magnetic Resonance Imaging,2016,44(3):620-632.
[15] Ye J,Bhagat SK,Li H,et al.Differentiation between recurrent gliomas and radiation necrosis using arterial spin labeling perfusion imaging[J].Experimental and Therapeutic Medicine,2016,11(6):2432-2436.
[16] Al Sayyari A,Buckley R,McHenery C,et al.Distinguishing recurrent primary brain tumor from radiation injury:a preliminary study using a susceptibility-weighted MR imaging-guided apparent diffusion coefficient analysis strategy[J].American Journal of Neuroradiology,2010,31(6):1049-1054.
[17] Jain R,Gutierrez J,Narang J,et al.In vivo correlation of tumor blood volume and permeability with histologic and molecular angiogenic markers in gliomas[J].American Journal of Neuroradiology,2011,32(2):388-394.
[18] Wirestam R,Borg M,Brockstedt S,et al.Perfusion-related parameters in intravoxel incoherent motion mr imaging compared with cbv and cbf measured by dynamic susceptibility-contrast Mr technique[J].Acta Radiologica,2001,42(2):123-128.
[19] Puig J,Sanchez-Gonzalez J,Blasco G,et al.Intravoxel incoherent motion metrics as potential biomarkers for survival in glioblastoma[J].PloS One,2016,11(7):e0158887.
(本文编辑薛妮)
国家自然科学基金面上项目(No.81471652);山西省自然基金面上青年基金项目(No.201601D021162)
1.山西医科大学(太原 030001);2.山西医科大学第一医院
张辉,E-mail:zhanghui_mr@163.com
信息:王斌,张辉,王效春,等.体素内不相干运动成像监测脑胶质瘤复发和治疗后反应的初步探讨[J].中西医结合心脑血管病杂志,2017,15(17):2202-2204.
R739.4 R273
:Bdoi:10.3969/j.issn.1672-1349.2017.17.038
:1672-1349(2017)17-2202-03
2017-02-21)

