梅花鹿鹿茸尖端组织Tβ-4基因全长cDNA的分离与生物信息学分析
黄皓郝丽肖向红刘畅李和平柴龙会张晶钰
(东北林业大学,哈尔滨,150040)
梅花鹿鹿茸尖端组织Tβ-4基因全长cDNA的分离与生物信息学分析
黄 皓 郝 丽肖向红 刘 畅李和平 柴龙会 张晶钰
(东北林业大学,哈尔滨,150040)
稿件运行过程
鹿茸; 胸腺素β4; cDNA文库; 分离; 生物信息学
鹿是十分珍贵的药用动物,几乎全身都可入药和经济利用,而鹿茸是其中重要的产品之一[1]。鹿茸是雄鹿(驯鹿除外)未骨化密生茸毛的幼角[2-3],是唯一具有周期性再生能力的哺乳动物器官[4],作为鹿体最活跃的生长点,拥有惊人的生长速度(最快可达2 cm/d)[5-6],现已成为研究哺乳动物细胞增殖、生长与分化的理想材料,可作为模拟哺乳动物器官再生及创伤修复得天独厚的理想动物模型[7-8]。
胸腺素(Thymosins)是由胸腺产生的一种淋巴生长因子,依据胸腺提取物组分等电点的不同,可划分为α、β、γ 3个生化组成不同和功能不同的多肽家族,其β族胸腺素(Thymosin β,Tβ)属极性蛋白质分子家族,有着不同程度地影响血管发生以及诱导凋亡的特性[9-10]。目前已发现15种,Tβ-4、Tβ10和Tβ15为主要成员,而其中Tβ-4亚型分布最广泛,含量最多[11-12],是目前研究的热点之一[13-14]。在绝大多数哺乳动物细胞中,Tβ-4 被认为是主要的G-肌动蛋白(G-actin)结合肽,其主要生理功能是能够遮蔽单体G-actin的ATP结合位点,能与G-actin按1∶1比例结合成G-肌动蛋白-Tβ-4复合体,从而阻断其聚合成微丝,在维持细胞骨架的动态平衡中起着重要作用[15]。Tβ-4不仅具有免疫活性,而且表现出多重生物学功能,参与了血管生成[16]、神经发育[17-18]、创伤愈合[19-20]、炎症反应[21]、细胞凋亡[22]、恶性肿瘤发生[23-24]及毛囊发育[25]等多种生理、病理学过程的调节。
本实验室从构建的cDNA文库的ESTs(表达序列标签)测序数据分析中发现Tβ-4基因为鹿茸尖端组织绝对高丰度表达基因,提示它可能是鹿茸发育过程中重要的调节因子。因此,本研究从梅花鹿鹿茸尖端组织全长cDNA文库中首次成功克隆了具有完整编码区的 Tβ-4基因的全长cDNA序列,并利用生物信息学方法对其序列进行了结构分析,为进一步研究Tβ-4的生物学功能及其在鹿茸生长发育中的分子调控机理奠定基础。
1 材料与方法
1.1材料
选取人工驯养的4岁健康东北梅花鹿(Cervus nippon)公鹿为试验动物,在其生茸至二杠茸型时,将鹿麻醉,采集茸顶端组织为试验样品(该处为鹿茸生长发育中细胞增殖、生长和分化中心)。用手术刀迅速切取鹿茸顶端约4 cm组织用酒精棉擦去茸皮表面污物,参照Li等[26]对马鹿(Cervus elaphus)生长顶端的分层方法(图1),切取皮肤层、间充质层、前软骨层和软骨层组织各25 mg,总共100 mg,于液氮保存。
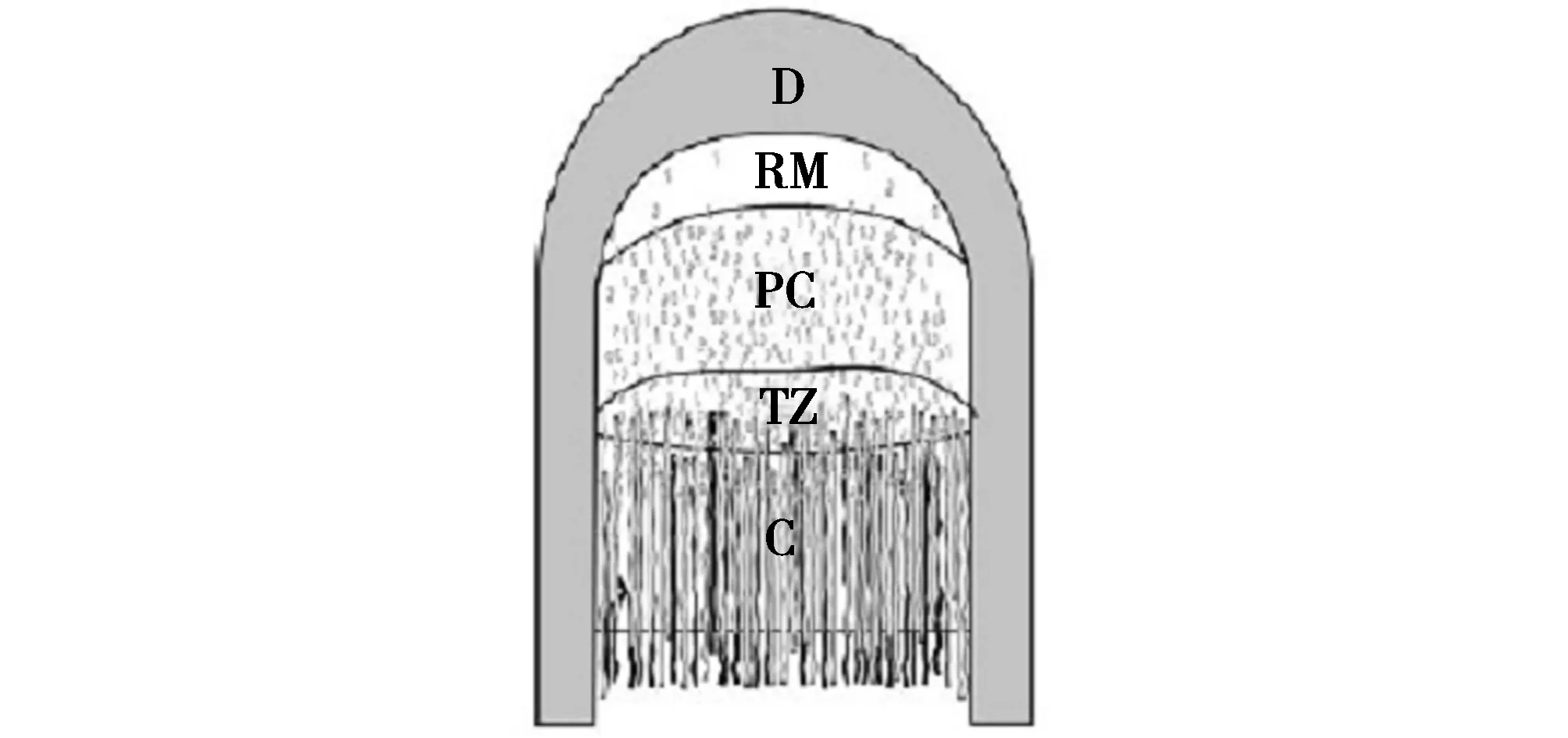
图1 鹿茸组织分离位置Fig.1 Position of isolated tissue in deer antlerD-茸皮层;RM-间充质层;PC-前软骨层;TZ-过渡层;C-软骨层D-Drmis;RM-Reserve mesenchyme;PC-Precartilage;TZ-Transition zone;C-Cartilage
1.2 Tβ-4基因全长cDNA的获得
按试剂盒 SV Total RNA Isolation System(Promega公司)操作说明提取鹿茸样品总RNA。依照Creator TM SMART TM cDNA文库构建试剂盒(Clontech公司)说明,进行全长cDNA文库构建:以逆转录酶PowerScript TM反转录合成第一链 cDNA,通过LD-PCR合成并扩增ds cDNA。扩增产物经蛋白酶K消化、SfiⅠ酶切、过Chroma SPIN-400柱去除小片段后,连接到pDNR-LIB质粒载体中,经电转化将重组质粒转入E.coli DH5α,摇菌复苏得到原始文库。
在3730XL测序仪上使用M13通用引物对鹿茸尖端组织原始文库中大量随机挑取的单菌落进行了5′端 ESTs测序。采用 Cross-match 软件去除 EST 中的低质量序列、载体序列、重复序列等,利用Phrap软件对高质量的 ESTs 进行聚类和拼接,得到重叠群和单拷贝EST。对拼接后的序列采用BLASTX和BLASTN程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi),在NCBI GenBank非冗余蛋白质和核酸库中进行序列同源性比对,并对具同源相似性的 unigenes使用Gene Ontolog分类标准进行功能注释。挑取Tβ-4基因对应的阳性菌落进行PCR鉴定,摇菌制备质粒,并对菌落质粒DNA进行双向测序。
1.3 Tβ-4的生物信息学分析
采用NCBI的ORF和BlastP程序结合ExPASy ProSite进行开放阅读框的查找和蛋白保守区预测;利用ExPASy服务器上的ProtParam和ProtScale计算蛋白分子量、理论等电点及分析蛋白疏水性等;程序SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)和TMpred(http://www.ch.embnet.org/software/TMPRED_form.html)预测蛋白的信号肽和跨膜区;使用SOPMA软件(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行二级结构预测;应用ClustalW程序(http://www.ebi.ac.uk/clustalw/)进行氨基酸的多重序列比对,MEGA5.1软件绘制系统进化树。
2 结果
2.1 Tβ-4基因全长cDNA的获得
从梅花鹿茸尖端组织全长cDNA文库中获得的Tβ-4基因的阳性菌落经PCR鉴定,得到一条长度在750 bp~1 000 bp之间的DNA插入片段(图2)。进一步对该阳性菌落进行质粒提取及双向测通,测序结果为770 bp,与预期片段大小一致。经与GenBank数据库进行Blast比对分析,证实为Tβ-4基因的全长cDNA序列(图3)。
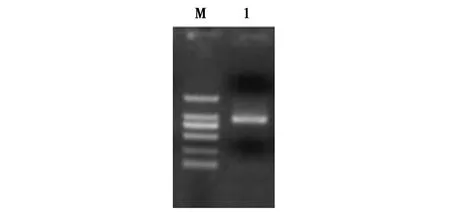
图2 梅花鹿Tβ-4基因cDNA菌落PCR结果Fig.2 Results of colony PCR of Tβ-4 gene cDNA from Sika Deer注:M-DL 2000 Marker;1-菌落 PCR 产物Note:M-DL 2000 marker;1-Colony PCR

图3 梅花鹿鹿茸尖端组织Tβ-4基因的全长cDNA序列和推导的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequences of Tβ-4 full-length cDNA of velvet antler tip tissue from sika deer
2.2氨基酸理化特性分析
对获得序列的ORF程序查找显示:Tβ-4全长cDNA的5′非翻译区为198 bp,3′非翻译区为437 bp,开放读码框为135 bp,编码44个氨基酸;ProtParam软件在线分析得到Tβ-4基因分子式C215H357N57O78S2,编码蛋白的相对分子质量为5 052.65 u,理论等电点为5.02;不稳定系数70.51,属于不稳定蛋白;亲水性平均值-1.620;整个氨基酸组成中赖氨酸(20.5%)和谷氨酸(18.2%)占很高比例。
2.3 Tβ-4蛋白结构分析
利用NCBI的BlastP程序进行蛋白保守区预测表明,与此基因匹配的蛋白保守区有1个“Thymosin family”结构域(图4),其匹配区段从第18~29氨基酸为共有区,其模式为“L-[KR]-K-T-[DENT]-T-x(2)-K-N-[PT]-L”与ExPASy ProSite程序分析结果一致;SOPMA软件预测结果显示,Tβ-4二级结构元件主要以无规则卷曲为主(分别占56.82%),其次是α-螺旋(38.64%),β-转角较少(4.55%),无折叠结构(图5)。软件SignalP 4.1和TMpred预测结果指出该蛋白为非跨膜蛋白,且N端未发现信号肽编码区。

图4 推导的Tβ-4氨基酸保守区查找Fig.4 Search for the conserved domains in deduced amino acid sequence of Tβ-4

图5 Tβ-4的二级结构预测Fig.5 Secondary structure prediction of Tβ-4注:h:α-螺旋,c:无规则卷曲,t:β-转角Note:h:Alpha helix,c:Random coil,t:Beta turn
2.4不同物种间Tβ-4的同源性分析
将梅花鹿与GenBank中选取的9种动物的Tβ-4氨基酸全序列进行BlastP,并用ClustalW和MEGA5.1软件对其进行多重序列比对及系统进化树的绘制(图6,图7),发现该基因在各物种间存在高度保守性,相似性普遍集中在77%~90%之间,与白颊长臂猿(Nomascusleucogenys)、人(Homosapiens)、牛(Bosmutus)、彩色锦龟(Chrysemyspictabellii)、灰仓鼠(Cricetulusgriseus)、东北虎(Pantheratigrisaltaica)、抹香鲸(Physetercatodon)、光滑爪蟾(Xenopuslaevis)和鸵鸟(Struthiocamelusaustralis)的同源性分别为89 %、87.8%、85.5%、84.3% 、83.2%、82.8%、82.8%、80.1%和77%。

图6 梅花鹿与其他动物Tβ-4氨基酸的多重序列比对Fig.6 Multiple alignment of amino acid sequences of the sika deer and other animal Tβ-4

图7 动物Tβ-4系统进化树Fig.7 The phylogenetic tree of Tβ-4 from animals.
3 讨论
鹿茸顶端由幼嫩的组织构成,而基部则由成熟组织构成,顶端幼嫩组织是鹿茸生长的关键部位。鹿茸从顶端到基部依次分为增殖区、成熟区、肥厚区和钙化区。鹿茸快速生长主要是通过激活存在于增殖区的细胞来实现的,该区可分为间充质层,前软骨层,过渡层和软骨层,鹿茸的变长是通过增殖区细胞经软骨内骨化过程完成。随着鹿茸的不断生长,增殖区的厚度逐渐变薄,直到秋季交配季节来临,增殖区完全消失,茸角停止生长,随后茸皮脱落,鹿茸完全骨化,形成鹿角。因此,本研究选取鹿茸顶端增殖区作为主要的试验材料。
Tβ-4蛋白的构象显示7~15位和34~44位氨基酸形成2个α-螺旋结构,在盐溶液中该二级结构是Tβ-4与肌动蛋白结合所必需的条件,且N端螺旋区,是相互结合的必需结构,其中央保守序列“LKKTETQ”尤为重要,且前3个氨基酸是相互作用的主要接触点。N端螺旋区作为与actin作用最强的区域,通过识别结合ATP的G-actin,起到分离actin的作用。Tβ-4蛋白其余部分结构不规则,呈伸展状态,无折叠,这种结构使Tβ-4具有可变性,而正是这种可变性使其易于识别不同种类的分子目标,通过与G-actin相互作用,从而与免疫和细胞生长的级联信号间相互传递信息,从而具备多种生物学功能。
根据ProtScale软件分析发现,Tβ-4蛋白疏水峰值主要出现在score 0.000以下,因此推断Tβ-4蛋白具有强疏水性,这与软件ProtParam所获得的亲水性平均值-1.620的结果相吻合。同源序列分析表明,Tβ-4不仅在哺乳动物中,且从人到两栖类再到鸟类等各物种动物体内均高度保守。梅花鹿与牛、人、白颊长臂猿亲缘关系较近,氨基酸同源性高于85%;与彩色锦龟、灰仓鼠、虎、抹香鲸的亲缘关系次之,氨基酸同源性均高于82%;与光滑爪蟾、鸵鸟的亲缘关系较远。可见梅花鹿与陆生哺乳动物亲缘关系更近,与两栖类和鸟类亲缘关系较远。
鹿茸是在复杂的分子网络调控下短期内能迅速成长为骨、血管、毛发和神经等俱全的综合器官,受特定的作用机理调控,许多重要的功能基因,都参与了其生长发育过程的调节。鹿茸除了具有周期性再生能力外,还存在多种特殊的生命现象,例如鹿茸含其他哺乳动物所没有的血管化软骨组织;茸角伤口愈合而不留疤痕;鹿茸角的生长最快可达2 cm/d,其速度比癌细胞还要快30几倍,且在这样快速生长情况下形成的鹿茸组织竟然没有任何癌变迹象等等,然而至今对这些生命现象的内在机制还没有从根本上阐明。由于Tβ-4在真核生物细胞中具有多重生物学功能(参与了包括血管生成、神经发育、创伤愈合、炎症反应、细胞凋亡、恶性肿瘤发生及毛囊发育等多种生理和病理学过程的调节),且在鹿茸尖端组织属绝对高丰度表达基因,推测Tβ-4很可能参与了鹿茸发育中多种生物学过程的调控。因此,本研究首次从梅花鹿鹿茸尖端组织cDNA文库中成功克隆了具有完整编码区的Tβ-4基因的全长cDNA序列,并且本实验室正在以此为基础进行进一步的表达和功能研究。
[1] Huo Yushu,Huo Hong,Zhang Jie.The contribution of deer velvet antler research to the modern biological medicine [J].Chinese Journal of Integrative Medicine,2014,20(10):723-728.
[2] Brockes J P,Kumar A.Appendage regeneration in adult vertebrates and implications for regenerative medicine [J].Science,2005,310(5756):1919-1923.
[3] 陈雪龙.鹿茸的药理作用及其研究进展 [J].四川畜牧兽医,2008,32(1):29-30.
[4] Kierdorf U,Kierdorf H.Deer antlers-a model of mammalian appendage regeneration:an extensive review [J].Gerontology,2011,57(1):53-65.
[5] Landete-Castillejos T,Estevez J A,Martínez A,et al.Does chemical composition of antler bone reflect the physiological effort made to grow it? [J].Bone,2007,40(4):1095-1102.
[6] Pita-Thomas W,Fernández-Martos C,Yunta M,et al.Gene expression of axon growth promoting factors in the deer antler[J].PloS One,2010,5(12):e15706.
[7] Li Chunyi,Zhao Haiping,Liu Zhen,et al.Deer antler-a novel model for studying organ regeneration in mammals[J].The International Journal of Biochemistry & Cell Biology,2014,56:111-122.
[8] 刘振,赵海平,杨春,等.鹿茸再生及其分子调节机理研究进展 [J].中国畜牧兽医,2013,40(2):50-53.
[9] Koutrafouri V,Leondiadis L,Avgoustakis K,et al.Effect of thymosin peptides on the chick chorioallantoic membrane angiogenesis model[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2001,1568(1):60-66.
[10] Lee S H,Zhang W,Choi J J,et al.Overexpression of the thymosin β-10 gene in human ovarian cancer cells disrupts F-actin Stress Fiber and Leads to Apoptosis[J].Oncogene,2001,20(46):6700-6706.
[11] Goldstein A L,Hannappel E,Kleinman H K.Thymosin β 4:actin-sequestering protein moonlights to repair injured tissues[J].Trends in Molecular Medicine,2005,11(9):421-429.
[12] Huff T,Müller C S G,Otto A M,et al.β-Thymosins,small acidic peptides with multiple functions[J].The International Journal of Biochemistry & Cell Biology,2001,33(3):205-220.
[13] Knop J,App C,Hannappel E.Antibodies in research of thymosin β4:investigation of cross-reactivity and influence of fixatives [J].Annals of the New York Academy of Sciences,2012,1270(1):105-111.
[14] Wang Xiaolei,Yang Guihua,Li Shanshuang,et al.TheEscherichiacoli-derived thymosin β4 concatemer promotes cell proliferation and healing wound in mice[J].BioMed Research International,2013,2013:241721.
[15] Stark C,Taimen P,Tarkia M,et al.Therapeutic potential of thymosin β4 in myocardial infarct and heart failure [J].Annals of the New York Academy of Sciences,2012,1269(1):117-124.
[16] Yan B,Singla R D,Abdelli L S,et al.Regulation of PTEN/Akt pathway enhances cardiomyogenesis and attenuates adverse left ventricular remodeling following thymosin β4 overexpressing embryonic stem cell transplantation in the infarcted heart[J].PloS One,2013,8(9):e75580.
[17] Xiong Y,Mahmood A,Meng Y,et al.Neuroprotective and neurorestorative effects of thymosin β4 treatment following experimental traumatic brain injury[J].Annals of the New York Academy of Sciences,2012,1270(1):51-58.
[18] Morris D C,Zhang Z G,Zhang J,et al.Treatment of neurological injury with thymosin β4[J].Annals of the New York Academy of Sciences,2012,1269(1):110-116.
[19] Wei M,Duan D,Liu Y,et al.Increased thymosin β4 levels in the serum and SF of knee osteoarthritis patients correlate with disease severity [J].Regulatory Peptides,2013,185:34-36.
[20] Li Xiankui,Zheng Lishu,Peng Fuwang,et al.Recombinant thymosin beta 4 can promote full-thickness cutaneous wound healing [J].Protein Expression and Purification,2007,56(2):229-236.
[21] Philp D,Badamchian M,Scheremeta B,et al.Thymosin β4 and a synthetic peptide containing its actin‐binding domain promote dermal wound repair in db/db diabetic mice and in aged mice[J].Wound Repair and Regeneration,2003,11(1):19-24.
[22] Müller C S,Huff T,Hannappel E.Reduction of thymosin β4 and actin in HL60 cells during apoptosis is preceded by a decrease in their mRNAs [J].Molecular and Cellular Biochemistry,2003,250(1/2):179-188.
[23] Can B,Karagoz F,Yildiz L,et al.Thymosin β4 is a novel potential prognostic marker in gastrointestinal stromal tumors [J].Apmis,2012,120(9):689-698.
[24] Xiao Yongtao,Chen Yingwei,Wen Jie,et al.Thymosin β4:a potential molecular target for tumor therapy[J].Critical ReviewsTMin Eukaryotic Gene Expression,2012,22(2):109-116.
[25] 李晔,包旭,陈曦.小鼠毛囊再生与胸腺素β4的促进效应[J].中国组织工程研究,2014,18(11):1687-1693.
[26] Li C,Suttie J M.Tissue collection methods for antler research[J].European Journal of Morphology,2003,41(1):23-30.
Velvet antler; Thymosin β4 (Tβ-4); cDNA library; Isolation; Bioinformatics
胸腺素β4(Thymosin β4,Tβ-4)是真核生物细胞中的一种具有多重生物学功能的肌动蛋白螯合分子。本研究首次从梅花鹿鹿茸尖端组织全长cDNA文库中成功克隆了Tβ-4基因的全长cDNA序列,并结合生物信息学方法对该基因的氨基酸序列进行了分析。结果表明,梅花鹿Tβ-4基因cDNA全长为770 bp,编码44个氨基酸,相对分子质量为5 052.65 u,理论等电点为5.02,其一级结构中赖氨酸和谷氨酸残基所占比例最高,二级结构元件主要以α-螺旋和无规则卷曲为主。结构分析发现,Tβ-4蛋白氨基酸序列含有“Thymosin family”结构域,没有N端信号肽,没有跨膜区。同源序列分析表明,梅花鹿与白颊长臂猿、人、牛的亲缘关系较近,氨基酸同源性高于85%。Tβ-4在鹿茸尖端组织全长cDNA文库中高丰度表达,提示它可能在鹿茸生长发育中起到重要调节作用。
Isolation and Bioinformatics Analysis of Tβ-4 Full Length cDNA in Sika Deer (Cervus nippon hortulorum)Velvet Tip Tissue
Huang Hao Hao Li*Xiao Xianghong Liu ChangLi Heping Chai Longhui Zhang Jingyu
(Northeast Forestry University,Harbin,150040,China)
Thymosin β4 (Tβ-4)is an actin chelating molecule with multiple biological functions in eukaryotic cells.We isolated the full-length cDNA of the Tβ-4 gene from velvet tip tissue full-length cDNA library of Sika Deer,and analyzed the bioinformatics of the amino acid sequence.The results showed the full-length cDNA of the Tβ-4 gene was 770 bp,encoding a peptide of 44 amino acids.The relative molecular weight of the peptide was 5 052.65u,isoelectric point was 5.02,and Lys and Glu occupied the highest proportion in primary structure.α-helix and random coil-based were dominant in the secondary structure.Structure analysis showed that the Tβ-4 protein contained a “Thymosin family” structural domain without and N-terminal signal peptide and transmembrane domain.Homologous sequence analysis indicated that sika deer was close toBosmutus,HomosapiensandNomascusleucogenys(the amino acids homology was higher than 85%).Tβ-4 gene has a higher expression level in velvet tip tissue full-length cDNA library,indicating that this gene may play a regulatory role in growth development of velvet antler.
国家自然科学基金资助项目(31271324);中央高校基本科研业务费专项资金资助(2572014EA05-03; 2572015CA18)
黄皓,女,23岁,硕士研究生;主要从事动物生理学研究。E-mail:694180823@qq.com
*通讯作者:郝丽,E-mail:haoli958@sina.com
2016-11-16
S825;S813
A
修回日期:2016-12-16
发表日期:2017-05-10
2310-1490(2017)02-162-06

