恒温超声辅助提取丁香总多酚工艺优化及其对低密度脂蛋白氧化修饰过程中荧光的抑制
, ,曲娟,2,,,,2,3,*, ,3,,3,,3
(1.九江学院药学与生命科学学院,江西九江 332000;2.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013; 3.九江安德和生物科技有限公司,江西九江 332000)
恒温超声辅助提取丁香总多酚工艺优化及其对低密度脂蛋白氧化修饰过程中荧光的抑制
熊一凡1,李文1,曲文娟1,2,刘龙秀1,张小霞1,江慎华1,2,3,*,郝澍1,3,张良慧1,3,谢丽琴1,3
(1.九江学院药学与生命科学学院,江西九江 332000;2.江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013; 3.九江安德和生物科技有限公司,江西九江 332000)
低密度脂蛋白(LDL)氧化是引起动脉粥样硬化(AS)的一个主要原因,为了探索恒温超声辅助技术对丁香总多酚的提取效果,及对LDL氧化修饰过程中荧光的抑制,本文采用该技术首先对丁香总多酚提取工艺进行了优化,进而分析其对LDL氧化修饰过程中荧光的抑制效果。结果表明,恒温超声辅助提取丁香总多酚最佳工艺条件为:超声功率270 W、超声频率80 kHz、超声时间30 min、超声温度50 ℃、料液比1∶30、乙醇浓度60%,此条件下所提取的总多酚含量为(0.301±0.0043) g/g。通过最优工艺得到的丁香总多酚提取物能有效抑制LDL氧化修饰过程中Trp淬灭、总荧光产物及脂褐素的产生,且抑制效果与浓度成正比,呈现出良好的量效关系。该研究为后续将丁香总多酚研发成抑制LDL氧化功能食品提供依据。
丁香,总多酚,恒温超声提取,低密度脂蛋白,总荧光
血液中的低密度脂蛋白(low density lipoprotein,LDL)主要功能是将胆固醇运送到外围组织[1]。LDL是直径18~25 nm[2]、密度1.019~1.063 g/mL的球形颗粒[3],平均分子量250万。LDL由胆固醇酯(29%)、磷脂(28%)、蛋白(21%)、游离胆固醇(11%)及甘油三酯(9%)组成。LDL由脂性核心与外围蛋白质apoB-100(由4536个氨基酸残基组成,分子量约500 kDa)组成[4-5]。
LDL富含多不饱和脂肪酸[6],在氧化应激条件下很容易被氧化修饰形成氧化修饰低密度脂蛋白(oxidized modified low-density lipoprotein,Ox-LDL)[7]。Ox-LDL通过各种生物通路促使动脉粥样硬化(atherosclerosis,AS)的产生和发展[8]。许多天然产物能有效缓解AS等慢性疾病[9]。因此,从相关天然产物中提取出对LDL氧化具有抑制效果的有效成分具有重要意义。
丁香为桃金娘科植物丁香(EugeniacaryophyllataThunb.)的干燥花蕾,属国家公布的药食两用植物,在我国南方地区(如海南、广东、广西、云南等地)广泛种植[6]。丁香花蕾色泽深褐色,气味浓郁,微涩[10],主要成分为多酚、黄酮类化合物及精油等[11],可用于治疗炎症、肝损伤、癌症、糖尿病和其他氧化应激引起的疾病等[10]。有研究证明,丁香具有很强的抗氧化活性[12],总多酚为其抗氧化活性的主要物质[9]。实验室前期研究结果也表明,丁香在国家公布的87种药食两用物品名单中总多酚含量最高[13],丁香总多酚具有很强的抗氧化作用[14]。尽管丁香中总多酚含量非常高[13]、其抗氧化能力很强[14],但是,丁香总多酚对LDL氧化修饰抑制效果,目前国内外尚不明确。
国内外很多学者采用超声方法对植物总多酚提取进行了相关研究。樊燕鸽等采取数控超声萃取怀菊水溶性总多酚[15];Biesaga等[16]采用超声提取蜂蜜中总多酚。尽管以上学者采用超声辅助提取各类天然产物总多酚获得了较好的效果,但是,在这些超声辅助提取总多酚过程中,溶液温度无法保持稳定,温度升高及超声辅助对高效提取的贡献无法明确,频率对提取效果的影响也无法确定。实验室前期研究发现采用恒温超声辅助提取诃子抗氧化活性物质时很好地解决了这一问题[17]。但是,采用恒温超声技术提取丁香总多酚,在国内外尚未见相关报道。因此,本文采用三频恒温超声波提取技术对丁香总多酚提取工艺进行了优化,并对提取所得丁香总多酚抑制LDL氧化过程荧光的抑制效果进行了相关研究,为后续将丁香研发成抑制LDL氧化功能食品提供依据。
1 方法与材料
1.1材料与仪器
丁香 江西樟树天齐堂中药饮片有限公司,产地广西,生产批号1511008,生产日期2015年11月20日,过60目筛后置冰箱中备用;LDL 自健康人血浆中分离得到[17-18],以牛血清白蛋白(Albumin from Bovine Serum,BSA)为标准品,采用Lowry’s方法测定LDL中蛋白浓度[19],以该蛋白浓度表示LDL浓度;肝素钠 购自上海阿拉丁生化科技股份有限公司;其他化学试剂 均采用优级纯或分析纯;沉淀剂 0.064 mol/L柠檬酸钠溶液(肝素钠浓度为50000 U/L),用5 mol/L盐酸,调节pH至5.04;洗涤液 0.064 mol/L柠檬酸钠溶液,用5 mol/L盐酸,调节pH至5.11;高盐磷酸盐缓冲溶液(pH4.5 PBS) 160 g/L NaCl、2.7 mmol/L KCl、8.1 mmol/L Na2HPO4、1.5 mmol/L KH2PO4。
KQ-300G VDV型三频恒温数控超声波清洗器 昆山市超声仪器有限公司;LS-55荧光磷光分光光度计 美国Perkin Elmer公司;CT15RT型高速冷冻离心机 上海天美生化仪器设备工程有限公司;101-1AB型电热鼓风干燥箱 天津市泰斯特仪器有限公司;LJL10冷冻干燥机 巩义市予华仪器有限公司;DFY-300摇摆式高速万能粉碎机 温岭市林大机械有限公司;PB-10 pH计 Sartorius仪器设备有限公司;XW-80A漩涡混合器 上海青浦沪西仪器厂。
1.2实验方法
1.2.1 恒温超声辅助提取总多酚 参照文献[20]的方法,略做修改,具体步骤如下:称取5.00 g丁香粉于150 mL锥形瓶中,按下列各单因素实验进行恒温超声提取,每次提取后采用4800 r/min离心分离提取液,共提取三次,合并上清液定容成300 mL统一体积,稀释200倍后测定总多酚含量。
1.2.2 恒温超声辅助提取丁香总多酚单因素实验
1.2.2.1 恒温超声提取时间单因素实验 选定超声时间10、20、30、40、50、60 min,固定其他参数:超声功率240 W、超声频率45 kHz、料液比1∶20、超声温度60 ℃、乙醇浓度60%,进行超声时间单因素实验。
1.2.2.2 恒温超声提取温度单因素实验 选定超声温度30、40、50、60、70、80 ℃,固定其他参数:超声功率240 W、超声频率45 kHz、料液比1∶20、超声时间30 min、乙醇浓度60%,进行超声温度单因素实验。
1.2.2.3 恒温超声提取频率单因素实验 选定设备固有的三个超声频率45、80、100 kHz,固定其他参数:超声功率240 W、料液比1∶20、超声时间30 min、超声温度60 ℃、乙醇浓度60%,进行超声频率的单因素实验。
1.2.2.4 恒温超声提取功率单因素实验 选定超声功率150、180、210、240、270、300 W,固定其他参数:超声频率45 kHz、料液比1∶20、超声时间30 min、超声温度60 ℃、乙醇浓度60%,进行超声功率的单因素实验。
1.2.2.5 恒温超声提取料液比单因素实验 选定超声料液比1∶15、1∶20、1∶25、1∶30、1∶35、1∶40,固定其他参数:超声功率240 W、超声频率45 kHz、超声时间30 min、超声温度60 ℃、乙醇浓度60%,进行超声料液比的单因素实验。
1.2.2.6 恒温超声提取乙醇浓度单因素实验 选定超声乙醇浓度30%、40%、50%、60%、70%、80%,固定其他参数:超声功率240 W、超声频率45 kHz、料液比1∶20、超声时间30 min、超声温度60 ℃、乙醇浓度60%,进行超声乙醇浓度的单因素实验。
1.2.3 恒温超声辅助提取丁香总多酚正交实验 以单因素实验结果为基础,设计四因素三水平正交实验,其因素水平如表1所示,以总多酚含量衡量提取效率。

表1 恒温超声辅助提取丁香总多酚正交实验因素水平Table 1 Orthogonal experiments of UAECT for extracting polyphenols from clove
1.2.4 总多酚含量的测定 参照文献[21]的方法测定总多酚的含量,具体步骤如下:将标准品没食子酸配制成质量浓度分别为0、3.125、6.25、12.5、25、50、100、150 μg/mL 8个样液;再将Folin试剂原液取出一定体积用蒸馏水稀释10倍;取该稀释液2.25 mL加入到0.5 mL样液中,然后加2.25 mL 6%碳酸钠溶液,振荡均匀,在35 ℃水浴静置90 min后在765 nm读数,得到标准曲线方程:
Y=0.0124X-0.015(R2=0.9988)
式中,Y-765 nm处OD值,X-总多酚质量浓度,μg/mL。
丁香总多酚含量计算公式为:
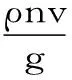
式中,Y-丁香总多酚提取含量,g/g;ρ-总多酚质量浓度,g/mL;n-稀释倍数;v-提取液最后定容体积,mL;g-提取前丁香粉质量,g。
1.2.5 不同浓度的丁香提取物对LDL的荧光强度影响
1.2.5.1 LDL氧化修饰孵育 LDL氧化修饰孵育分为以下几组:
实验组:取4.9 mL LDL溶液(500 μg/mL)加50 μL CuSO4(1.25 μmol/L),加50 μL不同浓度(经预实验确定量效关系明确的三个浓度:0.5、1.0、1.5 μg/mL)提取物溶液,37 ℃恒温孵育48 h。
空白组:等体积甲醇溶液代替提取物溶液,等体积去离子水代替氧化剂CuSO4·5H2O,其它操作均与实验组相同。
促氧组:等体积甲醇溶液代替提取物溶液,其它操作均与实验组相同。
阳性对照组:添加等体积2,6-二叔丁基对甲酚(2,6-Di-tert-butyl-4-methylphenol,BHT)代替提取物溶液(BHT浓度与提取物浓度相对应),其它操作均与实验组相同。
本文LDL及各种试剂均以起始浓度计。
1.2.5.2 丁香提取物对LDL氧化时的色氨酸(Trp)荧光淬灭的影响 采用Chen等[22]方法,略作修改。按1.2.5.1方法孵育反应体系,在Ex295/Em330处测定荧光强度。
1.2.5.3 丁香提取物对LDL氧化修饰产生的荧光产物的荧光定量测定 采用Yang等[21]方法,略作修改。按1.2.5.1方法孵育反应体系,在Ex360/Em430处测定荧光强度。
1.2.5.4 丁香提取物对LDL氧化修饰产生的脂褐素的荧光定量测定 采用刘颖琳等[23]方法,略作修改。按1.2.5.1方法孵育反应体系,在Ex350/Em460处测定脂褐素荧光强度。
1.2.6 三维荧光等高线光谱解析提取物抑制LDL氧化过程中荧光变化的量效关系 参照Ernst Koller[24]与Larry[25]等方法,略作修改。按照1.2.5.1方法孵育反应体系,采用石英比色皿设定Ex(200~420 nm)、Em(260~500 nm)、狭缝宽度均为4 nm及光谱间隔10 nm进行三维荧光扫描,以获得三维等高线光谱来反应丁香提取物抑制LDL氧化过程中荧光变化的量效关系。
1.3数据处理
采用DPS 7.05数据处理软件分析结果。
2 结果与分析
2.1恒温超声辅助提取丁香总多酚单因素实验
2.1.1 恒温超声提取时间的影响 由图1可以看出,恒温超声辅助提取10~40 min范围内,提取的丁香总多酚含量随着超声时间延长而升高,当超声时间为40 min时丁香总多酚含量达到最大值。此后,随超声时间延长,丁香提取液总多酚含量随之降低。可能的原因是,在40 min之前丁香粉末内总多酚被有机溶剂大量提取出来,所以随着时间延长而增多。40 min后,提取物发生氧化等反应,造成含量降低[26]。选定提取时间30、40、50 min做后续正交实验。

图1 恒温超声辅助提取时间单因素实验Fig.1 Results of extraction time experiment by UAECT
2.1.2 恒温超声提取温度单因素实验 温度单因素实验结果见图2所示。当温度在30~60 ℃范围内,超声辅助提取丁香总多酚含量随温度升高逐渐上升,60 ℃时达到最大含量,但是当温度超过60 ℃时,丁香总多酚提取含量逐渐下降。可能的原因是:温度在60 ℃之前,提取的总多酚会不断被有机溶剂提取出来;当60 ℃后,总多酚含量有所下降[27],是因为随温度升高,溶剂挥发导致部分总多酚析出,不能溶于溶剂中[28]。选定提取温度50、60、70 ℃做后续正交实验。
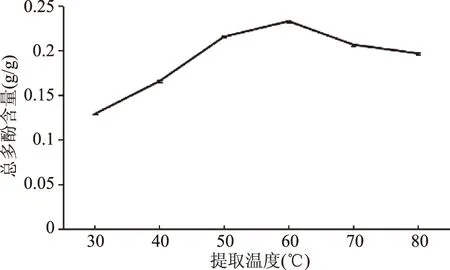
图2 恒温超声辅助提取温度单因素实验Fig.2 Results of ultrasonic temperature experiment by UAECT
2.1.3 恒温超声提取频率单因素实验 频率单因素实验结果如图3所示。从图3可看出,随频率升高,提取总多酚含量随之降低,因为超声频率与总波长成反比,波长会随频率增加而逐渐减小,造成声波在传播过程中逐渐衰减,影响丁香总多酚提取[18]。所以选定提取频率45、80、100 kHz做后续正交实验。
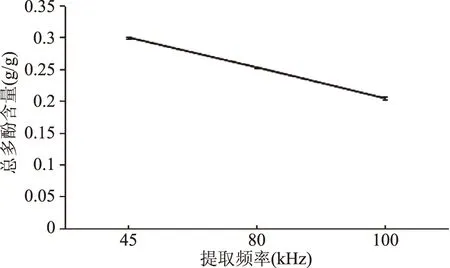
图3 恒温超声辅助提取频率单因素实验Fig.3 Results of ultrasonic frequency experiment by UAECT
2.1.4 恒温超声提取功率单因素实验 功率单因素实验结果如图4所示,在150~270 W范围内,丁香总多酚提取含量逐渐上升,当270 W时,含量达到最大值。提取功率超过270 W时,含量有所下降,可能原因是超声功率能导致体系内压力增大,破坏丁香结构,从而使提取含量有所下降[29]。所以选定提取功率240、270、300 W做后续正交实验。
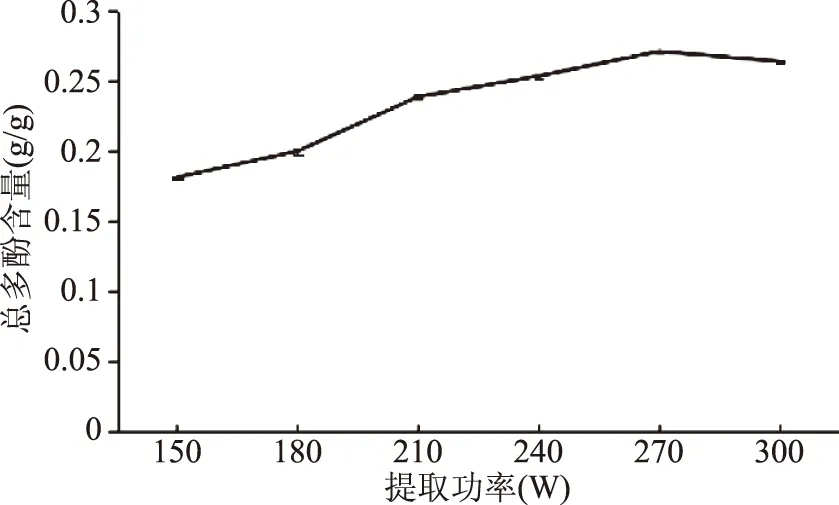
图4 恒温超声辅助提取功率单因素实验Fig.4 Results of ultrasonic power experiment by UAECT
2.1.5 恒温超声提取料液比单因素实验 料液比单因素实验结果如图5所示,开始时,随比例升高含量明显增长,当料液比达到1∶30后,再增大溶剂添加量时,提取的丁香总多酚含量变化不明显。开始时,总多酚含量会随有机溶剂增加不断被提取,当有机溶剂达到一定含量后,从理论上讲,额外溶剂的增加,不会导致浓度差显著增加,从而不会使提取率显著增加[30]。所以选定料液比为1∶30作为正交实验的固定料液比。

图5 恒温超声辅助提取料液比单因素实验Fig.5 Results of solvent to solid ratio experiment by UAECT
2.1.6 恒温超声提取乙醇浓度单因素实验 乙醇浓度单因素实验结果如图6所示,从图6中看出,乙醇浓度达到60%之前,总多酚含量会不断上升,是因为随乙醇浓度升高,总多酚能更快的被提取出。当乙醇浓度达到60%时,提取的总多酚含量最高,当浓度继续升高时,提取含量有所下降。可能是因为丁香中含有部分醇溶性杂质,当乙醇浓度超过一定量后溶出,从而增大干扰因素,使总多酚含量得率有所降低[31]。所以选定乙醇浓度60%作为正交实验的固定浓度。
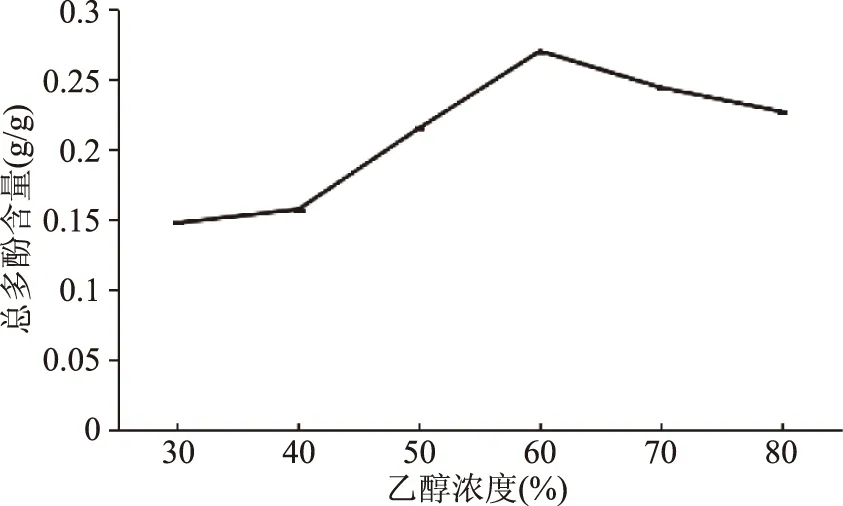
图6 恒温超声辅助提取乙醇浓度单因素实验Fig.6 Results of ethanol concentration experiment by UAECT
2.2恒温超声辅助提取丁香总多酚正交试验结果
正交实验结果如表2所示,由表2可以看出,影响恒温超声辅助提取丁香总多酚的因素从大到小排序依次为:超声时间>超声频率>超声功率>超声温度,正交表中最佳提取工艺为第8组试验:A3B2C1D3,即:超声功率300 W、超声频率80 kHz、超声时间30 min、超声温度70 ℃。正交试验方差分析如表3所示。
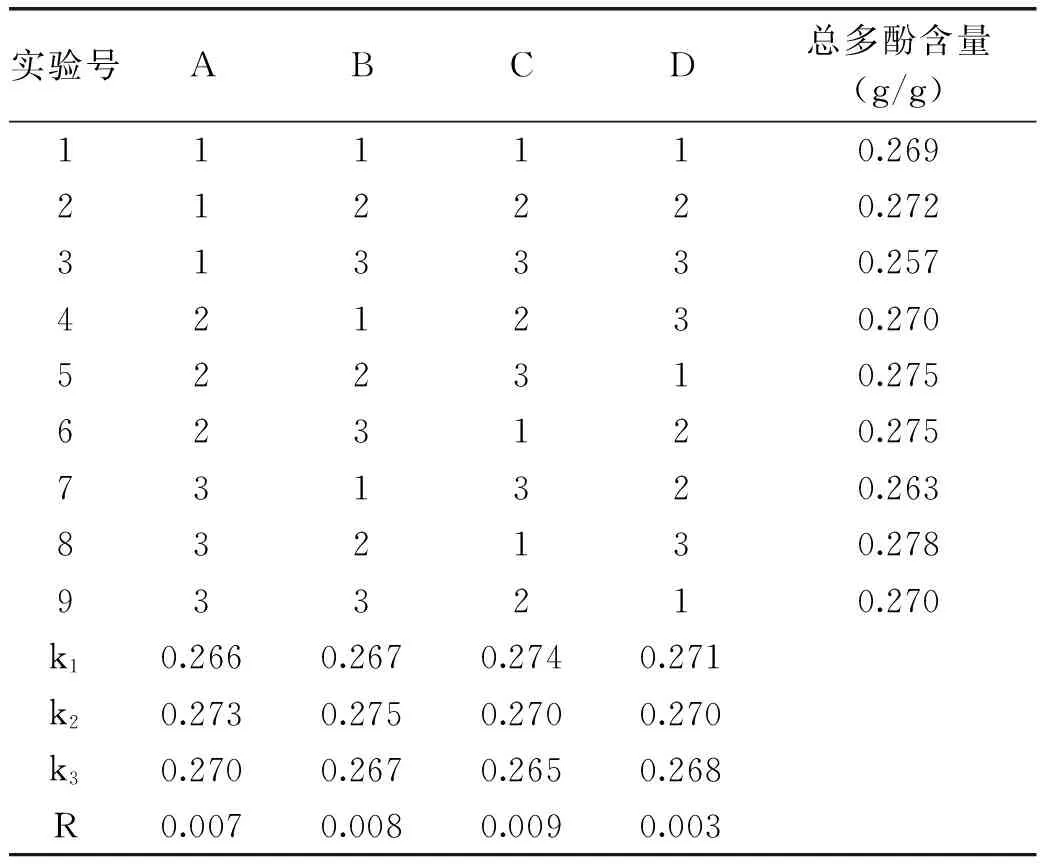
表2 恒温超声辅助提取丁香总多酚正交试验结果Table 2 Orthogonal experiments for extracting polyphenols from clove by UAECT
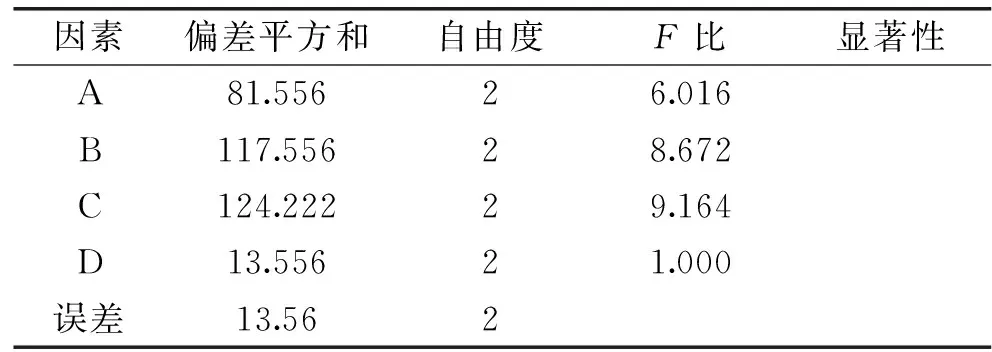
表3 正交试验方差分析Table 3 Analysis of orthogonal experiments
选取恒温超声提取最佳工艺(A2B2C1D1)与正交实验中总多酚含量最高的一组(A3B2C1D3)进行比较验证,得到恒温超声提取最佳工艺(A2B2C1D1)所提取的总多酚含量(0.301±0.0043) g/g高于正交表2中提取的总多酚含量的最高值(0.278±0.0049) g/g(p<0.001)。由此证明该最佳工艺较为可靠,可以考虑作为后续扩大提取工艺的提取条件。
2.3丁香总多酚提取物对LDL氧化修饰过程中荧光强度抑制效果
国内外研究结果表明植物总多酚能有效抑制LDL氧化修饰,降低AS发生[32],且有研究表明丁香总多酚含量也很高[13],为了确定丁香总多酚抑制LDL氧化修饰效果,本文采用1.2.5方法分别以Trp荧光淬灭、总荧光产物和脂褐素三个指标确定丁香总多酚对LDL氧化修饰过程中所产荧光的抑制效果。
2.3.1 丁香提取物对LDL氧化时的Trp荧光淬灭的影响结果 Cu2+诱导LDL氧化时,apoB-100中色氨酸残基结构遭到破坏、被氧化,导致其荧光淬灭[33]。通过测定Trp荧光淬灭可反映出丁香总多酚提取物抑制LDL氧化修饰作用[21]。通过1.2.5.2方法测定结果如图7所示。从图7中可看出,与空白组相比,促氧组Trp荧光强度明显衰弱(p<0.01)。与促氧组相比,不同浓度丁香总多酚提取物荧光强度均有不同程度上升,随着浓度升高,其荧光强度随之上升,表明丁香总多酚提取物在0.5~1.5 μg/mL浓度范围内对Trp残基荧光淬灭的抑制程度呈量效关系。Chen等[22]研究后发现,杏仁皮多酚能有效阻止Trp氧化修饰,从而抑制LDL氧化。本文发现丁香提取物富含总多酚,所以丁香总多酚提取物可能也是通过此途径防止Trp残基氧化修饰。
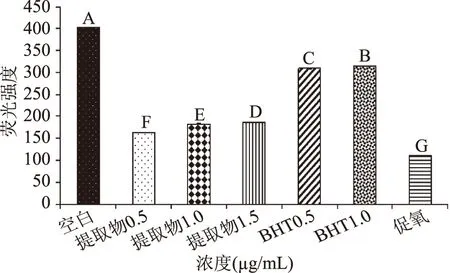
图7 不同浓度丁香总多酚提取物抑制Trp荧光淬灭定量效果Fig.7 The inhibition efficiency of the different concentrations of clove extracts on Trp fluorescence quenching by quantitative determination注:不同大写字母代表差异显著(p<0.01);图8、图9同。
2.3.2 丁香提取物对LDL氧化修饰过程中总荧光产物的抑制效果 LDL表面的apoB-100含有的赖氨酸(Lys)游离氨基与脂质氧化产物结合形成荧光发色团,Lys游离氨基活性反映出LDL氧化修饰程度[34]。采用1.2.5.3方法在Ex360/Em430处进行产物荧光定量测定反映LDL氧化修饰情况,测定结果如图8所示。促氧组荧光强度最强,表明LDL氧化修饰产生了大量荧光产物。与促氧组相比,随丁香总多酚提取物提取物浓度增高,荧光强度越弱,说明丁香提取物能够显著抑制氧化产物产生(p<0.001)。Chen等[35]通过研究也发现,绿茶总多酚通过优先与活性醛结合而抑制LDL氧化修饰,导致荧光产物减少。

图8 不同浓度提取物对LDL氧化修饰过程中荧光产物生成的抑制效果Fig.8 The inhibition efficiency of the different concentrations of clove polyphenol extracts on fluorescent products generated during oxidation of LDL
2.3.3 丁香总多酚提取物对LDL氧化修饰过程中脂褐素产生的抑制效果 脂褐素是LDL氧化过程中脂质氧化产物和蛋白结合形成具有荧光特性的化合物[36],通过测定Ex350/Em460处荧光强度反应其含量。采用1.2.5.4方法测定脂褐素荧光定量测定结果如图9所示。从图9中可看出,促氧组脂褐素荧光强度最高,说明LDL氧化会产生大量脂褐素。添加不同浓度丁香总多酚提取物后,荧光强度均有明显下降,与促氧组相比有极显著差异(p<0.001)。不同浓度丁香总多酚提取物对脂褐素的抑制效果与上述2.3.2中对荧光产物的抑制效果相似,进一步表明丁香总多酚能有效抑制LDL氧化修饰,与刘颖琳等[23]结果相似。

图9 不同浓度提取物对LDL氧化修饰过程中脂褐素生成的抑制效果Fig.9 The inhibition efficiency of the different concentrations of clove polyphenol extracts on lipofuscin generated during oxidation of LDL
2.4三维荧光等高线光谱解析丁香总多酚提取物对LDL氧化过程中荧光抑制效果的量效关系
为更深入考察丁香总多酚对LDL氧化修饰过程中荧光的抑制效果,本文采用1.2.6方法进行三维荧光扫描获得三维荧光等高线光谱图比较不同浓度丁香总多酚提取物对LDL氧化修饰的抑制效果[24]。测定结果如图10(横坐标为发射波长,纵坐标为激发波长;同心圆所在位置代表该处有荧光发色团)。
从图10(a)中可以看出,空白组只有一个荧光发色团,Peak A即为LDL中Trp的内源荧光,位于Ex280/Em340。
从图10(h)中可以看出,与空白组相比,促氧组在Ex280/Em340处荧光明显降低,说明Trp遭到氧化破坏后,其荧光产生淬灭[32]。在Ex360/Em430处出现了一个荧光强度为190.62的新荧光发色团。该新荧光发色团是因Lys游离氨基与脂质氧化产物结合形成[33]。
从图10(b、c、d)中可以看出,随丁香总多酚提取物浓度升高,Peak A的荧光信号逐渐增强,而Peak B的荧光信号逐渐降低,很好地验证了本文荧光强度的三个结果。与图10(e、f、g)相比可以得出,丁香总多酚提取物抑制LDL氧化修饰虽然不及BHT,但已非常接近。因此,丁香总多酚能有效抑制LDL氧化修饰。
3 结论
通过单因素实验和正交试验确定丁香总多酚恒温超声提取的最佳工艺条件为:超声功率270 W、超声频率80 kHz、超声时间30 min、超声温度50 ℃、料液比1∶30、乙醇浓度60%,此条件下所提取的总多酚含量为(0.301±0.0043) g/g。其可靠性由方差分析和验证实验得到确认。
丁香总多酚提取物能有效抑制LDL氧化修饰过程中Trp淬灭、总荧光产物及脂褐素的产生,且抑制效果与浓度成正比,呈现出良好的量效关系。
[1]Esterbauer H,Dieberrotheneder M,Waeg G,et al. Biochemical,structural,and functional properties of oxidized low-density lipoprotein.[J]. Chemical Research in Toxicology,1990,3(2):77.
[2]Prassl R,Laggner P. Molecular structure of low density lipoprotein:Current status and future challenges[J]. European Biophysics Journal,2009,38(2):145-158.
[3]Murtola T,Vuorela T A,Hyvönen M T,et al. Low density lipoprotein:structure,dynamics,and interactions of apoB-100 with lipids[J]. Soft Matter,2011,7(18):8135.
[4]Esterbauer H,Gebicki J,Puhl H,et al. The role of lipid peroxidation and antioxidants in oxidative modification of LDL[J]. Free Radical Biology & Medicine,1992,13(4):341-390.

图10 不同浓度丁香提取物对LDL氧化影响的三维荧光等高线光谱抑制效果Fig.10 The inhibition efficiency of the different concentrations of clove polyphenol extracts on three-dimensional flourescence contour spectroscopy during oxidation of LDL注:(a)空白组,(b)0.5 μg/mL提取物,(c)1 μg/mL提取物,(d)1.5 μg/mL提取物,(e)0.5 μg/mL BHT,(f)1 μg/mL BHT,(g)1.5 μg/mL BHT,(h)促氧组。
[5]Itabe H. Oxidized phospholipids as a new landmark in atherosclerosis[J]. Progress in Lipid Research,1998,37(37):181-207.
[6]赵锦. 丁香抗氧化活性物质提取及其抗LDL氧化修饰[D]. 天津:天津科技大学,2014.
[7]Obradovic M M,Trpkovic A,Bajic V,et al. Interrelatedness between C-reactive protein and oxidized low-density lipoprotein[J]. Clinical Chemistry & Laboratory Medicine,2014,53(1):29-34.
[8]Jiang X,Li M,Yang Q,et al. Oxidized Low Density Lipoprotein and Inflammation in Gout Patients[J]. Cell Biochemistry and Biophysics,2014,69(1):65-69.
[9]Gulcin I,Sat I G,Beydemir S,et al. Comparison of antioxidant activity of clove(EugeniacaryophylataThunb.)buds and lavender(LavandulastoechasL.)[J]. Food Chemistry,2004,87(3):393-400.
[10]Adefegha S A,Oboh G,Oyeleye S I,et al. Alteration of starch hydrolyzing enzyme inhibitory properties,antioxidant activities,and phenolic profile of clove buds(SyzygiumaromaticumL.)by cooking duration[J]. Food Science & Nutrition,2015,4(2):250.
[11]江慎华,万严,杨琼玉,等. 丁香有效部位对低密度脂蛋白弱氧化修饰的抑制效果[J]. 农业机械学报,2016,47(6):242-249.
[12]江慎华,蔡志鹏,廖亮,等. 丁香抗氧化活性物质提取及人工胃肠液对其活性的影响[J]. 农业机械学报,2012,43(7):149-155.
[13]ShenHua Jiang,Hanquan Li,Haile Ma,et al.Antioxidant activities of selected Chinese medicinal and edible plants[J]. International Journal of Food Sciences and Nutrition,2011,62(5):441-444.
[14]沈勇根,蔡志鹏,江慎华,等. 丁香非挥发性成分抗氧化活性[J]. 农业机械学报,2012,43(10):131-137.
[15]樊燕鸽,张娟梅,黄做华. 响应面法优化怀菊水溶性总多酚的超声提取工艺[J]. 食品工业科技,2016,37(5):268-272.
[16]Biesaga M,Pyrzyńska K. Stability of bioactive polyphenols from honey during different extraction methods[J]. Food Chemistry,2013,136(1):46-54.
[17]刘仁绿,肖敏,江卫青,等. 诃子粗提物及不同极性部位抑制低密度脂蛋白氧化修饰的研究[J]. 食品工业科技,2013,34(16):100-104.
[18]孙娟,刘尚喜,周玫,等. 血浆LDL的快速提取和脂质过氧化物含量的测定[J]. 南方医科大学学报,1994(1):56-57.
[19]Yang Q Y,Wan Y,Jiang S H,et al.the antioxidant inhibition of clove effective fraction on lipid,protein and spectra variation of LDL[J].Spectroscopy and Spectral Analysis,2017,37(1):312-320.
[20]刘梦莹,江慎华,王煌,等. 恒温超声辅助提取诃子FRAP类抗氧化活性物质的研究[J]. 食品工业科技,2015(20):238-243.
[21]江慎华,刘梦莹,杜余辉,等. 诃子总多酚恒温超声辅助提取与过程动力学研究[J]. 农业机械学报,2015,46(2):213-221.
[22]Chen C Y,Milbury PEChung S K,Blumberg J. Effect of almond skin polyphenolics and quercetin on human LDL and apolipoprotein B-100 oxidation and conformation[J]. Journal of Nutritional Biochemistry,2007,18(12):785-794.
[23]刘颖琳,刘耕陶. 丹酚酸-A体外对人血清低密度脂蛋白氧化修饰的抑制作用[J]. 药学学报,2002,37(2):81-85.
[24]Koller E,Quehenberger O,Jürgens G,et al. Investigation of human plasma low density lipoprotein by three-dimensional fluorescence spectroscopy[J]. Febs Letters,1986,198(2):229-234.
[25]Mclean L R,Hagaman K A. Effect of probucol on the physical properties of low-density lipoproteins oxidized by copper[J]. Biochemistry,1989,28(1):321-327.
[26]王逸飞,张玉龙,王佳威,等. 星点设计-效应面法优化超声提取丁香叶中紫丁香苷的工艺研究[J]. 中国医院药学杂志,2016(24):2148-2152.
[27]张妍,李杨,江连洲,等. 响应面法优化超声辅助水酶法提取菜籽油脂工艺参数及酶种类对油脂提取效果的影响[J].食品工业科技,2013,34(12):251-254.
[28]谢基隆,薛长风,裴志胜. 鹧鸪茶总多酚超声波提取工艺优化研究[J]. 农产品加工,2016(10):36-39.
[29]梁茜茜,李芬,李良玉,等. 超声—微波协同法提取燕麦麸皮多糖的参数优化及结构分析[J]. 中国食品添加剂,2016(9):178-187.
[30]Zhao S,Kwok K C,Liang H. Investigation on ultrasound assisted extraction of saikosaponins from Radix Bupleuri[J]. Separation & Purification Technology,2007,55(3):307-312.
[31]吕萍,李茜,薛波,等. 超声波辅助提取燕竹笋壳中多酚的工艺优化[J]. 现代食品科技,2012(12):1734-1738.
[32]Osakabe N. Polyphenols and Atherosclerosis[J]. Vitamins,2006,80(5):275-280.
[33]De L P R,Barcelos R P,de Bem A F,et al. Oximes as inhibitors of low density lipoprotein oxidation.[J]. Life Sciences,2008,83(25-26):878-885.
[34]Itakura K,Oya T. Detection of lipofuscin-like fluorophore in oxidized human low-density lipoprotein. 4-hydroxy-2-nonenal as a potential source of fluorescent chromophore.[J]. Febs Letters,2000,473(2):249-253.
[35]Chen T S,Liou S Y,Wu H C,et al. Amino acids with basic amino side chain accelerate the pro-oxidant ability of polyphenolic compounds[J]. Food Chemistry,2012,134(1):9-14.
[36]赵增翰. 脂褐素的研究及其进展[J]. 国际老年医学杂志,1981(4):3-7.
Optimizationofextractionprocessofclovetotalpolyphenolsbyultrasonicassistedextractionwithconstanttemperature(UAECT)anditsinhibitionoffluorescenceonlowdensitylipoprotein(LDL)intheprocessofoxidationmodification
XIONGYi-fan1,LIWen1,QUWen-juan1,2,LIULong-xiu1,ZHANGXiao-xia1,JIANGShen-hua1,2,3,*,HAOShu1,3,ZHANGLiang-hui1,3,XIELi-qin1,3
(1.School of Pharmacy and Life Science,Jiujiang University,Jiujiang 332000,China;2.School of Food and Biological Engineering Jiangsu University,Jiangsu Provincal Key Lab of Physical Processing of Agricultural Products,Zhenjiang 212013,China;3.Jiujiang Andehe Biotechnology Co.,Ltd.,Jiujiang 332000,China)
Oxidation of low density lipoprotein has been a major cause of atherosclerosis. In order to explore the extracting effect on total polyphenols from clove based on ultrasonic assisted extraction with constant temperature(UAECT),and its inhibition effect on fluorescence during the process of oxidation of(low density lipoprotein)LDL,the extrcation technology of total polyphenols from cloves were firstly optimized,then the inhibition effect on fluorescence during oxidation of LDL was analysized. The results showed that the optimal parameters of the extracting technology were as follows:ultrasound power was 270 W,ultrasound frequency was 80 kHz,ultrasound time was 30 min,ultrasound temperature was 50 ℃,solid-liquid ratio was 1∶30,and ethanol concentration was 60%. Under this optimal extracting technology,the total polyphenol content was(0.301±0.0043) g/g. The total polyphenols from clove by the optimal extracting technology significantly inhibited fluorescence of Trp from quenching,inhibited the generation of fluorescent products and lipofuscin from generating,and inhibited the variation of three-dimensional fluorescence. And the inhibition effects were proportional to the concentrations,it showed positive does-effect relationship. This study laid the foundation for the subsequent research and development of functional foods of total polyphenols from clove for inhibiting oxidation of LDL.
clove;total polyphenol;ultrasonic assisted extraction in constant temperature(UAECT);low density lipoprotein;fluorescent products
2017-02-07
熊一凡(1992-),男,大学本科,主要从事天然产物研究与开发方面的研究,E-mail:741639605@qq.com。
*通讯作者:江慎华(1973-),男,博士,教授,主要从事天然产物研究与开发方面的研究,E-mail:jiangshenhua66@163.com。
国家自然科学基金(31360371,31301423,31560308);江西省科技支撑计划(20151BBF60026,20171BBF60049);江西省卫生厅科研计划( 2013A017); 江苏省农产品物理加工重点实验室开放课题(JAPP2010-5);江西省天然产物与功能食品重点实验室开放基金资助项目;九江学院教学改革研究课题(2015-04);九江学院人才引进基金。
TS201.4
:B
:1002-0306(2017)16-0159-08
10.13386/j.issn1002-0306.2017.16.030

