荆半夏叶柄一步成苗组培快繁体系的优化
李先良+李居宁+彭春雷+赵志常
摘要:以竹叶型荆半夏叶柄为外植体,研究6-BA、2,4-D对半夏一步成苗的影响,以及多效唑(PP333)、茉莉酸甲酯(MJ)、蔗糖对块茎大小的影响。结果表明,提高6-BA浓度有利于叶柄诱导率和平均每个叶柄形成块茎数提高,添加低浓度2,4-D有助于提高平均每个叶柄形成块茎数;单因素试验表明,添加多效唑和茉莉酸甲酯、增加蔗糖浓度均能增加块茎直径;正交试验表明,4个因素对半夏块茎直径的影响顺序为6-BA浓度、蔗糖浓度、茉莉酸甲酯浓度、多效唑浓度。综合考虑,荆半夏一步成苗较适宜的培养基为MS+2.0 mg/L 6-BA+0.1 mg/L 2,4-D+0.5 mg/L PP333+2.0 μmol/L MJ+60 g/L蔗糖。
关键词:荆半夏;叶柄;一步成苗;块茎直径;组培快繁;培养基优化
中图分类号: S567.23+9.043文献标志码: A文章编号:1002-1302(2017)12-0042-03
半夏(Pinellia ternata)是天南星科半夏屬的一种多年生草本植物,也是一种以块茎入药的传统中药材,主要有润燥化痰、降逆、止呕等功效[1]。近年来研究发现,半夏还有抗早孕、抗肿瘤、降血脂、护肝等功能[2]。据统计,在中药处方中,半夏使用频率居第22位[3]。半夏需求量大,且野生资源匮乏。种茎是半夏人工栽培的主要成本之一,因此通过高效的方法生产半夏种茎是提高半夏人工栽培效益的有效途径之一。 组培快繁作为一种高效繁殖方法,被应用到半夏种茎的繁殖研究中。其中,半夏一步成苗研究较多,通过该方法接种到培养基上的外植体可直接形成完整植株,从而可减少组培快繁中分化成苗的步骤。一步成苗法具有再生周期短、易操作、培养程序简单等优势,展现了大规模工厂化生产潜能[4]。另外,一步成苗外植体的来源相对广泛,叶片、珠芽及块茎均可作为外植体[4-7]。在一步成苗过程中,不同外植体一般会经历一段愈伤组织阶段,之后愈伤组织分化成苗。分化出的半夏苗可以移栽,也可将产生的块茎直接作为种茎使用。由于种苗存在运输困难、移栽相对麻烦等问题,因此一步成苗以其产生的块茎为好。有文献报道,外植体可在培养基上形成块茎[8-9],但其增殖率不高[6]。另外,作为栽培用的种茎,其直径大小在1 cm 左右较好[10]。因此,种茎大小也是衡量一次成苗法的指标之一。本研究以荆半夏叶柄为外植体,研究不同激素组合﹑蔗糖浓度对一步成苗法产生块茎数量和大小的影响,探索并优化叶柄外植体一步成苗技术体系,旨在为推进半夏种茎组培快繁的应用奠定基础。
1材料与方法
1.1材料
半夏取自湖北省荆门市京山县永漋镇。叶柄为其中竹叶形半夏叶柄。
1.2方法
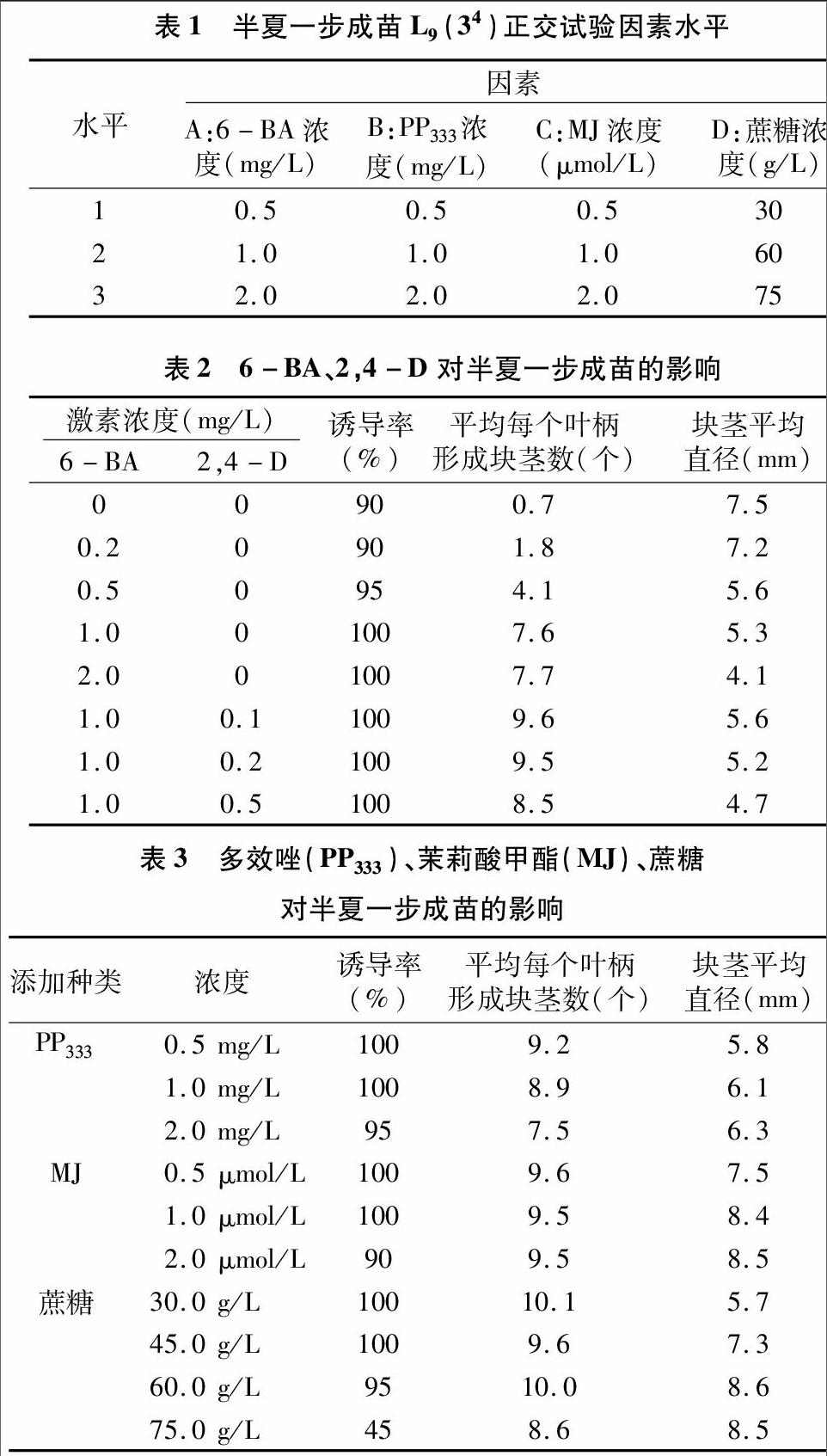
1.2.16-BA、2,4-D 对半夏一步成苗的影响叶柄灭菌后,切成1.5 cm左右,平躺接入MS培养基,培养基分别添加0.2、0.5、1.0、2.0 mg/L 6-BA,1.0 mg/L 6-BA+0.1 mg/L 2,4-D,1.0 mg/L 6-BA+0.2 mg/L 2,4-D,1.0 mg/L 6-BA+0.5 mg/L 2,4-D。
1.2.2多效唑(PP333)、茉莉酸甲酯(MJ)、蔗糖对半夏一步成苗的影响以MS+1.0 mg/L 6-BA+0.1 mg/L 2,4-D+30 g/L 蔗糖培养基为对照,在此基础上分别添加0.5、1.0、20 mg/L多效唑或0.5、1.0、2.0 μmol/L茉莉酸甲酯。在培养基MS+1.0 mg/L 6-BA+0.1 mg/L 2,4-D基础上分别添加30、45、60、75 g/L蔗糖。叶柄灭菌后,切成1.5 cm 左右,平躺接入上述培养基。
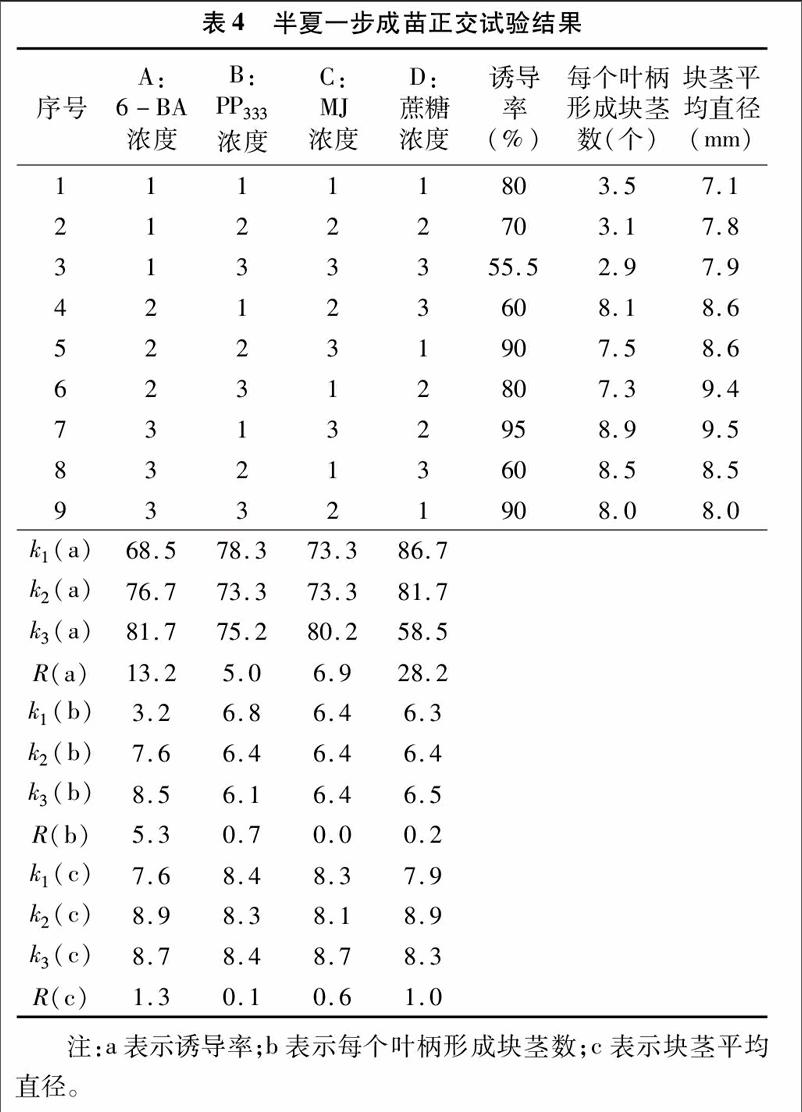
1.2.3叶柄一步成苗的正交试验以6-BA、多效唑(PP333)、茉莉酸甲酯(MJ)、蔗糖为因素,设置L9(34)正交试验。正交设计见表1。
1.2.4培养条件及结果统计培养条件:温度(26±2) ℃,光照周期12 h/d,光照度2 000~3 000 lx。每个处理接4瓶,每瓶接种5个叶柄。30 d后统计诱导率。60 d后统计每个外植体分化的块茎数。统计每个处理块茎平均直径。块茎计数以可分开块茎为标准。
愈伤组织诱导率=产生愈伤组织的叶片数/接种的叶片总数×100%;
平均每个外植体分化的块茎数=分化出的块茎总数/分化出块茎的总叶柄数。
2结果与分析
2.16-BA、2,4-D 对半夏一步成苗的影响
从表2可以看出,在不添加激素条件下叶柄也能形成块茎,但块茎是直接形成的,没有经历成苗阶段。培养基添加 6-BA可提高叶柄诱导率,且会使叶柄经历短暂的愈伤组织阶段,然后该愈伤组织分化成苗,在苗生长过程中形成块茎。随着6-BA浓度升高,形成块茎数增加,块茎直径变小。在添加6-BA基础上,添加2,4-D可以增加块茎数,但添加量增加不利于块茎数增加,同时添加2,4-D不利于块茎增粗。
表26-BA、2,4-D 对半夏一步成苗的影响
激素浓度(mg/L)6-BA2,4-D诱导率
(%)平均每个叶柄
形成块茎数(个)块茎平均
直径(mm)0 0 900.7 7.50.2 0901.8 7.2 0.5 0954.1 5.6 1.0 01007.6 5.3 2.0 01007.7 4.1 1.0 0.1 100 9.6 5.6 1.0 0.2 100 9.5 5.2 1.0 0.5 100 8.5 4.7
2.2多效唑(PP333)、茉莉酸甲酯(MJ)、蔗糖对半夏一步成苗的影响
从表3可以看出,在培养基 MS+1.0 mg/L 6-BA+0.1 mg/L 2,4-D中添加多效唑对诱导率影响不大,但能使块茎直径增大。随着多效唑浓度升高,每个叶柄形成块茎数减少,块茎直径变化不大。添加茉莉酸甲酯既可以降低每个叶柄形成块茎数,也能起到增加块茎直径的效果。升高蔗糖浓度对诱导率无影响,但当蔗糖浓度达到75 g/L时,部分叶柄因培养基高渗透压而死亡,升高蔗糖浓度能提高块茎直径。endprint
2.3正交试验结果
为了了解因素之间的相互作用对诱导率、每个叶柄形成的块茎数及块茎平均直径的影响,进行4因素3水平正交实验。从诱导率看,4个因素对其影响大小顺序是蔗糖浓度>6-BA 浓度>MJ浓度> PP333浓度。蔗糖浓度对诱导率的影响源于对培养基渗透压的改变,高蔗糖浓度形成高渗透压,进而导致部分外植体死亡。因此,不同蔗糖浓度对诱导率造成比较明显的影响。对诱导率而言,最佳组合为A3B1C3D1。
从平均每个叶柄形成块茎数看,4个因素对其影响大小顺序是6-BA浓度>PP333 浓度>蔗糖浓度> MJ浓度,最佳组合是A3B1C1D3。应该指出的是,平均每个叶柄形成块茎数时,并没有将因高渗透压死去的外植体计算在内,故D3水平的该指标值较高。因此,同时考虑诱导率情况下,最佳组合应为A3B1C1D2。高浓度蔗糖增加6-BA浓度有利于增加平均每个叶柄形成块茎数,PP333浓度升高不利于增加平均每个叶柄形成块茎数。
块茎平均直径对组培块茎用作栽培种茎而言是一个重要指标。从表4可见,4个因素对块茎直径影响大小顺序为 6-BA 濃度>MJ浓度>蔗糖浓度> PP333浓度。6-BA作为一种细胞分裂素,对于芽的形成具有重要作用,而半夏的珠芽和块茎具有类似的解剖结构,珠芽可看作块茎母体[11],因此 6-BA对于半夏块茎的形成具有重要影响,同时也对半夏块茎直径大小具有基础性作用。对于块茎直径而言,最佳组合为A2B3C3D2。
综合3个指标来看,最佳组合为A3B1C3D2,即MS+2.0 mg/L 6-BA+0.1 mg/L 2,4-D+0.5 mg/L PP333+20 μmol/L MJ+60 g/L蔗糖。
3结论与讨论
半夏叶柄来源广泛,用叶柄作外植体可扩大外植体选用范围。从诱导率和平均单个外植体形成块茎数2个指标看,与叶片外植体一步成苗效果相当。因此,叶柄作为一步成苗法的外植体是合适的。叶柄外植体一步成苗过程与叶片一步成苗类似,先脱分化形成愈伤组织,再分化成苗,但愈伤组织阶段比较短暂,愈伤组织也不明显。因此,培养基添加激素种类和浓度能配合其完成这一过程。6-BA在半夏愈伤组织诱导中经常被选用[12-18],半夏叶柄在添加6-BA的培养基上两端膨大,形成黄绿色愈伤。愈伤脱分化形成芽需要 6-BA 刺激。2,4-D能诱导叶柄产生愈伤组织,颜色淡黄,可能脱分化程度较高。2,4-D在愈伤组织分化过程中不起作用,因此单独添加2,4-D并不能最终分化成苗,单独添加6-BA能最终分化成苗。6-BA浓度升高可提高诱导率和平均单个叶柄形成的块茎数,这可能是因为升高6-BA浓度会增加愈伤组织量。适量升高2,4-D浓度可以增加愈伤组织量,进而提高平均单个叶柄形成的块茎数,2,4-D过高会抑制愈伤组织分化成苗。
半夏一步成苗法不仅要考虑增殖效果,即单位外植体形成苗或块茎的数量,还需考虑形成块茎的大小。多效唑作为一种植物生长延缓剂,通过控制茎叶生长,促进光合产物及时向块茎转运,进而促进植物贮藏器官的增大[19]。单因素试验结果表明,添加多效唑能起到增加块茎大小的作用。正交试验中,多效唑对块茎大小的作用不如其他3个因素,这表明多效唑可能与其他因素,特别是细胞分裂素之间存在相反作用。茉莉酸甲酯也能促进地下器官的形成[20],从单因素试验结果看,其具有增加块茎大小的作用,正交试验结果显示,茉莉酸甲酯对块茎大小的影响排在第3位。蔗糖在培养基中主要是提供植物在光合作用无法进行时所需的碳源,单因素试验结果表明,适当升高蔗糖浓度可以提高块茎大小;正交试验结果表明,其对半夏块茎直径影响在4个因素排在第2位,具有较大影响。
参考文献:
[1]国家药典委员会.中国药典(一部)[M].北京:化学工业出版社,2005:98-99.
[2]中国医学科学院药物研究所.中药志(第二册)[M].北京:人民卫生出版社,1993:38.
[3]郑汉臣.苏联近十年来药用植物研究概况(续)[J]. 中草药,1980,11(2):91-96.
[4]罗成科,彭正松.半夏组织培养一步成苗技术的研究进展[J]. 安徽农业科学,2003,31(5):798-799.
[5]张苏峰,谢素霞.半夏组织培养快速繁殖的研究[J]. 信阳师范学院学报(自然科学版),1998,11(1):56-88.
[6]罗成科,彭正松,蔡鹏.三叶半夏叶片一步成苗离体培养技术[J]. 广西植物,27(2):260-264.
[7]刘彩莲. 半夏一步成苗技术体系及生理生化研究[D].雅安:四川农业大学,2010.
[8]薛建平,朱艳芳,张爱民,等. 半夏试管块茎直接再生技术的研究[J]. 作物学报,2004,30(10):1060-1064.
[9]张爱民,杨生玉,薛建平,等. 多种因素对半夏外植体直接诱导形成试管小块茎的影响[J]. 中国中药杂志,2005,30(8):576-579.
[10]梅艳,赵明勇,阮培均,等. 不同种茎种植对半夏产量及相关性状、品质的影响[J]. 中国农学通报,2012,28(7):276-280.
[11]顾德兴,李云香,徐炳声.半夏的繁殖生物学研究[J]. 植物资源与环境学报,1994,3(4):44-48.
[12]罗华彦,庭玉凤,宋萍,等. 半夏快速繁殖体系的研究[J]. 植物生理学通讯,2005,41(6):777-778.
[13]章伟标,王姿云,张莹莹,等. 半夏疏松愈伤组织诱导及高产半夏蛋白悬浮株系筛选[J]. 浙江理工大学学报,2011,28(5):800-803.
[14]潘卫仓,刘菊英.半夏愈伤组织的诱导及植株的再生研究[J]. 北方园艺,2009(11):221-223.
[15]邱璐,黄静,范树国,等. 半夏愈伤组织的诱导与分化研究[J]. 江苏农业科学,2009(6):72-74.
[16]朱艳芳,毛春娜,张爱民,等. 半夏疏松愈伤组织诱导条件的优化研究[J]. 农业科学与技术(英文版),2011,12(8):1116-1117,1124.
[17]万美亮,陈宏康,詹亚华,等. 半夏组织培养与快速繁殖研究[J]. 中国中药杂志,1995,20(9):526-529.
[18]刘鑫欣,崔晓星,刘金欣,等. 不同植物生长调节剂对半夏愈伤组织诱导效应的研究[J]. 中国中医药信息杂志,2011,18(5):57-59.
[19]陈贵林,赵廷瑛,李世一. 赤霉素和多效唑对莴笋产品器官形成的影响[J]. 河北农业大学报,1989,12(4):88-93.
[20]甘立军,曾晓春,周燮. 茉莉酸类与植物地下贮藏器官的形成[J]. 植物学通报,2001,18(5):546-553.李朝炜,刘颖,王丹娜,等. 农杆菌介导小麦成熟胚遗传转化的几个影响因素研究[J]. 江苏农业科学,2017,45(12):45-47.endprint
——西红柿

