粗糙脉孢菌ERG-11蛋白抗原的原核表达、纯化及其多克隆抗体制备
刘雁霞李少杰樊振川
(1. 天津科技大学大健康生物技术研究所 天津市大健康生物技术国际联合研究中心 天津科技大学食品工程与生物技术学院,天津 300457;2. 中国科学院微生物研究所 真菌学国家重点实验室,北京 100101)
粗糙脉孢菌ERG-11蛋白抗原的原核表达、纯化及其多克隆抗体制备
刘雁霞1李少杰2樊振川1
(1. 天津科技大学大健康生物技术研究所 天津市大健康生物技术国际联合研究中心 天津科技大学食品工程与生物技术学院,天津 300457;2. 中国科学院微生物研究所 真菌学国家重点实验室,北京 100101)
构建pET-28a(+)-ERG-11重组质粒,表达6×His-ERG-11融合蛋白,制备ERG-11多克隆抗体。采用PCR技术扩增目的片段,插入pET-28a(+)原核表达载体,并转入E. coli BL21(DE3)感受态表达融合蛋白,融合蛋白经亲和纯化及分子筛纯化后免疫新西兰大白兔制备多克隆抗体,取血清后,采用间接ELISA法和Western blot法检测多克隆抗体的效价及特异性。成功构建了pET-28a(+)-ERG-11表达载体,SDS-PAGE电泳显示成功诱导出以包涵体形式存在的6 × His-ERG-11融合蛋白,两步纯化后得到纯度较高的抗原,间接ELISA法显示制备的多克隆抗体效价达到1∶512 000,Western blot显示具有较高特异性。成功实现了粗超脉孢菌ERG-11蛋白的原核表达,制备出一支兔抗粗超脉孢菌ERG-11的多克隆抗体。
粗超脉孢菌ERG-11基因;克隆;蛋白表达及纯化;多克隆抗体
近年来,随着抗生素的广泛应用,真菌感染的几率逐年增加,尤其存在于免疫力低下及免疫缺陷的人群中,如骨髓/器官移植者,人类免疫缺陷病毒(HIV)患者等[1]。目前随着一系列抗真菌药物的问世及人们的长期广泛使用,使得真菌的抗药性不断增强[2-5],由真菌感染所导致的各种疾病以及高死亡率成为临床上亟待解决的重大问题。目前,根据各种抗菌药物作用方式以及作用靶标的不同,可将抗菌药物分为多烯类药物、碱基类似物、唑类药物及棘球白素等四大类,其中唑类药物的应用最为广范,研究报道的也比较多[6]。真菌细胞膜上的特有脂质麦角固醇对于维持细胞的完整性及流动性有重要作用,14α-去甲基化酶(Erg11p)是麦角固醇合成过程中的限速酶,其编码基因为ERG11,唑类药物通过与14α-去甲基化酶结合,进而影响酶活,阻止细胞膜的正常形成,因此ERG-11基因的改变,如基因过度表达、基因突变等都会影响真菌的耐药性[7-10],基于此制备ERG-11多克隆抗体用于后续试验研究,进一步探究该基因与唑类药物的作用机理。
粗糙脉孢菌是一种属于真菌界(Fungi)子囊菌门(Ascomycota)粪壳菌纲(Sordariomycetes)粪壳菌目(Sordariales)粪壳菌科(Sordariaceae)脉孢菌属(Neurospora)[11]的真核生物,该菌易于在实验室培养,生长旺盛且不易被污染,同时不具致病性,也具备两性生活周期,能够快速获得性状分离、杂交后代等,已经完成全基因组测序工作,拥有清楚的遗传背景[12],以上这些特点使得该菌作为一种模式生物被广泛应用于细胞生物学、遗传学及基因调控等方面的研究[13-15]。为此,本研究以粗糙脉孢菌全基因组为模板,选择扩增长约800 bp的外显子区域,将该基因片段克隆至原核表达载体pET-28a(+),经IPTG诱导表达后经两步纯化,免疫新西兰大白兔制备兔抗粗糙脉孢菌多克隆抗体,旨在为进一步探讨ERG-11基因在粗糙脉孢菌中的生物学功能以及其抗药性和抗药机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒 原核表达载体pET-28a(+),感受态细胞E. coli BL21(DE3)及感受态细胞E. coli XL1-blue由本实验室保存,免疫用新西兰大白兔由天津欧阳实验种兔场提供,粗超脉孢菌基因组由中国科学院微生物研究所真菌学国家重点实验室李少杰课题组提供。
1.1.2 主要试剂 琼脂糖凝胶回收试剂盒购自北京天根生化科技有限公司,质粒小提试剂盒购自北京索来宝科技有限公司,限制性内切酶(BamH I/Hind III)、蛋白Marker、T4DNA连接酶购自美国赛默飞公司,100 bp/1 kb DNA Marker购自北京全式金公司,Ni SepharoseTM6 Fast Flow蛋白纯化填料、Hiload 16/60 Superdex 200 pg 预装柱、Protein A SepharoseTMCL-4B抗体纯化填料购自美国GE Healthcare公司;蛋白免疫印迹NC膜购自美国PALL公司;弗式完全佐剂和弗氏不完全佐剂购自美国Sigma公司;辣根过氧化物酶(HRP)标记的羊抗兔/鼠抗体购自美国Jackson公司;ECL化学发光显色液购自德国Millipore公司。
1.1.3 引物设计与合成 根据GenBank中粗超脉孢菌ERG-11基因序列(登录号:NCU02624)设计ERG-11的DNA扩增引物,选择一段长834 bp的外显子制备多克隆抗体,融合蛋白大小为36 kD,在上下游引物中插入BamH I和Hind III酶切位点,上游引物:5'-AAGGATCCGGATCCATGGACACCATC-3',下游引物:5'- TTAAGCTTAAGCTTTTACAACTGGC-3',引物由北京奥科鼎盛生物有限公司合成。
1.2 方法
1.2.1 重组表达质粒pET-28a(+)-ERG-11的构建 以粗糙脉孢菌基因组DNA为PCR扩增模板,PCR反应条件为:95℃预变性3 min;95℃变性45 s,57℃退火45 s,72℃延伸2 min,30个循环;72℃终延伸10 min。将扩增后的PCR产物经1.5%琼脂糖凝胶电泳检测,将大小正确的PCR产物与原核表达载体pET-28a(+)经BamH I/Hind III双酶切2 h后,利用T4连接酶4℃过夜连接,转化至感受态细胞E. coli XL1-blue中,次日挑选阳性克隆至液体培养基,提取质粒后进行双酶切验证,将验证大小正确的重组质粒命名为pET-28a(+)-ERG-11,进行测序验证。1.2.2 融合蛋白的诱导表达和纯化 将测序结果正确的重组质粒pET-28a(+)-ERG-11转化至感受态细胞E. coli BL21(DE3),37℃培养至对数期(OD600值约0.5-0.6),加入终浓度为0.2 mmol/L的IPTG诱导剂,25℃条件下诱导6 h[16],离心收集菌体,超声破碎后获得全蛋白。取上清和沉淀分别与5 × 蛋白上样缓冲液混匀,经12% SDS-PAGE电泳检测,鉴定融合蛋白的存在形式。
将诱导表达后的菌体离心收集,超声破碎,收集沉淀,向沉淀中加入含8 mol/L尿素的结合缓冲液(50 mmol/L Tris-HCl,500 mmol/L NaCl,8 mol/L尿素,pH7.4),使沉淀变性溶解,与Ni SepharoseTM6 Fast Flow填料4℃过夜结合[17];流出结合液,用含8 mol/L尿素的结合缓冲液洗涤杂蛋白,再用含8 mol/L尿素及咪唑的洗脱缓冲液梯度(50 mmol/L、100 mmol/L、500 mmol/L)洗脱目的蛋白。将纯化产物进行12% SDS-PAGE凝胶分析。
将经亲和纯化后的融合蛋白富集,再次进行分子筛纯化。用含8 mol/L尿素的PBS以1 mL/min 的速率平衡Hiload Superdex 200 pg 两个柱体积;上样3 mL(6 mg/mL),流速1 mL/min;以1 mL/min 的速率洗脱,收集蛋白。
1.2.3 动物免疫实验 免疫前,经耳动脉采血100 μL作为阴性对照血清。首次免疫,将融合蛋白与弗氏完全佐剂按照1∶1的比例充分混合,乳化至少2 h后,采用背部多点皮下注射法免疫新西兰大白兔(1 mg/次/只)。10 d后,用弗氏不完全佐剂与融合蛋白按照1∶1的比例充分混合,乳化至少2 h,加强免疫,共加强免疫4次,加强免疫剂量及途径与初免一致。末次免疫1周后,再次经耳动脉采血100 μL,分离血清,间接ELISA法测定抗血清效价。将效价合格的家兔经股动脉采血,分离血清,-80℃冻存备用。
1.2.4 多克隆抗体的纯化 取1 mg抗血清加入12 mL Protein A结合液(20 mmol/L Na2HPO4,pH7.2),与Protein A SepharoseTMCL-4B纯化介质室温结合30 min,5倍柱体积Protein A结合液洗涤后用洗脱缓冲液(0.1 mol/L甘氨酸,pH2.7)进行洗脱,并用1 mol/L Tris-HCl(pH9.0)将洗脱液pH调节至中性。1.2.5 多克隆抗体效价及特异性检测 采用间接ELISA法及Western blot法测定抗体效价和特异性。
间接ELISA法测定抗体效价[18],采用免疫前后兔血清作为一抗,分别将免疫前血清和免疫后血清按照1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000,1∶256 000,1∶512 000的比例稀释,二抗采用HRP标记羊抗兔抗体,酶标仪测定OD450值,若试验组血清OD450/阴性对照血清OD450≥2.0则判为阳性,其最高稀释度即为待测抗血清的效价。
Western blot法测定抗体特异性。分别在E. coli BL21及粗超脉孢菌中Western blot检测抗体特异性,SDS-PAGE电泳后转移至NC膜,以5 %牛奶/TBST室温封闭,将抗血清按1∶10 000、1∶20 000、1∶40 000稀释后,室温孵育;用5%牛奶/TBST按1∶10 000稀释HRP标记的羊抗兔二抗,室温孵育;用ECL显色液进行显色。
2 结果
2.1 重组质粒pET-28a(+)-ERG-11的构建
以粗超脉孢菌基因组为模板进行PCR扩增,琼脂糖凝胶显示在Marker 800 bp处有一条明亮条带(图1);利用BamH I/Hind III将目的片段与载体双酶切后连接,挑取4个阳性克隆酶切验证(图2),3号克隆验证大小正确,将3号重组质粒测序,测序结果正确,表达载体构建成功,将测序正确的重组质粒命名为pET-28a(+)-ERG-11。
2.2 融合蛋白6 ×His-ERG-11诱导表达及纯化
重组质粒pET-28a(+)-ERG-11转化至E. coli BL21(DE3)后,在25℃条件下,经IPTG诱导后的融合蛋白6 × His-ERG-11经SDS-PAGE电泳(图3),泳道3中,在35 kD以上有一条明显条带,大小与6 × His-ERG11融合蛋白预期大小相符,诱导表达成功,且融合蛋白主要以包涵体的形式存在。

图1 ERG-11 PCR扩增产物

图2 重组质粒pET-28a(+)-ERG-11双酶切验证

图3 融合蛋白的SDS-PAGE分析
镍柱亲和纯化后的蛋白经SDS-PAGE电泳(图4),8 mol/L尿素存在的条件下,50 mmol/L /100 mmol/L咪唑可将35 kD以下的杂蛋白洗脱,在70 kD及130 kD以上仍存在少量杂蛋白;将亲和纯化后的洗脱液超滤浓缩后,进行分子筛纯化,分子筛上样总蛋白约8 mg,取相应峰顶处样品进行SDSPAGE电泳(图5),将样品富集浓缩后得到免疫用抗原(图6),可得纯度较高的目的蛋白约3 mg,回收率为37.5%。
2.3 抗体的效价及特异性检测
采用间接ELISA法测定5次免疫后的抗血清,在1∶512 000的稀释度下,免疫后血清OD450(0.5)/免疫前血清OD450(0.15)≥2.0,抗血清滴度达到1∶512 000(图7)。分别取诱导表达前细菌全蛋白,诱导后细菌蛋白和纯化后细菌蛋白进行SDS-PAGE电泳分析,经Western blot分析显示,抗血清在1∶10 000的稀释条件下,诱导表达前细菌全蛋白无信号,诱导后细菌蛋白和纯化后细菌蛋白在35 kD、70 kD及以上处均有信号,与抗原纯化结果保持一致,且纯化后的蛋白在35 kD处相对于未纯化的蛋白信号较强,多克隆抗能够与ERG-11蛋白发生特异性结合(图8)。

图4 亲和纯化产物的SDS-PAGE分析
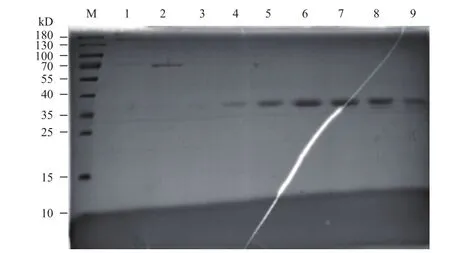
图5 分子筛纯化产物的SDS-PAGE分析

图6 纯化后的融合蛋白6×His-ERG-11
2.4 粗糙脉孢菌ERG-11蛋白检测

图7 间接ELISA法测定抗血清效价

图8 免疫印迹法验证ERG-11抗血清特异性
野生型粗糙脉孢菌中ERG-11全蛋白大小约为60 kD,粗糙脉孢菌ERG-11基因过表达菌株中ERG-11全蛋白大小为69.5 kD,多克隆抗体ERG-11在1∶2 000的稀释比例下,野生型及基因过表达菌株中均能检测到目标蛋白,在ERG-11基因敲低的菌株中未检测到目标蛋白(图9-A);在1∶10 000的稀释比下,基因敲低菌株及野生型菌株中相应蛋白大小处几乎无信号,仅在ERG-11基因过表达菌株中能够检测到信号(图9-B)。以上数据表明多克隆抗体ERG-11具有较高的特异性和灵敏度。
3 讨论
目前在临床上,唑类药物常作为真菌感染的普遍用药,对唑类药物的耐药研究最为突出[19-21],研究表明,ERG11基因编码的麦角甾醇14α-去甲基化酶失活将会造成真菌细胞膜破坏,达到抑制真菌的作用。为了研究ERG11基因的生物学功能,以粗糙脉孢菌作为研究生物,通过PCR获得该基因864 bp-1 698 bp间的834 bp外显子区域,克隆至原核表达载体pET-28a(+),该表达载体含有6个组氨酸编码序列,可使表达外源蛋白带有6个组氨酸的纯化标签,通过组氨酸与金属离子(Ni2+)的螯合作用,有利于表达蛋白的纯化,同时标签较小,不会影响蛋白的结构和功能。通过优化IPTG诱导的浓度及温度,最终得到以包涵体形式存在的目的蛋白,造成目的蛋白以包涵体形式存在,一方面可能与pET系统的高效表达有关,过快的蛋白合成速度以至于无法进行蛋白折叠,二硫键无法正确配对[22];另一方面可能与蛋白本身的结构有关,ERG-11蛋白属于膜蛋白的一种,其本身具有疏水性。研究也曾尝试采用pGEX和pMAL系列载体进行纯化免疫,利用GST与MBP标签的促溶性使其形成可溶性蛋白,但考虑到标签大于所表达的目的蛋白,可能会导致抗体效价不高以及后期抗体难于纯化,而本次研究最终目的为将抗体用于Western blot检测,因此最终选择pET载体进行表达纯化抗原。由于细菌中大部分蛋白都是水溶性蛋白,以包涵体形式存在的蛋白较少,更加简化了本次目的蛋白的纯化。通过镍柱亲和纯化和分子筛纯化后得到干净的免疫抗原后,直接用含高浓度尿素变性的蛋白免疫,在一免后相对于其他上清蛋白免疫效果来看,新西兰大白兔免疫后反应较大,这可能由于尿素含量高造成,但最终所得到的抗体在效价以及纯度上没有受到负面影响[23-24]。但该抗体仍存在一定的局限性,由于免疫抗原为变性蛋白,其空间构象发生改变导致抗原决定簇以线性表位形式刺激兔子产生免疫应答反应,这种情况下的抗血清不会影响Western blot的检测,但由于免疫组化所用抗体识别的是空间构象保持下的抗原表位,因此不能用于免疫荧光以及免疫共沉淀等免疫组学实验。在以后的实验中对于包涵体蛋白可采用蛋白沉淀法将尿素去除,以减轻对兔子的危害;另外可通过稀释、透析、超滤等方法使蛋白复性,使其能进一步用于免疫组学实验。
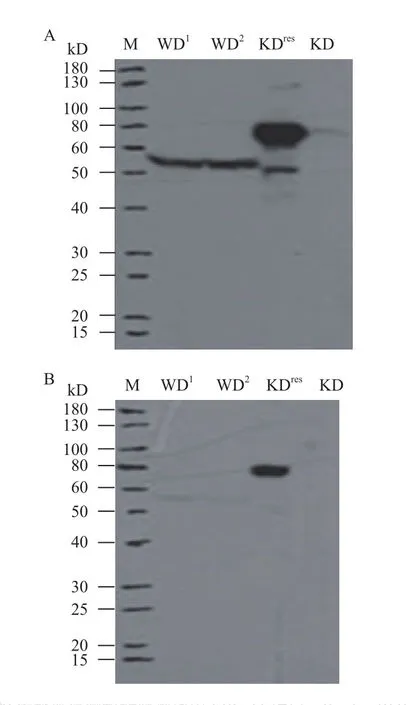
图9 粗糙脉孢菌中ERG-11蛋白检测
4 结论
本研究成功克隆了粗糙脉孢菌ERG-11基因,并诱导表达出融合蛋白6 × His-ERG-11,蛋白经纯化后免疫新西兰大白兔,得到抗血清,在利用表达宿主细菌BL21以及真菌粗糙脉孢菌进行Western blot检测时,相比于一般多抗的稀释比,显示具有较高的特异性,能够达到1∶10 000的稀释比,该抗体的成功获得可用于粗糙脉孢菌中不同转基因菌株ERG-11蛋白的检测分析。
[1] Arendrup MC, Fuursted K, Gahrnhansen B, et al. Seminational surveillance of fungemia in denmark:notably high rates of fungemia and numbers of isolates with reduced azole susceptibility[J]. Journal of Clinical Microbiology, 2005, 43(9):4434-4440.
[2] Nolte FS, Parkinson T, Falconer DJ, et al. Isolation and characterization of fluconazole- and amphotericin B-resistant Candida albicans from blood of two patients with leukemia[J]. Antimicrobial Agents & Chemotherapy, 1997, 41(1):196-199.
[3] Denning DW, Venkateswarlu K, Oakley KL, et al. Itraconazole resistance in Aspergillus fumigatus[J]. Antimicrobial Agents & Chemotherapy, 1997, 41(6):1364-1368.
[4] Kelly SL, Lamb DC, Kelly DE, et al. Resistance to fluconazole and amphotericin in Candida albicans from AIDS patients[J]. Lancet, 1996, 348(9040):1523.
[5] Rex JH, Rinaldi MG, Pfaller MA. Resistance of Candida species to fluconazole[J]. Antimicrobial Agents & Chemotherapy, 1995, 39(1):1.
[6] 买佳. 白色念珠菌ERG11基因突变与其耐三唑类抗真菌药物的关系[D]. 郑州:郑州大学, 2015.
[7] Lotfali E, Ghajari A, Kordbacheh P, et al. Regulation of ERG3, ERG6, and ERG11 genes in antifungal-resistant isolates of Candida parapsilosis[J]. Iranian Biomedical Journal, 2017, 21(4):275-281.
[8] Silva DBDS, Rodrigues LMC, Almeida AAD, et al. Novel point mutations in the ERG11 gene in clinicalisolates of azole resistant Candida species[J]. Memórias Do Instituto Oswaldo Cruz, 2016, 111(3):192-199.
[9] Feng W, Yang J, Wang Y, et al. ERG11 mutations and upregulation in clinical itraconazole-resistant isolates of Candida krusei[J]. Canadian Journal of Microbiology, 2016, 62(11):938.
[10] Xu Y, Fang S, Zhao J, et al. ERG11, mutations and expression of resistance genes in fluconazole-resistant Candida albicans, isolates[J]. Archives of Microbiology, 2015, 197(9):1087-1093.
[11] 王亚军, 何群. 表观遗传学研究的模式生物——粗糙脉孢菌[J]. 生物化学与生物物理进展, 2015(11):1026-1032.
[12] Galagan JE, Calvo SE, Borkovich KA, et al. The genome sequence of the filamentous fungus Neurospora crassa[J]. 2003, 422(6934):859-868.
[13] Gu X, Wei X, Yin Y, et al. The Hsp90 Co-chaperones Sti1, Aha1, and P23 regulate adaptive responses to antifungal azoles[J]. Frontiers in Microbiology, 2016, 7:1571.
[14] Chen X, Wei X, Zhou J, et al. De-repression of CSP-1 activates adaptive responses to antifungal azoles[J]. Scientific Reports, 2016, 6:19447.
[15] Liu J, Yuan Y, Wu Z, et al. A novel sterol regulatory elementbinding protein gene(sreA)identified in penicillium digitatum is required for prochloraz resistance, full virulence and erg11(cyp51)regulation[J]. PLoS One, 2014, 10(2):e0117115.
[16] 任海月, 董彬, 樊振川, 等. 莱茵衣藻纤毛内运输蛋白IFT46的原核表达纯化及其多克隆抗体的制备[J]. 生物工程学报, 2016, 32(8):1124-1132.
[17] 董彬, 吴松, 王晶, 等. 莱茵衣藻纤毛内运送蛋白IFT27的原核表达、纯化及多克隆抗体制备[J]. 生物技术, 2016(6):532-538.
[18] 田伟, 董彬, 李镇芳, 等. 莱茵衣藻IFT139蛋白抗原的原核表达、纯化及多克隆抗体的制备[J]. 天津科技大学学报, 2016, 31(6):27-33.
[19] Rex JH. Reference method for broth dilution antifungal susceptibility testing of yeasts:Approved standard[M]. Clinical and Laboratory Standards Institute, 2008.
[20] Wu SX, Guo NR, Li XF, et al. Human pathogenic fungi in China--emerging trends from ongoing national survey for 1986, 1996, and 2006[J]. Mycopathologia, 2011, 171(6):387-393.
[21] 詹燏, 汤贝贝, 刘水逸, 等. 临床标本中假丝酵母菌属的检出率及耐药性分析[J]. 中华医院感染学杂志, 2012, 22(3):645-646.
[22] 宏贤, 刘罡, 张晨, 等. 家蚕丝氨酸蛋白酶抑制剂4(serpin-4)的基因克隆、原核表达和多克隆抗体制备[J]. 昆虫学报, 2011, 54(6):642-647.
[23] 孙金娥, 肖长义, 付冰冰, 等. 抗HPV L1小鼠单克隆抗体及兔多克隆抗体的制备[J]. 免疫学杂志, 2013(12):1079-1083.
[24] 徐秋芳, 陈晴晴, 倪海平, 等. 灰飞虱原肌球蛋白的基因克隆、原核表达及多克隆抗体制备[J]. 中国农业科学, 2014, 47(19):3791-3798.
(责任编辑 朱琳峰)
Prokaryotic Expression,Purification and Polyclonal Antibody Preparation of Neurospora crassa ERG-11 Protein Antigen
LIU Yan-xia1LI Shao-jie2FAN Zhen-chuan1
(1. Institute of Health Biotechnology,International Collaborative Research Center for Health Biotechnology,College of Food Science and Biotechnology,Tianjin University of Science and Technology,Tianjin 300457;2. State Key Laboratory of Mycology,Institute of Microbiology,Chinese Academy of Science,Beijing 100101)
This work aims to construct the recombinant plasmid pET-28a(+)-ERG-11 and express the 6 × His-ERG-11 fusion protein for preparing ERG-11 polyclonal antibody. The target fragment amplified by PCR was inserted into pET-28a(+)prokaryotic expression vector,and then transformed into the competent cells of Escherichia coli BL21(DE3)for expressing the fusion protein. Further,the fusion protein was purified by affinity purification and gel filtration chromatography,and then immunized to New Zealand white rabbit for preparing polyclonal antibody. Taking serum,the titer and specificity of the polyclonal antibody were detected through indirect ELISA and Western blot,respectively. As results,the pET-28a(+)-ERG-11 expression vector was successfully constructed. SDS-PAGE showed that the 6 × His-ERG-11 fusion protein was induced successfully in the inclusion form. After two-step purification,the antigen with high purity was obtained. ELISA showed that the polyclonal antibody titer reached 1∶512 000,and Western blot confirmed its high specificity. Conclusively,the prokaryotic expression of ERG-11 gene was successfully conducted,and a polyclonal antibody against Neurospora crassa ERG-11 was prepared,providing a foundation for further study on the genetic structure and function of ERG-11 in N. crassa.
Neurospora crassa ERG-11;cloning;protein expression and purification;polyclonal antibody
10.13560/j.cnki.biotech.bull.1985.2017-0258
2017-04-01
国际遗传工程与生物技术中心联合研究项目(CRP/CHN15-01)
刘雁霞,女,硕士,研究方向:大健康生物技术;E-mail:liuyanxia@mail.tust.edu.cn
樊振川,男,博士,研究方向:大健康生物技术;E-mail:fanzhen@tust.edu.cn

