替加氟透明质酸纳米粒的制备
代培培,郭兴家,王 丹,吕京珊,许志强,刘 畅,刘立杰,王诗尧,郝爱军
(1.辽宁大学 药学院,辽宁 沈阳 110036;2. 辽宁大学 化学院,辽宁 沈阳 110036)
替加氟透明质酸纳米粒的制备
代培培1,郭兴家2,王 丹1,吕京珊1,许志强1,刘 畅1,刘立杰1,王诗尧1,郝爱军1
(1.辽宁大学 药学院,辽宁 沈阳 110036;2. 辽宁大学 化学院,辽宁 沈阳 110036)
采用透明质酸为原料,以己二酰肼为交联剂、EDCI为催化剂,制备了透明质酸纳米粒,并用做抗肿瘤药物替加氟的载体。红外光谱法确定了透明质酸纳米粒官能团的变化反应。采用激光粒度测定仪测定了纳米粒的粒径和zeta电位。结果表明,本方法制备的透明质酸纳米粒的平均粒径为218.3±41.38 nm,zeta电位为-24.0 ± 7.48 mV。替加氟在透明质酸纳米粒的包封率为92.1%。
替加氟;透明质酸;纳米粒;酰肼交联法
替加氟又名喃氟啶、FT-207,是氟尿嘧啶(5-Fu)的前体药物,在机体肝脏内被代谢酶(P-450)活化分解为5 - Fu而起抗肿瘤作用[1]。替加氟在临床上主要适用于消化道癌,对胃癌、直肠癌、结肠癌、胰腺癌有一定疗效,对乳腺癌及肝癌也有效[1-3]。在治疗肿瘤的同时,替加氟具有较多的不良反应,主要包括骨髓抑制反应,白细胞、血小板下降,神经毒性反应等。研究表明,替加氟是时间依存性抗癌药,即药物杀灭癌细胞的效能与接触细胞时间长短正相关。因此,为增加替加氟的治疗效果,人们研究了替加氟的静脉脂肪乳剂[5]、缓释片剂[6]、白蛋白微球[7]及脂质体[8-9]等剂型。其中纳米类给药系统尤其引人关注。
纳米药物是指是指粒径在 1-1000 nm范围内的微粒类药物[10]。用作纳米药物载体的纳米粒主要包括由合成聚合物或天然高分子构成。由于纳米粒尺寸在纳米级别而产生独特的纳米效应,包括表面效应、体积效应、量子尺寸效应和宏观隧道效应等,最终,纳米材料在光学、热学、力学、磁学等物理性能方面都有较为显著的提高。因此,纳米粒在化工、陶瓷、电子学、光学、生物医药等诸多方面具有广阔的应用前景和开发潜力[10]。尤其是纳米药物近年来得到快速发展。普通小分子药物常规给药方式下,缺少组织靶向性,在治疗疾病的同使具有较大的毒副作用[11-12]。采用纳米粒子作为药物载体制备成纳米药物,利用纳米粒子在体内的EPR效应,纳米药物可以实现良好的肿瘤和炎症组织的靶向传递,可以减少给药次数,提高药物对病变部位的靶向性[11-12]。本文以生物相容性聚合物透明质酸钠为原料制备载替加氟的纳米给药系统。
透明质酸又称玻尿酸(Hyaluronan),是由两个双糖单位D-葡萄糖醛酸及N-乙酰葡糖胺组成的高分子量的糖醛酸[13-14]。透明质酸具有独特的分子结构和理化性质,在机体内显示出多种重要的生理功能,如润滑关节,调节血管壁的通透性,调节蛋白质,水电解质扩散及运转,促进创伤愈合等作用。同时,现代肿瘤相关研究表明,透明质酸在多种肿瘤组织中的含量均有所升高。同时,分子药理学研究表明,透明质酸钠可以特异性识别并特异性结合细胞表面CD44受体,引起信号传导和细胞骨架的重排[15]。有研究表明CD44受体具有促进侵袭性肿瘤存活的能力,而抑制CD44的活性则诱导侵袭性肿瘤的凋亡。同时也有研究表明,不同分子量的透明质酸在体内的作用差别很大。小分子量的透明质酸可以促进肿瘤的增长和转移,中高分子量的透明质酸可以抑制肿瘤产生。
本文利用透明质酸钠作为原料,采用酰肼交联法制备透明质酸纳米粒,并用作抗肿瘤药物替加氟的药物载体,制备替加氟透明质酸纳米粒。
1 实验部分
1.1 原料和试剂
透明质酸钠(100万Dalton,华熙福瑞达生物医药有限公司);己二酰肼(ADH)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)为市售分析纯;替加氟(江苏南通精华制药有限公司)。激光粒度测定仪(Nano ZS-90,马尔文公司)。
1.2 替加氟分析方法的建立
准确称取4.0 mg替加氟溶于100mL容量瓶中,加水定容。再经稀释配制成2.00、4.00、6.00、8.00、10.00、12.00、14.00、16.00、18.00和20.00 μg/mL浓度的替加氟标准溶液。用紫外分光光度计在最大吸收波长272 nm波长处下测定其吸光度,并取其三次平均值。记录数据,并绘制标准曲线。
1.3 透明质酸纳米粒制备:
方法[16],采用碳二亚胺催化,酰肼交联的方法制备透明质酸纳米粒。具体方法如下:于500 mL的烧杯中,加入80 mL的去粒子水,加入0.2 g的透明质酸,溶解后得到透明的粘性溶液(2.5 mg/mL)。加入适量丙酮,搅拌15 min,保证均匀溶解。将80 mg的EDC和40 mg的ADH溶于2 mL的去离子水中,加入到上述烧杯中,搅拌30 min后,加入适量丙酮,继续搅拌3 h,用截留分子量(MWCO 1000)透析袋透析,冷冻干燥。得到纳米粒。
称0.0500 g替加氟溶解并定容于50 mL容量瓶中。将上述透明质酸纳米粒称重,分散于1.00 mL 去离子水,按纳米粒与药重量10:1比例将药物溶液与纳米粒混合,最后定容得到载药透明质酸纳米粒。
1.4 载药透明质酸纳米粒表征
取上述载药透明质酸纳米粒超声至溶液均匀后,取5 mL 在离心机中进行离心分离10 min(10000 rpm,10 min)。取上清液于用紫外分光光度计测其吸光度,测三次数据并取其平均值,记录数据并计算载药率。
2 实验结果与讨论
2.1 透明质酸纳米粒制备
透明质酸纳米粒的制备方法有多种,可以采用戊二醛、ADH等进行交联得到微球[16]。采用ADH交联方法可以很好地控制纳米粒的形状和交联深度,使得到的纳米粒在纳米范围。
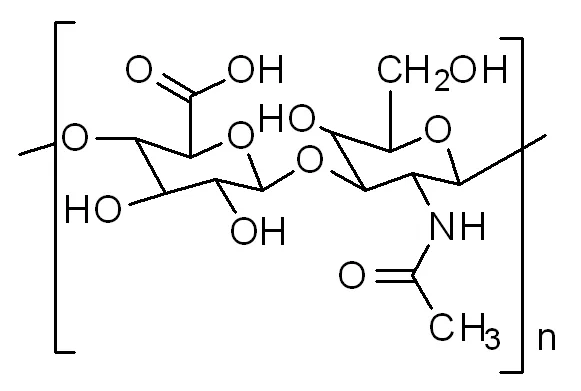
图1 透明质酸结构
透明质酸及其交联纳米粒的红外图谱,图2为透明质酸红外图谱,图3为己二酰肼交联透明质酸纳米粒的红外图谱。
由透明质酸的红外谱图(图2)可见: 在3399.71 cm-1为HA 的OH 伸缩振动峰; 在611.57、1410.86、1617.40 cm-1处为羧酸盐的特征吸收峰,说明有游离羧基结构存在; 在1410.86、1617.40 cm-1处出现C=O和C-N伸缩振动峰,说明未交联的透明质酸中存在乙酰氨基的结构。制备得到的HA-ADH纳米粒红外光谱图谱中(图3)在3402.54 cm-1处出现明显的N-H伸缩振动吸收峰;1410.86、1617.40 cm-1处的羧酸盐特征吸收峰消失,在1656.90 cm-1处表现出强吸收峰,说明透明质酸与ADH 反应生成了新的酰胺键,说明透明质酸纳米粒是通过化学交联反应形成的。

图2 透明质酸原料的红外光谱图

图3 透明质酸纳米粒的红外光谱图
2.2 透明质酸纳米粒的粒径和zeta电位
在制备得到透明质酸纳米粒后,我们用激光粒度测定仪测定了纳米粒的粒径和Zeta电位,结果如图4和图5所示。

图4 透明质酸纳米粒的粒径和表面电荷
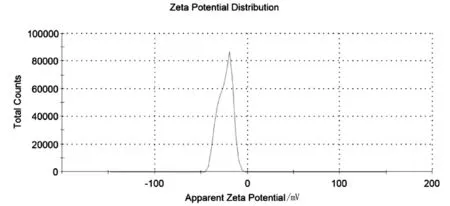
图5 透明质酸纳米粒的zeta电位
透明质酸采用ADH交联形成纳米粒后,其平均粒径为218.3±41.38 nm。说明粒径比较均匀,在纳米范围。同时,透明质酸纳米粒的 zeta电位为-24.0±7.48 mV。说明透明质酸纳米粒表面带有较大的负电荷,有利于纳米粒体系的稳定。
2.3 透明质酸纳米粒载药
按照实验部分操作,替加氟的标准曲线为A=0.044c+0.033,r2=0.9996。准确称取透明质酸纳米粒66 mg, 按10:1则加入药量6.6mg。原溶液浓度为0.66mg/mL,即660.0 μg/mL。离心后测定上清液中药物浓度。计算游离药物。得到替加氟的包封率为92.1 %。透明质酸纳米粒与替加氟药物溶液的质量比对替加氟的包封率的影响有待进一步考察。
3 结论
本文采用酰肼交联法制备了透明质酸纳米粒,采用红外光谱法测定了透明质酸纳米粒的官能团变化,采用激光粒度测定仪测定了纳米粒的平均粒径和zeta电位。结果显示,酰肼交联法可以制备透明质酸纳米粒粒径为218.3±41.38 nm,zeta电位为-24.0 ± 7.48 mV。采用该纳米粒在替加氟药物的包封率为92.1%。
参考文献
[1] 马东玉,刘 明,党 云. 用替加氟和氟尿嘧啶对胃癌患者进行化疗的效果对比[J]. 当代医药论丛 , 2015 (11) :283-284.
[2] Takiuchi H, Ajani J A. Uracil-tegafur in gastric carcinoma: a comprehensive review[J]. Journal of Clinical Oncology , 1998 , 16 (8) :2877-2885.
[3] Sadahiro S, Tsuchiya T, Sasaki K, et al. Randomized phase III trial of treatment duration for oral uracil and tegafur plus leucovorin as adjuvant chemotherapy for patients with stage IIB/III colon cancer: final results of JFMC33-0502[J]. Annals of oncology, 2015 , 26 (11) :2274-2280.
[4] 刘 刚,杨 沔, 陈本栋. 替加氟与氟尿嘧啶治疗胃癌的疗效比较[J]. 中国药房 2014: 4546-4548.
[5] 韩继洪, 苏德森. 抗癌药物FT-207脂肪乳剂物理性质的研究[J]. 沈阳药学院学报 1991 (1) :14-17 ,35.
[6] 谢怀江,宋聚忠,彭 涛,等. 辐射聚合制备抗癌药FT-207缓放制剂的研究[J]. 辐射研究与辐射工艺学报 1995,13 (2) : 114-117.
[7] 赵中丹, 梁桂媛, 周宜开, 等. 替加氟白蛋白微球的制备[J]. 广东药学 2000 , 10 (3) :19-22.
[8] 郝爱军, 邓英杰, 杨静文, 等. 影响替加氟脂质体包封率的因素[J]. 沈阳药科大学学报, , 2005 , 22 (5) :327-330.
[9] 高晓黎, 季兴梅. 替加氟新型前体脂质体小肠吸收试验研究[J]. 西北药学杂志 2003 , 18 (5) :214-215.
[10] 刘 洋, 蒋 晨. 纳米药物递释系统的脑靶向研究进展[J]. 药学学报 , 2013 (10) :1532-1543.
[11] Jahangirian H, Lemraski EG, Webster TJ, et al. A review of drug delivery systems based on nanotechnology and green chemistry: green nanomedicine[J]. International journal of nanomedicine ,2017, 12: 2957-78.
[12] Saha M. Nanomedicine: promising tiny machine for the healthcare in future-a review[J]. Oman medical journal 2009,24: 242-247.
[13] Allison D D, Grande-Allen K J. Review Hyaluronan: a powerful tissue engineering tool[J]. Tissue engineering 2006, 12(8): 2131-2140.
[14] Reitinger S, Lepperdinger G. Hyaluronan, a ready choice to fuel regeneration: a mini-review[J]. Gerontology 2013,59:71-76.
[15] Cortes-Dericks L, Schmid R A. CD44 and its ligand hyaluronan as potential biomarkers in malignant pleural mesothelioma: evidence and perspectives[J]. Respiratory research 2017,18: 58.
[16] Pitarresi G, Craparo E F, Palumbo F S, et al. Composite nanoparticles based on hyaluronic acid chemically cross-Linked with α,β-polyaspartylhydrazide[J]. Biomacromolecules 2007, 8: 1890-1898.
(本文文献格式:代培培,郭兴家,王 丹,等.替加氟透明质酸纳米粒的制备[J].山东化工,2017,46(14):13-16.)
Preparation of tegafur entrapped hyaluronic acid nanoparticles
DaiPeipei1,GuoXingjia2,WanDan1,LyuJingshan1,XuZhiqiang1,LiuChang1,LiuLijie1,WangShiyao1,HaoAijun1
(1. School of Pharmaceutical Science, Liaoning University, Shenyang 110036,China;2. College of Chemistry, Liaoning University, Shenyang 110036,China)
In this paper, hyaluronic acid nanoparticles were prepared and used as tegafur carrier with ADH as crosslinking agent, EDCI as catalyst. FTIR analysis confirmed the changes of functional groups of nanoparticles compared to that of hyaluronic acid. The particle diameter and zeta potentials of the particles were determined by Laser Particle Size Analyzer. The results indicated that the mean particle diameter of hyaluronic acid nanoparticles prepared is 218.3 + 41.38 nm with zeta potential of -24.0 + 7.48 mV. Encapsulation efficiency of tegafur in hyaluronic acid nanoparticles is about 92.1%.
tegafur; hyaluronic acid; nanoparticles; hydrazide cross-linking method
2017-05-16
中国医药教育协会孙思邈中医药研究专项课题 (2016SKT-M019); 辽宁大学2016年"大学生创新创业训练计划"项目(x201610140238)
代培培(1993—),辽宁大学制药工程专业本科生;通讯作者,郝爱军(1968—),河北邢台人,辽宁大学副教授,药剂学博士,2013-2014年美国肯塔基大学研修,从事药物新剂型和制剂新技术研究。
R944.1
A
1008-021X(2017)14-0013-04

