东方粘虫中肠V-ATP酶A亚基突变体TSCA的原核表达及复性纯化
侯文思,李玉洁,王媛媛,陶 虎
(1.西北农林科技大学 理学院,陕西杨凌 712100;2.西北农林科技大学 生命科学学院,陕西杨凌 712100)
东方粘虫中肠V-ATP酶A亚基突变体TSCA的原核表达及复性纯化
侯文思1,李玉洁1,王媛媛2,陶 虎1
(1.西北农林科技大学 理学院,陕西杨凌 712100;2.西北农林科技大学 生命科学学院,陕西杨凌 712100)
根据得到的东方粘虫[Mythimnaseparate(Walker)]中肠V-ATPase A亚基(VHA-A)基因(VATPA),预测其三维结构,构建定点突变并复性。利用Swiss-Model在线预测VHA-A三维结构,确定突变位点,通过重折叠PCR(Overlap-PCR)技术构建突变基因并将其整合到pET-22b(+)载体上,得到重组质粒pET-22b(+)-TSCA,转入大肠杆菌BL21中表达,最后通过亲和层析纯化包涵体蛋白质并进行透析复性。结果表明,成功构建突变基因和融合表达载体,融合蛋白质以包涵体形式表达,并得到大量纯化的可溶性蛋白。
V-ATP酶A亚基;定点突变;原核表达;包涵体复性
液泡型ATP酶(V-ATPase)是由14个不同亚基组成的复合体,作为持家基因广泛分布于细胞膜系统中[1]。V-ATPase利用水解ATP释放能量将H+转运到囊泡或胞外,从而维持胞质pH的平衡,形成跨膜电化学势梯度,为细胞活动的正常进行及各种离子和代谢物的转运提供必不可少的条件[2]。在昆虫中肠,V-ATPase存在于上皮杯状柱细胞,是唯一的离子运输启动器,严格调控昆虫中肠的离子运输[3]。V-ATPase的缺失会导致昆虫出现病理变化甚至死亡[4]。近年来越来越多的学者将V-ATP酶作为药物靶标来研究[5]。已有学者利用Western杂交和质谱等方法鉴定出多种昆虫中肠的V-ATP酶A亚基可以和苏云金芽孢杆菌[Bacillusthuringiensis(Bt)]毒素结合。徐丽娜[6]通过双向凝胶电泳、配体杂交等方法发现亚洲玉米螟[Ostriniafurnacalis(Guenée)]幼虫刷状缘膜囊(Brush border membrane vesicles,BBMV )的V-ATP酶A亚基是Cry1Ab、Cry1Ac、Cry1Ah、Cry1Ie蛋白的结合位点。V-ATPase A 亚基是高度保守的催化亚基[7],研究表明A亚基上walker A motif (GXXXXGKT) 特定残基具有重要作用:将极端嗜热杆菌V-ATPase A亚基第232位丝氨酸突变为丙氨酸,第235位苏氨酸突变为丝氨酸能够降低ADP反馈抑制,提高全酶催化活性[8]。目前,V-ATPase A亚基的重组表达已有文献报道,如靳婷婷等[9]构建原核表达载体在大肠杆菌中表达玉米螟幼虫中肠A亚基。已有的文献[10-11]均显示,原核表达的V-ATPase A亚基在大肠杆菌中均以包涵体形式存在,而利用真核系统表达蛋白质代价昂贵。本研究通过分析东方粘虫[Mythimnaseparata(Walker)]中肠V-ATP酶A亚基核酸结合区域,筛选可能提高酶活力的氨基酸位点,进行基因定点突变,通过原核表达、包涵体复性等方法获得大量可溶性蛋白质,为进一步研究东方粘虫A亚基的结构与功能奠定基础,也为相关抑制剂的开发和筛选新农药奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株与质粒 表达载体pET-22b(+)和大肠杆菌Turbo、BL21(DE3) 为西北农林科技大学理学院蛋白质结构研究实验室保存;克隆载体pMD 19-T-Simple购自TaKaRa公司;质粒pET-22b(+)-VATPA由西北农林科技大学农药所提供。
1.1.2 主要生化试剂TaqDNA Polymerase、T4DNA Ligase、限制性内切酶NdeⅠ、HindⅢ、DNA Marker、核酸酶均购于TaKaRa公司;Pfu DNA Polymerase、蛋白质Markers购于Thermo公司;胶回收试剂盒、广谱蛋白Markers购于康为世纪公司;Bradford试剂盒购于天根生化科技有限公司;Ni-NTA agarose柱购于GE公司;其他相关试剂均为国产分析纯,购自杨凌三力化玻站。
1.2 方 法
1.2.1 原核表达载体的构建与鉴定 以嗜热杆菌(Thermusthermophiles,PDB:3GQ)A亚基氨基酸序列及其突变体TSSA为模板,利用NCBI Blast软件,与东方粘虫中肠V-ATPase酶A亚基序列比较,确定东方粘虫中肠V-ATPase A亚基突变位点。根据选定的突变点C254突变为A254,T257突变为S257,设计引物(小写部分为突变位点氨基酸对应密码子)(表1)。
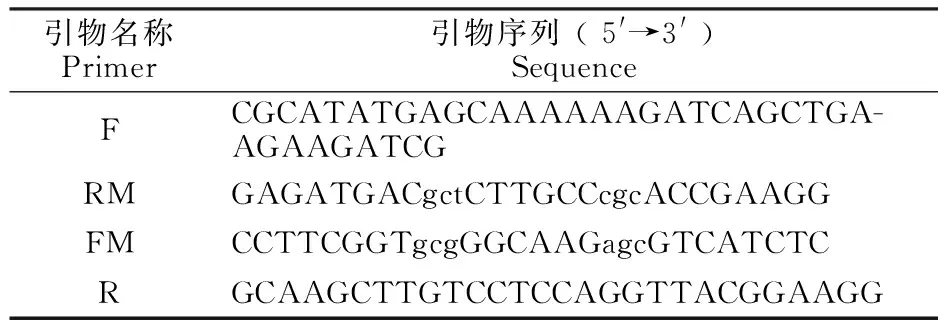
表1 重折叠PCR引物序列Table 1 Primers for Overlap-PCR
利用overlap PCR方法构建定点突变基因[12],以pET-22b(+)-VATPA质粒为模板,引物F、RM,FM、R进行PCR扩增,分别扩增出上下游片段A、B;以等量的A、B基因为模板,引物F、R进行PCR扩增并回收。将回收的PCR产物加A尾后与pMD19-T-Simple连接,转化至E.coliTurbo,提取质粒,将重组质粒与pET-22b(+)载体均进行NdeⅠ、HindⅢ双酶切并连接,得到表达载体pET-22b(+)-TSCA,转入E.coliTurbo,挑取单克隆进行PCR验证后测序。
1.2.2 目的蛋白的诱导表达 将测序结果正确的表达载体转化至E.coliBL21(DE3) 感受态细胞,并将其涂布于含氨苄青霉(Amp)的LB平板,过夜培养。挑取阳性单克隆于5 mL含100 mg/L Amp的新鲜LB培养液中37 ℃过夜培养。次日以1% 接种量接种至50 mL含100 mg/L Amp的LB培养基中,37 ℃培养至OD600≈ 0.6时,将培养物以每管5 mL分装于4个无菌15 mL EP管中,分别加入异丙基硫代半乳糖苷(IPTG)至终浓度为0.1、0.2、0.5和1 mmol/L,于37 ℃诱导表达4 h。 6 000 r/min、4 ℃离心5 min 收集菌体,用PBS缓冲液重悬,超声破碎,于12 000 r/min、4 ℃离心30 min,分别取37 ℃诱导上清和沉淀进行SDS-PAGE检测。
1.2.3 蛋白质复性与纯化 参照文献[13],在37 ℃ 条件下以0.2 mmol/L的IPTG终浓度大量诱导(1 L液体LB培养基) pET-22b(+)-TSCA在大肠杆菌BL21中表达5 h,离心取菌体,用Lysis buffer(20 mmol/L Tris-HCl , 150 mmol/L NaCl pH 7.0)重悬,加溶菌酶至150 μg/mL,冰浴30 min,超声破碎,加入0.5倍体积含15 g/L Triton X-100的洗涤液(100 mmol/L Tris-HCl,150 mmol/L NaCl,pH 7.0)搅拌混匀,12 000 r/min、4 ℃ 离心30 min,弃上清。将沉淀用35 mL含5 g/L Triton X-100的洗涤液重悬,再用匀浆器研磨15 min,12 000 r/min、4 ℃ 离心30 min,弃上清。用不含Triton X-100的洗涤液重复上述步骤2次。洗涤后将包涵体溶解于35 mL溶解液(100 mmol/L Tris-HCl,1 mmol/L DTT,8 mol/L 尿素,pH 8.0)中,室温搅拌2~3 h,12 000 r/min,4 ℃离心30 min,取上清,用0.22 μm滤膜过滤后溶液即为包涵体蛋白液。pET-22b(+)表达的融合蛋白C端含有一个His-tag,可使用Ni-NTA亲和层析纯化变性后包涵体蛋白。用结合缓冲液(100 mmol/L Tris-HCl,1 mmol/L DTT,8 mol/L 尿素,pH 8.0)平衡Ni-NTA层析柱,调节蛋白质样品pH至8.0,以1.5 mL/min流速上样,用洗涤缓冲液(100 mmol/L Tris-HCl,1 mmol/L DTT,8 mol/L 尿素,pH=6.3)洗去杂蛋白,用洗脱缓冲液(100 mmol/L Tris-HCl,1 mmol/L DTT,8 mol/L 尿素,pH 4.5)洗脱目的蛋白。收集的洗脱液用Bradford试剂盒测蛋白质质量浓度后于-80 ℃ 冻存。取适当体积Ni-NTA纯化后蛋白质样品用新鲜溶解液稀释至终体积100 mL,终质量浓度0.1~0.2 mg/mL。稀释后的蛋白质样品于复性缓冲液Ⅰ(1 mol/L L-精氨酸,1 mmol/L DTT,50 mmol/L Tris-HCl,pH 8.0)4 ℃透析24 h,12 000 r/min,4 ℃离心30 min,上清继续用复性缓冲液Ⅱ (20 mmol/L Tris-HCl,150 mmol/L NaCl,1 mmol/L DTT,1 mmol/L 苯甲脒,pH 7.3)透析12 h,换新鲜溶液Ⅱ继续透析,12 000 r/min,4 ℃离心 30 min,上清为复性成功的蛋白质。
2 结果与分析
2.1 同源建模和突变位点的选择
选用与蛋白一级序列相似度最高(一致性65.24%)且已获得3D蛋白结构的酵母V-ATP酶A亚基( PBD:3J9T )为模板,利用Swiss-Model( http://swissmodel.expasy.org/interactive )软件进行同源建模,获得东方粘虫中肠V-ATPase A亚基三维结构模型(图1)。
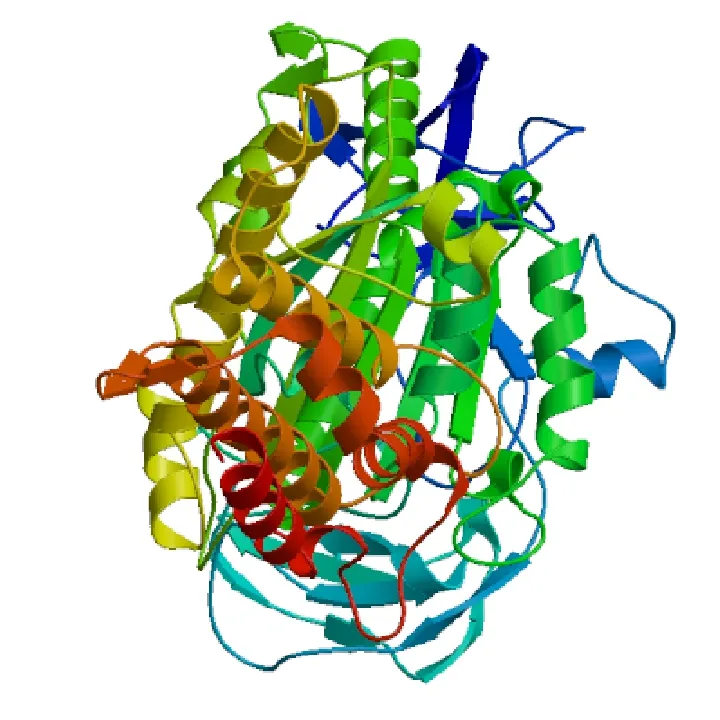
图1 东方粘虫中肠V-ATPase A亚基三维结构模拟图Fig.1 Simulative tertiary structure ofMythimna separata subunit A
2.2 原核表达载体的构建与鉴定
提取重组质粒pET-22b(+)-TSCA转入E.coliTurbo后,挑取阳性克隆并提取质粒,进行PCR验证,电泳条带与预期大小一致(图2),且质粒测序结果正确,重组质粒pET-22b(+)-TSCA构建成功。
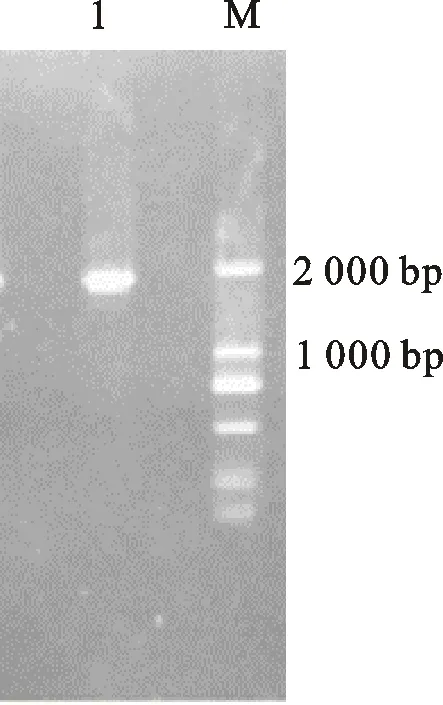
M. DM 2000 DNA marker;1. pET-22b(+)-TSCA的PCR结果 Result of pET-22b(+)-TSCA gene by PCR
图2 PCR验证pET-22b(+)-TSCA表达载体
Fig.2 Identification of pET-22b(+)-TSCA expression vector by PCR
2.3 融合蛋白的表达
将测序验证正确的pET-22b(+)-TSCA表达载体转入BL21(DE3)表达菌株中,在37 ℃不同IPTG终浓度诱导该蛋白质表达。融合蛋白分子质量理论值约为69.7 ku,目的蛋白与广谱蛋白标准比对条带位置正确(图3)。且不同诱导剂浓度下,菌体超声破碎后的上清液中均没有明显的目的条带,沉淀中有明显的目的蛋白条带。这表明绝大多数的蛋白以包涵体形式存在,且IPTG终浓度为0.2 mmol/L时沉淀中目的蛋白含量最大。
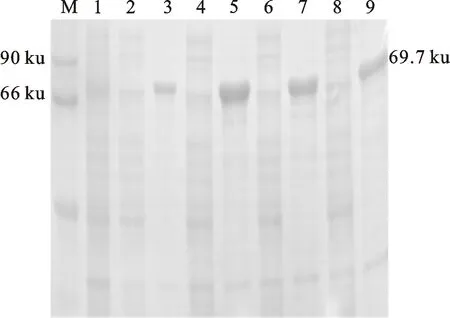
M. 蛋白质标准分子质量 Protein molecular weight marker; 1. 未经IPTG诱导的细胞总蛋白质 Total cell proteins without induced by IPTG;2-9:不同浓度IPTG诱导后的上清液和沉淀,IPTG浓度分别为0.1 mmol/L、0.2 mmol/L、0.5 mmol/L和1 mmol/L Supernatant and pellet induced by IPTG,and the inducer concentrations were 0.1 mmol/L, 0.2 mmol/L, 0.5 mmol/L and 1 mmol/L
图3 37 ℃下不同浓度IPTG表达蛋白的鉴定
Fig.3 Identification of TSCA expression at 37 ℃ under different IPTG concentration
2.4 包涵体的纯化与复性
细胞裂解后的包涵体蛋白质用Triton X-100处理,再利用Ni-NTA层析柱纯化,上样后用洗杂蛋白液洗去部分杂蛋白(图4-A、4-B)。透析液Ⅱ透析后的蛋白质为复性好的可溶性蛋白质,经10% SDS-PAGE检测为一条带,且条带位置与理论分子质量一致(图4-C)。包涵体用8 mmol/L尿素溶解后,用bradford试剂盒测粗蛋白质样品,其质量浓度为4.13 mg/mL,体积约为35 mL。复性好的蛋白质经Bradford蛋白质点定量试剂盒测得质量浓度约为48 μg/mL,体积约为110 mL,一次复性效率约53%。培养1 L菌体最终可获得纯蛋白质约67 mg。
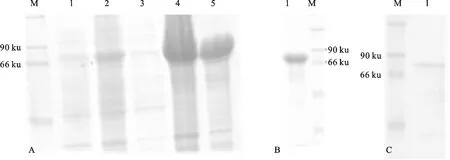
A. pET-22b(+)-TSCA融合蛋白表达分析 Analysis of the expression of pET-22b(+)-TSCA (M.蛋白质标准分子量 Protein molecular weight marker ; 1.未经IPTG诱导的细胞总蛋白质 Total cell proteins without induced by IPTG ; 2.IPTG诱导的细胞总蛋白质 Total cell proteins induced by IPTG ; 3.细胞裂解后上清 Supernatant proteins of cell disruption ; 4.细胞裂解后沉淀 Pellet of cell disruption;5.洗涤后包涵体 Washed inclusion bodies); B.目的蛋白的纯化检测 SDS-PAGE of the purified proteins (M.蛋白质标准分子量 Protein molecular weight marker ; 1.Ni-NTA纯化后蛋白质 Recombinant protein purified by Ni-NTA ); C.复性蛋白质的检测 Analysis of the refolded proteins (M.蛋白质标准分子量 Protein molecular weight marker ; 1.重折叠蛋白质 Refolded proteins)
图4 TSCA诱导表达与纯化检测
Fig.4 SDS-PAGE analysis of the expression and the purification of recombinant proteins
3 结论与讨论
V-ATPase广泛存在于真核细胞的内膜系统上,由胞内的V1结构域和镶嵌在膜上的V0结构域组成[14]。V 1由A~H 8个亚基组成,具有ATP水解作用;V0由a、d、e、c和c′′亚基组成,负责质子运输。酵母包含1个额外的亚基c′[15],更高级的真核生物则有额外的蛋白质Ac45[16]。V-ATPase A亚基是催化亚基[17],由4个结构域组成:N端的β桶状结构域,包含凸起的非同源结构域;中心的α/β结构域和C端结构域[18]。C端结构域包含Walker A motif、Walker B motif。Walker A motif与核酸结合有关,而Walker B motif与天冬氨酸介导的Mg2+反应有关[19-20]。
本试验通过预测V-ATPase A亚基蛋白质三维结构,同源比对确定突变位点,利用over-lap PCR等分子生物学技术构建突变工程菌。在前期,对诱导温度、时间和IPTG浓度进行摸索,期望能得到更多的可溶性蛋白质,但结果目的蛋白质绝大多数以包涵体形式存在。可能是因为原核表达系统缺乏引导多肽正确折叠的分子伴侣或者调解机制,使得蛋白质无法正确折叠,失去原有特性和功能,最终以包涵体形式存在。本试验最终决定通过复性获得可溶性目的蛋白,考虑到纯化方法和复性步骤,选用pET-22b(+)构建表达载体,采取一步透析法,在透析液pH 8.0,添加终浓度为1 mol/L的L-精氨酸,获得高收率的可溶性蛋白质。本试验1 L菌体最终可得到67 mg左右较纯的可溶性蛋白质,复性效率为53%,为后续研究V-ATP酶活性,A亚基的功能和结构,利用突变体TSCA筛选ATP酶抑制剂提供条件。
Reference:
[1] BEYENBACH K W,WIECZOREK H.The V-type H+ATPase:molecular structure and function,physiological roles and regulation[J].JournalofExperimentalBiology,2006,209(4):577-589.
[2] BRETON S,BROWN D.Regulation of luminal acidification by the V-ATPase[J].Physiology,2013,28(5):318-329.
[3] WIECZOREK H,GRUBER G,HARVEY W R,etal.Structure and regulation of insect plasma membrane H+-V-ATPase[J].JournalofExperimentalBiology,2000,203 (1):127-135.
[4] WIECZOREK H,BEYENBACH K W,HUSS M,etal.Vacuolar-type proton pumps in insect epithelia[J].JournalofExperimentalBiology,2009,212 (11):1611-1619.
[5] KARTNER N,MANOLSON M F.V-ATPase subunit interactions:the long road to therapeutic targeting[J].CurrentProtein&PeptideScience,2012,13(2):164-179.
[6] 徐丽娜.Cry1Ab抗性亚洲玉米螟对不同Bt毒素的交互抗性及其产生的分子机理[D].北京:中国农业科学院,2010:34-58
XU L N.Cross-resistance and molecular mechanism of Cry1Ab-selectedOstriniafurnacalisto other Bt toxins[D].Beijing:Chinese Academy of Agricultural Sciences,2010:34-58( in Chinese with English abstract ).
[7] MA B Y,YUN X,LI Z A.Structural bases of physiological functions and roles of the vacuolar H+-ATPase[J].CellularSignalling,2011,23(8):1244-1256.
[8] IMAMURA H,FUNAMOTO S,YOSHIDA M,etal.Reconstitution in vitro of V1 complex ofThermusthermophilusV-ATPase revealed that ATP binding to the A subunit is crucial for V1 formation[J].JournalofBiologicalChemistry,2006,281(50):38582-38591.
[9] 靳婷婷,李 宁,王振营,等.亚洲玉米螟中肠Cry1Ac毒素结合蛋白V-ATP酶A亚基的研究[J].中国生物防治学报,2015,31(2):208-215.
JIN T T,LI N,W ZH Y,etal.Cloning and characterization of the CrylAc-binding V-ATPase subunit A in the Asian corn borer[J].ChineseJournalofBiologicalControl,2015,31(2):208-215(in Chinese with English abstract).
[10] 毛毅辉,李会勇,王天宇,等.玉米液泡ATP酶亚基A基因的克隆及表达分析[J].作物学报,2008,34(1):31-36.
MAO Y H,LI H Y,WANG T Y,etal.Cloning and expression analysis of a vacuolar ATPase subunit A gene in maize[J].ActaAgronomicaSinica,2008,34(1):31-36(in Chinese with English abstract ).
[11] HUNKE C,CHEN W J,SCHAFER H J,etal.Cloning,purification,and nucleotide-binding traits of the catalytic subunit A of the V1V0 ATPase fromAedesalbopictus[J].ProteinExpressionandPurification,2007,53(2):378-383.
[12] HECKMAN K L,PEASE L R.Gene splicing and mutagenesis by PCR-driven overlap extension[J].NatureProtocols,2007,2(4):924-32.
[13] 沈 琴,邓汉卿,侯文思,等.人降钙素受体胞外域的复性及新的体外活性测定方法[J].中国生物化学与分子生物学报,2014,30(9):942-947.
SHEN Q,DENG H Q,HOU W S,etal.Method of in vitro bioactivity assay for refolded human ectodomain of calcitonin receptor[J].ChineseJournalofBiochemistryandMolecularBiology,2014,30(9):942-947(in Chinese with English abstract).
[14] FORGAC M.Vacuolar ATPases:rotary proton pumps in physiology and pathophysiology[J].NatureReviewsMolecularCellBiology,2007,8(11):917-929.
[15] ZHAO J H,BENLEKBIR S,RUBINSTEIN J L,etal.Electron cryomicroscopy observation of rotational states in a eukaryotic V-ATPase[J].Nature,2015,521(7551):241.
[16] COTTER K,STRANSKY L,MCGUIRE C,etal.Recent insights into the structure,regulation,and function of the V-ATPases[J].TrendsinBiochemicalSciences,2015,40 (10),611-622.
[17] CROSS R L,MULLER V.The evolution of A-,F-,and V-type ATP synthases and ATPascs:reversals in function and changes in the H+/ATP coupling ratio[J].FebsLetters,2004,576(1/2):1-4.
[18] MAHER M J,AKIMOTO S,IWATA M,etal.Crystal structure of A3B3 complex of V-ATPase fromThermusthermophilus[J].EmboJournal,2009,28(23):3771-3779.
[19] MARSHANSKY V,RUBINSTEIN J L,GRUBER G.Eukaryotic V-ATPase:Novel structural findings and functional insights[J].BiochimicaEtBiophysicaActa-Bioenergetics,2014.1837(6):857-879.
[20] MAEGAWA Y,MORITA H,IYAGUCHI D,etal.Structure of the catalytic nucleotide-binding subunit A of A-type ATP synthase from Pyrococcus horikoshii reveals a novel domain related to the peripheral stalk[J].ActaCrystallographica,2010,62(5):483-488.
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Prokaryotic Expression, Refolding and Purification of V-ATPase Subunit A Mutant TSCA in the Midgut ofMythimnaseparate
HOU Wensi1, LI Yujie1, WANG Yuanyuan2and TAO Hu1
(1.College of Science, Northwest A&F University, Yangling Shaanxi 712100, China;2.College of Life Sciences, Northwest A&F University, Yangling Shaanxi 712100,China)
Based on V-ATPase A subunit gene(VATPA) in the midgut ofMythimnaseparate, three-dimensional structure was predicted, site-directed mutant was built and recombinant protein was obtained after renaturing.The protein structure of VHA-A was analyzed, three-dimensional structure was predicted by Swiss-Model online,and the mutation site was designed.The mutant gene was constructed with overlap PCR, and inserted into pET-22b(+) vector. The recombinant plasmid pET-22b(+)-TSCA was transformed intoE.coliBL21(DE3) for expression. After purified by Ni-NTA column, the inclusion body was renatured. The results showed the recombinant plasmid was successfully built, the fusion proteins were expressed as inclusion bodies, and the soluble proteins were successfully obtained in large scale.The study will facilitate the investigation of structure and function of V-ATPase subunit A and creation of environmental friendly pesticides.
V-ATPase subunit A; Designated mutation; Protein prokaryotic expression; Refolding of inclusion body
2016-05-29 Returned 2016-06-15
Special Talent Recruitment Fund of Northwest A&F University(No.Z111021101); the National Natural Science Foundation of China(No.21403168 )
HOU Wensi, female, master student. Research area:protein expression and purification. E-mail:956850986@qq.com
TAO Hu, male, professor, master supervisor.Research area:protein-protein interaction and structural resolution. E-mail:taohu@nwsuaf.edu.cn
日期:2017-08-18
2016-05-29
2016-06-15
西北农林科技大学引进人才专项资金(Z111021101 );国家自然科学基金(21403168)。 第一作者:侯文思,女,硕士研究生,从事蛋白质表达和纯化研究。E-mail:956850986@qq.com
陶 虎,男,教授,硕士生导师,从事蛋白质三维结构研究。E-mail:taohu@nwsuaf.edu.cn
Q786
A
1004-1389(2017)08-1248-05
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170818.0939.040.html

