鼻状杯环线虫形态学与分子生物学鉴定
高远,仇建华,常巧呈,高俊峰,王春仁
(黑龙江八一农垦大学动物科技学院,大庆 163319)
鼻状杯环线虫形态学与分子生物学鉴定
高远,仇建华,常巧呈,高俊峰,王春仁
(黑龙江八一农垦大学动物科技学院,大庆 163319)
为了确定收集于马体内某种寄生虫的种类,采用形态学观察与分子生物学相结合的方法对大庆地区自然感染马体内的寄生虫进行鉴定。形态学观察初步鉴定为鼻状杯环线虫。采用PCR方法对其核糖体内转录间隔区序列(ITS)进行扩增,结果显示,雌、雄两个虫体的ITS序列长度均为842 bp,其中ITS1、5.8S和ITS2长度分别为370 bp、152 bp和320 bp。雌虫、雄虫ITS序列与GenBank上已发表的鼻状杯环线虫的ITS序列的同源性分别为99.8%和99.6%。据此,鉴定该虫为鼻状杯环线虫。
鼻状杯环线虫;形态学观察;分子生物学鉴定;ITS序列
鼻状杯环线虫(Cylicocyclusnassatus)隶属于圆线科(Strongylidae),盅口亚科(Cyathostominae),是马属动物体内常见且重要的病原之一,寄生在宿主大肠内。据文献记载该虫体分布于欧洲、埃及、加拿大、美国、巴西等国,而我国的北京、江西、广西、黑龙江等地也有报道[1-2]。该种线虫往往与多种盅口亚科线虫同时寄生,造成马匹消瘦、贫血、腹泻、肠绞痛,幼虫时期还会引起宿主“幼虫性盅口线虫病”,致死率可高达50%[3]。
寄生虫的鉴定是寄生虫研究工作的前提。准确的鉴定对于病原特性研究、流行病学调查、疾病防控等尤为重要。寄生虫传统的鉴定方法主要是形态学观察,这对工作人员的要求较高,而且对于形态上相似的寄生虫或某些具有隐藏种的虫种来说往往更具有局限性,如区别鼻状杯环线虫和阿氏杯环线虫以及Hypodontusmacropi的隐藏种。随着分子生物学技术的快速发展,为寄生虫虫种的分子鉴定提供可靠的基因标记和方法。核糖体内转录间隔区序列(ITS)因具有选择压力较小、进化速度快、长度不大、种内差异微小、种间差异较大等特点而被认为是一种有效的分子标记,广泛的应用于寄生虫的分类鉴定[4-8]。因此研究采取形态学观察和分子生物学相结合的方法对采自马体内的某种线虫进行鉴定。
1 材料与方法
1.1 虫体的来源
虫体采集自大庆地区自然感染的马大肠内,保存于黑龙江八一农垦大学寄生虫实验室。
1.2 形态学观察
将新鲜虫体置于载玻片上,滴加50%甘油乳酸液,在显微镜下先用低倍镜调整位置后再用高倍镜观察虫体的具体形态特征。选取具有代表性的位置进行拍照,参考相关文献鉴定虫体[1-2]。
1.3 分子生物学鉴定
1.3.1 DNA的提取取已初步鉴定的雌、雄虫体各一条用蒸馏水反复冲洗数次后,根据TIANamp Genomic DNA Kit(TIANGEN)说明书提取DNA,-20℃保存备用。
1.3.2 ITS序列扩增由上海生工生物工程股份有限公司合成的通用引物,序列如下:上游-NC5(5’-GTAGGTGAACCTGCGGAAGGATCATT-3’)和下游-NC2(5’-TTAGTTTCTTTTCCTCCGCT-3’)。PCR总反应体系为25 μL,具体如下:2.5 μL Ex Taq Buffer(pH8.5),2 μLdNTP mixture(2.5 mM),上、下游引物各0.5 μL(10 pmol·mL-1),1 μL DNA模板和0.2 μL Ex Taq DNA酶(5 U·mL-1)。扩增条件如下:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环;72℃延伸7 min。将所得到的PCR产物经过琼脂糖凝胶电泳后,将目的条带切下,根据DNA凝胶回收试剂盒的说明书回收后,用PMD-18T载体连接后转化到DH5α感受态细胞中培养,将得到的阳性结果送至上海生工生物工程股份有限公司测序。
1.3.3 序列分析将所得测序结果用DNAstar 5.0,MEGA 5.0等软件进行分析,划界。最后与NCBI上已发表的马相关线虫的ITS序列进行比对,用Megalign软件进行同源性分析。
2 结果
2.1 线虫的形态学观察结果
显微镜下可观察到虫体口领显著,背腹面观察可见口囊呈矩形,侧面观察口囊靠拢呈X状。偏中乳突长,伸出于口领之外,有背沟,约为口囊深度一半。外叶冠明显,约20叶,内叶冠未能清楚观察到。颈乳突分两侧分布,位于食道约三分之一处,与排泄孔位置相似。
雌虫长10.1 mm,口囊长0.150 mm,宽0.038 mm,食道长0.68 mm,尾部长0.13 mm,阴门与肛门的距离为0.147 mm,雌虫尾部稍向背部弯曲(图1)。

图1 雌虫形态特征Fig.1Female morphological characteristics
雄虫长7.1 mm,口囊长0.105 mm,宽0.021 mm。食道长0.57 mm,雄虫交合伞背叶宽,长度中等,2个腹肋并列,3个侧肋分开,外背肋从背肋基部发出,背肋分为两个分支,每个分支有分为3个小的分支,在第三分支中又出现细小的分支(图2)。
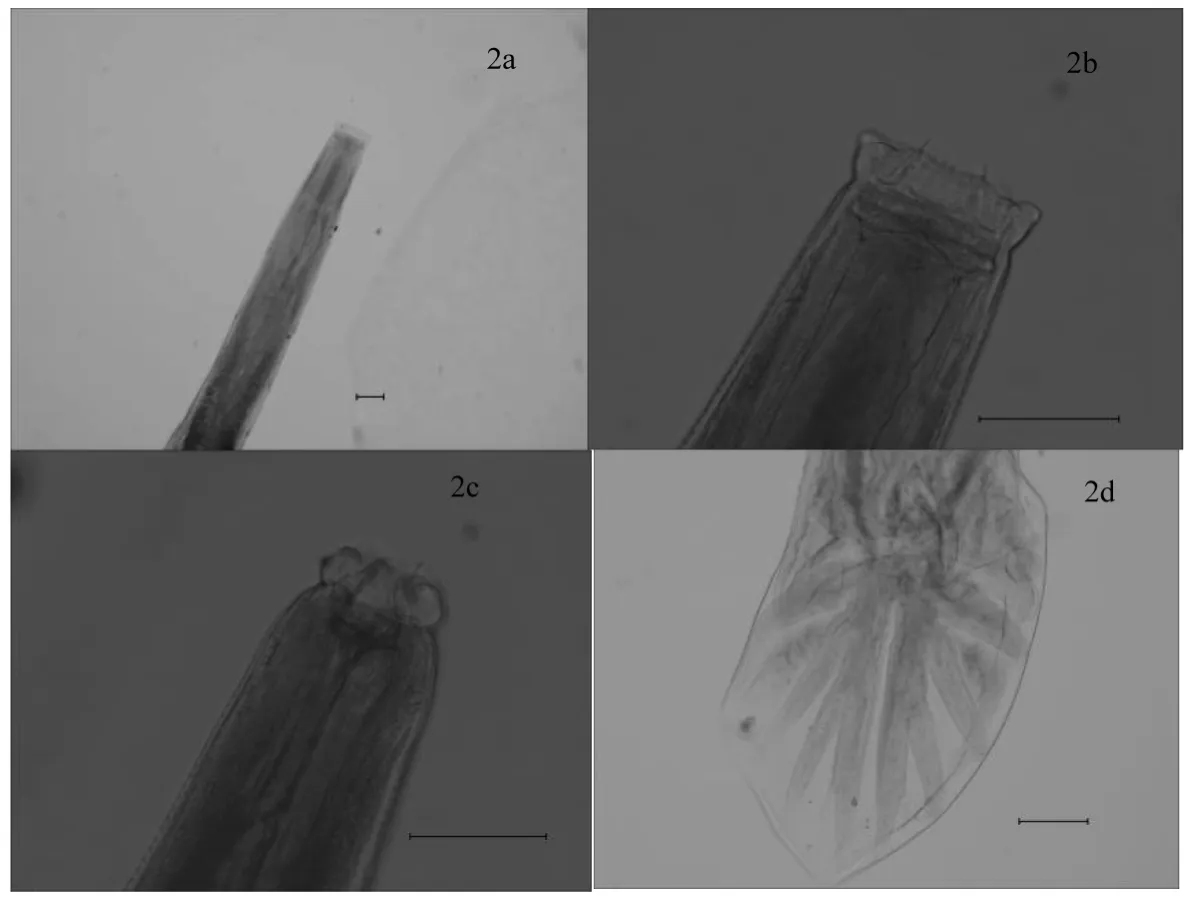
图2 雄虫形态特征Fig.2Male morphological characteristics
依据以上形态特征,参照相关文献初步认定该种虫体为鼻状杯环线虫。
2.2 虫体的分子生物学鉴定结果
研究中获得的线虫雌虫的ITS(包含5.8S)全长为842 bp,其中ITS1长度为370 bp,A+T含量为52.70%。ITS2长度为320 bp,A+T含量为59.38%。5.8S全长为152 bp。与NCBI上已发表多种线虫的ITS序列进行比较,发现与鼻状杯环线虫(序列号:JQ906420.1)相比,只有ITS2的长度比其少一个碱基。两者的同源性为99.8%。其中两者的ITS1和5.8S完全相同,同源性为100%。ITS2序列的同源性为99.4%,有两处碱基发生了变化,一处为296 bp的位置发生A-G碱基的转换,另一处为在310 bp的位置发生T碱基的缺失。
雄虫的ITS1,ITS2,5.8S的长度和A+T含量与雌虫基本相同,但ITS2的A+T含量略低于雌虫,为59.06%。与NCBI上发表的鼻状杯环线虫ITS序列同源性为99.6%。ITS2的同源性为99.1%,有三处碱基发生了变化,即289 bp的位置T-C碱基的转换,296 bp的位置A-G碱基的转化,310 bp的位置同样发生了T碱基的缺失。与研究中的雌虫相比,ITS全长的同源性为99.9%,ITS2的同源性为99.7%,只有一处碱基发生了变化即T-C碱基的转换。
基于以上的形态学与分子生物学的结果鉴定该种线虫为鼻状杯环线虫。
3 讨论
ITS序列存在于高度重复的核糖体中,因进化速度较快,长度不大,具有种内变异小而种间变异大的特性,因而被作为是种类鉴定和系统发育分析的重要分子标记。Hung等[5]通过比较微小杯冠线虫的ITS种内差异,分析得出微小杯冠线虫是至少包括两个种的隐藏种。任娣等[6]对斑鼻羚体内分离出的毛首线虫进行ITS序列的扩增,分析发现其属于羊毛首线虫。
传统的马的盅口亚科线虫鉴定主要是依据形态学观察,如虫体的叶冠数量与大小,口囊形状,雌虫、雄虫尾部特征等。盅口亚科线虫种类多且形态相似,即使是对有经验的研究人员来说形态学鉴定也较难,因此借助分子生物学手段鉴定是十分必要的。例如:阿氏杯环线虫曾被认为是鼻状杯环线虫的同物异名,但最终阿氏杯环线虫被Lichtenfels等人[7]确定为一种有效的物种。此后,Hung等[8]通过比较阿氏杯环线虫、鼻状杯环线虫和隐匿杯环线虫的ITS的差异,从分子层面证明了阿氏杯环线虫是不同于鼻状杯环线虫的另一个物种。研究通过形态学观察与分子生物学手段,对盅口亚科的鼻状杯环线虫进行鉴定,与GenBank上已发表的该虫体ITS序列比对,全ITS的同源性达99.6%和99.8%,ITS1序列完全相同,ITS2序列在雌虫和雄虫中分别有两处和三处的碱基发生了改变,由此证明了研究中的虫体为鼻状杯环线虫,还说明了ITS序列是寄生虫分子鉴定的有效基因标记。
[1]张路平,孔繁瑶.马属动物的寄生线虫[M].北京:中国农业出版社,2002.
[2]齐普生,李靓如.中国草食家畜常见寄生蠕虫图鉴[M].北京:中国农业出版社,2012.
[3]Traversa D,Milillo P,Barnes H,et al.Distribution and species-specific occurrence of cyathostomins(Nematoda, Strongylida)in naturally infected horses from Italy,United Kingdom and Germany.[J].Vet Parasitol,2010,168(1-2):84-92.
[4]Gasser R B,Stevenson L A,Chilton N B,et al.Species markers for equine strongyles detected in intergenicrDNA by PCR-RFLP[J].Mol Cell Probe,1996,10(5):371-378.
[5]Hung G C,Chilton N B,Beveridge I,et al.Molecular evidence for cryptic species within Cylicostephanusminutus(Nematoda:Strongylidae)[J].Int J Parasitol,1999,29(2):285.
[6]任娣,陈武,宋亚芬,等.斑鼻羚毛首线虫ITS序列的PCR扩增及分析[J].动物医学进展,2011,32(3):47-50.
[7]Lichtenfels J R,Kharchenko V A,Sommer C,et al.Key characters for the microscopical identification of CylicocyclusnassatusandCylicocyclusashworthi(Nematoda,Cyathostominae)of the horse,Equuscaballus[J].J Helminthol Soc W,1997,64,120-127.
[8]Hung G C,Chilton N B,Beveridge I,et al.Molecular delineation of Cylicocyclusnassatus and C.ashworthi(Nematoda:Strongylidae)[J].Int J Parasitol,1997,27,601-605.
Identification of Morphology and Molecular Biology of Cylicocyclusnassatus
Gao Yuan,Qiu Jianhua,Chang Qiaocheng,Gao Junfeng,Wang Chunren
(College of Animal Science and Technology,Heilongjiang Bayi Agricultural University,Daqing 163319)
In order to confirm the species of the nematodes,the worms from the naturally infected horse in Daqing were identified based on the morphological observation and molecular biological method.The result of the morphological observation showed that the worms mightbe theCylicocyclusnassatus.The nuclear ribosomal internal transcribed spacer sequences(ITS)of single female and male worms were amplified by PCR.The results showed that the length of the ITS sequences were all 842 bp,and the length of the ITS1,5.8S and ITS2 were 370 bp,152 bp and 320 bp,respectively.Compared the ITS sequences of female and male worms with the C.nassatus available in the GenBank,the sequences identity were 99.8%and 99.6%,respectively.So the result demonstrated that the nematodes wereC.nassatus.
Cylicocylusnassatus;morphological observation;molecular biological identification;ITS sequence
S855.9+1
A
1002-2090(2017)04-0045-04
10.3969/j.issn.1002-2090.2017.04.011
2016-04-20
黑龙江省普通高等学校黑龙江八一农垦大学动物医学重点实验室开放课题(AMKL201304)。
高远(1992-),女,黑龙江八一农垦大学动物科技学院2015级硕士研究生。
王春仁,男,教授,博士研究生导师,E-mail:chunrenwang@sohu.com。

