烯效唑对玉米幼胚培养的影响
彭晓辉,莫兴梅, 曹玉桃
( 1.四川卧龙国家级自然保护区管理局,四川 汶川623000;2.四川省商贸学校,四川 德阳 618000;3.九寨沟风景名胜区管理局,四川 九寨沟 623402)
烯效唑对玉米幼胚培养的影响
彭晓辉1,莫兴梅2, 曹玉桃3
( 1.四川卧龙国家级自然保护区管理局,四川 汶川623000;2.四川省商贸学校,四川 德阳 618000;3.九寨沟风景名胜区管理局,四川 九寨沟 623402)
以玉米幼胚为外植体,研究了烯效唑对玉米幼胚愈伤组织诱导以及愈伤组织分化成植株的影响。结果表明,烯效唑(S-3307)的浓度越高玉米幼胚胚芽的生长受抑制作用越强,胚性愈伤组织发生率越高,有的基因型幼胚对过高浓度的烯效唑表现出不适反应,以至于胚性愈伤转化成非胚性愈伤;不同基因型的玉米幼胚在不同浓度的烯效唑影响下愈伤组织诱导率差异较大;烯效唑的浓度越高胚性愈伤组织分化率也高,但不同基因型对烯效唑的反应不尽相同。
玉米;幼胚;烯效唑;愈伤组织
烯效唑(Uniconazole),代号S-3307,简称S-07,分子式C15H18N3OCI2,是三唑类一种新型高效的植物生长调节剂,具有促进分蘖、矮化植株、防止倒伏的作用[1]。烯效唑在组织培养上已经得到应用。近几年,安调过、钟冠昌、穆素梅等对烯效唑在小麦幼胚培养中的应用进行了研究[1];李松、何新民等对烯效唑在甘蔗组织培养中的应用进行了研究[4],并取得了一定进展。烯效唑在玉米组织培养中的应用研究报道甚少。为研究烯效唑对玉米幼胚的影响,2015年6月28日—10月25日进行了烯效唑对玉米幼胚培养的试验。
1 材料与方法
1.1 试验材料
供试的玉米品种为18红、18白、R15;以授粉12~15天的幼胚作外植体进行幼胚培养,烯效唑添加浓度分别为0 mg/L,0.10 mg/L,0.25 mg/L,0.50 mg/L,1.00 mg/L。
1.2 试验培养基
基本培养基:N6+蔗糖3%+琼脂0.6%,pH值6.0。
诱导培养基:基本培养基+2,4-D 2 mg/L+脯氨酸1.38 mg/L+水解酪蛋白500 mg/L。
继代培养基:基本培养基+2,4-D 2 mg/L+脯氨酸1.38 mg/L+水解酪蛋白500 mg/L。
分化培养基:基本培养基+KT 1 mg/L +水解酪蛋白500 mg/L。
1.3 试验方法
1.3.1 愈伤组织诱导
取授粉12~15天的玉米果穗,剥去苞叶,于超净工作台上用75%的酒精擦拭,无菌水冲洗3~4遍,用解剖刀切去玉米果穗中部的玉米粒上半部分,用镊子挑出幼胚,盾片朝上接种于添加不同浓度烯效唑的诱导培养基上[5-8],每处理重复7管,每管接种10个幼胚,27 ℃暗培养。
培养10天后,将处理半数的玉米胚芽夹掉,27 ℃继续暗培养。40天后调查各处理胚性愈伤组织诱导率(有愈伤胚数/接种幼胚数)。
1.3.2 愈伤组织分化
挑取胚性愈伤组织[2],并将大块胚性愈伤组织夹碎,分成大小适度的若干细胞团[6],再将其转移到含不同浓度烯效唑的分化培养基上,在2 000 lx光照和27 ℃条件下分化小植株。
2 结果与分析
2.1 烯效唑对愈伤组织诱导率的影响
幼胚经过8天培养,所有的胚都有膨大,表明幼胚已经开始吸收营养物质进行脱分化,且有胚芽的出现[5-6]。将处理半数的玉米胚芽夹掉,继续诱导培养,培养数日后再进行继代培养。
愈伤组织分为:Ⅰ型(白色,致密,坚硬,干燥,表面皱起,生长慢,可发生胚状体,但易发生器官分化),Ⅱ型(黄绿色,颗粒状,较致密,较湿润,生长快,易发生胚状体)和Ⅲ型(灰棕色,疏松,表面湿润,生长缓慢,不发生胚状体)[2]。胚性愈伤组织为Ⅰ型和Ⅱ型[2-3]。经过40天培养,调查统计胚性愈伤组织发生率。从表1可以得到:烯效唑有促进胚性愈伤组织发生的作用,R15去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度0.50 mg/L,达6.38%,其次为浓度1.00 mg/L,为2.17%,浓度为0 mg/L、0.10 mg/L、0.25 mg/L均最低,为0;未去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度0.25 mg/L,达16.67%,其后依次为浓度0.50 mg/L、1.00 mg/L、0.10 mg/L,分别为8.70%、8.33%、3.85%,最低为浓度0 mg/L,为0。18红去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度0.25 mg/L,达38.89%,其后依次为浓度0.50 mg/L、1.00 mg/L、0.10 mg/L分别为33.33%、20.34%、14.81%,最低为浓度0 mg/L,为14.00%;未去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度1.00 mg/L,达209.10%,其后依次为浓度0.25 mg/L、0.50 mg/L、0.10 mg/L,分别为125.00%、68.75%、50.00%,最低为浓度0 mg/L,为35.00%。18白去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度1.00 mg/L,达65.12%,其后依次为浓度0.50 mg/L、0.25 mg/L、0 mg/L,分别为5.00%、23.91%、23.73%,最低为浓度0.10 mg/L,为20.45%;未去芽的幼胚胚性愈伤组织发生率最高为烯效唑浓度1.00 mg/L,达103.70%,其后依次为浓度0.50 mg/L、0.25 mg/L、0 mg/L,分别为62.50%、54.17%、47.37%,最低为浓度0.10 mg/L,为11.54%。
R15、18红、18白未去芽的幼胚愈伤组织诱导率均与去芽的幼胚愈伤组织诱导率无显著差异,表明幼胚的芽对愈伤组织诱导没有显著影响。浓度为0 mg/L、0.10 mg/L、0.25 mg/L的烯效唑作用于R15去芽的幼胚时均未诱导出愈伤组织, R15去芽和未去芽幼胚的对照也未诱导出愈伤组织;18红、18白的各处理均诱导出愈伤组织。表明烯效唑有促进胚性愈伤组织发生的作用,但不同基因型对烯效唑的反应又不尽相同。由此可以推断不同基因型的幼胚在不同烯效唑浓度条件下,胚性愈伤组织发生率不同,并且有的基因型表现为不适反应,以致胚性愈伤组织转变为非胚性愈伤组织;有的基因型表现为促进作用,且随着烯效唑浓度的增大促进作用增强。
2.2 烯效唑对胚性愈伤组织分化的作用
将胚性愈伤组织进行23天的分化培养,调查统计胚性愈伤组织分化苗数(胚性愈伤组织分化出苗高不低于1 cm的植株纳入统计范围)及分化率(分化苗数/接种胚性愈伤组织块数)。从表2可以得到:R15胚性愈伤组织分化率在不同烯效唑浓度下均为0(因此未对R15胚性愈伤组织分化进行重复试验及方差分析);18红胚性愈伤组织平均分化率在烯效唑的浓度为0.25 mg/L最大,达75.93%,其后依次为浓度1.00 mg/L、0 mg/L、0.50 mg/L,分别为37.88%、21.43%、18.45%,浓度0.10 mg/L最低,为15.20%;18白胚型性伤组织平均分化率在烯效唑的浓度为0.25 mg/L最大,达117.65%,其后依次为浓度0 mg/L、1.00 mg/L、0.10 mg/L,分别为107.14%、89.71%、89.29%,浓度0.50 mg/L最低,为81.98%。浓度为0.25 mg/L、1.00 mg/L的烯效唑对18红胚性愈伤组织分化表现为极显著(α=0.01)的促进作用,浓度为0.50 mg/L的烯效唑对18红胚性愈伤组织分化表现为显著(α=0.05)的抑制作用,浓度为0.10 mg/L的烯效唑对18红胚性愈伤组织分化表现为极显著(α=0.01)的抑制作用;浓度为0.25 mg/L的烯效唑对18白胚性愈伤组织分化表现为极显著(α=0.01)的促进作用,浓度为0.10 mg/L、0.50 mg/L、1.00 mg/L的烯效唑对18白胚性愈伤组织分化均表现为极显著(α=0.01)的抑制作用。
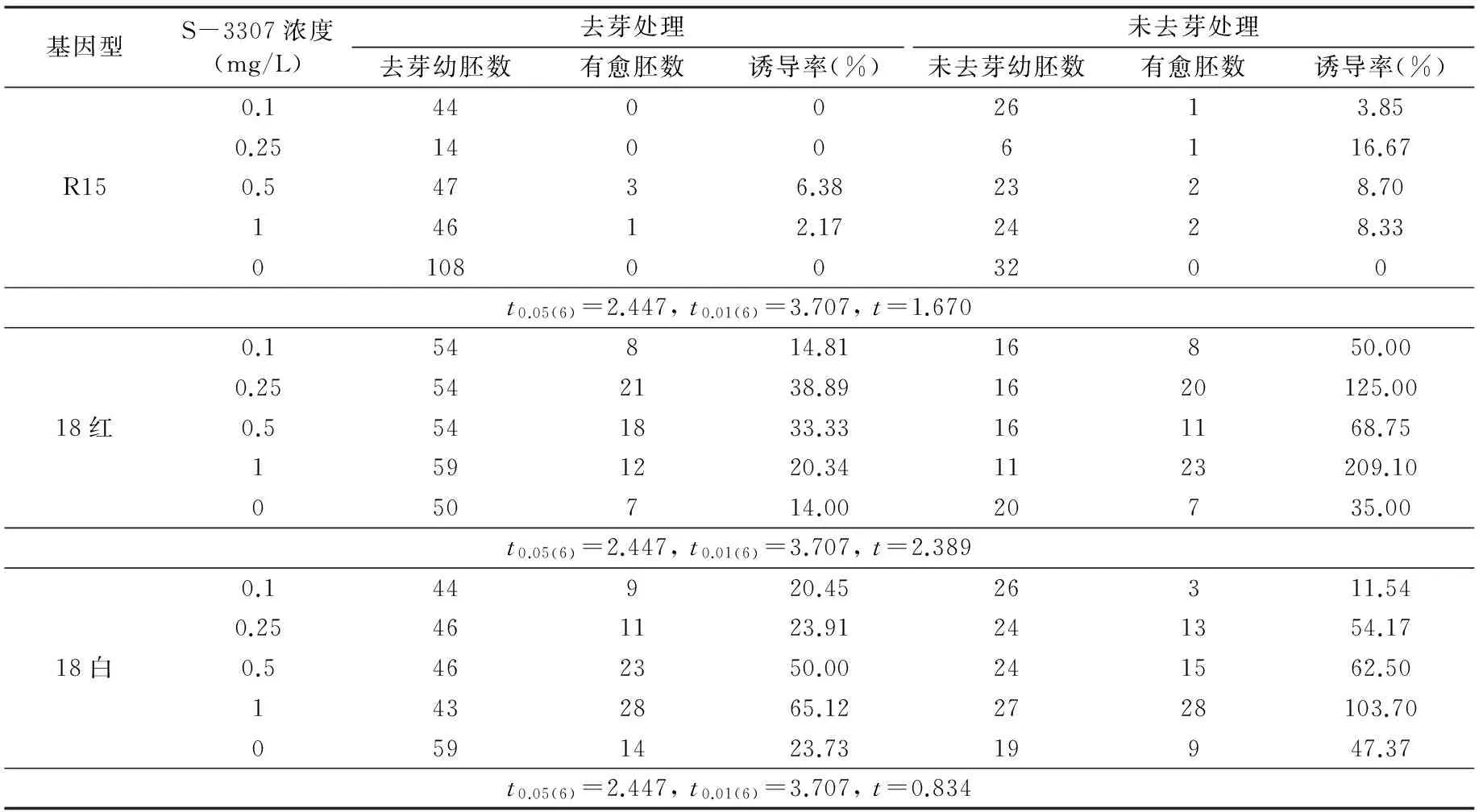
表1 S-3307对愈伤组织诱导率的影响
R15的胚性愈伤组织不能分化植株,而18红、18白则表现为烯效唑的浓度越大其胚性愈伤组织分化苗数越多,18白在烯效唑浓度为0 mg/L时仍有较高胚性愈伤组织分化率,表明18白胚性愈伤组织本身就具有较强的分化能力。不同基因型胚性愈伤组织分化率不同,同一基因型在不同烯效唑浓度处理下胚性愈伤组织分化率也不同;有的基因型则无论烯效唑浓度大小胚性愈伤组织均不能分化植株;有的基因型胚性愈伤组织能够分化成植株,且烯效唑的浓度越大其胚性愈伤组织分化苗数越多。
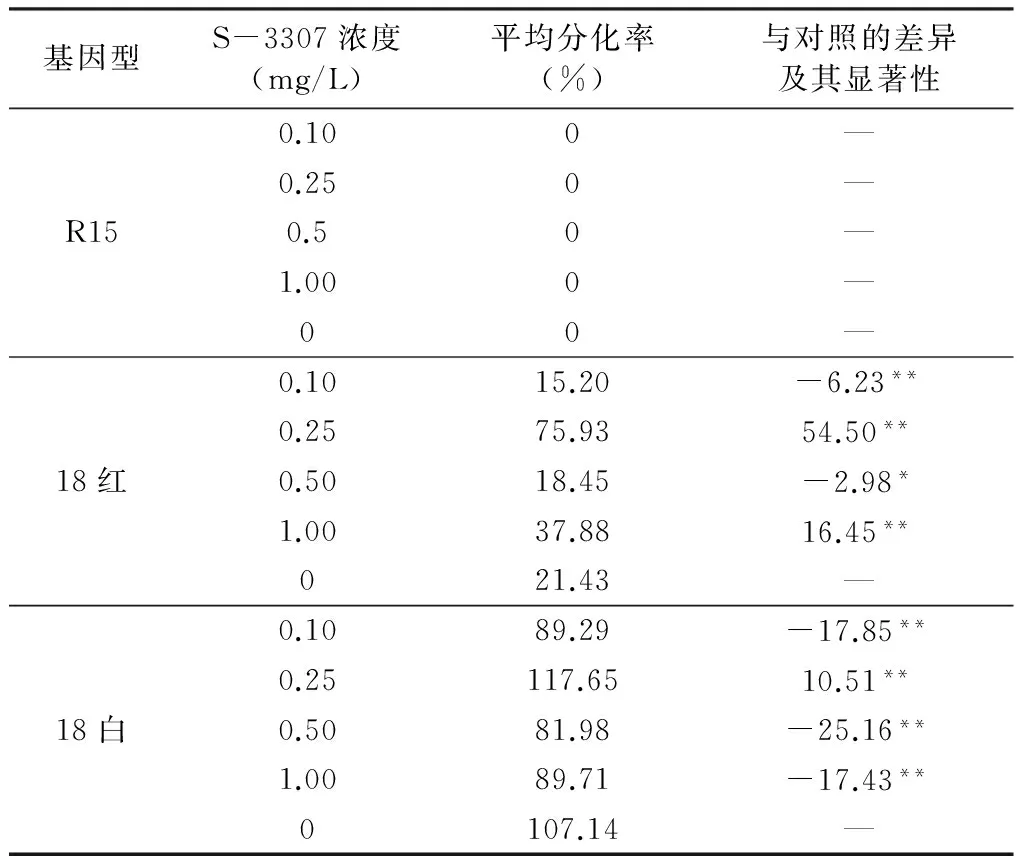
表2 S-3307对胚性愈伤组织分化的影响
注:*表示α=0.05水平上显著;**表示α=0.01水平上极显著。
3 结论和讨论
本试验所用的几个玉米材料均能诱导愈伤组织,表明幼胚愈伤组织的诱导确实具有普遍性[7]。在不同基因型诱导愈伤组织过程中, 幼胚的胚芽对愈伤组织诱导没有显著影响;有的基因型可能由于烯效唑浓度过高而发生胚性愈伤组织转化为非胚性愈伤组织,这表明该基因型的玉米幼胚对烯效唑有不适反应;有的基因型则表现为烯效唑浓度越大,胚性愈伤组织的发生率越高,这表明烯效唑对该基因型的幼胚愈伤组织发生有促进作用。在不同浓度的烯效唑作用下,有的基因型幼胚愈伤组织诱导率高,而胚性愈伤组织分化率则低;有的基因型幼胚愈伤组织诱导率低,而胚性愈伤组织分化率则高。这表明烯效唑对有的基因型幼胚愈伤组织诱导有促进作用,而对有的基因型胚性愈伤组织分化有促进作用,但不同基因型对烯效唑的反应不尽相同。
[1] 安调过,钟冠昌,穆素梅,等. 烯效唑在小麦幼胚培养中的应用[J].西北植物学报,1997,17(4):487-492.
[2] 付凤玲,李晚忱,刘玉贞. 玉米幼穗培养及植物再生[J].四川农业大学学报, 1999,17(3):278-281.
[3] 石太渊,杨立国,杜艳艳. 玉米体细胞培养中不同基因型和外植体的反应[J].国外农学—杂粮作物,1999,19(5):11-14.
[4] 李松,何新民. 烯效唑在甘蔗组织培养中的应用研究[J].甘蔗糖业,2001, 6:19-22.
[5] 吴敏生,黄健秋,卫志明.玉米幼胚高效再生系统的建立[J].植物生理学报, 2001,27(6):489-494.
[6] 候艳华,徐仲,苍晶,等. 玉米自交系愈伤组织的诱导及再生[J].吉林农业大学学报,2002,24(6):7-10.
[7] 王宏伟,史振声,王志斌,等. 玉米幼胚愈伤组织的诱导及再生研究[J]. 沈阳农业大学学报,2002-10,33(5):321-323.
[8] 孙红炜,尚佑芬,杨崇良,等. 影响玉米愈伤组织诱导和植株再生的有关因素研究[J]. 山东农业科学, 2002,6:30-31.
Effect of Uniconazole on the Immature Embryo Culture of MaizePeng
Xiaohui1, Mo Xingmei2, Cao Yutao3
(1. Sichuan Wolong National Nature Reserve Administration, Wenchuan 623000, China;2. Sichuan Commerce and Trade School, Deyang 618000, China;3. Jiuzhaigou Scenic Area Administrative Bureau, Jiuzhaigou 623402, China)
Using immature embryo of three genotypes maize as explants to induce embryogenic calli, the effect of S-3307 on the induction and differentiation of calli was studied. The results showed that the growth of the maize calli could be inhanced by the high concentration of S-3307 and inhibited by the low concentration of S-3307. The higher concentration of S-3307 the higher induction rate of maize calli, and the embryogenic calli of maize could be differentiated more small plants by adding the higher concentration of S-3307 in differentiating-medium. Remarkable difference of the effect of S-3307 on induction rate of calli was found among these genotypes. But, some genotypes calli showed a discomfort response to adding high concentration of S-3307, so that the embryogenic calli transformed non-embryogenic calli. The higher concentration of S-3307, the more differentiation rate of plants was produced. But the different genotypes of maize had the different responses to S-3307.
maize; immature embryo; uniconazole; callus
10.3969/j.issn.1006-9690.2017.04.007
2016-11-16
彭晓辉(1977—),男,农学学士,工程师,主要从事野生动植物保护。E-mail: philipsphill@qq.com
Q813.1;S513
A
1006-9690(2017)04-0029-04

