醒脑静对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤的保护作用
尚亚细亚 杜菊梅 张磊 申艳方 张文青 梁风俊
醒脑静对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤的保护作用
尚亚细亚 杜菊梅 张磊 申艳方 张文青 梁风俊
目的 观察醒脑静注射液对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤的保护作用。方法 将培养的SH-SY5Y细胞随机分为5组,即(1)正常对照组:细胞正常培养27 h;(2)AD细胞模型组:细胞正常培养3 h,随后用老化的Aβ25-35(25μmol/L)处理24 h;(3)醒脑静低浓度组:醒脑静注射液(5 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h;(4)醒脑静中浓度组:醒脑静注射液(10 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25μmol/L)处理24 h;(5)醒脑静高浓度组:醒脑静注射液(20 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h;处理后各组细胞利用MTT法检测细胞存活率,紫外分光光度法检测细胞内ATP含量,流式细胞仪检测线粒体膜电位水平。结果 AD细胞模型组细胞存活率较正常对照组降低(P<0.05),醒脑静不同浓度组细胞存活率较AD细胞模型组均明显升高(P<0.05);AD细胞模型组细胞内ATP含量、线粒体膜电位水平较正常对照组下降(P<0.05),醒脑静不同浓度组细胞内ATP含量、线粒体膜电位水平较AD细胞模型组显著升高(P<0.05)。结论 醒脑静预处理可抑制Aβ25-35诱导的SH-SY5Y细胞凋亡,提高细胞存活率,其机制可能与醒脑静提高细胞内ATP含量及线粒体膜电位水平而发挥线粒体保护作用有关。
醒脑静 阿尔茨海默病 β淀粉样蛋白 ATP 线粒体膜电位
阿尔茨海默病(Alzheimer disease,AD)是老年人常见的神经系统变性疾病,也最常见的痴呆类型,临床上主要表现为进行性记忆与认知功能减退。目前我国有AD患者600~800万,其中65岁以上老年人AD患病率为3%~7%,随着人口老年化社会的不断加剧,AD防治形势不容乐观。目前AD具体发病机制尚不明确,β淀粉样蛋白(amyloid beta, Aβ)沉积形成的老年斑及神经原纤维缠结形成是AD典型病理特征。研究表明Aβ可直接或间接对线粒体结构及功能造成损伤[1-3],而线粒体损伤后一方面可诱发氧化应激、激活凋亡信号通路等级联反应;另一方面可促进Aβ生成[4],进一步加重线粒体损伤,从而形成恶性循环,导致神经元变性凋亡。因此,抑制Aβ诱导的线粒体损伤对减轻AD病理损害具有重要意义。
醒脑静注射液是由传统名方“安宫牛黄丸”经科学改制而成的水溶性中药注射液,主要成分为麝香、郁金、冰片、栀子。研究显示醒脑静注射液可改善临床AD患者MMSE、ADAS-cog、GDS评分[5],但其具体机制尚不清楚。脓毒症大鼠实验发现醒脑静注射液可减轻心肌线粒体肿胀、空泡样改变,降低线粒体电镜下的半定量评分,具有线粒体保护作用[6]。在AD患者中醒脑静注射液是否可发挥线粒体保护作用、抑制神经元凋亡、改善认知障碍尚未明确。本研究利用AD细胞模型探讨醒脑静注射液对Aβ25-35诱导的线粒体损伤的保护作用。
1 材料与方法
1.1 实验材料
SH-SY5Y细胞购自中国科学院上海细胞库;高糖DMEM培养基(Gibco公司);胎牛血清(Hyclone公司);0.25%胰酶(Trypsin公司);Aβ25-35(Sigma公司);噻唑蓝MTT(Sigma公司);ATP含量测试盒(南京建成生物工程研究所);细胞凋亡线粒体膜电位检测试剂盒(南京建成生物工程研究所);醒脑静注射液。
1.2 方法
1.2.1 Aβ25-35老化处理
用1.8 mL重蒸水将1 mg Aβ25-35溶解成浓度为500 μmol/L的母液,于37 ℃下孵育7 d以形成聚集形式的Aβ25-35,-20℃冷冻保存备测,测量前用培养基稀释成实验所需浓度。
1.2.2 细胞培养
SH-SY5Y细胞株接种于盛有DMEM完全培养基的培养瓶中,放置于37 ℃、5%的CO2培养箱中,每天在倒置显微镜下观察细胞生长状况,每3~4 d传代1次,传代按1∶3进行,取对数生长期细胞进行实验。
1.2.3 AD细胞模型制备
AD细胞模型制备参考Hongquan等方法[7]:用DMEM完全培养基将老化的Aβ25-35稀释至25 μmol/L,将正常培养的SH-SY5Y细胞暴露于 Aβ25-35(25 μmol/L)中24 h,即制成所需AD细胞模型。
1.2.4 实验分组
将培养的SH-SY5Y细胞随机分为5组,即(1)正常对照组:细胞正常培养27 h;(2)AD细胞模型组:细胞正常培养3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h;(3)醒脑静低浓度组:醒脑静注射液(5 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h;(4)醒脑静中浓度组:醒脑静注射液(10 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h;(5)醒脑静高浓度组:醒脑静注射液(20 μl/mL)预处理细胞3 h,随后用老化的Aβ25-35(25 μmol/L)处理24 h。
1.2.5 MTT法检测细胞存活率
SH-SY5Y细胞接种于96孔培养板,按照实验分组干预处理后每孔加入MTT溶液(5 mg/ml)20 μL,37 ℃继续孵育4 h,终止培养,移除孔内培养液,每孔加入150 μl DMSO,摇床上低速震荡10 min使甲臜充分溶解,空白孔调零,酶标仪上490 nm波长处检测各孔OD值,记录并计算细胞存活率。
1.2.6 细胞ATP含量检测
SH-SY5Y细胞接种于6孔培养板,按照实验分组干预处理后严格按ATP含量测试盒说明书进行操作,利用紫外分光光度计检测各孔吸光度值,记录并计算ATP含量,ATP含量(μmol/L)=[(测定OD值-对照OD值)/(标准OD值-空白OD值)]×标准品含量×样本测定前稀释倍数÷待测样本蛋白含量。
1.2.7 细胞线粒体膜电位检测
利用JC-1荧光探针检测线粒体膜电位,将SH-SY5Y细胞接种于6孔培养板,按照实验分组干预处理后严格按线粒体膜电位检测试剂盒说明书操作,各组单细胞悬液用流式细胞仪检测(Ex=488 nm;Em=530 nm),绿色荧光通过FITC通道FL1检测,红色荧光通过PI通道FL2检测,计算各组红绿荧光强度比值。
1.2.8 统计学处理
2 结 果
2.1 各组细胞存活率
AD细胞模型组细胞存活率较正常对照组降低(P<0.05);与AD细胞模型组比较,醒脑静低浓度组、中浓度组及高浓度组细胞存活率明显升高(P<0.05);不同浓度醒脑静组比较,醒脑静低浓度组细胞存活率高于中浓度组、高浓度组(P<0.05)(表1)。
注:与正常对照组比较,*P<0.05;与AD细胞模型组比较,#P<0.05;与醒脑静低浓度组比较,▲P<0.05
2.2 ATP含量检测
与正常对照组比较,AD细胞模型组ATP含量显著降低(P<0.05);醒脑静低浓度组、中浓度组及高浓度组ATP含量较AD细胞模型组升高(P<0.05);不同浓度醒脑静组比较,醒脑静低浓度组ATP含量高于中浓度组、高浓度组(P<0.05)(表2)。
2.3 线粒体膜电位检测
与正常对照组比较,AD细胞模型组线粒体膜电位明显降低(P<0.05);醒脑静低浓度组、中浓度组及高浓度组线粒体膜电位较AD细胞模型组升高(P<0.05);不同浓度醒脑静组比较,醒脑静低浓度组线粒体膜电位高于中浓度组、高浓度组(P<0.05)(图1,表3)。
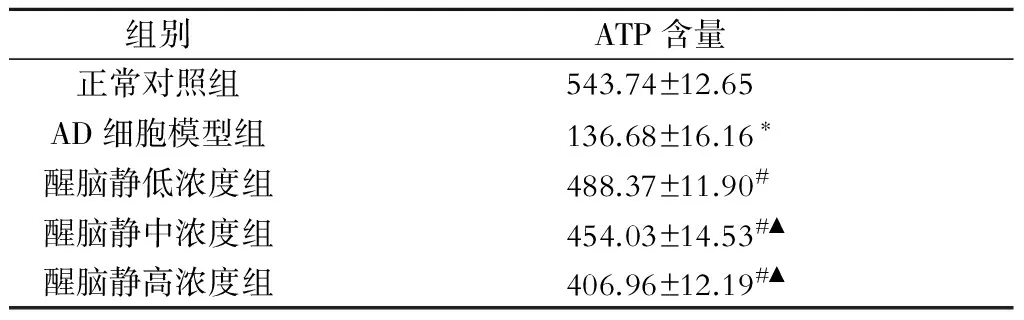
表2 各组细胞ATP含量检测(μmol/L)
注:与正常对照组比较,*P<0.05;与AD细胞模型组比较,#P<0.05;与醒脑静低浓度组比较,▲P<0.05
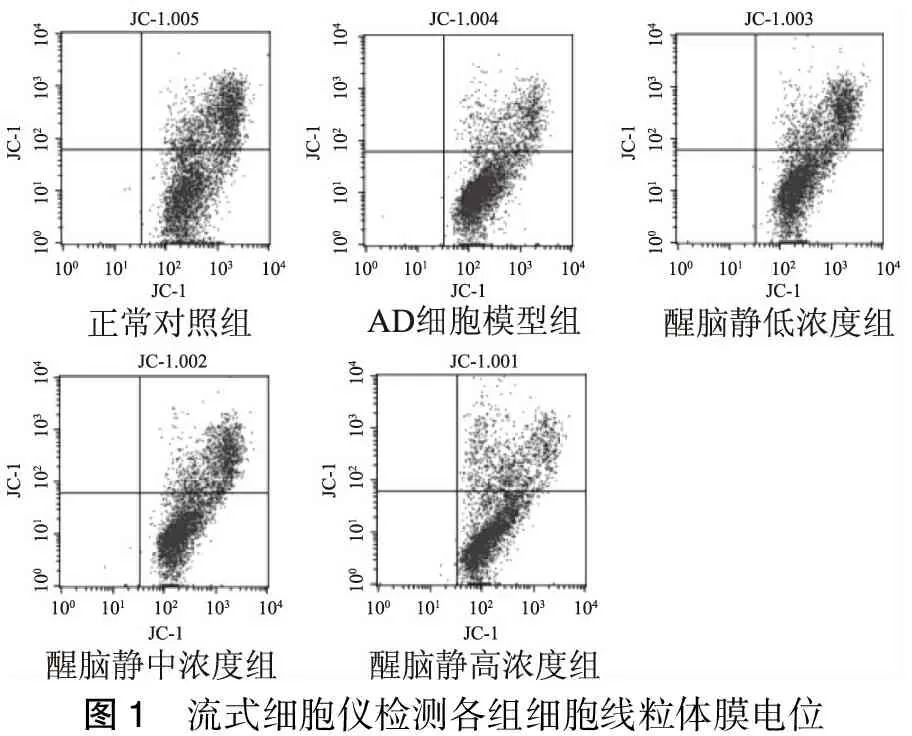
图1 流式细胞仪检测各组细胞线粒体膜电位
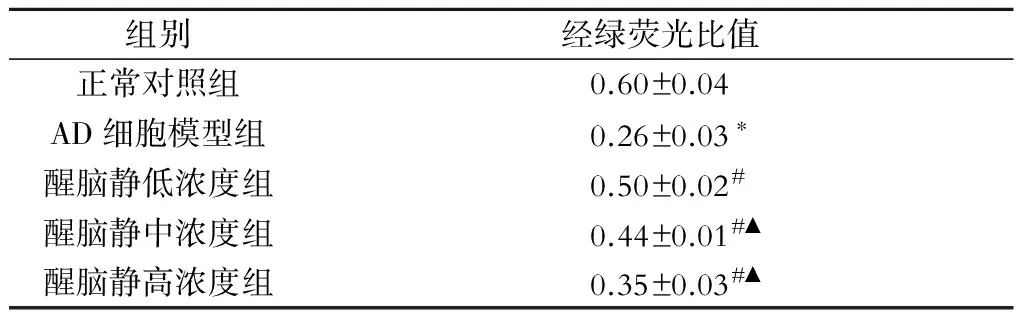
表3 各组细胞线粒体膜电位检测
注:与正常对照组比较,*P<0.05;与AD细胞模型组比较,#P<0.05;与醒脑静低浓度组比较,▲P<0.05
3 讨 论
AD是老年人最常见的痴呆类型,虽然随着国内外学者对AD研究的不断深入,相继提出了Aβ级联假说、Tau蛋白过度磷酸化假说、氧化应激假说、胆碱能假说、兴奋性氨基酸毒性假说等发病机制假说,但目前AD发病机制仍未完全阐明,亦无确切有效的治疗方法。脑组织中Aβ异常沉积形成老年斑是AD典型病理特征之一,研究表明Aβ对神经元内线粒体具有显著毒性作用,AD模型大鼠脑组织中靠近Aβ斑块的神经元内线粒体数量减少、膜电位下降,并可见营养不良和破碎的线粒体[8]。利用电子显微镜观察AD患者海马、额叶皮层、小脑皮层、丘脑等部位的神经元,亦可见广泛的线粒体肿胀、数量减少、嗜锇物质聚集,严重者出现空泡变性和线粒体嵴断裂[9]。线粒体损伤后可刺激APP经淀粉样代谢途径水解生成具有毒性作用的Aβ[4],从而形成Aβ聚集→线粒体损害→Aβ生成的恶性循环,加重AD病理损害。因此,积极寻求线粒体保护剂来抑制Aβ诱导的线粒体损伤对缓解AD病理损害具有重要意义。
中医学认为,神明失用是阿尔茨海默病发病的基本病理,心肾虚衰、痰瘀阻滞是导致神明失用的内在机制,治疗当以开窍醒神、强记益智为施治总则。醒脑静注射液是由《温病条辨》传统名方“安宫牛黄丸”经科学改制而成的水溶性中药注射液,主要成分为麝香、郁金、冰片、栀子,四药相配具有醒脑开窍、行痰通瘀、清解毒邪之功效。有研究发现醒脑静注射液可明显缩短AD模型大鼠在水迷宫试验中的逃避潜伏期,增加跨越原平台次数,减轻AD模型大鼠的学习记忆障碍[7],改善临床AD患者MMSE、ADAS-cog、GDS评分[5],但其具体分子机制尚不清楚。在脓毒症大鼠心肌损伤实验中王金华等研究发现醒脑静注射液可减轻脓毒症大鼠心肌线粒体肿胀、空泡样改变,降低线粒体电镜下的半定量评分,对脓毒症大鼠心肌线粒体发挥保护作用[6]。醒脑静是否可通过线粒体保护作用来减轻Aβ细胞毒性、改善AD患者痴呆症状尚不清楚,本研究利用AD细胞模型探讨醒脑静注射液对Aβ25-35诱导的SH-SY5Y细胞线粒体损伤的保护作用。
线粒体是细胞内能量转换的主要结构,被称为“细胞动力工厂”。线粒体通过三羧酸循环、电子传递过程使H+经ATP酶复合体回流产生自由能,进而驱动ATP合酶将高能磷酸键转移给ADP生成ATP。前期研究表明Aβ可引起线粒体ATP合成减少,其机制可能是Aβ结合ATP合酶的α亚单位后引起ATP合酶构象改变,从而阻碍了底物水平磷酸化产生的高能磷酸键转移至ADP生成ATP[10];也可能与Aβ诱导细胞氧化应激,降低细胞色素C氧化酶活性,抑制了线粒体电子传递和氧化磷酸化过程有关[11]。本研究发现,Aβ25-35可导致SH-SY5Y细胞ATP含量下降,而醒脑静预处理可相对提高细胞内ATP含量,提示醒脑静预处理可减轻Aβ25-35引起的SH-SY5Y细胞ATP合成障碍。ATP是细胞内能量储存的主要形式,ATP高能磷酸键水解生成ADP所释放的能量,可为细胞分裂增殖、离子转运、信号传导、神经元轴突运输等生理活动提供动力支持,醒脑静预处理提高AD模型细胞内ATP含量,有利于维持细胞正常新陈代谢、减少细胞凋亡。
线粒体是由流动的双层单位膜套叠形成的封闭性膜囊结构,双侧单位膜分别称为外膜和内膜,外膜可允许分子量10000以下的小分子物质自由通过,而内膜对物质的通透具有高度选择性,是线粒体膜电位形成的基础。线粒体膜电位下降是线粒体损伤和细胞凋亡的早期标志,研究发现Aβ干预海马神经元8 h后神经元内线粒体膜电位下降、细胞凋亡增加,其机制可能与Aβ激活多聚-ADP-核糖聚合酶(PARP)有关[12]。Rao等研究发现线粒体通透转换孔(mPTP)开放在Aβ诱导的线粒体膜电位下降中也发挥作用,Aβ可与mPTP上的亲环素-D相互作用,促进mPTP开放,引起线粒体膜电位下降[13]。本研究Aβ25-35干预SH-SY5Y细胞24 h后细胞线粒体膜电位显著下降,与前期研究结果一致,而醒脑静各组细胞线粒体膜电位较AD模型细胞明显升高,提示醒脑静预处理可减轻Aβ引起的线粒体膜电位下降,从而有利于维持线粒体膜正常通透性及线粒体内膜两侧电荷梯度,稳定细胞氧化呼吸及能量代谢。
线粒体膜电位下降是细胞凋亡的早期标志,醒脑静可相对升高Aβ25-35诱导的SH-SY5Y细胞线粒体膜电位,可能具有抗Aβ诱导的细胞凋亡作用。本研究利用MTT法检测细胞存活率,结果发现醒脑静各组细胞存活率较AD模型组细胞明显升高,提示醒脑静预处理可抑制Aβ诱导的细胞凋亡。有研究发现醒脑静可通过下调Caspase-3水平来抑制脑外伤、脑出血后神经元凋亡[14-16],醒脑静的抗神经元凋亡作用可能与其调节Caspase-3活性有关,Caspase-3是Caspase依赖凋亡途径的主要下游分子,线粒体损伤后线粒体膜电位下降、ATP含量减少,线粒体通透性增加,可导致线粒体内细胞色素C、内核酸酶G、凋亡诱导因子等凋亡相关蛋白释放,活化Caspase-3,启动Caspase依赖细胞凋亡[17]。本研究发现醒脑静可提高Aβ25-35干预后SH-SY5Y细胞存活率,同时可提高线粒体膜电位、ATP含量,推测醒脑静抗神经元凋亡作用可能与其减轻Aβ诱导的线粒体损伤,减少线粒体凋亡蛋白释放有关,但其对线粒体的保护作用机制尚有待进一步研究。
综上所述,本研究发现醒脑静预处理可抑制Aβ25-35诱导的SH-SY5Y细胞凋亡,提高细胞存活率,其机制可能与醒脑静提高细胞内ATP含量及线粒体膜电位水平,发挥线粒体保护作用有关,但其对线粒体的保护作用机制尚有待进一步研究。醒脑静是临床上广泛用于脑血管病、脑外伤的治疗,其安全性、有效性已获得临床认可,深入发掘醒脑静在AD治疗方面的潜在作用机制将有望为AD治疗提供新的治疗选择。
[1] Crouch PJ,Harding S-,White AR,et al.Mechanisms of a beta mediated neurodegeneration in alzheimer's disease[J].International Journal of Biochemistry & Cell Biology,2008,40(2):181-198.
[2] Manczak M,Mao PZ,Calkins MJ,et al.Mitochondria-Targeted antioxidants protect against amyloid-beta toxicity in alzheimer's disease neurons[J].Journal of Alzheimers Disease,2010,20(2, SI):S609-S631.
[3] Butterfield DA,Galvan V,Lange MB,et al.In vivo oxidative stress in brain of Alzheimer disease transgenic mice: Requirement for methionine 35 in amyloid beta-peptide of APP[J].Free Radical Biology and Medicine,2010,48(1):136-144.
[4] Leuner Kristina,Schütt Tanja,Kurz Christopher,et al.Mitochondrion-derived reactive Oxygen species Lead to enhanced amyloid beta formation[J].Antioxid Redox Signal,2012,16(12):1421-1433.
[5] 李明秋,黄海华,张国胜,等.醒脑静注射液治疗阿尔茨海默病的临床疗效观察[J].中国中西医结合急救杂志,2011,18(5):309-311.
[6] 王金华,车頔,陈东,等.醒脑静注射液对脓毒症大鼠心肌线粒体氧化应激损伤的作用[J].实用医学杂志,2015,31(9):1403-1406.
[7] Wang Hongquan,Xu Yuxia,Yan Jie,et al.Acteoside protects human neuroblastoma SH-SY5Y cells against beta-amyloid-induced cell injury[J].Brain Res,2009,1283(8):139-147.
[8] Xie Hong,Guan Jisong,Borrelli A,et al.Mitochondrial alterations near amyloid plaques in an Alzheimer's disease mouse model[J].J Neurosci,2013,33(43):17042-17051.
[9] Baloyannis SJ.Mitochondrial alterations in Alzheimer's disease[J].J Alzheimers Dis,2006,9(2):119-126.
[10]Schmidt C,Lepsverdize E,Chi L,et al.Amyloid precursor protein and amyloid beta-peptide bind to ATP synthase and regulate its activity at the surface of neural cells[J].Mol Psychiatry,2008,13(10):953-969.
[11]Hauptmann S,Scherping I,Dr se S,et al.Mitochondrial dysfunction: an early event in Alzheimer pathology accumulates with age in AD transgenic mice[J].Neurobiol Aging,2009,30(10):1574-1586.
[12]Abeti Rosella,Abramov Y,Duchen R.Beta-amyloid activates PARP causing astrocytic metabolic failure and neuronal death[J].Brain,2011,134(Pt 6):1658-1672.
[13]Rao Koteswara,Carlson A,Yan Shidu.Mitochondrial permeability transition pore is a potential drug target for neurodegeneration[J].Biochim Biophys Acta,2014,1842(8):1267-1272.
[14]郭晋辉,姜勇.醒脑静注射液对蛛网膜下腔出血后海马神经元凋亡的影响[J].山东大学学报:医学版,2011,49(7):57-60.
[15]戴永建,戢翰升.醒脑静注射液对大鼠脑损伤后细胞凋亡及相关蛋白表达的影响[J].中国临床神经外科杂志,2006,11(9):551-553.
[16]刘轶林,洪缨,王晶,等.CORM-2通过激活Caspase依赖性线粒体途径诱导神经细胞凋亡及 醒脑静对其干预作用的机制研究[J].世界科学技术-中医药现代化,2013,15(8):1725-1734.
[17]郑天胜.线粒体凋亡通路的研究进展[J].医学综述,2013,19(18):3282-3285.述,2013,19(18):3282-3285.
(2016-11-17收稿)
The protective effect of Xingnaojing on mitochondrial damage of SH-SY5Y cells induced by Aβ25-35proteins
ShangYaxiya,DuJumei*,ZhangLei,etal.
DepartmentofNeurology,TheSecondAffiliatedHospitalofShaanxiUniversityofChineseMedicine,Xianyang712000
Objective To investigate the protective effect of Xingnaojing on mitochondrial damage of SH-SY5Y cells induced by Aβ25-35proteins.Methods SH-SY5Y cells were divided into 5 groups: (1) normal control group(cells were cultured for 27 h), (2) AD cell model group(after 3h in normal culture, cells were treated with 25 μM Aβ25-35for 24h), (3) Xingnaojing low concentration group( before treatment with 25 μM Aβ25-35for 24h, cells were pretreated with 5 μl/mL Xingnaojing for 3 h), (4) Xingnaojing middle concentration group(before treatment with 25μM Aβ25-35for 24 h, cells were pretreated with 10 μl/mL Xingnaojing for 3 h), (5) Xingnaojing high concentration group(before treatment with 25 μM Aβ25-35for 24 h, cells were pretreated with 20 μl/mL Xingnaojing for 3 h). After treatment, cell viability was measured by MTT conversion, levels of mitochondrial membrane potential and ATP contents were evaluated by flow cytometry and UV-Spectrophotometric method respectively.Results cell viability significantly decreased in AD cell model group compared with normal control group(P<0.05), Xingnaojing(5,10,20 μl/mL) pretreatment significantly elevated cell viability compared with AD cell model group(P<0.05). Exposure of SH-SY5Y cells to Aβ25-35for 24 h reduced mitochondrial membrane potential and ATP contents(P<0.05), compared with AD cell model group, Xingnaojing(5,10,20 μl/mL) pretreatment significantly elevated ATP content and mitochondrial membrane potential(P<0.05).Conclusion Xingnaojing pretreatment could inhibit apoptosis of SH-SY5Y cells induced by Aβ25-35and improve cell viability, which might be related with Xingnaojing elevated intracellular ATP contents and the level of mitochondrial membrane potential to protect mitochondria.
Xingnaojing Alzheimer's disease Beta-amyloid proteins ATP Mitochondrial membrane potential
陕西中医药大学科研创新基金(项目编号2016PY20);陕西中医药大学第二附属医院专项科研计划项目(项目编号2016ZD02)
712000 陕西省咸阳市陕西中医药大学(尚亚细亚);陕西中医药大学第二附属医院 [杜菊梅(通信作者)张磊 申艳方 张文青 梁风俊]
R742
A
1007-0478(2017)04-0297-05
10.3969/j.issn.1007-0478.2017.04.005

