土壤干旱和强光交互作用对青藏高原高山嵩草光合功能的影响
师生波, 李天才, 王 伟, 德科加, 徐先英, 王 祺, 马剑平, 李爱德, 康才周
(1.中国科学院西北高原生物研究所/高原生物适应与进化重点实验室/青海省作物分子育种重点 实验室, 青海 西宁 810001; 2.青海大学/畜牧兽医科学院, 青海 西宁 810016; 3. 甘肃省治沙研究所/甘肃省沙生植物 工程技术研究中心, 甘肃 兰州730070)
高山嵩草(KobresiapygmaeaClarke)是生长在青藏高原的典型地带性植物,属莎草科(Cyperaceae)嵩草属(Kobresia),在海拔3 800~4 500 m的高原地带形成以其为优势种的高寒嵩草草甸植物群落[1]。嵩草草甸为我国独特的植被类型,在青藏高原分布最广、面积最大[2]。草甸植被中高山嵩草的盖度可达40%~60%,有时高达80%。高山嵩草营养价值较高,粗蛋白含量超过野生豆科牧草花首蓿(Medicagoruthenica(L.) Trautv.)[3],为夏秋季家畜的主要牧草[4],尽管产草量较低,但在草地畜牧业生产中仍占有较高的地位。青藏高原为世界最高高原,平均海拔在4 000 m以上。整个高原面上空气稀薄、大气尘埃少、水蒸气和二氧化碳等气体含量很低,大气透明度高,近地表太阳光辐射强且日照时间长;同时,受高原大陆性气候影响,早春和晚秋季节高原地区寒冷且少雨,土壤干旱现象十分明显[1],植物常处于非生物胁迫引起的生理性干旱状态。研究表明,在年平均气温-0.1~-1.6℃,≥5℃的积温仅543.1~886.9℃的高寒地带,高山嵩草仍能正常生长发育,呈现出极强的耐寒能力[5]和对高原环境的适应。高山嵩草对高原极端环境的适应机理一直是学术界关注的重点,然而迄今为止,绝大多数对高山嵩草的研究工作主要集中在分布格局[6-7]、繁殖特性[8-9]、物候特征[3]等方面,鉴于其植株构型的特殊性和生存环境的恶劣,有关生理生态适应性方面的研究一直鲜有开展。
光合作用是植物体重要的生理过程,其功能的有效运行取决于生长环境的适宜程度和植物对逆境的适应能力。太阳光能为驱动植物光合作用中一系列原初反应过程和合成富含有机物质的各种生化反应最终能量来源,然而强太阳光也可引起植物体光合活性的下调,诱发光合作用的光抑制。在没有严重的环境胁迫时,光抑制的形式主要表现为非辐射能量耗散(non-radiative dissipation, NRD)的增加[14];存在其他胁迫因素时,高光强则可引起光合机构电子传递活性的功能下调和光系统II (PSII)反应中心复合体结构破坏,导致光失活,甚至光伤害[11]。强光引起的高山嵩草叶片光化学量子效率的降低是否会因土壤干旱的胁迫而进一步加剧,土壤干旱是否会加重强光对植物叶片PSII光化学和非光化学猝灭能力,目前尚缺乏对此类问题的深入探讨。叶绿素荧光与植物光合机构的光化学反应过程紧密相关, 能够提供光合生理的诸多信息, 特别适宜于探测胁迫环境中植物光合功能的响应及适应性变化, 是研究光合作用的快速、无损伤探针[10]。近几十年来, 这一测量手段已在不同植物的多种环境胁迫研究方面得到了广泛应用[11-13]。叶绿素荧光图像分析作为高度创新的一类动力学荧光成像测定方法,在研究微小植物体的光合生理方面具有独特的优越性[14-15]。本文采用英国埃塞克斯大学研发的叶绿素荧光图像分析系统(CF imager),从光合机构的光能利用和耗散两方面研究了高山嵩草对强光和土壤干旱胁迫的生理适应性,并借助一般线性模型单变量方差分析法探索了强光与土壤干旱胁迫的交互作用及相对贡献。
1 材料与方法
1.1 试验样地及植物材料
试验样地邻近青海大学-清华大学三江源高寒草地生态系统野外观测站,草地类型为高山嵩草杂类草草甸。试验站位于青海省玉树州称多县珍秦镇,地理坐标为33°24' N,97°18' E,海拔4 270 m。站区年平均气温为-5.6~3.8℃,年均降水量为562.2 mm,降水主要分布在植物生长季的6—9月份,约占全年降水总量的75%;属典型高原大陆性气候。
高山嵩草为该草甸的主要优势种,次优势种有矮嵩草(Kobresia.humilisClarke)、异针茅(StipaalienaKeng.)、珠芽蓼(PolygonumviviparumL.)、雪白萎陵菜(Potentilla.nivea L.)等。伴生植物包括羊茅(FestucaovinaL.)、垂穗披碱草(ElymusnutansKeng)、滇藏紫菀(Astertsarungensis(Griers.)Ling)、美丽风毛菊(SaussureasuperbaAnth)等。站区草场暖季试验期间无家畜放牧利用。
土壤类型为高山草甸土,土层薄,一般仅40~50 cm厚;腐殖质含量丰富,土壤pH值为6.92。受高寒低温气候的影响,腐殖层分解缓慢,土壤有效肥力不高,有机质含量仅为2.36%。土壤中速效氮14.0 mg·L-1,其中氨态氮和硝态氮分别为5.1和8.9 mg·L-1,土壤速效磷l7.0 mg·L-1,速效钾76.5 mg·L-1。
1.2 试验设计
草皮层切割移位处理:在高山嵩草杂类草草甸选择地势平坦的样地3块,每个样地挖取15 cm×15 cm的毗邻草皮2块,厚度约20 cm。仔细剪除上面的其他种类植物,且注意维持高山嵩草处于自然生长状态;用塑料胶带缠住草毡层的4个边后,其中一块放回原位,设为对照组;另一块集中安置在相邻的草地样方扣笼上,距离地面约40 cm,设为干旱组。原位对照组草皮块每日喷洒少量水,维持草毡表层处于湿润状态;干旱组草皮块每晚移入遮雨棚内,以隔绝夜间降雨。
试验开始于2014年8月28日。干旱处理持续7 d,期间多为晴天间有夜雨。9月1日起每天10:00左右依次取干旱组和对照组草皮块在室内进行叶绿素荧光图像测定;9月4日试验结束后,剥取草皮块中部土壤测定水分含量,干旱组和对照组的相对含水量分别为(5.20±1.44)%和(25.75±1.25)%,呈极显著差异(P<0.001)。
1.3 叶绿素荧光参数测定
在暗室内,开启CF-imager叶绿素荧光图像分析仪(Chlorophyll fluorescence Imager, Technologica Ltd, UK ),运行预先编制的程序,获取暗适应及稳态作用光强下的各叶绿素荧光图像。测定期间室内温度维持在20 ± 1.5℃,相对湿度恒定。
1.3.1测定程序 准确暗适应15 min后测定PSII反应中心关闭状态时的最小叶绿素荧光产率(Fo),和开放状态的最大叶绿素荧光产量(Fm)。设200,800,1 500 μmol·m-2·s-1低、中、高3个稳态作用光强,并依次开启;每个光强辐照15 min,每5 min测定一次最大荧光产率(Fm′)和稳态荧光产率(Fs)。测定Fm和Fm′的饱和脉冲光为6 840 μmol·m-2·s-1,脉冲频率设为60 ms。
1.3.2叶片定位及图像解析 程序图形编辑框中,定位并分割无重叠的高山嵩草叶片图像,解析为叶绿素荧光参数的数据值。共解析24枚叶片,视做多株个体的重复测定。具体处理过程见CF imager操作手册。
1.3.3PSII光化学效率和过剩激发能的非光化学猝灭分析 分别计算200,800,1 500 μmol·m-2·s-1低、中、高3个稳态光强下,和第5、10、15 min时的各叶绿素荧光参数。Fo′以Oxborough和Baker[16]经验公式估算:Fo′ =Fo/(Fv/Fm-Fo/Fm′),式中Fo和Fm为准确暗适应15 min后的叶绿素荧光产率。
PSII最大效率(Fv'/Fm')和PSII运行效率(Fq'/Fm')分别由下式[17]计算:Fv'/Fm' = (Fm′ -Fo′)/Fm′;Fq'/Fm' = (Fm′ -Fs)/Fm′。PSII效率因子(Fq'/Fv')和非光化学猝灭系数(NPQ)依照Bilger 和 Björkman[18]的公式计算:Fq'/Fv' = (Fm′ -Fs)/(Fm′ -Fo′);NPQ=Fm/Fm′ - 1。PSII反应中心的开放比率qL用Baker[14]提出的方法估算,qL= [(Fm′ -Fs)/(Fm′ -Fo′)]×(Fo′/Fs)。PSII反应中心光化学效率的相对限制(L(PFD))依照下式[19]估计:L(PFD)= 1 - [(Fm′ -Fs)/Fm′]/0.83,0.83为稳态作用光下的平均最适量子效率。
1.4 叶绿素含量测定
叶绿素荧光测定试验结束后,分别剪取对照和干旱组的高山嵩草叶片,精确称取0.100 g鲜叶,浸入内含10 mL丙酮和乙醇的混合提取液(丙酮∶乙醇∶水=4.5∶4.5∶1)的玻璃瓶,盖紧样品瓶盖,置低温处避光浸提约10 d至叶片无色[20]。每处理组设3次重复,叶绿素含量的测定与计算见朱广廉等[21]。
1.5 数据分析
本文选用9月3日,即干旱处理第6天的成组测定数据进行分析。此时干旱组草毡表层已较为干燥,但高山嵩草仍未显受损迹象,仅个别植株叶片略有泛黄迹象。
数据经Microsoft Excel 2010整理后,用SPSS 16.0软件进行统计分析。独立样本t检验法比较土壤干旱和对照组叶片间的差异显著性;不同处理光强和不同照光时间之间的差异采用单因素方差分析(one-way ANOVA),最小显著差异法(LSD) 进行多重比较, 显著性水平设定为0.05;光强和土壤干旱胁迫间交互效应分析采用一般线性模型单变量方差分析法(GLM univariation)。图中数据为平均数, 垂直条表示标准差(SD),样本数为24。
2 结果与分析
2.1 土壤干旱胁迫对高山嵩草叶绿素含量的影响
表1表明,与对照相比,土壤干旱处理后高山嵩草叶片的叶绿素a(Chla)含量和叶绿素a、b比值(Chla/b)均有所降低,且Chla呈极显著降低(P< 0.01);但叶绿素b(Chlb)和总叶绿素含量几无差异。

表1 土壤干旱胁迫对高山嵩草叶片叶绿素含量的影响Table 1 Effects of soil drought stress on chlorophyll contents in leaves of K. pygmaea
2.2 稳态作用光强对高山嵩草PSII光化学效率的影响及土壤干旱胁迫的加剧
图1表明, 随稳态作用光强的升高,PSII最大效率(Fv'/Fm')、运行效率(Fq'/Fm')和效率因子(Fq'/Fv')均呈显著降低趋势;与对照组植物相比,干旱胁迫引起了Fv'/Fm'和Fq'/Fm'的极显著降低(P<0.01),而Fq'/Fv'在中等光强时有升高趋势。说明,Fv'/Fm'和Fq'/Fm'的变化易受强光胁迫的影响,且被土壤干旱所加强。
图2为800 μmol·m-2·s-1中等光强的测定结果,200 μmol·m-2·s-1低光强和1 500 μmol·m-2·s-1高光强时各荧光参数也呈现类似变化趋势。15 min的稳态作用光辐照期间,Fv'/Fm'和Fq'/Fm'较为稳定,但土壤干旱引起了其极显著降低(图2a和图2c)(P<0.01);Fq'/Fv'呈增高趋势,且略为干旱胁迫所促进(图2b)。显然,高山嵩草PSII光化学效率对光强有较快的响应和适应能力。

图1 不同稳态作用光下PSII最大效率(Fv'/Fm')、PSII效率因子(Fq'/Fv')和PSII运行效率(Fq'/Fm')的变化及对土壤干旱胁迫的响应Fig.1 Responses of PSII maximum efficiency(Fv'/Fm'), PSII efficiency factor(Fq'/Fv') and PSII operating efficiency(Fq'/Fm') to actinic light intensity and soil drought stress in leaves of K. pygmaea

图2 稳定作用光照期间PSII最大效率(Fv'/Fm')、PSII效率因子(Fq'/Fv')及PSII运行效率(Fq'/Fm')的变化及对土壤干旱胁迫的响应(800 μmol·m-2·s-1)Fig.2 PSII maximum efficiency (Fv'/Fm'),PSII efficiency factor (Fq'/Fv') and PSII operating efficiency (Fq'/Fm') during the illumination by actinic light of 800 μmol·m-2·s-1 and their responses to soil drought stress in leaves of K. pygmaea
2.3 PSII非光化学猝灭和开放比率对作用光强和干旱胁迫的响应
图3a表明,随稳态作用光强的增加,PSII非光化学猝灭系数(NPQ)显著增大;且土壤干旱胁迫下高山嵩草叶片的NPQ均显著和极显著高于对照(P< 0.05和P< 0.01)。15 min 800 μmol·m-2·s-1稳态作用光辐照期间,对照和土壤干旱组的NPQ均相对恒定(P< 0.01) (图3b)。说明,高山嵩草的PSII非光化学猝灭过程对光强波动和土壤干旱胁迫的敏感性都较高。

图3 稳态作用光强和土壤干旱胁迫对高山嵩草叶片PSII非光化学猝灭系数(NPQ)的影响Fig.3 Effects of actinic light and soil drought on PSII non-photochemical quenching coefficient (NPQ) in leaves of K. pygmaea
PSII反应中心的开放比率(qL)随稳态作用光强的增高而显著降低(图4a);除200 μmol·m-2·s-1低光强外,土壤干旱引起了qL的极显著和显著增高(P<0.01和P<0.05)。尽管差异并不都显著,随光照时间的延长,qL呈增加趋势,土壤干旱组的qL在5 min和15 min间具显著性差异(P< 0.05),而10 和15 min时对照组qL也显著高于5 min的(P<0.05) (图4b)。尽管qL在高光强趋于降低,但土壤干旱胁迫和持续光照后qL都有升高趋势,反映了高山嵩草对逆境胁迫的驯化适应过程。
2.4 PSII反应中心光化学效率的相对限制和交互效应分析
不同光强和辐照期间的分析表明,随稳态作用光强的增高,PSII反应中心光化学效率的相对限制(L(PFD))呈显著升高的趋势,且土壤干旱胁迫下的L(PFD)极显著高于对照组植物的(P< 0.01)(图5a);800 μmol·m-2·s-1光强下随辐照时间的延长,对照组L(PFD)在第10和15 min时显著低于5 min,而干旱组L(PFD)的降低无显著差异(图5b)。显然土壤干旱可加剧光合作用的光抑制程度,但L(PFD)随辐照时间的延长略有减轻趋势,可能缘于光合机构的驯化适应。

图4 稳态作用光强和土壤干旱胁迫对高山嵩草叶片PSII反应中心的开放比率(qL)的影响Fig.4 Effects of actinic light and soil drought on fraction of PSII centers that are “opened” (qL) in leaves of K. pygmaea
采用一般线性模型单变量方差分析法(general linear model univariate),开展了土壤干旱与强光间的交互作用的研究。结果表明:稳态作用光强下各荧光参数的η2值都较高,说明光强对总变异的贡献较大。强光和土壤干旱共存时,qL、NPQ和Fv'/Fm'的Sig.均较小(P< 0.01),表明两胁迫因子间存在着较强的交互作用(表2);而Fq'/Fm'和L(PFD)的Sig.较大(P> 0.05),意味着两因子间的交互作用不显著,且η2值都很低,对总变异的影响很小。除Fq'/Fv'外,各因素对总变异的贡献依次为:光强>土壤干旱>光强×土壤干旱。
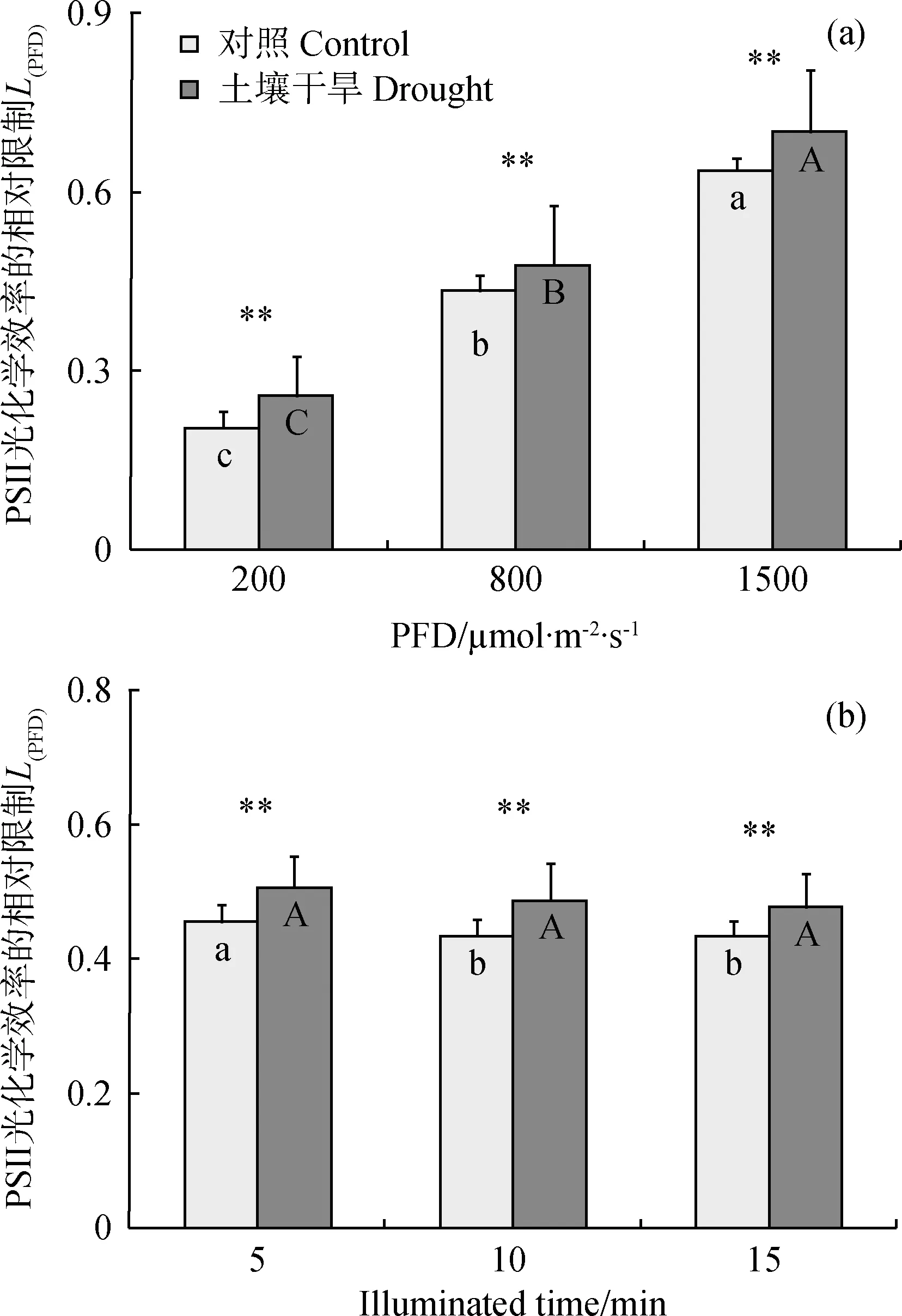
图5 高山嵩草叶片PSII反应中心光化学效率的相对限制(L(PFD))分析Fig.5 Relative limitation of PSII photochemical efficiency (L(PFD)) in leaves of K. pygmaea

表2 土壤干旱和光强处理对叶绿素荧光参数的交互效应分析Table 2 Analysis of inter-effectiveness of light and soil drought on chlorophyll fluorescence parameters
3 讨论与结论
光合作用是绿色植物和光合细菌在光的参与下积蓄能量和形成有机物的过程,植物光合机构就是推动光合作用过程的“生命发动机”[19],其反应中心的光化学效率易受诸多因素的影响,对外界环境因子的变化极为敏感[22-23]。叶绿素荧光图像分析有助于探测叶片光合功能的空间异质性(photosynthetic heterogeneity)问题[24],也适用于矮小植株和细小叶片的光合生理研究。本研究发现,高山嵩草在强光和土壤干旱胁迫下,PSII最大效率Fv'/Fm' 和PSII运行效率Fq'/Fm'都呈降低趋势;与此同时,PSII非光化学猝灭系数NPQ和光化学效率的相对限制L(PFD)则呈增加趋势。显然强光和土壤干旱的交互作用在导致PSII反应中心光化学效率限制加剧同时,引起了PSII反应中心非光化学能量耗散的加强,可降低激发能过剩对光合机构的潜在伤害,显示了高山嵩草光合机构的一种积极调解方式。
PSII反应中心的激发能利用取决于电子传递原初醌受体QA的氧化还原状态。基于Stern-Volmer途径的Lake模型引入了一个新荧光参数qL,定义为PSII反应中心的开放比率(fraction of PSII centers that are opened), 可反映QA的氧化还原状态,与PSII反应中心的开放呈线性关系[25]。随稳态作用光强的增高,qL呈显著降低趋势,但土壤干旱组的qL似呈现较小的降低程度,很可能干旱过程诱导了PSII反应中心构型的驯化适应,有利于QA氧化状态的维持[26]。强光和土壤干旱交互作用下NPQ呈升高趋势,此时植物体内基质类囊体膜上PSII反应中心多呈失活状态, 失活的反应中心与光捕获天线色素一起共同参与过剩激发能的耗散过程, 可保护功能反应中心免遭多余光能的进一步伤害[26-27]。
PSII光化学和非光化学能量耗散的调节能力取决于植物种的特性和环境的变化幅度[24]。15 min稳态作用光照期间Fv'/Fm' 和Fq'/Fm',以及NPQ都几乎无波动,说明高山嵩草的光合机构对外界环境变迁的适应能力较强且迅速。Demmig-Adams等[23]认为,PSII光化学效率的可逆性变化范围较广,从桉树冠层下藤本植物的数秒,到亚高山松树似乎贯穿整个冬季的持久可逆都有表现。PSII光化学效率的明显差异有赖于叶黄素循环的存在,也包含其他特性,如跨膜pH质子梯度、内囊体蛋白组成和磷酸化等[24]。本文研究发现,800 μmol·m-2·s-1稳态作用光辐照期间,PSII反应中心的开放比率qL略有增高趋势,L(PFD)也呈现非常弱的降低趋势,是强光塑造下光合机构光胁迫驯化(light-stress acclimation) 的反映。PSII反应中心的非辐射能量耗散是过剩激发能耗散的主要途径[18, 28],强光和干旱的交互作用下L(PFD)增大,NPQ也随之而升高,可祛除激发能的过量堆积,维持光合机构光化学反应的正常运行[14],是植物对逆境胁迫的一种积极响应途径。
逆境胁迫通常会引起叶绿素分子的降解[19, 29]。土壤干旱胁迫下高山嵩草Chla降低可能缘于活性氧分子积累对光合色素的破坏。由Chla/b比值的降低可知,Chla较集中的PSII反应中心蛋白复合体是土壤干旱胁迫的敏感部位,也可能是引起Fv'/Fm' 和Fq'/Fm'降低的原因;而失活反应中心的形成促进了非光化学能量耗散的升高[19]。
土壤干旱能加剧强光对PSII光化学量子效率和非光化学能量耗散的影响。有学者[30-31]曾综合分析了田间增强紫外线-B辐射(UV-B; 280~315 nm)的多年试验结果,发现在水分条件较充足的年份,人为增补UV-B辐射可引起作物产量的显著降低,但在水分亏却年份其影响就很不明显;认为干旱胁迫诱导的植物体紫外线吸收物质和比叶重(specific leaf weight)的增加有助于增强对UV-B辐射的抗性,是两胁迫因子UV-B辐射与水分亏却间发生交互效应(interaction effect)的结果。两种环境因子间存在交互作用的研究已有较多报道,如光照与温度[32]、光照与氮元素[33]、磷元素与土壤酸化[34]等。但很多研究仅限于对表观现象的分析,缺乏显著性的判断,也缺少因子相对贡献的数学界定。本文采用一般线性模型单变量方差分析法(general liner model univariation),探讨了土壤干旱与强光间的交互作用。结果表明,高山嵩草的Fq'/Fm'和L(PFD)在两因素间不存在交互效应,即强光引起的PSII实际光能捕获效率的降低和光化学效率的相对限制增加并没有因为干旱胁迫的存在而加剧;但NPQ和Fv'/Fm'则存在着两胁迫因子的交互效应。研究认为,Fv'/Fm'的波动受叶黄素循环中玉米黄质形成的影响[24],被用来评价非光化学猝灭波动对PSII运行效率变化的贡献[14],其参数1 -Fv'/Fm'也曾被用作表征非光化学能量耗散的强弱[14-15];可以确定,高山嵩草叶片的PSII非光化学能量耗散过程存在着两胁迫因子交互效应。显然,仅凭表象推断Fv'/Fm'和L(PFD)的变化被土壤干旱所加剧并不能确定两因子间交互效应的存在,必需经一般线性模型单变量方差分析的显著性检验和相对贡献分析才能界定。因子相对贡献的分析可知,光强是影响高山嵩草PSII反应中心光能利用和能量耗散的主要因素,且两因子的交互效应常小于单独土壤干旱胁迫的贡献。qL和Fq'/Fv'的η2值显示,尽管存在交互作用,但其值和与干旱胁迫对总变异的贡献很接近且η2值很小,变异主要缘于光强度的贡献。
高山嵩草为典型寒冷中生植物[1],植株低矮,株高仅1~3 cm;叶片呈线形,叶长约3 cm,宽约1 mm。高山嵩草的根系非常发达,主要分布在10 cm土层内,与土壤形成致密的草根盘结层[35-36],其物候特征和生理过程主要受制于对浅层土壤水分的可利用性[37]。尽管采用草皮层切割移位测定的方法解决了高山嵩草植株低矮、叶片纤细的光合生理研究瓶颈,无疑是测定方法的一个突破;但如何做到野外自然条件下的精细控制测量,依然有很多问题需要解决。
综上可知,土壤干旱胁迫可引起高山嵩草叶片PSII反应中心光化学效率相对限制L(PFD)的显著增加,进而导致PSII光化学效率的降低和非光化学能量耗散的加强。高山嵩草的光合机构存在着光胁迫驯化适应现象,土壤干旱胁迫下叶内活性氧分子的积累可加重光合色素的破坏,引起Chla含量和Chla/b比值的降低,形成诸多失活反应中心,并导致非光化学能量耗散的升高。PSII反应中心的非光化学猝灭存在着两胁迫因子的交互作用,可以缓解土壤干旱胁迫时PSII光化学效率降低后强光对光合机构的进一步伤害,是高山嵩草抵御多因素胁迫的一种适应策略。

