放牧对冷蒿根际土壤微生物群落结构多样性的影响
臧晓琳, 张洪芹, 王鑫朝, 马元丹, 宝音陶格涛, 张汝民, 高 岩*
(1. 浙江农林大学亚热带森林培育国家重点实验室, 浙江 临安 311300; 2. 内蒙古大学生命科学学院, 内蒙古 呼和浩特 010021)
近年来,由于全球气候变暖和人为因素的干扰,内蒙古草原出现大面积的退化,生物多样性和初级生产力大大下降,引起生态系统稳定性降低、服务功能衰退[1-3]。草场退化严重阻碍了内蒙古草原畜牧业的可持续发展,控制放牧量已成为当前退化草场恢复与重建的主要措施[4-5]。冷蒿(Artemisiafrigida)是退化草场的主要优势种,具有强烈的耐牧性,这与其自身的生物学特性[6]和根系代谢产物对根际微环境的调控有关[7]。
土壤微生物是土壤生态系统的重要组成部分,在土壤有机质的分解、养分循环与转化、土壤肥力演替等方面具有重要作用[8]。根际是植物根系、土壤、微生物形成的动态微域,根际微生物是土壤生态系统中最为活跃的构成因子之一,对植物的生长发育和环境适应产生重要的影响[9]。研究表明,冷蒿根际土壤微生物数量和酶活性普遍高于非根际土壤[10];草原典型植物根际土壤微生物群落多样性明显高于非根际[11],放牧是影响土壤微生物群落结构的重要因素[12]。牛磊等[13]采用磷脂脂肪酸分析法(phospholipid fatty acids,PLFAs)研究了我国西藏那曲地区不同放牧方式下高寒草甸土壤微生物群落结构的差异,认为休牧和轻度放牧均有利于高寒草甸健康稳定;Linda等[14]研究了不同扰动对土壤微生物的影响,发现土壤中细菌和真菌的PLFAs含量在局部扰动后显著下降主要是由土壤有机质含量减少引起的。研究放牧干扰下冷蒿根际土壤微生物特性差异对于提高土壤肥力、削弱荒漠化,合理和可持续地开发利用草地资源具有重要意义。
本研究拟采用PLFAs法,对锡林格勒草原不同放牧强度下冷蒿根际土壤理化性质、土壤微生物群落结构多样性进行研究,探讨放牧对冷蒿根际土壤微生物生物量、群落结构、具体微生物类群和应力比的影响,明确冷蒿根际土壤微生物群落结构多样性对放牧干扰的响应规律,为进一步探讨冷蒿耐牧性与土壤微生物多样性之间的关系奠定基础。研究结果不仅可为揭示冷蒿耐牧性提供土壤生态学方面的理论依据,还可为退化草原恢复、草原生物多样性保护提供科学依据。
1 材料与方法
1.1 研究地区概况
本试验依托内蒙古锡林浩特市毛登牧场(内蒙古大学草地生态学研究基地)进行,其地理位置为44°10′02.4″ N,116°28′56.8″ E,海拔1 160 m,属半干旱大陆性气候,冬季寒冷干燥,夏季在一定程度上受海洋季风气候影响。全年平均气温为-0.4°C,最冷月(1月)平均温度-22.3°C,最热月(7月)平均气温18.8°C,≥0°C年积温为2 410°C,≥10°C积温为1597.9°C,无霜期91 d,草场植物生长期为150 d左右。全年平均降水量为365.6 mm,集中于6-9月,占年降水量的80%左右,但年度间的变幅较大,多雨和少雨的年份降水量相差一倍以上。该地雨热同期,有利于植物的生长,土壤为栗钙土。本研究区域主要草原植物为羊草(Leymuschinensis)、糙隐子草(Cleistogenessquarrosa)、克氏针茅(S.krylovii)、大针茅(S.grandis)、防风(Saposhnikoviadivaricata)、冷蒿(A.frigida)、瓣蕊唐松草(Thalictrumpetaloideum)、阿尔泰狗哇花(Heteropappusaltaicus)等。
1.2 样地设置及土样采集
1.2.1试验设计 试验于2012年5月—2014年7月连续2年对草场进行不同放牧强度处理,每年放牧时间为5—9月。试验按照放牧强度设置不放牧为对照(CK),5月和7月每月21日放牧1 d为轻度放牧(Light grazing,LG),5—9月每月21日放牧1 d为重度放牧(Heavy grazing, HG),3个处理;受天气因素的影响,每次放牧时间延后。每个处理分别设置3个重复,每个小区面积为33.3 m×33.3 m。试验用羊为当年生乌珠穆沁羊Caprahircus‘Ujimqin’,各个放牧季节羊放牧率为6只·小区-1。
1.2.2土壤样品的采集与保存 土壤样品采集于2014年7月冷蒿生长高峰期,在每个小区采用5点取样法,随机选取4~5丛冷蒿,用铁铲以冷蒿株丛为中心,将冷蒿纯植株丛完整挖起(0~10 cm),轻轻抖动根系并去除粘附在根系上的较大颗粒土,作为冷蒿非根际土壤,采集粘附在根系表面的土壤作为冷蒿根际土壤。每个小区采集的土壤混合均匀作为该小区的土样。将土壤装入无菌封口塑料袋,带回实验室。将土样分成2份,一份放入-40°C保存,用于微生物磷脂脂肪酸分析,另一份风干过2 mm筛,用于测定土壤理化性质。
1.3 测定方法
1.3.1磷脂脂肪酸的分离与气相色谱检测 采用PLFAs生物标记法进行土壤微生物群落结构分析。PLFA的提取过程和分析参考吴则焰等[15]方法。具体操作步骤为:称量4 g新鲜土样,将其与20 mL的0.2 mol·L-1的KOH甲醇溶液加到50 mL离心管中,混合均匀,37°C下温育1 h(磷脂脂肪酸释放并甲酯化),样品每10 min涡旋一次;加入4 mL 1.0 mol·L-1的醋酸溶液中和pH值,充分摇匀,加入10 mL正己烷,震荡3~5 min,使PLFAs转到有机相中;2 000 r·min-1离心10 min后,将上层正己烷转到干净试管中,在N2气流下挥发掉溶剂,得到土壤微生物PLFA样本。
将PLFA充分溶解在0.5 mL内含十九烷酸甲酯(19:0)(作为内标,浓度为30 μg·mL-1)的正己烷溶液中,取1.0 μL进样,进行GC-MC分析。仪器及参数设置条件:GC(7890A,Agilent,Wilmington,USA)条件:色谱柱HP-5MS(30 m×250 μm×0.25 μm);进样量为1.0 μL,不分流进样,进样口温度为280°C;载气气体为氦气,流速0.8 mL·min-1;柱箱程序为70°C起始,保持2 min,以15°C·min-1升温至190℃,保持5 min,再以10°C·min-1升温至240°C,保持5 min。MS(5975C型,Aligent,Wilmington,USA)条件:电离方式EI;电子能量70eV;离子源温度230°C;四级杆温度150℃;传输线温度250°C;扫描质量范围28~450。采用NIST 2008谱图库兼顾色谱保留时间定性。
1.3.2磷脂脂肪酸的定性与定量 定性分析是采用GC-MS的方法测定甲基化后的磷脂脂肪酸甲酯,利用气质联用仪计算的NIST 2008谱库,结合计算机检索和手工检索,根据气相色谱(GC)的保留时间和质谱(MS)谱图,以样品中脂肪酸与外标中脂肪酸标样的气相色谱保留时间和质谱谱图的标准谱库相比较,对磷脂脂肪酸甲酯进行定性分析。定量分析是通过内标法,根据样品气相色谱的各脂肪酸甲酯峰面积换算每种脂肪酸得到其含量,含量用μg.g-1表示。
1.3.3土壤微生物的各类群及标记 不同菌群的PLFAs特征谱图不同,在高度专一性基础上具有多样性,从土壤中直接提取磷脂类化合物可以准确指示微生物群落结构及生物量[16]。在本研究中,将PLFAs分成6个功能组,用于描述土壤微生物群落的不同组成部分,包括细菌、革兰氏阳性菌(G+)、革兰氏阴性菌(G-)、放线菌(Act)、腐生真菌(fungi)和丛枝菌根真菌(AMF)(表1)[17]。PLFA的命名采用X:YωZ(c/t),其中X为主链碳原子总数;Y为不饱和烯键个数;ω代表甲基末端;Z为烯键或环丙基的位序;前缀i(iso)和a(anteiso)分别表示反异丙基和异丙基;cy和Me分别代表环丙基和甲基分支脂肪酸,后缀c和t分别表示双键为顺式和反式构型[16]。

表1 微生物生物量的脂肪酸的估算Table 1 PLFA calculating for soil microbial biomass
微生物总PLFAs用所有C14~C20的加和表示,土壤微生物群落结构随放牧强度的变化通过计算PLFAs的比率,包括阳性菌/阴性菌(G+/ G-),真菌/细菌(F/B),另外cy/pre比值(CYC)—(cy17:0+cy19:0)/(16:1ω7c+18:1ω7c)用来表示潜在的细菌压力[18]。
1.3.4土壤理化性质测定 测定参照鲁如坤的土壤农化分析方法[19]进行。有机质(Organic matter,OM)采用重铬酸钾容量法;全氮(Total nitrogen,TN)采用半微量凯氏定氮法;碱解氮(Hydrolysis nitrogen,HN)采用碱解扩散法;全磷(Total phosphorus,TP)采用NaOH碱溶一钼锑抗比色法;速效磷(Available phosphorus,AP)采用碳酸氢钠浸提钼锑抗比色法;全钾(Total potassium,TK)采用NaOH碱溶-火焰光度法;速效钾(Available potassium,AK)采用乙酸氨浸提-火焰光度法;pH值采用酸度计法,土壤悬液为水土比为m(水)∶m(土)=5∶1。
1.4 数据统计分析
将所有数据均分为两组进行统计分析:组1为冷蒿根际土壤,组2为非根际土壤。每一组的数据利用Origin 8软件(美国Origin Lab公司)进行统计分析和作图。统计方法采用One-Way ANOVA进行检验,并进行Fisher LSD多重比较(P<0.05)。各变量数值表示为平均值±标准误差。采用独立样本t检验进行冷蒿根际土壤和非根际土壤与对照组之间的差异分析,采用Two-Way ANOVA进行评估土壤类型×放牧处理相互作用的影响。采用SPSS 19.0统计软件的Pearson′s相关分析,*表示在α=0.05水平上差异达到显著,**表示在α=0.01水平上差异达到极显著,并用SPSS 19.0进行主成分分析[20]。
2 结果与分析
2.1 放牧对冷蒿根际土壤化学性质的影响
冷蒿根际土壤和非根际土壤中全氮、碱解氮、速效磷、速效钾和pH具有极显著差异,有机质差异显著,全磷和全钾差异不显著(表2);放牧对两种土壤中的有机质、全磷、碱解氮、速效钾和pH影响具有极显著差异,全氮和全钾影响具有显著差异,对速效磷的影响不显著。轻度放牧,冷蒿根际土壤与对照相比,速效磷和速效钾无显著变化,有机质、全氮、全磷、全钾和碱解氮均显著增加,pH显著下降;重度放牧,除全钾外,有机质、全氮、全磷、碱解氮、速效磷和速效钾均显著升高,与对照相比分别增加20.0%,29.1%,17.7%,13.0%,3.4% 和6.7%。非根际土壤放牧处理后,速效磷和速效钾显著增加,pH显著下降,但仍高于冷蒿根际土壤;相同放牧处理下冷蒿根际土壤中有机质、全氮、碱解氮、速效磷和速效钾的养分含量均显著高于非根际土壤。说明冷蒿能够显著降低土壤的pH,增加土壤中速效磷、速效钾、碱解氮、有机质和全氮等组分,有效地改善土壤养分状况,调节放牧对土壤的干扰。
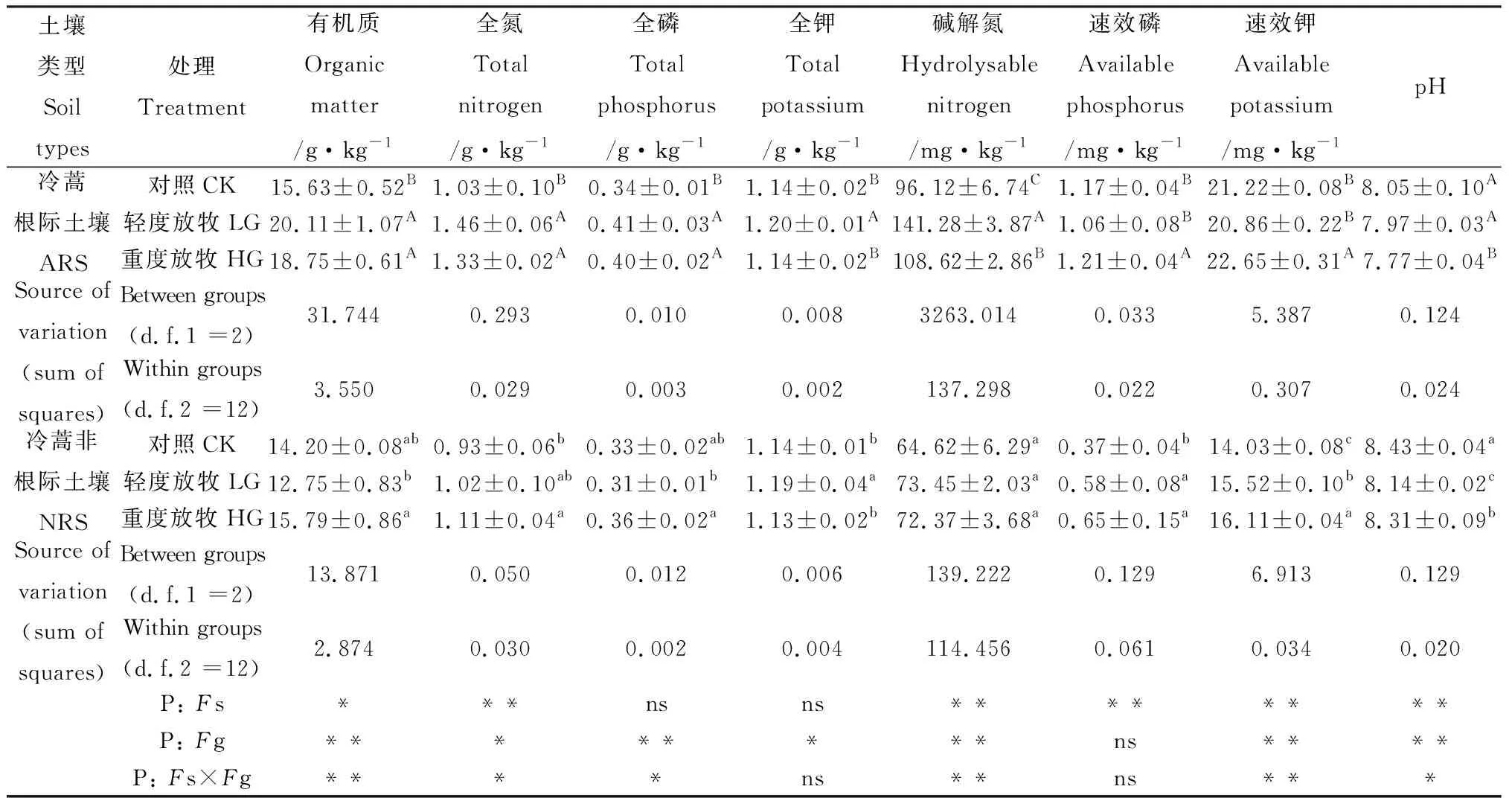
表2 不同放牧强度下土壤化学性质Table 2 The soil chemical properties under different grazing intensities
注:每个值均为平均值±标准误(n=5)。根据LSD测验(P<0.05),不同大写字母表示冷蒿根际土壤差异显著,不同小写字母表示冷蒿非根际土壤差异显著。Fs:土壤类型的影响;Fg:放牧的影响;Fs ×Fg:土壤类型与放牧的交互作用;*:P<0.05;**:P<0.01;***:P<0.001; ns:不显著;LG:轻度放牧;HG:重度放牧;ARS:冷蒿根际土壤;NRS,非根际土壤
Note: Each value is the mean ± standard error (n=5). Different uppercase letters denote statistically significant differences of rhizosphere soil ofArtemisiafrigida, and different lowercase letters denote statistically significant differences of non-rhizosphere soil ofA.frigidaaccording to LSD test (P<0.05).Fs: soil types effects;Fg: grazing effects;Fs ×Fg: the interactive effect of soil types and grazing treatment; *:P<0.05; **:P<0.01; ns: non-significant; LG: Light grazing; HG: Heavy grazing; ARS: rhizosphere soil ofA.frigida; NRS: non-rhizosphere soil ofA.frigida
2.2 不同放牧强度下冷蒿根际土壤微生物的PLFA分析
2.2.1土壤微生物的PLFA种类及含量 对6种土壤样地中检测到的磷脂脂肪酸种类和含量进行统计,共得到24种PLFA生物标记(表3)。从表中可以看出,冷蒿根际土壤和非根际土壤的磷脂脂肪酸种类及含量差异较大,有些PLFA生物标记只在冷蒿根际土壤中有分布,为不完全分布,如i19:1ω7c,20:1ω9c,20:4ω6;有些PLFA生物标记在冷蒿根际和非根际土壤中均有分布,属于完全分布,如i16:0,18:18t等。

表3 不同放牧强度下土壤微生物主要磷脂脂肪酸构成特征(平均值±标准误)Table 3 Characteristics of main PLFAs of soil microorganisms under different grazing intensities (Mean ±SE)
注: i,a,cy 和 Me 分别表示异丙基、反异丙基、环丙基和甲基分支脂肪酸,ω 后的数字表示出现双键的碳原子位序,c 和 t 分别表示该双键为顺式构型和反式构型
Note: i,a,cy,and Me denote an isopropyl group,anti-isopropyl,cyclopropyl and methyl-branched fatty acids,respectively,and the number behind ω indicate an occurrence sequence of carbon atoms of double bond, c and t denote a cis configuration and a trans configuration for a double bond
结合图1可知,冷蒿根际土壤PLFA生物标记种类和总量显著高于非根际土壤,LG-ARS最高,PLFA生物标记共23种,总量为(599.38±93.34) μg·g-1,CK-ARS和HG-ARS土壤PLFA标记种类分别为23种和22种,总量分别为(471.09±42.26) μg·g-1和(575.92±83.87) μg·g-1,放牧对冷蒿根际土壤微生物总量影响不明显;而CK-NRS土壤PLFA标记种类和总量最低,仅14种,总生物量为(178.21±25.15) μg·g-1,放牧后非根际土壤PLFA生物标记总量显著增加,轻度放牧后最高,PLFA生物标记种类为20种,总量为(424.03±30.09) μg·g-1。可见冷蒿能够显著增加土壤微生物种类和生物量,并在一定程度上削弱了放牧干扰。
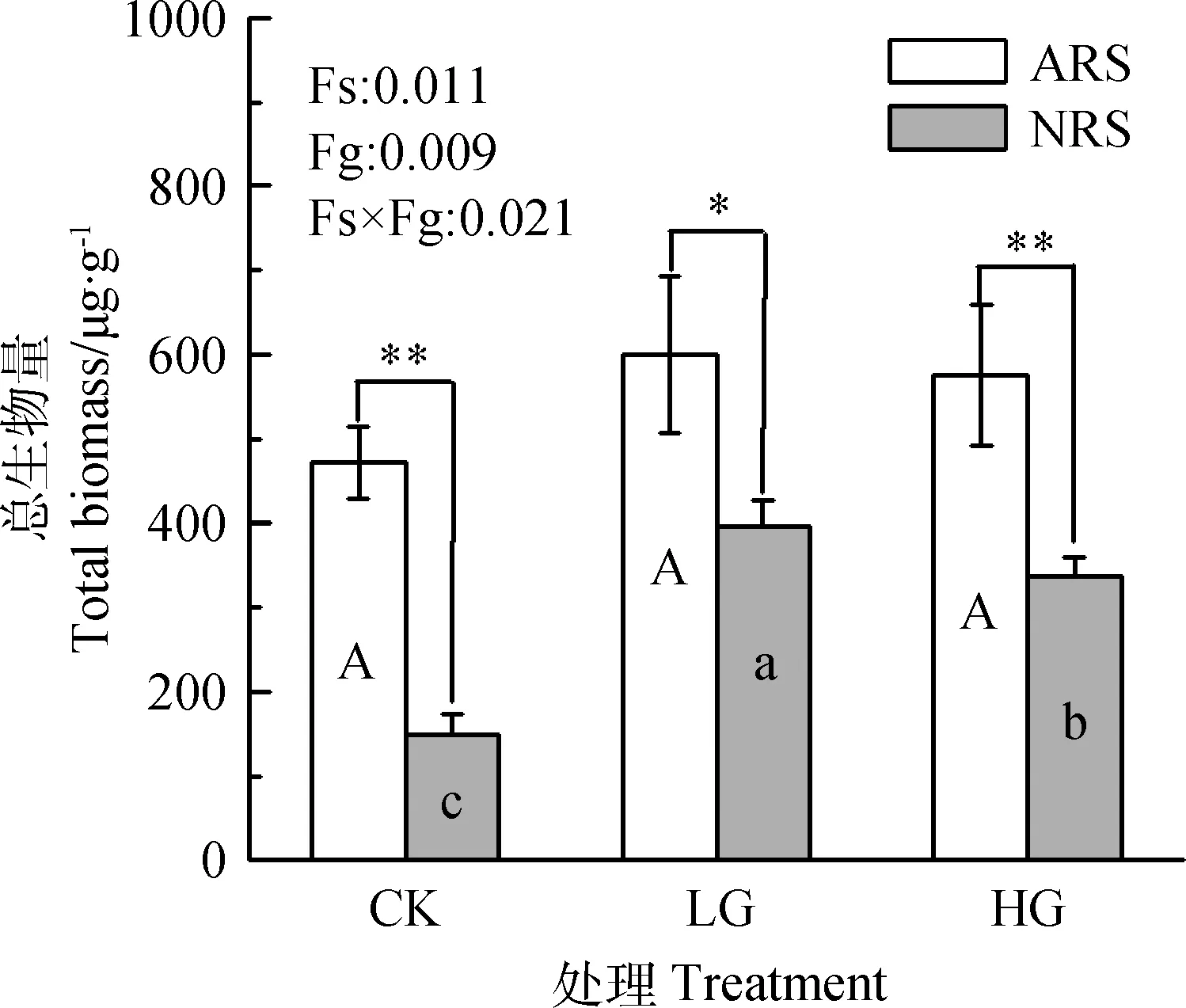
图1 不同放牧强度下土壤微生物总生物量Fig.1 Total biomass of different grazing degree
2.2.2土壤优势微生物类群PLFA分布 6种样地土壤中含量均较高的PLFA生物标记是i16:0,18:18t,18:1ω7c和10Me17:0,表明其在不同处理的土壤中起主要作用,且在冷蒿根际土壤分布量明显高于非根际土壤。从PLFA生物标记的变化看,CK-ARS土壤中20:1ω9c,18:18t,i16:0和10Me17:0这4种PLFA占总脂肪酸含量的60.67%;LG-ARS土壤中,含量位于前4位的分别是i16:0,20:1ω9c,18:18t和18:1ω7c,占总脂肪酸含量的56.41%;以i16:0,20:4ω6,18:1ω7c和18:18t为主体的4种脂肪酸含量在HG-ARS土壤中占59.51%;CK-NRS土壤中含量较高的为i16:0,i15:0,18:18t和18:1ω7c,占总量的60.04%;LG-NRS土壤中i19:0,i16:0,10Me17:0和18:1ω7c占脂肪酸总量的51.19%;i17:0,20:0,i16:0和10Me17:0为HG-NRS土壤中排名前4位的脂肪酸,占总量的54.47%。总之,不同处理的土壤类型中,含量较高的PLFA生物标记种类基本相同,以i16:0,18:18t,18:1ω7c和10Me17:0为主。
2.3 不同放牧强度下冷蒿根际土壤特征微生物类群的PLFA分布
PLFA生物标记名i16:0,18:2ω6,9和10Me17:0分别是细菌、真菌和放线菌PLFA的主要生物标记之一。由表3可知,3种特征微生物相对生物量在6类处理样地土壤中分布不同,细菌分布量最大,其次是真菌,放线菌分布量最小。分别计算细菌、真菌、放线菌、革兰氏阳性菌、革兰氏阴性菌和菌根真菌的PLFAs含量如图2所示。在此6类特征微生物中,细菌PLFA含量最高,冷蒿根际土壤中细菌PLFAs含量在249.44~389.36 μg·g-1之间变化,显著高于非根际土壤,放牧处理后两类土壤的细菌含量均增加,LG-ARS土壤最高(389.36 μg·g-1),CK-NRS土壤最低(119.59 μg·g-1),相当于LG-ARS的30.71%;放线菌含量大小为LG-ARS>HG-ARS>CK-ARS>LG-NRS>HG-NRS>CK-NRS;真菌含量大小排序为HG-ARS >LG-ARS> CK-ARS>LG-NRS> CK-NRS> HG-NRS;不同放牧处理下,革兰氏阳性菌的PLFA含量变化趋势与细菌相似,含量最高的是LG-ARS(204.59μg·g-1),CK-NRS土壤最低(69.58 μg·g-1),相当于LG-ARS的34.01%;革兰氏阴性菌含量最高的是HG-ARS(80.67 μg·g-1),冷蒿根际土壤中阴性菌含量随放牧强度增加而增加,CK-NRS含量最低(24.01 μg·g-1),放牧后非根际土壤中阴性菌含量先增加后减少,轻度放牧后虽最高但仍低于冷蒿根际土壤;两类土壤中菌根真菌的PLFA含量在放牧干扰下变化均不显著,但冷蒿根际土壤显著高于非根际土壤,其中LG-ARS土壤含量最高(15.88 μg·g-1),LG-NRS含量最低(3.93 μg·g-1),并且非根际土壤中菌根真菌含量呈下降趋势。
2.4 不同放牧强度下冷蒿根际土壤主要微生物类群的比率
由图3所示,冷蒿土壤的G+/G-值在1.83~3.32之间,LG-ARS最高,LG-NRS最低,方差分析显示,在不同土壤类型以及不同放牧强度处理之间差异均显著。F/B值很小,冷蒿根际土壤在0.05~0.07间变化,非根际土壤变化范围为0.02~0.05,统计分析表明,重度放牧后冷蒿根际土壤显著升高,而非根际土壤显著下降,且根际土壤的F/B值显著高于非根际土壤。CYC值同样很小,统计分析显示,随放牧程度加强,冷蒿根际土壤CYC值显著下降,变化范围在0.09~0.26间,非根际土壤CYC值显著升高,在0.28~0.78之间变化,重度放牧后冷蒿根际土壤CYC值低于非根际土壤87.83%,差异达显著水平。
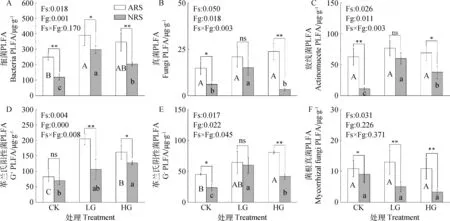
图2 不同放牧强度下细菌、真菌、放线菌、革兰氏阳性菌、革兰氏阴性菌和菌根真菌含量Fig.2 The amounts of PLFA for bacteria, fungi, Gram-negative(G+)、Gram-positive(G-)and Arbuscular mycorrhizae fungi (AMF) in soil under different grazing intensities

图3 磷脂脂肪酸(PLFA)生物量比值Fig.3 Ratios of phospholipid fatty acid (PLFA) concentration
2.5 不同放牧强度下冷蒿根际土壤微生物群落主成分分析
由不同放牧强度下土壤微生物群落主成分分析(图4)表明,与土壤微生物PLFA群落多样性相关的两个主成分累计贡献率达到66.03%,其中,第1主成分(PC1)和第2主成分(PC2)分别解释变量方差的46.91%和19.12%,对第1主成分起主要作用的磷脂脂肪酸为16:1w5c,18:2ω6,9,10Me16:0,i18:0,cy19:0,16:1w7c,18:18t,而对第2主成分起主要作用的脂肪酸为cy17:0,20:0w15:00,CK-ARS,LG-ARS,HG-ARS和CK-NRS土壤位于主成分1的正端,数值均大于0.6,且分布集中,而LG-NRS和HG-NRS位于主成分1的0值附近,冷蒿根际土壤样点与非冷蒿根际土壤样点在坐标轴上明显区分开,第1主成分反映了冷蒿和非根际土壤类型微生物群落的差异情况;CK-NRS,LG-NRS,HG-NRS和HG-ARS土壤均位于主成分2的正端,放牧处理组与未放牧对照组在坐标轴上明显区分开,而CK-ARS和LG-ARS位于其负端,区分不明显,第2主成分反映了不同放牧强度特别是重度放牧土壤微生物群落的差异情况。
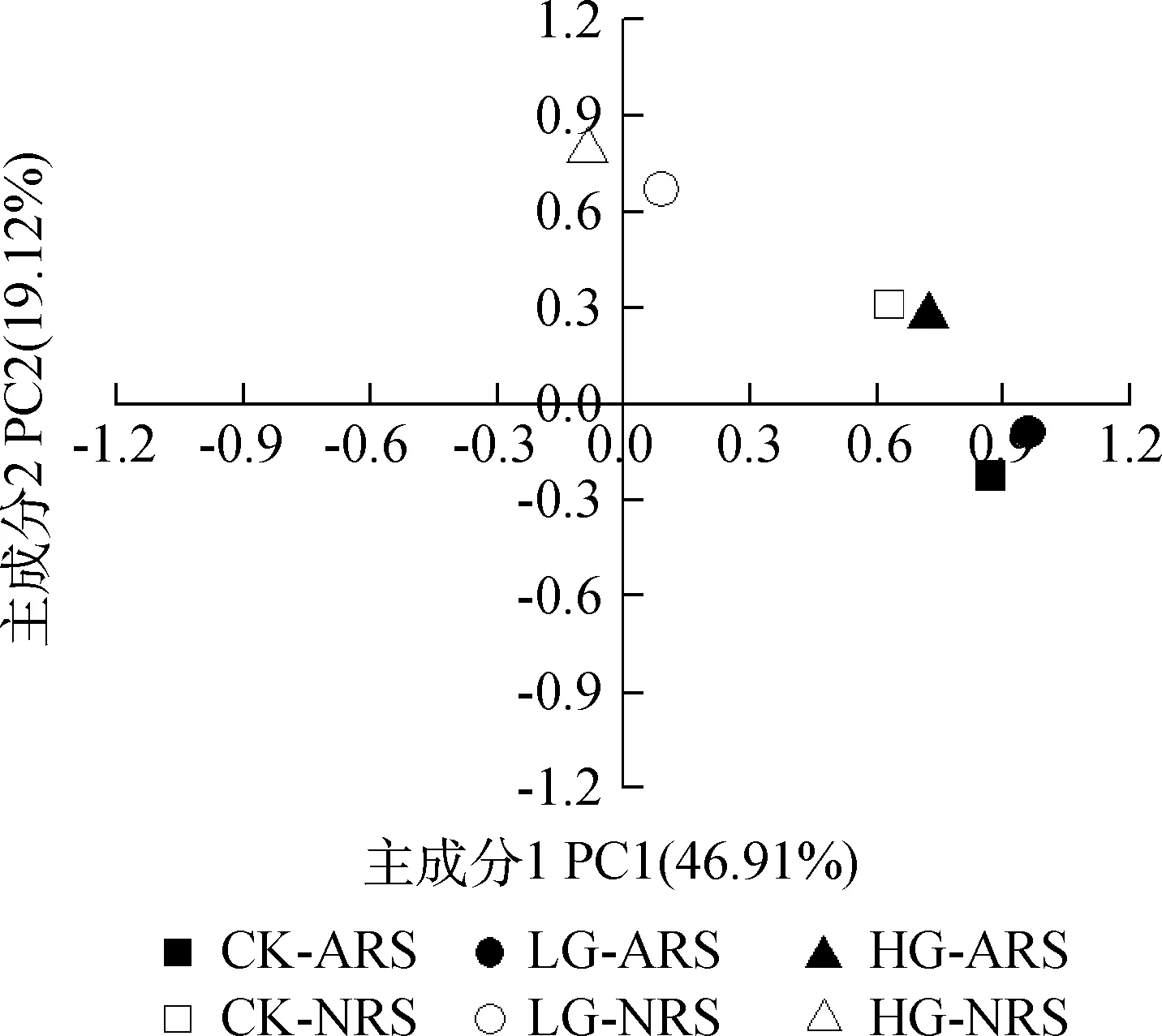
图4 不同放牧强度下土壤微生物群落主成分分析Fig.4 Principal components analysis of different microbial group’s PLFA in soil under different grazing intensities
2.6 土壤微生物主要类群PLFAs与土壤养分的相关性
通过对各菌群PLFAs含量与土壤养分相关性分析表明(表3),不同微生物类群受到的环境影响因子不同,不同土壤类型中相同微生物类群受到的环境影响因子也不同。其中真菌、放线菌和菌根真菌与土壤pH值呈现负相关关系,革兰氏阴性菌与土壤pH值显著正相关;有机质、全氮、全磷、全钾等土壤养分与土壤微生物总量、细菌、真菌和放线菌的生物量均呈正相关,但冷蒿根际土壤中相关性不显著,而非根际土壤中相关性显著甚至极显著,表明有机质、全氮、全磷和全钾是影响土壤微生物的重要环境因子,但在冷蒿根际土壤中这些养分不作为微生物生长的限制因子。
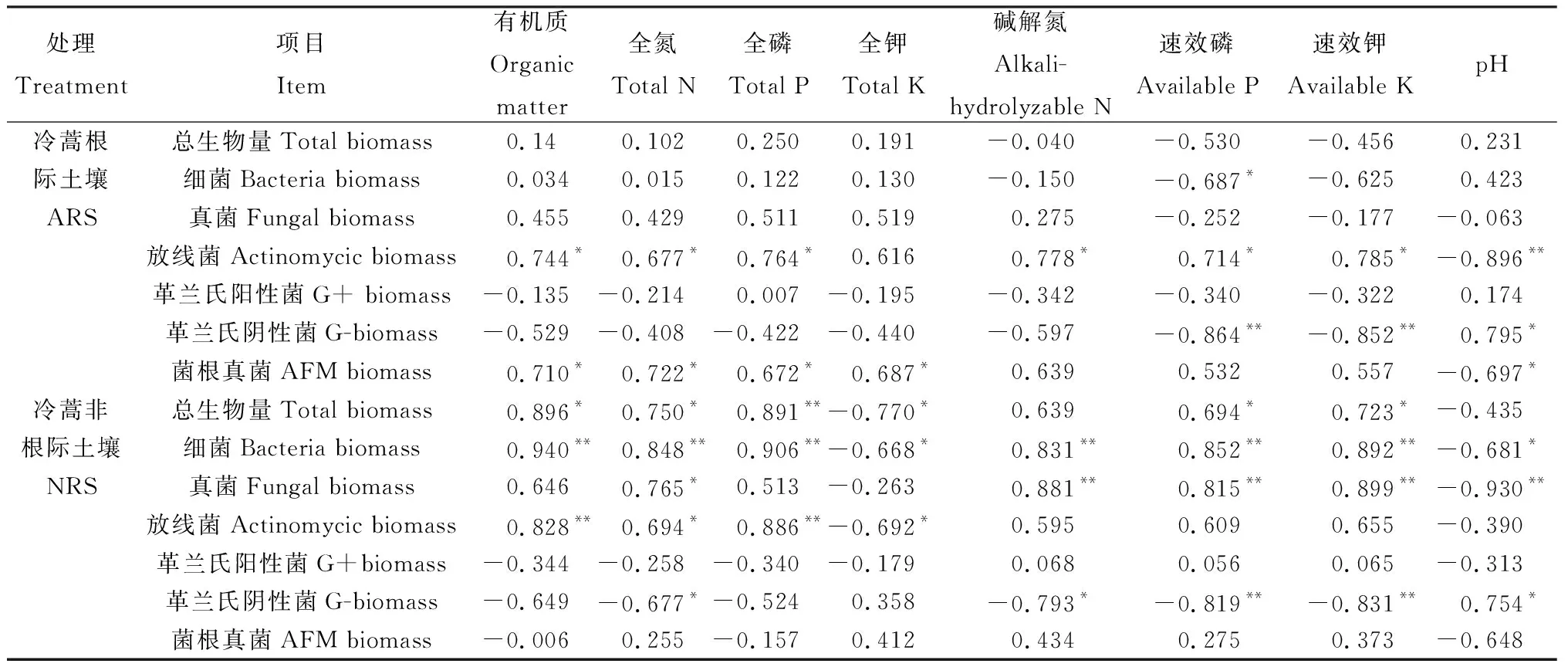
表4 微生物量与土壤养分间的Pearson′s相关性分析Table 4 Pearson′s correlation analysis between the quantity of soil microbial biomass and soil nutrients
注:*表示差异显著P<0.05,**表示差异极显著P<0.01
Note: *indicate significant difference at the 0.05 level , **indicate significant difference at the 0.01 level
3 讨论
3.1 放牧和冷蒿对根际土壤养分的影响
放牧是草地利用方式之一,其强度大小可以影响到土壤养分的含量。作为土壤质量的重要指标,土壤有机质含量和质量显著影响土壤理化性质。放牧后冷蒿根际土壤和非根际土壤中有机质含量均增加,说明放牧增加了土壤中有机质的输入。放牧过程中家畜践踏可增强凋落物的破碎性进而加快分解,增加碳和养分向地下转化,Reeder[21]、安慧[22]等也有类似发现。本试验表明冷蒿根际土壤有机质含量显著高于非根际土壤,说明冷蒿根际土壤肥力高于非根际。放牧中随牧压的增大,冷蒿的生物量、盖度及根茎比增加[23],其形成的盘状根系不断扩大[23-24],同时分泌大量有机酸等物质[25],使根际土壤中有机质含量显著高于非根际土壤。
土壤养分中氮、磷、钾元素是初级生产力的首要限制资源,氮是组成蛋白质、遗传物质以及叶绿素等的重要元素;磷参与植物体部分化合物的组成及调节光合、呼吸等生理作用;钾可促进植物中某些酶的活化并能够增强光合作用,促进糖代谢等,是植物生长发育的必需元素。本研究表明,放牧后冷蒿根际土壤和非根际土壤全氮、全磷、碱解氮、速效磷和速效钾含量均升高,说明放牧有助于土壤养分含量的提高;冷蒿根际土壤中碱解氮、速效磷和速效钾含量显著高于非根际土壤,说明冷蒿根际土壤可被利用养分的生物有效性高,供应状况优良;冷蒿根际土壤的pH显著低于非根际土壤,根际土壤的弱碱性更利于活化土壤中K+、Ga2+、Mg2+、Fe2+等,提高了土壤养分有效性。杨阳等[26]发现荒漠草原植物可以通过降低根际土壤pH值提高根际土壤养分含量,Colla等[27]研究发现西瓜根系分泌物中的有机酸促进了植物体对P、Fe、Mn等元素的吸收。冷蒿能够通过根系分泌酸性磷酸酶酸化根际[7],降低土壤pH,促进碱解氮、速效磷速效钾等物质形成[7],提高土壤各养分含量。罗世琼等[28]对野生黄花蒿根际和非根际土壤养分的研究也表明,黄花蒿根际土壤的有机质、碱解氮、有效磷和速效钾含量等都显著高于非根际土壤,而pH显著低于非根际土壤,认为根际土壤环境及养分优良,利于植物生长。
3.2 冷蒿和放牧强度对土壤微生物群落组成的影响
微生物细胞膜的PLFAs组成因微生物种类不同而存在差异,因此PLFAs组成可以指示其种群变化。本研究的PLFAs标记显示,放牧后根际土壤和非根际土壤中各类磷脂脂肪酸含量(总PLFAs、细菌PLFAs、真菌PLFAs、放线菌PLFAs、G+PLFAs、G-PLFAs和菌根真菌PLFAs)均升高,说明放牧改变了土壤微生物组成[29];冷蒿根际土壤的各类PLFAs含量均高于非根际土壤(图2-F),说明冷蒿根际土壤微生物种类丰富、数量较高、群落结构稳定。微生物群落受土壤微环境的影响,与土壤特性间具有很强的相关性[30-31],其中土壤有机碳、氮是微生物生物量和多样性的主要影响因子[32]。相关分析表明,土壤有机质、全氮和全磷与土壤微生物磷脂脂肪酸总量及细菌、真菌、放线菌三大微生物类群脂肪酸含量均呈正相关,说明冷蒿根际丰富的营养物质资源可为微生物生长提供大量的碳源、矿物质和能源,促进其生长、繁殖,提高其生物有效性。关于羊草、大针茅和冷蒿等内蒙古草原典型植被对根际土壤微生物影响的研究表明,根际土壤中细菌及真菌在数量和群落结构上显著优于非根际土壤,且植物种类对根际微生物数量有显著影响[11];邱权等[33]等对4种人工灌木丛根际和非根际土壤特性的综合比较指出,土壤微生物数量总体呈现出根际高于非根际的规律;罗世琼等[28]发现野生黄花蒿根际土壤微生物PLFAs总量、细菌、真菌和放线菌等PLFAs含量总体上显著高于非根际土壤,本研究结果与前人结果一致。通过主成分分析表明,土壤微生物群落结构的差异主要由冷蒿引起,放牧影响相对较小。说明冷蒿能够削弱放牧干扰,提高土壤养分含量、丰富微生物组成,在一定程度上维持土壤生态平衡。
3.3 放牧对冷蒿根际土壤主要微生物菌群分布的影响
对不同放牧强度下冷蒿根际土壤和非根际土壤的革兰氏阳性菌/阴性菌(G+/G-)、真菌/细菌(F/B)和CYC值进行分析后发现,放牧处理后,冷蒿显著影响土壤中G+和G-的组成(图3-a),特别是重度放牧后冷蒿根际土壤中G-的生物量最高(图2-E)。因为阴性菌倾向于利用根际来源的碳,大量的阴性菌标志着土壤从贫营养到富营养的转变,推测放牧处理刺激了冷蒿根系生长,根系分泌大量酸性物质有利于土壤营养物质的转化;重度放牧后冷蒿根际土壤真菌数量及F/B值均显著高于非根际(图3-b),F/B越大则土壤生态系统的效率越高、可持续性越强[34],说明冷蒿根际土壤生态环境优于非根际,Sara等[35]对草场恢复中土壤微生物群落的研究发现草场恢复后F/B值增加,土壤生态系统稳定性增强;随放牧强度增加,冷蒿根际土壤中CYC值显著下降,重度放牧后冷蒿根际土壤的CYC值极显著低于非根际土壤(图3-c),有研究认为CYC值越大说明土壤养分资源越匮乏、土壤环境越恶劣[36],表明冷蒿能够削弱放牧对土壤微生态环境的破坏。张莉等[37]研究连续围封对高寒草甸土壤微生物群落结构的影响时发现,与围封处理相比,放牧后的CYC值较低,认为连续围封不利于生态系统稳定性,并推测是由地上植被种类改变所致。总之,放牧破坏了土壤生态系统稳定性,而冷蒿根际的土壤环境明显优于非根际土壤,推测以“纯植株丛”形式生长的冷蒿,形成盘状根系,在这个特殊的根系微域中,一方面营造出较稳定的土壤微生态环境,更加适合微生物的生长、繁殖,同时丰富的微生物又可以增加根际土壤养料转化,保障冷蒿生长发育,使得冷蒿在牧压增大的情况下仍能具有相对良好的生产力,具有较强耐牧性。
4 结论
放牧能够丰富土壤中有机质、全氮、全磷、碱解氮、速效磷和速效钾等养分含量,且各养分含量均表现为冷蒿根际土壤高于非根际;放牧后土壤的各类磷脂脂肪酸含量(总PLFAs、细菌PLFAs、真菌PLFAs、放线菌PLFAs、G+PLFAs、G-PLFAs和菌根真菌PLFAs)均升高,且冷蒿根际土壤各PLFAs含量均显著高于非根际。表明根际土壤丰富的营养物质资源及较高的微生物群落结构多样性能够促进冷蒿生长,冷蒿是引起土壤微生物群落结构差异的主要因子,放牧影响相对较小;并且冷蒿的存在,在一定程度上削减了放牧的影响,成为草场退化的阻击者。

