合并2型糖尿病乳腺癌患者肿瘤组织中FOXC2的表达情况及其临床意义
李大伟
(海南医学院附属医院 内分泌科,海南 海口 571200)
合并2型糖尿病乳腺癌患者肿瘤组织中FOXC2的表达情况及其临床意义
李大伟
(海南医学院附属医院 内分泌科,海南 海口 571200)
目的:探讨FOXC2在合并2型糖尿病乳腺癌患者肿瘤组织中的表达情况,并分析其临床意义。方法:选取2013年1月至2015年12月77例合并2型糖尿病乳腺癌患者为实验组,另取80例非2型糖尿病乳腺癌患者作为对照组。手术切取患者肿瘤组织,对一部分标本提取组织RNA,利用反转录-聚合酶链反应(reverse transcription PCR,RT- PCR)技术检测两组患者癌组织中FOXC2 mRNA表达水平;对另一部分标本石蜡切片行ER、PR、Her- 2、FOXC2免疫组化检测,对比免疫组化FOXC2表达结果与RT- PCR结果的一致性。比较两组乳腺癌分子分型构成比的差异,并做FOXC2表达与三阴乳腺癌(基底细胞样型)的相关性分析。通过Kaplan Meier- plotter法分析FOXC2与乳腺癌患者预后的相关性。结果:RT- PCR结果显示,实验组癌组织FOXC2 mRNA表达水平显著高于对照组(P<0.05)。免疫组化的结果显示,FOXC2的表达水平与RT- PCR结果一致。实验组luminal A型占比为22.1%(17/77),luminal B型为18.2%(14/77),Her- 2过表达型为24.7%(19/77),基底细胞样型为35.1%(27/77);对照组luminal A型占比为37.5%(30/80),luminal B型为30.0%(24/80),Her- 2过表达型为16.3%(13/80),基底细胞样型为16.3%(13/80)。两组患者luminal A型、luminal B型及基底细胞样型占比差异有统计学意义(P<0.05)。两组患者FOXC2 mRNA表达水平与患者基底细胞样型表型呈显著正相关性(P<0.05)。Kaplan Meier- plotter结果显示,高表达FOXC2乳腺癌患者预后差。结论:FOXC2是2型糖尿病致恶性肿瘤的潜在关键因子。
乳腺癌; 2型糖尿病; FOXC2; 乳腺癌分子分型; 预后
随着人类生活方式的改变,2型糖尿病发病率出现逐年上升的趋势,世界卫生组织预计2030年全球2型糖尿病患者将达到5.52亿,严重威胁人类健康安全[1]。近年来许多研究显示,2型糖尿病人群中某些肿瘤发生率明显提高,其中就包括乳腺癌,其相对危险度是非糖尿病患者的1.27倍(相对危险度RR=1.27)[2],但其机制尚未完全阐明。FOXC2是人类forkhead家族的转录因子之一,作为控制能量代谢的关键基因,其可诱导棕色脂肪分化,提高胰岛素敏感性,在对抗糖尿病的发生发展起着重要作用[3- 4];但新近的研究[5- 8]显示,FOXC2在多种恶性肿瘤中表达异常,且促进胃癌和结直肠癌细胞EMT的过程,影响宫颈癌和乳腺癌组织的血管的生成。以此为依据,本研究拟探究FOXC2在合并2型糖尿病乳腺癌患者中的表达情况及其与乳腺癌恶性程度和患者预后的关系,揭示其可能的临床意义,以期指导临床工作。
1 资料与方法
1.1 一般资料
收集本院2013年1月至2015年12月77例合并2型糖尿病乳腺癌患者肿瘤组织标本为实验组,以同期80例非2型糖尿病乳腺癌患者肿瘤组织标本作为对照组。手术切取的肿瘤组织一部分置于冻存管中,液氮下保存,用于RT- PCR实验检测FOXC2 mRNA表达;另一部分送至病理科做石蜡切片用于免疫组化检测。患者基本情况见表1,两组患者年龄、男女比例及病程差异均无统计学意义(P>0.05)。
表1 两组患者一般情况的比较
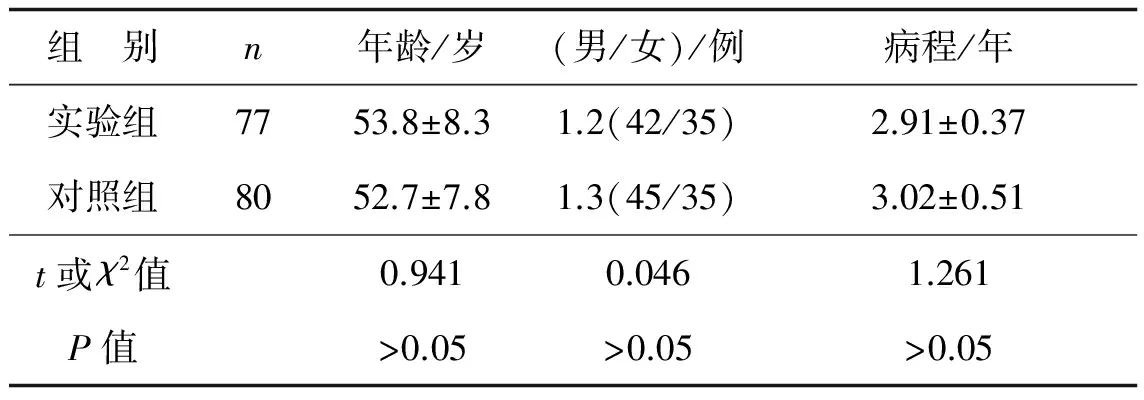
组 别n年龄/岁(男/女)/例病程/年实验组7753.8±8.31.2(42/35)2.91±0.37对照组8052.7±7.81.3(45/35)3.02±0.51t或χ2值0.9410.0461.261P值>0.05>0.05>0.05
1.2 糖尿病的诊断标准
患者术前存在既往糖尿病史(二级以上医院明确诊断为2型糖尿病);患者既往无糖尿病史,但具有糖尿病典型症状,入院时空腹血糖≥7.0 mmol·L-1或餐后2 h血糖≥11.1 mmol·L-1;患者既往无糖尿病史,无糖尿病典型症状,连续2次以上空腹血糖≥7.0 mmol·L-1或餐后2 h血糖≥11.1 mmol·L-1。
1.3 主要试剂及抗体
主要试剂:逆转录试剂盒(Maxima®First Strand cDNA Synthesis Kit, Fermentas)、定量PCR试剂盒(iQ SYBR Green Supermix, BioRad)、RNAiso Plus(TaKaRa公司,Code No:9108)、免疫组化试剂盒[Rabbit specific HRP/DAB(ABC)Detection IHC Kit(ab64261)]。抗体:FOXC2抗体(Abcam,ab55004)、Anti- Estrogen Receptor alpha抗体[EPR4097]- ChIP Grade(ab108398)、Anti- Progesterone Receptor抗体[Alpha PR6]- ChIP Grade(ab2765)、Anti- Ki67抗体(ab15580)、Anti- ErbB 2抗体[3B5](ab16901)。
1.4 检测方法
1.4.1 肿瘤组织中mRNA水平的检测 将收集的组织液氮下研磨至粉末,加入RNAiso Plus 1 ml,严格按照说明书上操作流程提取组织mRNA,取5 μg RNA使用逆转录试剂盒进行逆转录,得到cDNA后利用荧光定量PCR仪检测mRNA水平。反应条件:预变性94 ℃ 4 min;扩增条件94 ℃ 30 s,60 ℃ 1 min,40个循环。FOXC2上游引物为5′- GATGCATTATCTTTGTCTCCTGATC- 3′,下游引物为5′- GCTGCCCAGTTCTCAGCTCACAGGC- 3′,扩增引物大小为319 bp。以β- actin为内参基因,其上游引物序列为5′- TGGCACCCAGCACAATGAA- 3′,下游引物序列为5′- CTAAGTCATAGTCCGCCTAGAAGCA- 3′,目的片段大小为186 bp。
1.4.2 免疫组化的检测与结果分析 将收集的组织制成4 μm石蜡切片,SP免疫组化技术法检测组织中FOXC2、雌激素受体(ER)、孕激素受体(PR)及人表皮生长因子受体2(HER- 2)的表达情况,操作严格按照试剂盒说明书进行。一抗使用质量浓度为3 μg·ml-1,均用PBS稀释,4 ℃孵育过夜,二抗孵育后,二氨基联苯胺(DAB)显色,苏木素复染,冲洗后脱水、树胶封片再行镜检。
IHC染色切片采用光学显微镜进行观察,每张切片选取10个高倍视野,每个视野观察100个肿瘤细胞,计算其中平均阳性的细胞比例。ER及PR以细胞核内出现棕黄色颗粒为阳性判断标准,无阳性细胞或阳性细胞<10%的为阴性(-),≥10%的为阳性(+)。Her- 2以细胞膜呈清晰棕色为阳性细胞,无阳性细胞或阳性细胞<10%的为阴性(-),≥10%的为阳性(+)。Ki67以细胞核为棕黄色为阳性细胞,选阳性细胞密集的区域观察500个细胞,计数阳性细胞的百分数,≥14%为阳性,<14%的为阴性。FOXC2以细胞浆或细胞核出现棕黄色为阳性细胞,无阳性细胞或阳性细胞<10%的为阴性(-),10%至50%的为阳性(+),>50%为强阳性(++)。根据2011年ST Gallen共识乳腺癌亚型的定义和治疗策略,将乳腺癌分为4个亚型,即腔上皮型乳腺癌A型(luminal A型)[ER(+)或PR(+)且HER- 2(-)]、腔上皮型乳腺癌B型(luminal B型)[ER(+)或PR(+)且HER- 2(-)]、HER- 2过表达型[ER(-),PR(-)且HER- 2(+)]及基底细胞样(basal like)型[ER(-),PR(-)、HER- 2(-)]。
1.5 统计学处理
采用SPSS 19.0统计分析软件,计量资料采用平均数±标准差表示。行t检验比较两组患者RT- PCR检查结果差异是否有统计学意义,采用χ2检验检测两组患者乳腺癌分子分型构成比的差异,采取Spearman相关性分析检测患者FOXC2 mRNA水平的表达与基底细胞样型的关系。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者mRNA表达水平比较
RT- PCR结果显示,77例实验组FOXC2 mRNA表达水平为0.220 5±0.064,显著高于对照组的0.112 8±0.041(t=12.60,P<0.001)。
2.2 两组患者免疫组化结果比较
实验组FOXC2强阳性为28.6%,高于对照组的18.75%,差异有统计学意义(P<0.05);实验组FOXC2阳性为42.8%,高于对照组的38.75%,但差异无统计学意义(P>0.05);实验组FOXC2阴性患者为26.0%,低于对照组的42.5%,差异有统计学意义(P<0.05)。见表2。
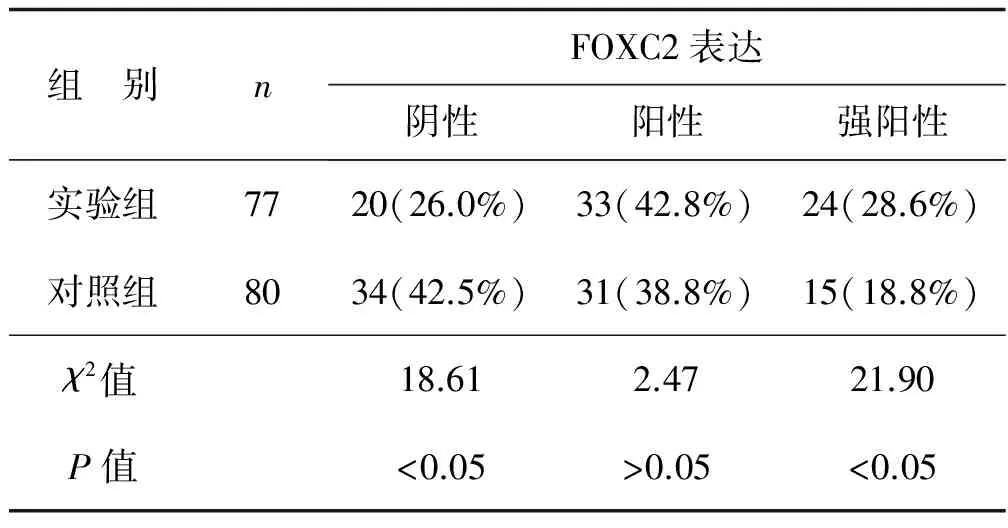
表2 两组患者肿瘤组织FOXC2免疫组化阳性率的比较 例
乳腺癌分子分型情况中,实验组luminal A型为22.1%,低于对照组的37.5%,差异有统计学意义(P<0.05);实验组luminal B型为18.2%,低于对照组的30.0%,差异有统计学意义(P<0.05);实验组Her- 2过表达型为24.7%,高于对照组的16.3%,但差异无统计学意义(P>0.05);实验组基底细胞样型为35.1%,高于对照组的16.3%,差异有统计学意义(P<0.05)。见表3。
2.3 两组患者FOXC2表达水平与基底细胞样型的相关性分析
Spearman相关性分析结果示,实验组和对照组患者FOXC2的mRNA表达水平与患者基底细胞样型呈正相关(r=0.672,P<0.05)。
2.4 Kaplan Meier- plotter分析乳腺癌患者FOXC2的表达与患者预后的相关性
根据Kaplan Meier- plotter乳腺癌数据库中的FOXC2表达水平及患者随访资料,837例患者FOXC2的表达水平分为高表达与低表达组。绘制生存分析曲线发现,FOXC2高表达组较低表达组预后差,差异具有统计学意义(P<0.05),见图1。
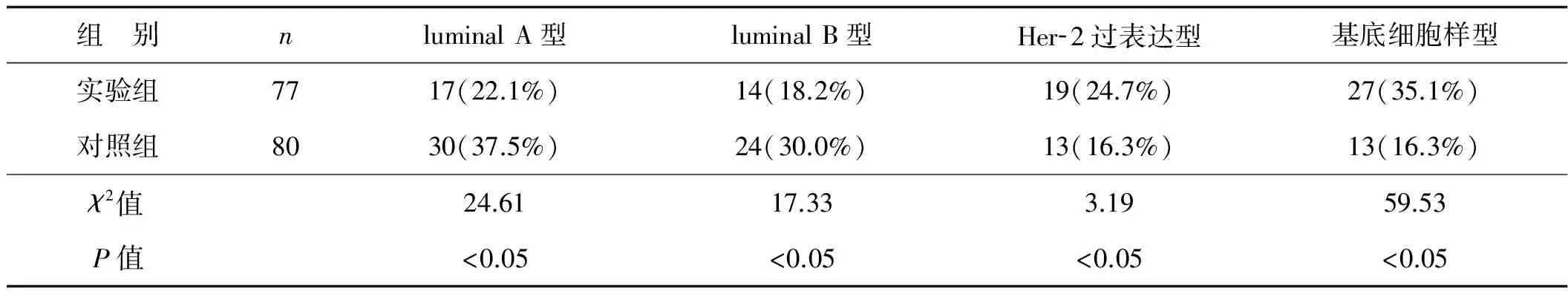
表3 两组患者肿瘤组织乳腺癌分子分型的比较 例
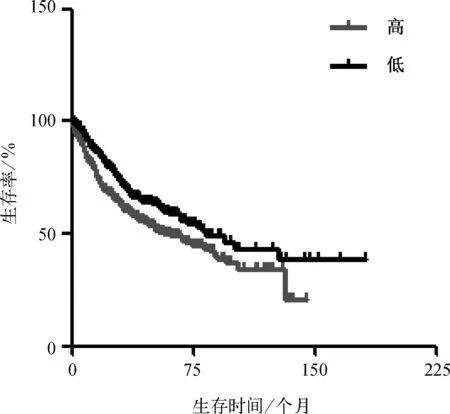
图1 乳腺癌患者肿瘤组织FOXC2的表达的生存曲线
3 讨 论
2型糖尿病的发生与多种肿瘤的发生存在密切关系[9],其机制尚未完全阐明,可能的机制包括:(1)2型糖尿病发生的胰岛素抵抗直接或间接地导致高胰岛素血症,进而增加血中胰岛素样因子-1(insulin- like growth factor- 1,IGF- 1)的水平,其能促进细胞的增殖和分化,并抑制肿瘤细胞的凋亡[10];(2)持续高血糖状态为生长迅速的肿瘤细胞提供了充足的能量来源,且长期高血糖可导致细胞线粒体呼吸酶受损,细胞呼吸功能障碍,导致细胞内ROS累积增加,可能对DNA造成损伤[11- 13];(3)长期高血糖状态可能导致免疫功能障碍,免疫监视功能受损,对肿瘤的发生发展起到积极作用[14- 15]。FOXC2是调节代谢的关键基因,该基因的低表达可导致体质量指数、三酰甘油水平升高,胰岛素敏感性及基础代谢率降低,导致代谢综合征的发生[16- 17]。Yang等[18]的研究表明,胰岛素抵抗的患者脂肪组织及骨骼肌FOXC2表达水平显著降低,棕色脂肪组织数量减少;Riddestrale等[19]发现,内脏脂肪细胞的FOXC2 mRNA表达水平与胰岛素抵抗指数呈负相关,证实了FOXC2在代谢方面的重要作用。近年关于FOXC2与肿瘤的相关研究逐渐增多,其在多种恶性肿瘤高表达,如TGF、WNT、Snai1/FOXC2经典肿瘤信号通路,且FOXC2本身也能促进多种肿瘤的发生发展过程。Mortazavi等[20]研究发现,在非小细胞肺癌细胞系中FOXC2的表达与其EMT过程呈正相关,FOXC2可下调E- cadherin的表达而降低细胞间黏附作用,增强细胞的转移倾向;Paranjape等[21]的研究显示,前列腺癌细胞中FOXC2促进其细胞干性的维持;Nishida等[22]的研究指出,食管癌患者癌组织中FOXC2的表达与基质金属蛋白酶- 2(MMP2)及基质金属蛋白酶- 9(MMP9)的表达呈正相关,提示FOXC2可能对食管癌侵袭转移起促进作用。
本研究合并2型糖尿病乳腺癌患者肿瘤组织中FOXC2的mRNA及蛋白表达水平明显高于非糖尿病乳腺癌患者,推测可能的原因是实验组患者受到致病因素的影响,正常组织如脂肪组织、骨骼肌中FOXC2的表达量下降,使机体发生胰岛素抵抗,代偿性地导致肿瘤组织FOXC2的表达增加,导致两组患者肿瘤组织FOXC2的表达出现差异。肿瘤组织FOXC2的表达量增加,不仅促进了机体整体的糖代谢,也加快了肿瘤组织的代谢进程,且FOXC2与肿瘤侵袭转移、肿瘤干性的维持密切相关,加深细胞恶性程度,使得患者预后不良。本研究结果也证实了上述推测,实验组患者乳腺癌分子分型更倾向于恶性程度高的基底细胞样型,且肿瘤组织FOXC2表达高的患者预后不良。
关于2型糖尿病导致恶性肿瘤的机制尚不完全明确,本研究为揭示其确切机制提供了线索,FOXC2可能在其中发挥重要的中间作用。今后研究须进一步明确FOXC2在乳腺癌中扮演何种角色,探究其与其他分子间的相互作用,确定其可能的靶标分子,为乳腺癌临床诊断及治疗提供新的依据。
[1] WILD S,ROGLIC G,GREEN A,et al.Global prevalence of diabetes:estimates for the year 2000 and projections for 2030[J].Diabetes Care,2004,27(5):1047- 1053.
[2] GALLAGHER E J,LEROITH D.Diabetes,antihyperglycemic medications and cancer risk:smoke or fire?[J].Curr Opin Endocrinol,2013,20(5):485- 494.
[3] 念馨,卫俊杰,苏艳丹,等.内脏脂肪组织FOXC2mRNA表达水平与2型糖尿病的关系[J].中国组织工程研究,2011,15(50):9496- 9500.
[4] NIAN X,ZHANG X,WANG Y,et al.Correlations of FOXC2 gene expression and polymorphism with type 2 diabetes mellitus[J].Clin Lab,2016,62(5):781- 791.
[5] JIN L Z,YONG X S,WANG Z N,et al.The clinical significance of mesenchyme forkhead 1 (FoxC2) in gastric carcinoma[J].Histopathology,2013,62(7):1038- 1048.
[6] 王静苗,贾喜花,王晓博,等.FOXC2和E- cad在结肠癌组织中的表达及临床意义[J].临床肿瘤学杂志,2016,21(8):718- 721.
[7] ZHENG C H,QUAN Y,LI Y Y,et al.Expression of transcription factor FOXC2 in cervical cancer and effects of silencing on cervical cancer cell proliferation[J].Asian Pac J Cacner Prev,2014,15(4):1589- 1595.
[8] HOLLIER B G,TINNIRELLO A A,WERDEN S J,et al.FOXC2 expression links epithelial- mesenchymal transition and stem cell properties in breast cancer[J].Cancer Res,2013,73(6):1981- 1992.
[9] HANDELSMAN Y.Diabetes and cancer- an AACE/ACE consensus statement[J].Endocr Pract,2013,19(5):899- 899.
[10] LIU X,CHOI R Y,JAWAD S M,et al.Androgen- induced PSA expression requires not only activation of AR but also endogenous IGF- I or IGF- I/PI3K/Akt signaling in human prostate cancer epithelial cells[J].Prostate,2011,71(7):766- 777.
[11] CATRINA S B.Impaired hypoxia- inducible factor (HIF) regulation by hyperglycemia[J].J Mol Med,2014,92(10):1025- 1034.
[12] BELL E L,EMERLING B M,RICOULT S J,et al.SirT3 suppresses hypoxia inducible factor 1α and tumor growth by inhibiting mitochondrial ROS production[J].Oncogene,2011,30(26):2986- 2996.
[13] ZHAO X,XIN R,RONG Z,et al.Zinc oxide nanoparticles induce oxidative DNA damage and ROS- triggered mitochondria- mediated apoptosis in zebrafish embryos[J].Aquat Toxicol,2016,180(2):56- 70.
[14] TEMMING P,TRÖGER B,THONNISSEN S,et al.The effect of hyperglycemia on neonatal immune responsesinvitro[J].J Matern Fetal Neonatal Med,2012,25(1):94- 98.
[15] BLACK C T,HENNESSEY P J,ANDRASSY R J.Short- term hyperglycemia depresses immunity through nonenzymatic glycosylation of circulating immunoglobulin[J].J Trauma,1990,30(7):832- 833.
[16] 章晓燕,贾伟平.FOXC2基因与肥胖[J].国际内分泌代谢杂志,2004,24(3):160- 162.
[17] KIM J K,KIM H J,PARK S Y,et al.Adipocyte- specific overexpression of FOXC2 prevents diet- induced increases in intramuscular fatty acyl CoA and insulin resistance[J].Diabetes,2005,54(6):1657- 1663.
[18] YANG X,ENERBCK S,SMITH U.Reduced expression of FOXC2 and brown adipogenic genes in human subjects with insulin resistance[J].Obes Res,2003,11(10):1182- 1191.
[19] RIDDERSTRÅLE M,CARLSSON E,KLANNEMARK M,et al.FOXC2 mRNA Expression and a 5′ untranslated region polymorphism of the gene are associated with insulin resistance[J].Diabetes,2002,51(12):3554- 3560.
[20] MORTAZAVI F,AN J,DUBINETT S,et al.p120- catenin is transcriptionally downregulated by FOXC2 in non- small cell lung cancer cells[J].Mol Cancer Res,2010,8(5):762- 774.
[21] PARANJAPE A N,SOUNDARARAJAN R,WERDEN S J,et al.Inhibition of FOXC2 restores epithelial phenotype and drug sensitivity in prostate cancer cells with stem- cell properties[J].Oncogene,2016,35(46):5963- 5976.
[22] NISHIDA N,MIMORI K,YOKOBORI T,et al.FOXC2 is a novel prognostic factor in human esophageal squamous cell carcinoma[J].Ann Surg Oncol,2011,18(2):535- 542.
2016- 10- 21
2017- 05- 15
李大伟(1980-),男,海南海口人,主治医师,在读硕士研究生。E- mail:dawei0898@163.com
李大伟.合并2型糖尿病乳腺癌患者肿瘤组织中FOXC2的表达情况及其临床意义[J].东南大学学报:医学版,2017,36(4):619- 623.
R737.9; R587.1
A
1671- 6264(2017)04- 0619- 05
10.3969/j.issn.1671- 6264.2017.04.025

