大黄素通过影响AQP3表达水平改善急性重症胰腺炎大鼠的器官功能
陈锋,赵煜,熊伟
(四川省人民医院1.急诊科,2.急诊外科,3.肝胆外科,四川 成都 610072)
大黄素通过影响AQP3表达水平改善急性重症胰腺炎大鼠的器官功能
陈锋1,赵煜2,熊伟3
(四川省人民医院1.急诊科,2.急诊外科,3.肝胆外科,四川 成都 610072)
目的:探讨大黄素对急性重症胰腺炎(SAP)大鼠器官功能及水通道蛋白3(AQP3)信号通路的影响。方法:将72只大鼠随机分为假手术组(Sham组,24只)、模型组(Model组,24只)和大黄素组(Emodin组,24只)。Model组和Emodin组通过胰管内注射牛黄胆酸钠的方法建立SAP大鼠模型,Sham组仅向胰管内注射等量生理盐水。Emodin组采用大黄素灌胃,Sham、Model组给予等量生理盐水。造模后24、48、72 h每组分别处死8只大鼠,取其组织,石蜡包埋切片后经苏木精-伊红(HE)染色后光镜下观察大鼠胰腺、肝脏、肺脏组织病理改变,采用酶联免疫吸附试验(ELISA)检测各组大鼠血清肿瘤坏死因子- α(TNF- α)、白细胞介素- 6(IL- 6)水平含量,氯化硝基苯- α- 半乳糖麦芽糖苷法检测血清淀粉酶(Amy)的含量,蛋白质免疫印迹法(Western blotting)检测回肠中AQP3蛋白表达,实时荧光定量PCR(RT- qPCR)检测回肠中AQP3的mRNA表达。结果:Sham组不同时间点胰腺、肝脏、肺脏病理评分均显著低于Emodin组和Model组(均P<0.05),Emodin组不同时间点胰腺、肝脏、肺脏病理评分均显著低于Model组(均P<0.05)。Sham组不同时间点血清Amy、TNF- α、IL- 6水平均显著低于Emodin组和Model组(均P<0.05),Emodin组不同时间点血清Amy、TNF- α、IL- 6水平均显著低于Model组(均P<0.05)。Sham组回肠中不同时间点AQP3蛋白及mRNA表达均显著低于Emodin组和Model组(均P<0.05),Emodin组回肠中不同时间点AQP3蛋白及mRNA表达均显著低于Model组(均P<0.05)。结论:SAP病理改变与AQP3异常表达有关;大黄素能够保护SAP的器官功能,降低炎症因子释放,其作用机制可能与下调AQP3表达、降低肠黏膜通透性有关。
大黄素; 急性重症胰腺炎; 水通道蛋白3; 炎症细胞因子; 大鼠
重症急性胰腺炎(severe acute pancreatitis,SAP)发病与全身炎症反应有关。SAP常累及全身多器官,导致多器官功能衰竭或全身感染,这亦是SAP死亡的主要原因[1]。国外研究[2]显示,在胰腺炎早期单核细胞、巨噬细胞及中性粒细胞等释放多种细胞因子,当血液循环中细胞因子水平升高会进一步诱导全身严重反应及多器官功能障碍综合征。基础研究[3]证实,SAP急性反应期器官功能衰竭的病理基础是肠黏膜通透性增高,毛细血管渗漏而引起体液丢失。水通道蛋白3(aquaporin 3,AQP3)是存在于消化系统上皮细胞的一种转化蛋白,其表达水平与甘油、水等小分子物质的通透性有关[4]。在病理情况下,AQP3表达异常,导致肠黏膜通透性增加,黏膜屏障受损。大黄素(emodin)是从大黄中提取的蒽醌类衍生物。体外研究[5]证实,大黄素具有导泻、抑菌、利尿等作用,能够改善SAP患者临床症状,但是大黄素对SAP的具体作用机制尚不清楚。本研究对SAP大鼠采用大黄素灌胃治疗,观察大鼠器官功能及AQP3表达水平,旨在探讨大黄素治疗SAP的作用机制,现将研究结果报道如下。
1 材料和方法
1.1 实验动物及分组
本实验大鼠处置方法经过本院动物伦理学委员会批准,选择72只SPF级健康SD大鼠,雌雄各半,6~8周龄,体质量220~300 g,平均(245±34)g,均购自四川省华西医院实验动物中心,动物合格证号为SCXK- 2015- 009。按照随机数字表法将72只大鼠分为假手术组(Sham组,24只)、模型组(Model组,24只)和大黄素组(Emodin组,24只);Sham、Model、Emodin组3组大鼠的周龄、体质量比较差异均无统计学意义(P>0.05),具有可比性。
1.2 主要仪器与试剂
牛磺胆酸钠购自上海一研生物科技有限公司(纯度>95%);大黄素购自台州海辰药业有限公司;淀粉酶(amylase,Amy)定量测定试剂盒购自保定长城临床试剂有限公司;肿瘤坏死因子- α(tumor necrosis factor,TNF- α)、白细胞介素- 6(interleukin- 6,IL- 6)购自上海基免生物技术有限公司;兔抗鼠AQP3多克隆抗体购自Sigma公司;免疫组化试剂盒、3,3′- 二氨基联苯胺(DAB)、Trizol试剂盒购自美国Invitrogen公司;甘油醛- 3- 磷酸脱氢酶(glyceraldehyde- 3- phosphate dehydrogenase,GAPDH)、辣根过氧化物酶标记的二抗购自美国Santa Cruz公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜、磷酸缓冲盐溶液(phosphate buffered saline, PBS)、RPMI 1640培养基购自武汉博士德生物工程有限公司。AU5800全自动生化分析仪购自贝克曼库尔特公司;GeneAmp 9700 PCR仪购自美国ABI公司;TS100- F倒置显微镜购自尼康公司;Odyssey成像系统及图像分析软件购自美国LI- COR公司。
1.3 方法
1.3.1 大鼠SAP模型的建立 参考Abe等[6]报道,大鼠术前24 h禁食,自由饮水,3%戊巴比妥钠按1 ml·kg-1腹腔注射麻醉;于上腹正中作长约2 cm切口,注射针头经十二指肠浆肌层行胆胰管穿刺术,穿刺成功后用无创伤血管钳夹住胆胰管近肝端及十二指肠穿刺处,向胰管内均匀注射5%的牛黄胆酸钠(1 ml·kg-1),注射后观察5~10 min,去除血管钳,确认腹腔无活动性出血后关腹。Sham组仅向胰管内注射等量生理盐水;Emodin组采用大黄素灌胃,20 mg·kg-1,每日灌胃1次,连续灌胃3 d;Sham、Model组给予等量生理盐水,方法及给药时间同Emodin组。各组造模成功后分别于造模后24、48、72 h分别处死8只大鼠,处死后从心脏取血置于肝素抗凝管中,-20 ℃保存待检。再分别取米粒大小的回肠、胰腺、肝脏、肺脏组织,5%多聚甲醛固定,液氮保存待检。
1.3.2 组织形态学的观察 将不同时段的胰腺、肝脏、肺脏组织样本从液氮中取出,置于10%甲醛-水溶液中72 h,常规脱水、透明、包埋,制成连续切片,采用苏木精伊红染色,并于光镜下观察切片。由病理科医生采用双盲法对组织病理进行评分,其中胰腺病理评分标准参考Rongione评分法[7],肝脏病理评分参考Camargo等[8]报道的评分标准,肺脏参考Jiang等[9]报道的评分标准;病理评分越高,组织损伤越严重。
1.3.3 血清指标的检测 取各时段全血1 ml,800×g离心10 min,静置10 min后吸取上清液;血清置于全自动生化分析仪检测,采用酶联免疫吸附试验检测血清TNF- α和IL- 6的含量,氯化硝基苯- α- 半乳糖麦芽糖苷法检测血清Amy的含量。相关检测操作均严格按照试剂盒说明书进行。
1.3.4 免疫组化染色检测各组织AQP3蛋白的表达 将组织样本制成厚度约为4 μm的切片,二甲苯、酒精梯度洗脱,切片脱蜡至水,加入3%过氧化氢室温孵育5 min,以消除内源性过氧化酶。自来水冲洗后PBS浸泡3 min,常规加入5%山羊血清封闭,室温孵育10 min,加入1∶150兔抗鼠AQP3多克隆抗体,4 ℃孵育过夜。PBS冲洗3次,再加入辣根过氧化物酶标记的羊抗兔IgG的二抗,37 ℃孵育30 min,PBS冲洗3次,DAB显色,自来水充分冲洗,复染,封片。结果判定由两名病理科医生采用盲法阅片,显微镜下随机选择10个视野,采用半定量法对细胞染色程度进行评分。染色强度无染色为0分,浅棕色后淡红色为1分,棕黄色为2分,棕褐色为3分。着色细胞所占百分比染色细胞<5%为0分,染色细胞5%~25%为1分,染色细胞26%~50%为2分,染色细胞51%~75%为3分,染色细胞>75%为4分。以染色强度×染色细胞百分比作为总分,其中总分0分代表阴性,1~4分代表弱阳性,5~8分代表阳性,9~12分代表强阳性;其中1分以及上代表阳性。
1.3.5 免疫印迹法(Western blotting)检测回肠中AQP3蛋白的表达 将样本充分研磨后加入蛋白裂解液冰上充分裂解30 min,4 ℃、1 400g离心10 min,留取上清液,置于-80 ℃冰箱保存待检。配置好上样缓冲液,沸水中变性5 min,冰浴5 min;SDS- PAGE电泳分离蛋白,将电泳段转移至PVDF膜上,电转后将PVDF膜取出。5%脱脂牛奶封闭2 h,PBS冲洗3次,加入兔抗鼠AQP3多克隆抗体,室温孵育1 h,4 ℃过夜;PBS冲洗3次;再加入辣根过氧化物酶标记的二抗,室温下振摇1 h,PBS冲洗3次。荧光图像扫描及条带灰度值分析,目的蛋白相对表达量为样本条带与GAPDH条带灰度值之比。
1.3.6 实时荧光定量PCR(real- time quantitative PCR,RT- qPCR)检测回肠AQP3的mRNA表达 按照RNA提取试剂盒说明书提取细胞总RNA,并逆转录成cDNA。引物委托南京金斯瑞生物科技有限公司设计。AQP3上游引物序列为5′- AGCTGGATCGGCTTGAATTGT- 3′,下游为5′- AGTGAAAACGGCACGTGGAT- 3′,产物大小为379 bp;GAPDH上游引物序列为5′- CTGAAGTAGATCCTGTAGATGTTGCA- 3′,下游为5′- GTTGCCATTGTGACGGTTCAGT- 3′,产物大小为125 bp。PCR反应体系为ddH2O 24.5 μl、10×buffer缓冲液5 μl、dNTP 2 μl、上下游引物各0.5 μl,cDNA 5 μl、Taq酶0.5 μl,总反应体系38 μl;反应条件为95 ℃预变性5 min,95 ℃变性30 s,65 ℃退火45 s,72 ℃延伸1 min,35个循环后72 ℃ 5 min。记录检测指标的CT值,每组测量3次取平均值,以GAPDH为内参照,计算AQP3 mRNA相对表达量(2-ΔΔCT);其中ΔCt=Ct(检测样品mRNA)-Ct(GAPDH mRNA)。
1.4 统计学处理
采用SPSS 19.0统计软件进行数据处理,计量资料采用均数±标准差表示,多组间比较采用单因素方差分析(ANOVA),各组间均数两两比较采用SNK- q检验,P<0.05为差异有统计学意义。
2 结 果
2.1 3组大鼠各组织形态学的改变
造模后Sham组大鼠的胰腺、肝脏、肺脏组织细胞排列整齐,形态结构清晰,细胞间隙未见炎症细胞浸润及水肿。Emodin组胰腺细胞较Model组清晰,炎性浸润面积明显缩小;肝细胞未见空泡样变性,肺组织充血、水肿明显减轻。Model组胰腺组织出现大量细胞坏死,并伴有炎症细胞浸润,腺泡结构不清;肝细胞结构混乱不清,细胞出现明显肿胀,部分可见空泡样变性;肺间质水肿或充血,部分可见肺泡融合而成的肺大疱。见图1。
2.2 3组大鼠各器官病理评分的比较
Emodin组造模后24、48、72 h各组织病理评分呈显著下降趋势(P<0.05);Sham组不同时间点胰腺、肝脏、肺脏组织病理评分显著低于Emodin组和Model组(均P<0.05),Emodin组病理评分显著低于Model组(均P<0.05)。见表1。
2.3 3组大鼠不同时段血清Amy、TNF- α、IL- 6浓度变化的比较
Emodin组造模后24、48、72 h血清Amy、TNF- α、IL- 6水平均呈明显下降趋势(P<0.05)。Sham组不同时间点血清Amy、TNF- α、IL- 6浓度显著低于Emodin组和Model组(均P<0.05),Emodin组不同时间点血清Amy、TNF- α、IL- 6浓度显著低于Model组(P<0.05),见表2。
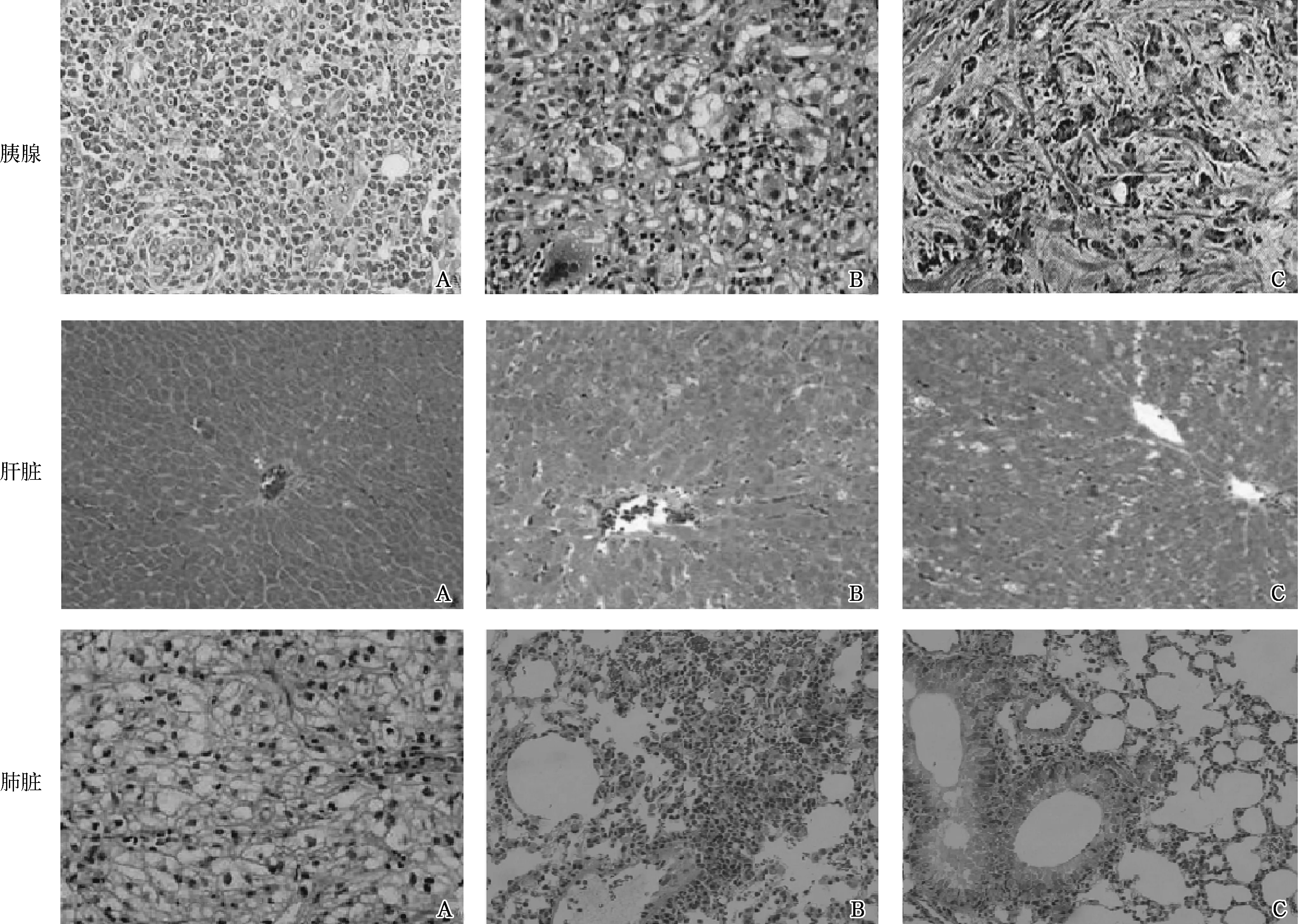
A.Sham组; B.Emodin组; C.Model组
图1 造模48 h后3组大鼠胰腺、肝脏、肺脏组织形态学改变(HE ×200)
Fig 1 Pathological changes of rats’ pancreas,liver and lung in three groups after 48 h of model establishment(HE ×200)
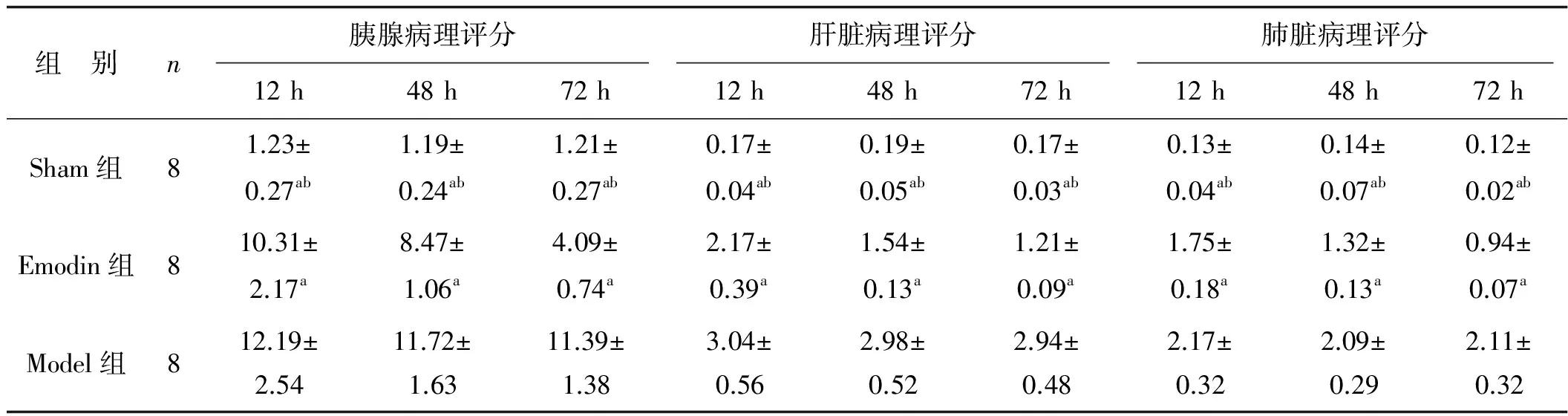
组 别n胰腺病理评分肝脏病理评分肺脏病理评分12h48h72h12h48h72h12h48h72hSham组81.23±0.27ab1.19±0.24ab1.21±0.27ab0.17±0.04ab0.19±0.05ab0.17±0.03ab0.13±0.04ab0.14±0.07ab0.12±0.02abEmodin组810.31±2.17a8.47±1.06a4.09±0.74a2.17±0.39a1.54±0.13a1.21±0.09a1.75±0.18a1.32±0.13a0.94±0.07aModel组812.19±2.5411.72±1.6311.39±1.383.04±0.562.98±0.522.94±0.482.17±0.322.09±0.292.11±0.32
与Model组比较,aP<0.05; 与Emodin组比较,bP<0.05
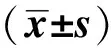
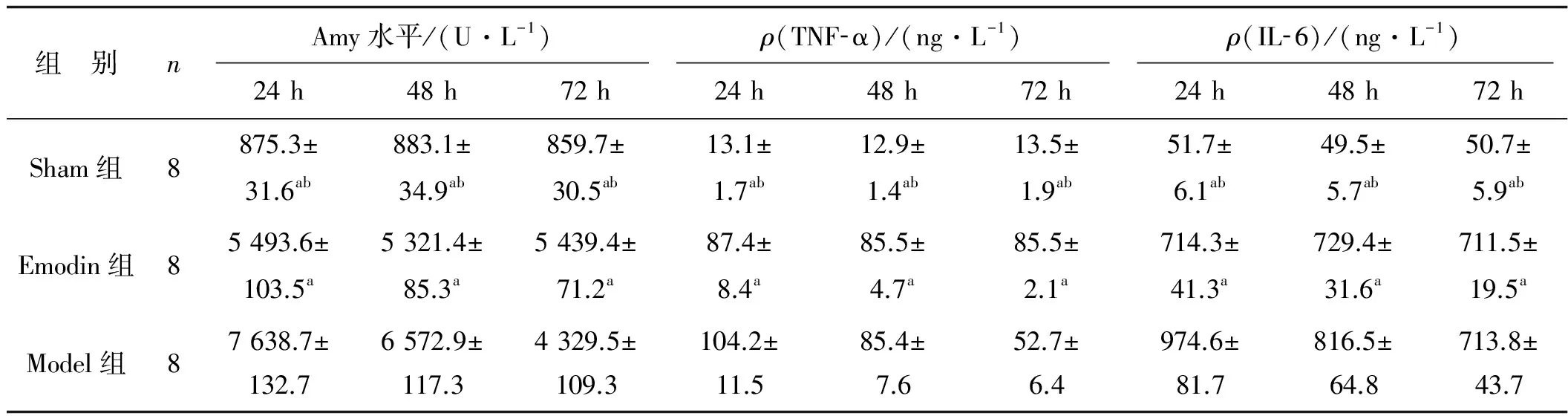
组 别nAmy水平/(U·L-1)ρ(TNF⁃α)/(ng·L-1)ρ(IL⁃6)/(ng·L-1)24h48h72h24h48h72h24h48h72hSham组8875.3±31.6ab883.1±34.9ab859.7±30.5ab13.1±1.7ab12.9±1.4ab13.5±1.9ab51.7±6.1ab49.5±5.7ab50.7±5.9abEmodin组85493.6±103.5a5321.4±85.3a5439.4±71.2a87.4±8.4a85.5±4.7a85.5±2.1a714.3±41.3a729.4±31.6a711.5±19.5aModel组87638.7±132.76572.9±117.34329.5±109.3104.2±11.585.4±7.652.7±6.4974.6±81.7816.5±64.8713.8±43.7
与对照组比较,aP<0.05;与大黄素组比较, bP<0.05
2.4 3组大鼠不同时段回肠AQP3蛋白的表达
免疫组化染色显示,Sham组AQP3蛋白呈弱表达,主要集中于回肠黏膜绒毛上端上皮细胞内;Model组AQP3蛋白呈强表达,并由回肠黏膜绒毛上端向隐窝延伸;Emodin组AQP3蛋白水平较Model组明显减少,并主要集中分布于黏膜绒毛上端。Western blotting结果显示,Emodin组造模后24、48、72 h AQP3蛋白水平均呈下降趋势(P<0.05),其中Sham组不同时间点AQP3蛋白水平显著低于Emodin组和Model组(均P<0.05),Emodin组显著低于Model组(均P<0.05)。见图2。
2.5 3组大鼠不同时段回肠AQP3的mRNA表达
Emodin组回肠AQP3的mRNA水平在造模后24、48、72 h呈逐渐下降的趋势(均P<0.05),Sham组不同时间点AQP3 mRNA显著低于Emodin组和Model组(均P<0.05),Emodin组不同时间点AQP3 mRNA显著低于Model组(均P<0.05),见图3。
3 讨 论
大黄素是从中药大黄中提取的一类蒽醌类化合物。基础药理学研究[11- 12]证实,大黄素具有导泻、抑菌、免疫抑制、利尿、抗组胺等作用。Ni等[13]认为,大黄素能够显著降低SAP并发腹水形成,对SAP的预后具有显著改善作用。临床研究[14]显示,大黄素联合西药治疗能够降低SAP的手术率和死亡率,其作用机制与缓解括约肌痉挛和抑制二十碳烯酸类血管活性物质有关。动物实验[15]也证实,大黄素能够促进胃肠道局部微循环,加速细胞和内毒素排除,并通过增加血供和氧供修复肠黏膜。
本研究显示,与Sham组和Model组比较,Emodin组Amy、TNF- α、IL- 6水平呈下降趋势,且Emodin组造模后血清Amy、TNF- α、IL- 6水平显著低于Model组,说明大黄素能够显著降低炎症因子的释放,从而改善局部炎症反应,缓解局部组织器官的损伤。Suboj等[16]报道,大黄素能够显著抑制大鼠脑缺血区组织ICAM- 1的表达,参与调节NF- κB信号途径,降低中性粒细胞和炎症介质的释放,从而对局部组织起到保护作用。Yin等[17]证实,大黄素能够下调Toll样受体- 4 mRNA表达水平,抑制瘤坏死因子- α、二胺氧化酶能细胞因子释放,对SAP肠屏障具有显著改善作用。本研究显示,Emodin组胰腺、肝脏、肺脏病理评分均显著降低,说明大黄素对SAP引起的器官损伤具有保护作用,这可能与大黄素改善局部血液循环、缓解炎症反应有关。

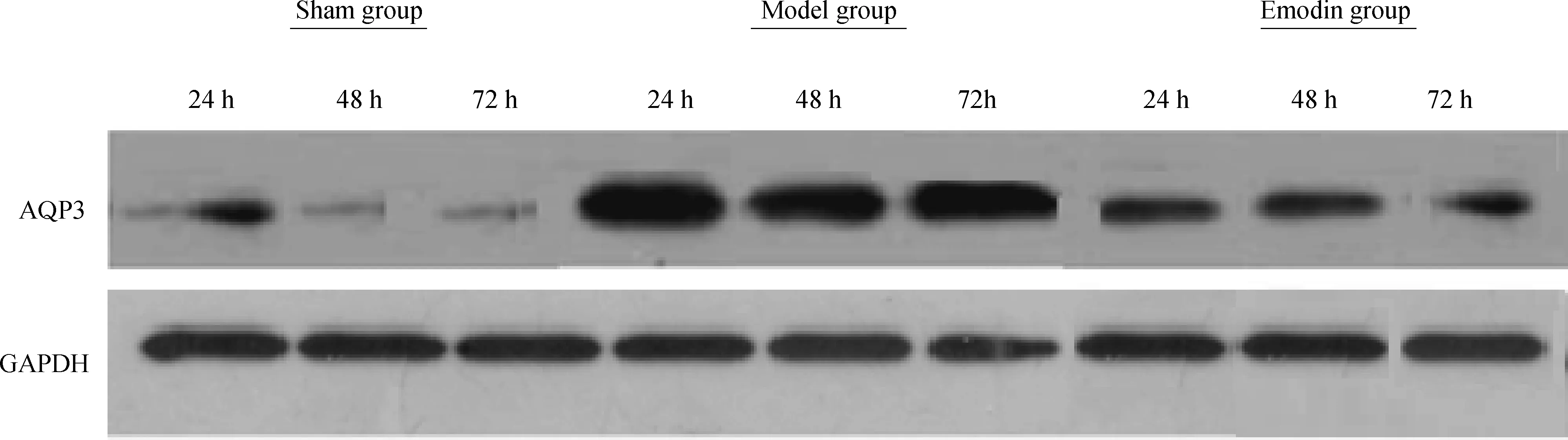
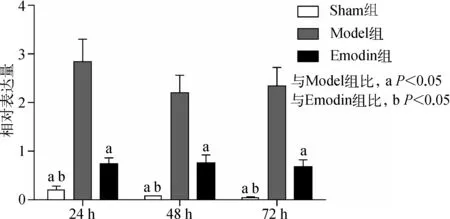
A.Sham组;B.Model组;C.Emodin组
图2 3组大鼠不同时间点回肠AQP3表达水平(上行为免疫组化检测,下行为Western blotting检测)
Fig 2 AQP3 protein expression level of three groups in different time
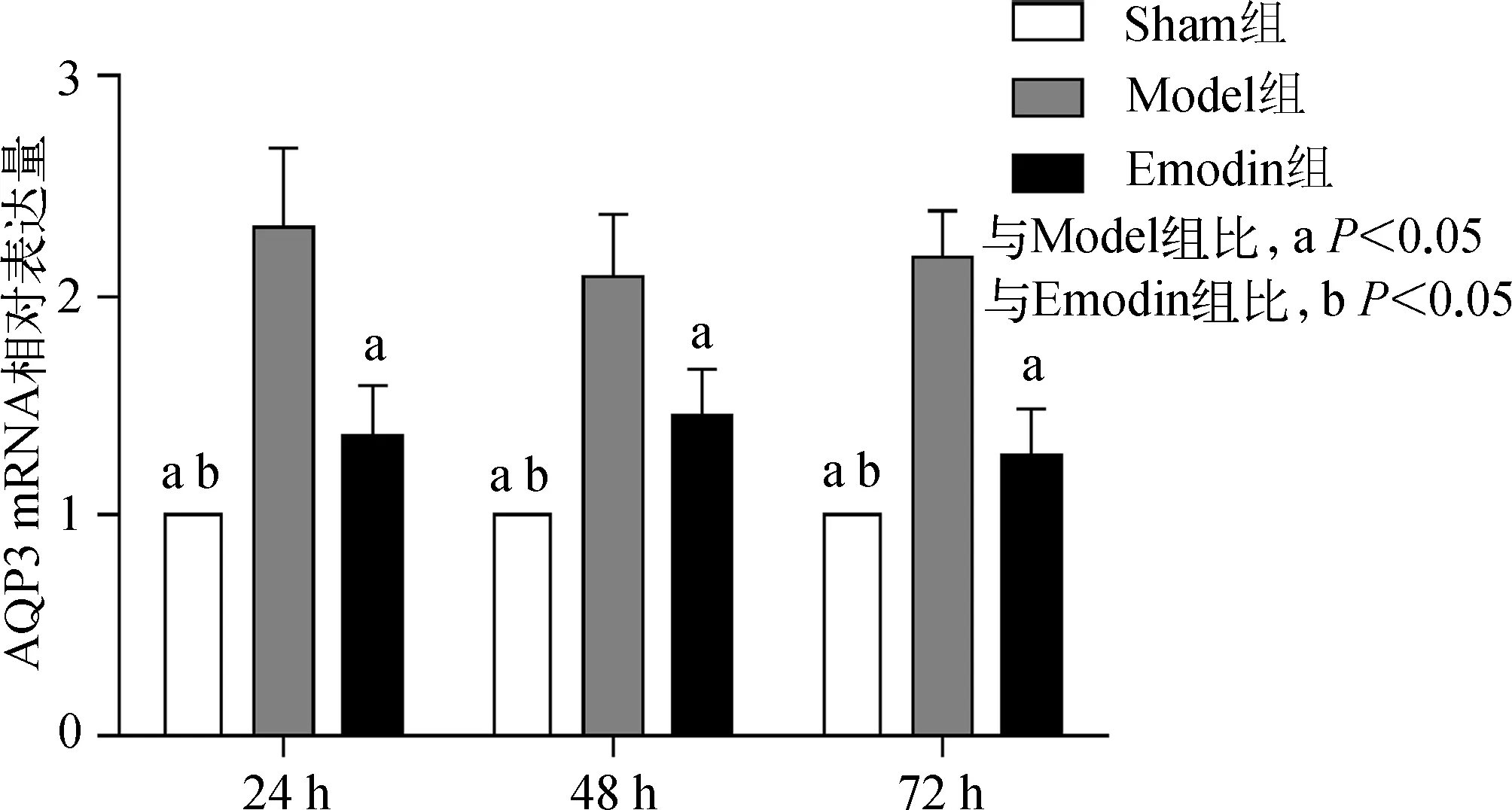
图3 3组大鼠回肠AQP3 mRNA在不同时间点的表达水平
Fig 3 AQP3 mRNA expression level of three groups in different time
AQP3是哺乳动物内广泛存在的一类活性蛋白,参与特异性水转运、细胞膜流动性、血管生长调节等过程[18- 19]。Matsuo等[20]将小鼠AQP3基因敲除,结果显示小鼠肾集合管对水的通透性显著降低,小鼠表现出多尿症状。Nong等[21]报道,小肠部分切除术患者随着肠道AQP3 mRNA表达显著升高,患者术后腹泻明显改善,AQP3在此过程中发挥了重要作用。大黄素具有通腑泻下的作用。齐文杰等[22]证实,大黄提取的总蒽醌类化合物能够导致大鼠腹泻,回肠、结肠段AQP3、AQP4蛋白明显下调。Masaldan等[23]报道,大黄酚、大黄素、大黄酸等能够抑制LoVo细胞膜表面AQP3蛋白和mRNA的表达水平,这亦是大黄致泻的主要机制。本研究显示,随着治疗时间的延长,Emodin组AQP3蛋白和mRNA呈逐渐降低趋势,且Emodin组不同时间点AQP3蛋白和mRNA均显著低于Model组。说明SAP能够诱导AQP3异常表达,而大黄素能够下调AQP3表达水平,从而降低肠黏膜的通透性。
综上所述,SAP病理改变与AQP3异常表达有关,大黄素能够保护SAP的器官功能,降低炎症因子释放[24],其作用机制可能与下调AQP3表达、降低肠黏膜通透性有关。
[1] KOYASU S,ISODA H,TSUJI Y,et al.Hepatic arterial perfusion increases in the early stage of severe acute pancreatitis patients:evaluation by perfusion computed tomography[J].Eur J Radiol,2012,81(1):43- 46.
[2] TALUKDAR R,CLEMENS M,VEGE S S.Moderately severe acute pancreatitis:prospective validation of this new subgroup of acute pancreatitis[J].Pancreas,2012,41(2):306- 309.
[3] CHO Y S,KIM H K,JANG E C,et al.Usefulness of the bedside index for severity in acute pancreatitis in the early prediction of severity and mortality in acute pancreatitis[J].Pancreas,2013,42(3):483- 487.
[4] KUBO H,HAYASHI T,AGO K,et al.Forensic diagnosis of ante- and postmortem burn based on aquaporin- 3 gene expression in the skin[J].Leg Med (Tokyo),2014,16(3):128- 134.
[5] 张丽丽,张慧英,王黎敏,等.大黄素对肝纤维化大鼠肺损伤的保护作用[J].中国病理生理杂志,2014,30(2):291- 296.
[6] ABE N,WATANABE T,OZAWA S,et al.Pancreatic endocrine function and glucose transporter (GLUT)- 2 expression in rat acute pancreatitis[J].Pancreas,2002,25(2):149- 153.
[7] RONGIONE A J,KUSSKE A M,KWAN K,et al.Interleukin 10 reduces the severity of acute pancreatitis in rats[J].Gastroenterology,1997,112(3):960- 967.
[8] CAMARGO C A Jr,MADDEN J F,GAO W,et al.Interleukin- 6 protects liver against warm ischemia/reperfusion injury and promotes hepatocyte proliferation in the rodent[J].Hepatology,1997,26(6):1513- 1520.
[9] JIANG H,MENG F,LI W,et al.Splenectomy ameliorates acute multiple organ damage induced by liver warm ischemia reperfusion in rats[J].Surgery,2007,141(1):32- 40.
[10] 张晓芹,贾晓云,李涛,等.清胰汤对L- 精氨酸诱发的重症急性胰腺炎小鼠胰腺p- STAT3表达的影响[J].中国病理生理杂志,2011,27(11):2175- 2179.
[11] SURBATOVIC M,RADAKOVIC S.Tumor necrosis factor- α levels early in severe acute pancreatitis:Is there predictive value regarding severity and outcome?[J].J Clin Gastroenterol,2013,47(7):637- 643.
[12] SINGH K B,TRIGUN S K.Apoptosis of Dalton’s lymphoma due toinvivotreatment with emodin is associated with modulations of hydrogen peroxide metabolizing antioxidant enzymes[J].Cell Biochem Biophys,2013,67(2):439- 449.
[13] NI Q,SUN K,CHEN G,et al.Invitroeffects of emodin on peritoneal macrophages that express membrane- bound CD14 protein in a rat model of severe acute pancreatitis/systemic inflammatory response syndrome[J].Mol Med Rep,2014,9(1):355- 359.
[14] 陈霞,赵宏贤,王巧稚,等.大黄素对重症急性胰腺炎肠黏膜屏障的保护作用及机制[J].天津医药,2015,43(12):1398- 1400.
[15] SHRIMALI D,SHANMUGAM M K,KUMAR A P,et al.Targeted abrogation of diverse signal transduction cascades by emodin for the treatment of inflammatory disorders and cancer[J].Cancer Lett,2013,341(2):139- 149.
[16] SUBOJ P,BABYKUTTY S,VALIYAPARAMBIL GOPI D R,et al.Aloe emodin inhibits colon cancer cell migration/angiogenesis by downregulating MMP- 2/9,RhoB and VEGF via reduced DNA binding activity of NF- κB[J].Eur J Pharm Sci,2012,45(5):581- 591.
[17] YIN X,GONG X,JIANG R,et al.Emodin ameliorated lipopolysaccharide- induced fulminant hepatic failure by blockade of TLR4/MD2 complex expression in D- galactosamine- sensitized mice[J].Int Immunopharmacol,2014,23(1):66- 72.
[18] 贾增强,王来,刘丽冰,等.Ghrelin对脑缺血再灌注大鼠脑水肿和水通道蛋白4表达的影响[J].中国病理生理杂志,2013,29(5):867- 871.
[19] 谭美华,陈建苏,招志毅,等.共培养环境中兔角膜内皮细胞诱导人iPSCs分化[J].中国病理生理杂志,2012,28(8):1488- 1493.
[20] MATSUO K,KAWANO K.Immunohistochemical distribution and morphometric analysis of aquaporin- 3 in oral squamous cell carcinoma[J].Int J Oral Maxillofac Surg,2014,43(1):13- 21.
[21] NONG Y, LIU F, CHEN Y,et al.The expression and distribution of aquaporin 3 in mouse embryos before and after vitrification[J].J Assist Reprod Genet,2013,30(4):601- 606.
[22] 齐文杰,张淑文,王红,等.大黄素对重症急性胰腺炎大鼠小肠水通道蛋白3表达的调节作用[J].中国中西医结合急救杂志,2010,17(4):214- 217.
[23] MASALDAN S,IYER V. Exploration of effects of emodin in selected cancer cell lines:enhanced growth inhibition by ascorbic acid and regulation of LRP1 and AR under hypoxia- like conditions[J].J Appl Toxicol,2014,34(1):95- 104.
[24] 刘博.经鼻空肠营养管给予中药大黄联合生大黄外敷治疗重症急性胰腺炎的临床研究[J].现代医学,2014,42(3):281- 284.
《东南大学学报(医学版)》唯一投稿网址:www.ddxbyxb.cn
Effect of emodin on organ function and AQP3 expression level in severe acute pancreatitic rats
CHEN Feng1,ZHAO Yu2,XIONG Wei3
(1.DepartmentofEmergency, 2.DepartmentofEmergencySurgery, 3.HepatobiliarySurgery,People’sHospitalofSichuan,Chengdu610072,China)
Objective: To investigate the organ function and AQP3 signal pathway effect of emodin on severe acute pancreatitis rats. Methods: A total of 72 rats accorded to the random number table method was divided into sham operation group (Sham group) of 24 rats, Model group of 24 rats and Emodin group of 24 rats, SAP model was established in the Emodin group and the Model group, same volume of normal saline was intraperitoneal injected into the pancreatic duct in the Sham group. The Emodin group was orally administered emodin, the Sham group and the Model group were given the same amount of normal saline. After 24 h, 48 h and 72 h of model establishment, 8 rats was sacrificed in each group, the pathological changes of pancreas, liver and lung were observed under electron microscope, serum TNF- α, IL- 6 level was detected by enzyme- linked immunosorbent test, serum Amy level was detected by chlorinated nitrobenzene alpha galactose method, ileal AQP3 protein expression level was detected by Western blotting, ileum AQP3 mRNA expression level was detected by quantitative real- time PCR. Results: 24 h, 48 h, 72 h after model establishment, pancreas, liver, lung tissue had significantly pathological changes in the three groups. After 24 h, 48 h, 72 h, histopathological score in the Emodin group showed a significant decreased trend (P<0.05). The pathological scores of the pancreas, liver, lung in the Sham group at different time points were significantly lower than those of the Emodin group and the Model group (P<0.05), moreover those of the Emodin group at different time points were significantly lower than those of the Model group (P<0.05).After 24 h, 48 h, 72 h, serum Amy,TNF- α,IL- 6 level in the Emodin group showed a significant decreased trend (P<0.05),those of the Sham group at different time points were significantly lower than those of the Emodin group and the Model group (P<0.05), those of the Emodin group at different time points were significantly lower than those of the Model group (P<0.05). After 24 h, 48 h, 72 h, AQP3 protein and mRNA in the Emodin group showed a significant decreased trend (P<0.05), AQP3 protein and mRNA in the Sham group at different time points were significantly lower than those of in the Emodin group and the Model group (P<0.05), with the former lower than the latter (P<0.05). Conclusion: The abnormal expression of AQP3 is related to SAP, emodin can protect the organ function of SAP and reduce the release of inflammatory factors, and its mechanism may be related to the down- regulation of AQP3 expression and decrease intestinal permeability.
Emodin; acute severe pancreatitis; aquaporin 3; inflammatory factor; rats
2016- 12- 21
2017- 05- 18
四川省卫生厅项目(080349)
陈锋(1972-),男,四川攀枝花人,副主任医师,医学硕士。E- mail:liushan12345624437@126.com
熊伟 E- mail:linyong63@163.com
陈锋,赵煜,熊伟.大黄素通过影响AQP3表达水平改善急性重症胰腺炎大鼠的器官功能[J].东南大学学报:医学版,2017,36(4):574- 580.
R576; R282.710.7
A
1671- 6264(2017)04- 0574- 07
10.3969/j.issn.1671- 6264.2017.04.016

