胃癌长链非编码RNA SNHG16异常表达及其临床病理意义
赵娟娟,韦四喜,2,严芝强,刘娟娟,万颖,黄海,2
(1.贵州医科大学医学检验学院 临床生化教研室,贵州 贵阳 550004; 2.贵州医科大学附属医院 生化科,贵州 贵阳 550004; 3.贵州医科大学附属医院 胃肠外科,贵州 贵阳 550004)
胃癌长链非编码RNA SNHG16异常表达及其临床病理意义
赵娟娟1,韦四喜1,2,严芝强3,刘娟娟1,万颖1,黄海1,2
(1.贵州医科大学医学检验学院 临床生化教研室,贵州 贵阳 550004; 2.贵州医科大学附属医院 生化科,贵州 贵阳 550004; 3.贵州医科大学附属医院 胃肠外科,贵州 贵阳 550004)
目的:检测长链非编码RNA SNHG16在胃癌组织与癌旁组织中的表达及其临床意义。方法:实时荧光定量PCR(quantitative real time- PCR,qRT- PCR)法检测SNHG16在41例胃癌组织及5株不同分化程度细胞系和胃黏膜上皮细胞中的表达情况,分析SNHG16表达与胃癌临床病理的相关性。结果:胃癌组织中SNHG16相对于癌旁组织其表达量为(2.64±1.59),表达显著上调且与胃癌侵袭相关(P<0.05,r=0.361)。与GES- 1细胞株比较,HGC- 27中SNHG16相对表达量为(4.21±0.69),MGC- 803为(1.99±0.21),BGC- 803为(1.90±0.44),SGC- 7901为(0.76±0.05),AGS为(3.36±0.81);SNHG16在SGC- 7901中低表达,但差异无统计学意义(P>0.05),在其他4株细胞中显著高表达(P<0.01)。结论:SNHG16在胃癌组织中高表达,且其表达水平与胃癌侵袭程度相关,可成为胃癌预后监测及治疗的靶点。
胃癌; 长链非编码RNA; SNHG16; qRT- PCR
胃癌是消化系统常见恶性肿瘤之一,在全球恶性肿瘤中发病率排第4位,癌症死亡率排第2位[1- 2]。胃癌的发生是一个多步骤、多因素进行性发展的过程,涉及多条信号传导通路的异常改变[3]。因此了解并研究其机制对于胃癌的诊断与治疗极其重要。
长链非编码RNA(long non- coding RNA,LncRNA)是一类转录本长度超过200 nt的且不能编码蛋白质的RNA分子[4- 5],近年来已成为肿瘤研究的热点。研究表明其参与了基因组印记、剂量补偿效应、表观遗传等多种重要的细胞生物学过程[6- 8]。snoRNA host gene 16(SNHG16)是位于人17号染色体17q25.1上的长链非编码RNA。现有研究报道,成神经细胞瘤患者SNHG16表达上调[9],在膀胱癌中其表达与膀胱癌侵袭相关[10],在结肠癌中与细胞增殖、凋亡等相关[11],而在胃癌中未见相关报道。因此,本研究旨在检测胃癌长链非编码RNA SNHG16的表达并分析其与临床病理特征的关系。
1 材料与方法
1.1 材料
1.1.1 组织标本 收集2014年3月至2015年4月贵州医科大学附属医院收治的41例初诊胃癌患者的癌组织及对应癌旁组织。胃癌患者术前未进行化疗和放疗。胃癌分期按美国癌症联合委员会(American Joint Committee on Cancer,AJCC)胃癌TNM病理分期的标准。本研究经过贵州医科大学附属医院伦理委员会论证批准(NO.21)。
1.1.2 胃癌细胞株 不同分化程度的人胃癌细胞株AGS、SGC- 7901、BGC- 823、MGC- 803和HGC- 27,永生化的人胃黏膜上皮细胞株GES- 1购自中国科学院上海生命科学研究院细胞中心。所有细胞株用含1%双抗(青霉素与链霉素)、1%谷氨酰胺、10%胎牛血清的RPMI 16402培养基,于37 ℃、体积分数5%CO2条件下常规培养。
1.1.3 试剂与仪器 RPMI 1640培养基(美国BD公司),Trizol、TaKaRa逆转录试剂盒、TaKaRa SYBR Green试剂盒(日本TaRaKa公司)。二氧化碳培养箱(日本SANYO公司)、超微量分光光度计(美国Themo公司)、Eppendorf5331型PCR仪(德国Eppedorf公司)、LightCycler480实时荧光定量PCR仪(瑞士罗氏公司)。
1.2 总RNA提取
称取50~100 mg胃癌组织,边研磨边加入液氮,充分研磨后移入EP管中,加入1 ml Trizol。按Trizol试剂说明书提取组织和细胞的总RNA。测定RNA浓度及OD260 nm/OD280 nm。最后通过1%的琼脂糖凝胶电泳对RNA进行完整性检测。
1.3 逆转录及实时荧光定量PCR
按照TaKaRa逆转录试剂盒两步合成cDNA,于-20 ℃保存。进行荧光定量PCR;按照TaKaRa SYBR Green试剂盒要求配置20 μl反应体系,罗氏LightCycler 480(LC480)进行检测。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环;以HPRT为内参。癌旁组织作为对照组。细胞中SNHG16基因表达量检测以GES- 1作为对照,用2-ΔΔCT表示SNHG16的相对表达量。
1.4 统计学处理
相对表达量以均数±标准差表示,应用SPSS 17.0统计软件,组织样本数据比较行配对样本t检验,细胞数据用独立样本t检验。SNHG16基因的表达量与组织标本病理参数之间的关系用卡方检验。双侧P<0.05表示差异具有统计学意义。
2 结 果
2.1 SNHG16在不同胃癌细胞株中的表达
qRT- PCR结果显示,与胃黏膜上皮细胞GES- 1比较,胃癌细胞株HGC- 27 SNHG16的表达量为4.21±0.69,MGC- 803为1.99±0.21,BGC- 803为1.90±0.44,SGC- 7901为0.76±0.05,AGS为3.36±0.81;SNHG16在SGC- 7901中低表达,但差异无统计学意义(P>0.05),其他4株细胞中显著高表达(P<0.01)。
2.2 SNHG16在胃癌及癌旁组织中的表达
41例胃癌组织中SNHG16表达量为2.64±1.59,与对应的癌旁组织表达量比较SNHG16表达上调,差异具有统计学意义(P<0.01)。
2.3 SNHG16与胃癌临床病理资料的相关分析
41例胃癌患者胃癌组织中,SNHG16表达水平与肿瘤的侵袭相关(r=0.361,P<0.01),且侵袭程度T3- T4期的患者其SNHG16表达量高于侵袭程度T1- T2期(图1);但在性别、年龄、分化程度、淋巴结转移及TNM分期等其他的病理特征上差异无统计学意义(P>0.05)。见表1。
3 讨 论
目前越来越多的研究表明,lncRNA在肿瘤的发生发展中发挥着重要的作用[12],但对于这些lncRNA在癌症发生发展过程中所扮演的角色及作用机制仍知之甚少[13- 16]。本研究结果显示,lncRNA SNHG16在胃癌组织中的表达高于癌旁组织。进一步分析癌组织中SNHG16表达水平与临床病理特征的关系发现,SNHG16的表达与肿瘤的侵袭程度(T1- T4)呈正相关,随着侵袭程度加深,SNHG16癌组织中的表达量增高,而与其他临床病理特征不相关。这一研究结果提示,SNHG16可能通过一定信号途径参与胃癌的侵袭,从而进一步影响胃癌的进展及预后。
不同分化程度的胃癌细胞株SNHG16高表达,其中未分化细胞株HGC- 27表达量最高,高分化细胞株AGS次之,中分化细胞株MGC- 803和BGC- 823表达水平相当,且SNHG16表达水平与胃癌细胞的分化程度无明显关联。结果说明,SNHG16主要的生物学作用可能更大程度上影响胃癌细胞侵袭,而不是分化和恶性变。
表1 SNHG16表达与胃癌临床病理参数间的关系
Tab 1 Correlation between the SNHG16 expression and clinicopthological characteristics in gastric cancer
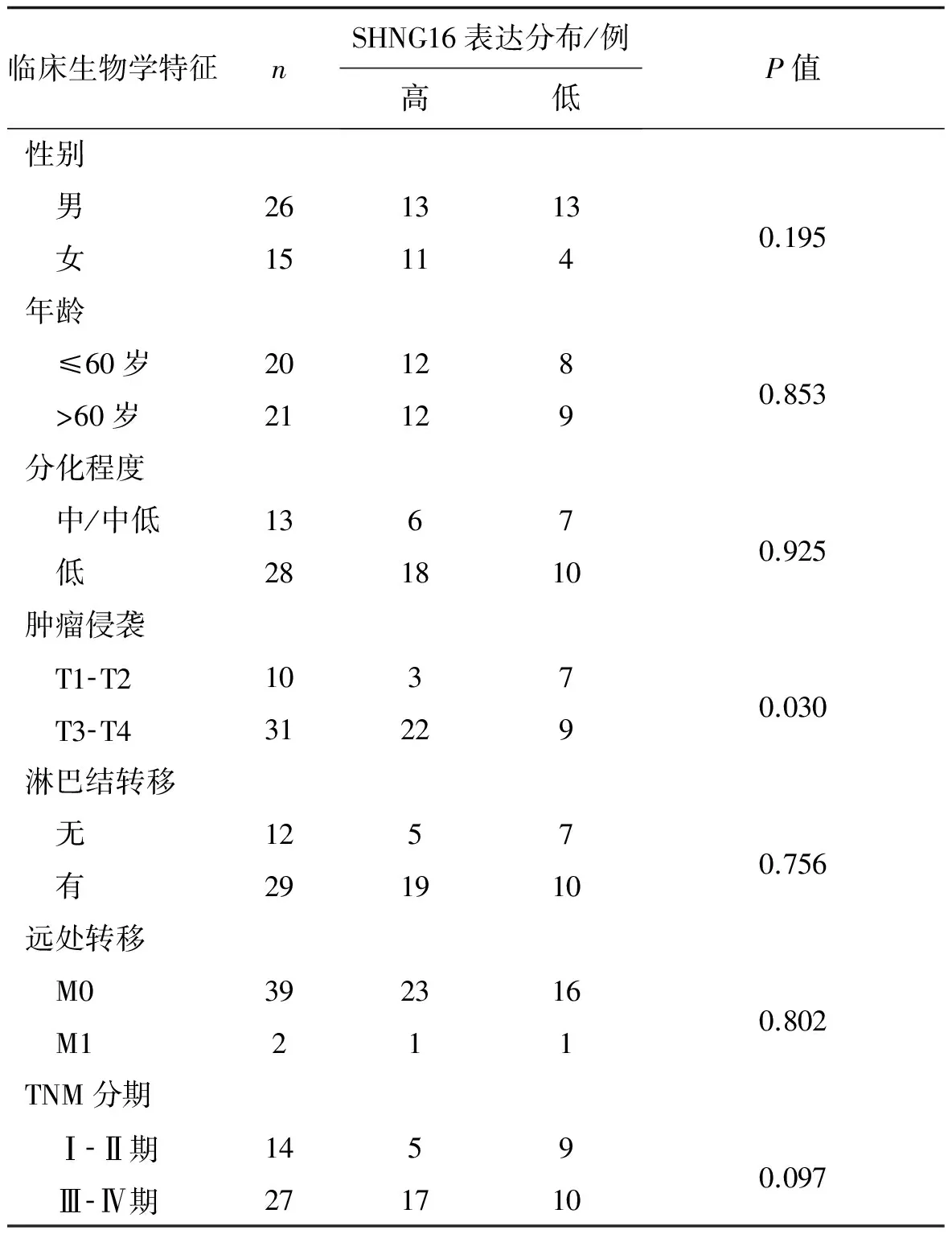
临床生物学特征nSHNG16表达分布/例高低P值性别 男2613130.195 女15114年龄 ≤60岁201280.853 >60岁21129分化程度 中/中低13670.925 低281810肿瘤侵袭 T1⁃T210370.030 T3⁃T431229淋巴结转移 无12570.756 有291910远处转移 M03923160.802 M1211TNM分期 Ⅰ⁃Ⅱ期14590.097 Ⅲ⁃Ⅳ期271710
注:以SNHG16表达量的中位数作为临界值,高于临界值视为高表达,小于中位数为低表达。
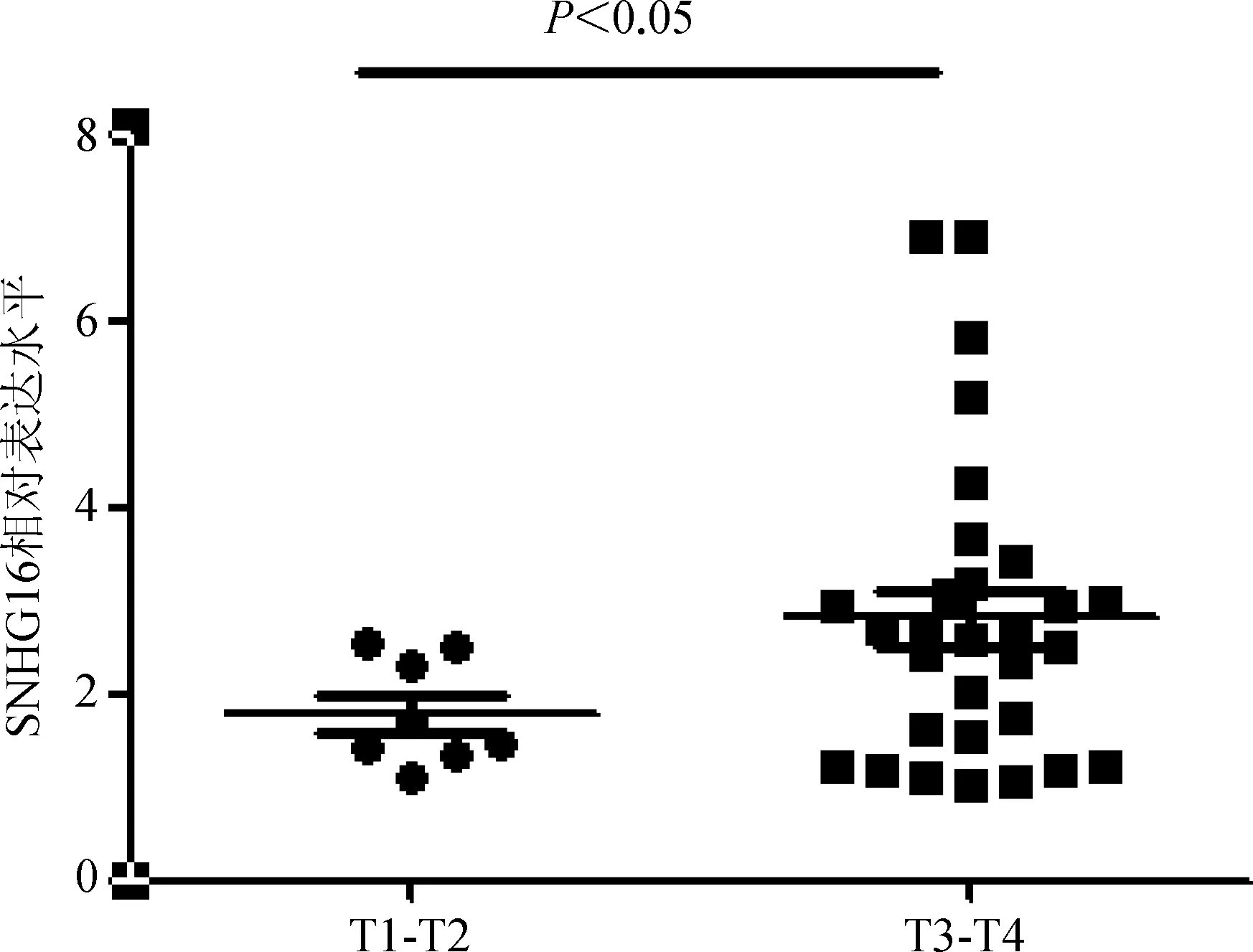
图1 不同侵袭程度中SNHG16的表达量
Fig 1 The expression of SNHG16 in different invasion degrees
综上所述,侵袭与转移是胃癌重要生物学行为之一,也是造成患者不能及时有效获得治疗并导致死亡的主要原因[17]。SNHG16在胃癌的进展中可能发挥致癌基因的作用,主要参与胃癌细胞的侵袭过程,对分化及其恶化作用不大,但其在胃癌的进展和预后过程中的具体作用机制还有待进一步研究。
[1] LIN X,ZHAO Y,SONG W M,et al.Molecular classification and prediction in gastric cancer[J].Comput Struct Biotechnol J,2015,13:448- 458.
[2] FERLAY J,SOERJOMATARAM I,DIKSHIT R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359- 386.
[3] 张立广,许旭,李全福.semaphorin6B在胃癌中的表达及临床意义[J].中国现代医学杂志,2013,23(34):45- 47.
[4] HONG J,ZHANG H,KAWASE- KOGA Y,et al.MicroRNA function is required for neurite outgrowth of mature neurons in the mouse postnatal cerebral cortex[J].Front Cell Neurosci,2013,7:151.
[5] SRIVASTAVA S P,KOYA D,KANASAKI K.MicroRNAs in kidney fibrosis and diabetic nephropathy:roles on EMT and EndMT[J].Biomed Res Int,2013,2013:125469.
[6] SHI X,SUN M,LIU H,et al.Long non- coding RNAs:a new frontier in the study of human diseases[J].Cancer Lett,2013,339(2):159- 166.
[7] ZHU J,FU H,WU Y,et al.Function of lncRNAs and approaches to lncRNA- protein interactions[J].Sci China Life Sci,2013,56(10):876- 885.
[8] FROBERG J E,LIN Y,LEE J T.Guided by RNAs:X- inactivation as a model for lncRNA function[J].J Mol Biol,2013,425(19):3698- 3706.
[9] SCHEUERMANN J C,BOYER L A.Getting to the heart of the matter:long non- coding RNAs in cardiac development and disease[J].EMBO J,2013,32(13):1805- 1816.
[10] YU M,OHIRA M,LI Y,et al.High expression of ncRAN,a novel non- coding RNA mapped to chromosome 17q25.1,is associated with poor prognosis in neuroblastoma[J].Int J Oncol,2009,34(4):931- 938.
[11] CHRISTENSEN L L,TRUE K,HAMILTON M P,et al.SNHG16 is regulated by the Wnt pathway in colorectal cancer and affects genes involved in lipid metabolism[J].Mol Oncol,2016,10(8):1266- 1282.
[12] GUPTA R A,SHAH N,WANG K C,et al.Long non- coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J].Nature,2010,464(7291):1071- 1076.
[13] DENG K,GUO X,WANG H,et al.The lncRNA- MYC regulatory network in cancer[J].Tumour Biol,2014,35(10):9497- 9503.
[14] DHAR D,SEKI E,KARIN M.NCOA5,IL- 6,type- 2 diabetes and HCC:the deadly quartet[J].Cell Metab,2014,19(1):6- 7.
[15] DI C I,TORO A.The quality of life after surgery for HCC can support the choice of this treatment[J].World J Surg,2014,38(11):3035.
[16] DOERR A.Unraveling the lncRNA mystery[J].Nat Methods,2014,11(9):890.
[17] 赵久达,徐兵河.长链非编码RNA与胃癌发生、发展、诊治及预后关系的研究进展[J].中华医学杂志,2015,95(2):153- 155.
Long non- coding RNA SNHG16 dysregulated expression in gastric cancer and its clinicopathological significance
ZHAO Juan- juan1,WEI Si- xi1,2,YAN Zhi- qiang3,LIU Juan- juan1, WAN Ying1,HUANG Hai1,2
(1.DepartmentofClinicalBiochemistry,SchoolofClinicalLaboratoryScience,GuizhouMedicalUniversity,Guiyang550004,China; 2.DepartmentofClinicalBiochemistry,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,China; 3.DepartmentofGastrointerstinalSurgery,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,China)
Objective: To explore the expression of long non- coding RNA SNHG16 in human gastric cancer tissues and cell lines, as well its clinical implication. Methods: Quantitative real- time PCR (qRT- PCR) was performed to detect the expression of SNHG16 in 41 pairs of gastric cancer samples and four gastric cancer cell lines with different degrees of differentiation and normal gastric mucosa cell line GES- 1. The potential relationship between lncRNA SNHG16 expression levels in tumor tissues and clinicopatholoical features of gastric cancer were analyzed. Results: The qRT- PCR confirmed that expression of SNHG16 was significantly increased in gastric cancer tissues(2.64±1.59),which was associated with the depth of the invasion, compared with adjacent non- tumor tissues(P<0.05,r=0.361). Compared with GES- 1, the relative expression of SNHG16 in cell lines with different degrees of differentiation were respectively:HGC- 27(4.21±0.69),MGC- 803(1.99±0.21),BGC- 803(1.90±0.44),SGC- 7901(0.76±0.05)and AGS(3.36±0.81). The expression of SNHG16 was up- regulated in different degrees of gastric cancer cells compared with GES- 1(P<0.01).SNHG16 expression was down- regulated in SGC- 7901 compared with GES- 1(P>0.05). Conclusion: High expression of SNHG16 is involved in the depth of invasion of gastric cancer and may represent a potential biomarker for the prognosis monitoring and treatment of gastric cancer.
gastric cancer; long non- coding RNA; SNHG16; qRT- PCR
2017- 02- 26
2017- 05- 22
国家自然科学基金资助项目(81460364)
赵娟娟(1989-),女,贵州盘县人,在读硕士研究生。E- mail:liushan12345624437@126.com
黄海 E- mail:cffchen321@163.com
赵娟娟,韦四喜,严芝强,等.胃癌长链非编码RNA SNHG16异常表达及其临床病理意义[J].东南大学学报:医学版,2017,36(4):551- 554.
R735.2
A
1671- 6264(2017)04- 0551- 04
10.3969/j.issn.1671- 6264.2017.04.010

