无菌果蝇模型的改进与酵母促进果蝇发育
胡坤坤,李玉娟,刘威,3,金珊
(1.湖北大学生命科学学院,湖北 武汉 430062;2.山西医科大学汾阳学院科技中心,山西 汾阳 032200;3.山西医科大学汾阳学院医学检验系,山西 汾阳 032200)
无菌果蝇模型的改进与酵母促进果蝇发育
胡坤坤1,2,李玉娟2,刘威2,3,金珊1
(1.湖北大学生命科学学院,湖北 武汉 430062;2.山西医科大学汾阳学院科技中心,山西 汾阳 032200;3.山西医科大学汾阳学院医学检验系,山西 汾阳 032200)
人等所有后生动物体内微生物数量多、种类复杂,给人们的研究带来了很多的困难,建立无菌和悉菌的动物模型则是当前急迫之需,无菌果蝇模型日益受到重视.本实验优化无菌果蝇模型,发现威露士可以协助次氯酸和乙醇消毒,对大肠杆菌、金黄色葡萄球菌和白色念珠菌杀灭效率为99.999%,提高表面消毒能力,卵存活率从50%左右提高到67.3%.从而高效率地建立果蝇悉菌模型.在此基础上研究酵母对该模型的影响,结果发现酵母能显著地促进无菌果蝇的生长与发育.在营养条件匮乏(0.5%酵母)情况下,常规饲养果蝇蛹和成虫羽化时间分别为6.0 d和11.7 d;无菌果蝇蛹和成虫羽化时间分别为7.8 d和18.9 d,说明共生微生物可以促进果蝇的发育.本研究优化了无菌果蝇操作过程,为实验室建立悉生果蝇模型提供了便利,有利于研究宿主与微生物之间相互作用.
果蝇;无菌模型;悉生;发育;酵母

由于人体肠道结构复杂,同时肠道微生物种类广、数量多以及功能复杂,如果直接用人进行研究有很多的困难,有的研究可能涉及到某种伦理问题.因此,选择一种好的模式生物来研究肠道共生菌对宿主的影响很有必要.目前,大部分研究采用小鼠建立无菌模型.但是该模型具有操作复杂、代价高昂与容易污染等缺点.首先,需要在怀孕小鼠临近产期运用剖腹产小鼠获得无菌的小鼠,避免产道微生物的定植;其次,小鼠需要严格地在无菌培养箱中培养, 要求提供无菌的食物和空气,确保小鼠清洁;最后,因为小鼠饲养周期和后代数量的限制以及小鼠无菌培养设备的昂贵,在一定程度上限制了对这方面的研究.最近,我们及其他实验室利用黑腹果蝇(Drosophilamelanogaster)建立无/悉菌模型[5],有可能是研究肠道细菌的一个优秀宿主模型.
1969年,Bakula等首次建立和验证了无菌果蝇模型[6].他们分别用HgCl2溶液、70%和95%乙醇溶液等联合消毒法,除去卵表面所有的微生物,最终获得了无菌果蝇.HgCl2溶液对环境不利,并且对果蝇神经系统有毒害作用,后来被次氯酸溶液所代替[7].然而,我们实验室在验证该方法时发现其效率仍然不是很高,在保证卵存活条件之下除菌效果不理想.本实验室在已有的基础上增加一种消毒液—威露士(Walch)与次氯酸和乙醇联合消毒,建立一种操作简便、效率高的无菌果蝇的方法.使用这种方法获取的无菌果蝇卵更加安全,而且消毒除菌后卵成活率非常高.
1 材料与方法
1.1 实验材料 实验中所用果蝇品系为野生型黑腹果蝇OregonR(OR).果蝇体内混合菌来自常规饲养果蝇的肠道.
1.2 试剂与仪器 消毒剂威露士Walch(广州威莱);高活性干酵母(安琪酵母股份有限公司);次氯酸钠(Sigma);紫外-可见分光光度仪(岛津,UV-1800);37 ℃恒温培养箱(新苗,GNP9080BS-Ⅲ);25 ℃恒温恒湿培养箱(恒丰,WS-01Y).
1.3 果蝇的培养和培养基成分 果蝇在25 ℃,湿度50%条件下培养.果蝇培养基为酵母-玉米琼脂培养基,成分如下(1 000 mL):dd H2O 1 000 mL,琼脂13 g,CaCl20.83 g,蔗糖31.6 g,葡萄糖63.2 g,玉米粉77.7 g,酵母粉24 g.果蝇收卵所用葡萄汁-酵母培养基成分(1 000 mL):dd H2O 750 mL,葡萄汁250 ml,琼脂30 g,蔗糖12 g.收卵时在培养基表面涂抹适量的酵母膏.

1.5 卵孵化率 将消毒后卵转移到高压灭菌后的果蝇食物上,用透气不透菌的塞子密封玻璃管,放置到清洁培养箱内培养,第二天计数卵孵化率.
1.6 果蝇发育时间的测定 将CR (Conventionally Reared)、GF (Germ-Free)和GF + 混合菌3组卵,按照无菌和悉菌模型建立方法,分别接种到酵母浓度不同培养基(0.25%、0.5%、1.0%、2.5%、5.0%)中,记录每天成蛹和羽化果蝇的数量,计算果蝇在不同酵母浓度下成蛹和羽化的天数.
1.7 数据统计和分析 试验中所有结果均重复3次及以上,对收卵后卵表面的细菌数量、卵成活率、果蝇蛹和成虫发育平均时长进行统计,并将每组数据平均后采用t检验(studentt-test),检验其差异度.
2 结果
2.1 消毒液的除菌效果的比较 本研究参考已有建立无菌果蝇的方法,结果发现该方法在我们实验室不够理想.无菌果蝇模型建立需要满足两个要求:其一,要有效地去除果蝇卵体表所有的微生物;其二,胚胎要保持较高的存活率.因此我们分别研究了次氯酸和乙醇消毒效果.结果显示,75%乙醇消毒能力弱,对胚胎损伤小,处理15 min,卵存活率为17.3%(图1A),而次氯酸消毒能力强,但毒性强,对果蝇胚胎损伤较大,处理5 min卵存活率为0%(图1B).因此,该方法在本实验室得到活的无菌果蝇胚胎几率比较低.为了解决上述问题,尝试利用威露士溶液协助消毒卵.威露士溶液杀菌主要成分为对氯间二甲基苯酚,可引起革兰氏阳性、阴性菌以及霉菌表面蛋白质变性,以杀灭这些微生物.结果显示,使用仅有威露士的溶液处理果蝇胚胎3次,每次1 min,除菌效果一般.但对果蝇胚胎损伤最小,处理15 min,卵存活率高达为38.1% (图1C).上述结果表明,单独使用任何一种消毒液均不能有效地除菌.
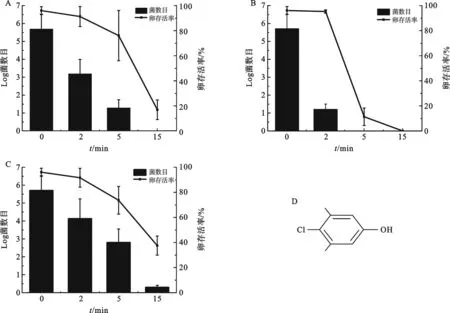
图1 3种不同消毒剂的消毒效果(卵表面菌数和卵存活率)的比较 A 75%乙醇; B 次氯酸;C 威露士(1∶30,威露士/水);D 对氯间二甲基苯酚分子结
2.2 果蝇胚胎无菌操作的优化 如图1所示,虽然HClO溶液消毒效果最好,但其毒性最大,容易引起胚胎死亡.本研究进一步摸索不同浓度的HClO溶液与75%乙醇、威露士联合消毒除菌的效果,结果表明,HClO溶液的浓度为原试剂浓度的40%以上时,经过1 min消毒处理后就能保证卵表面无菌(图2),果蝇胚胎的存活率为67.3%,远高于3种消毒液单独除菌后卵的存活率,说明改进的消毒方法对胚胎毒性比较小(图2).因此,本研究增加了使用威露士联合消毒方法,并且找到HClO最适浓度,从而建立了一套高效的无菌果蝇胚胎的技术和方法.
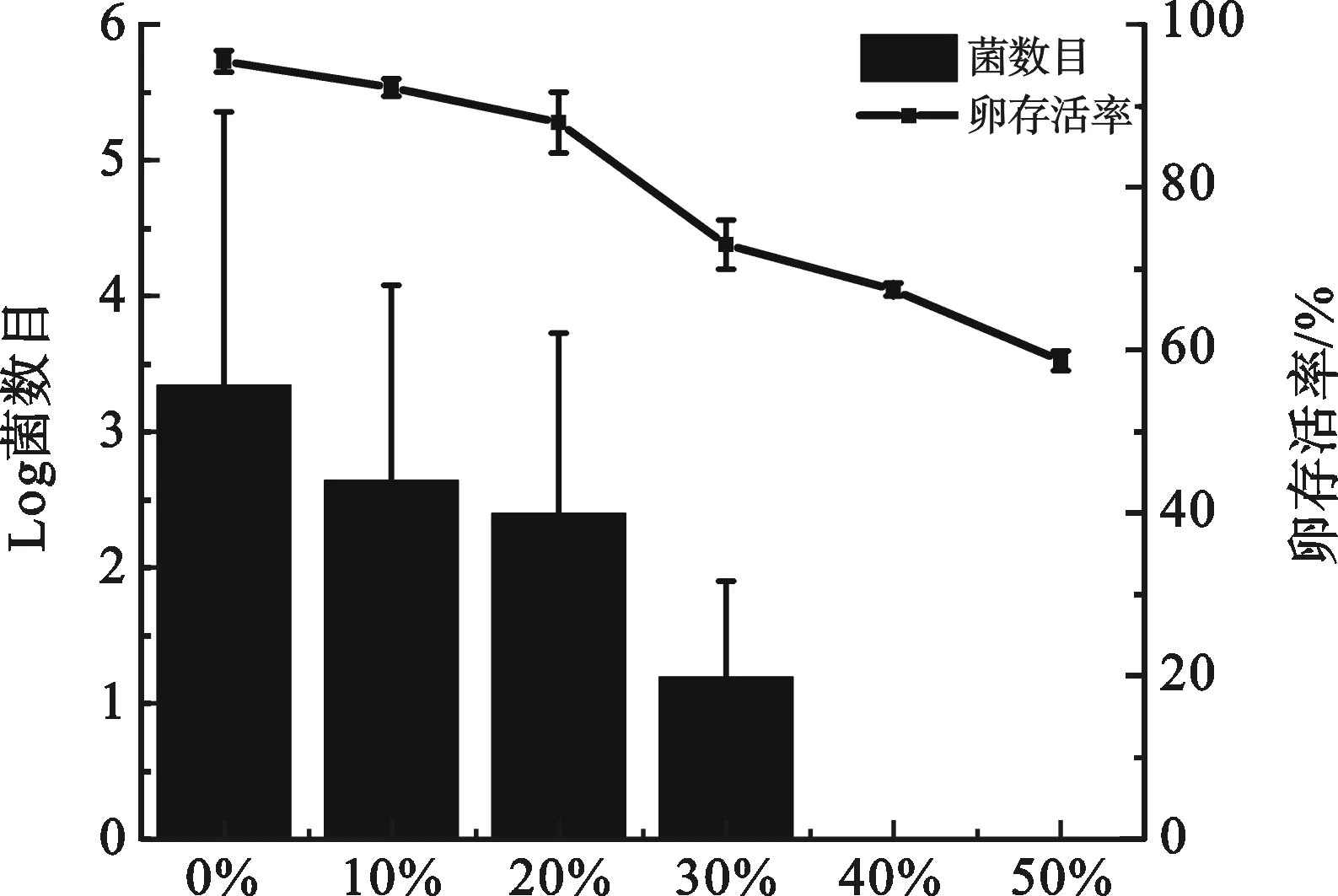
图2 不同浓度次氯酸与威露士、乙醇共处理后卵表面菌数和卵存活
2.3 酵母促进果蝇发育 在自然界中,果蝇喜食腐烂的水果.这些水果含有大量的酵母菌,同时酵母也是实验室饲养果蝇的主要食物之一.因此,在构建无菌果蝇基础上进一步研究灭菌后酵母浓度对无菌果蝇发育与生长的影响.本研究运用上面无菌果蝇技术,分别建立无菌果蝇、常规饲养果蝇和无菌果蝇卵补加果蝇混合菌,探究不同浓度的酵母食物对它们发育的影响.如图3所示,在营养条件充足(酵母浓度高于2.5%)的情况下,GF、CR和GF+CR菌3种果蝇发育几乎没什么差异.例如:酵母的浓度为5%时,CR果蝇蛹发育平均时长为(4.5±0.2)d,成虫为(8.8±0.3)d,GF果蝇蛹发育平均时长为(5.1±0.2)d,成虫为(9.0±0.2)d(P>0.05),无明显差异.但是在营养条件匮乏(酵母浓度小于1%)的情况下,CR果蝇发育周期比无菌果蝇短.例如:在酵母的浓度为0.5%时,CR果蝇蛹发育平均时长为(6.5±0.3)d,成虫为(11.8±0.1)d,而GF果蝇蛹发育平均时长为(18.5±0.8)d(P<0.001),成虫为(19.5±1.3)d(P<0.001).结果说明酵母能够促进果蝇蛹和成虫出现,并且在这6种不同浓度酵母饲养的条件下,GF+CR菌的果蝇蛹和成虫的发育与CR果蝇之间没有明显差异(P>0.05),混合菌可以挽救GF果蝇发育迟缓,排除了试剂毒导致果蝇发育迟缓的可能性.
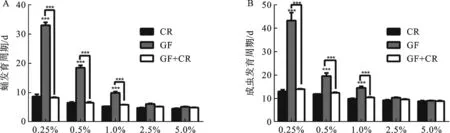
图3 不同酵母浓度对CR、GF、GF+CR蛹和成虫发育周期的影响a: CR、GF、GF+CR菌在不同浓度酵母下蛹发育周期;B: CR、GF、GF+CR菌在不同浓度酵母下成虫发育周
3 讨论
最近,对宿主和共生微生物菌群之间的研究已经取得了突破[8-9].但是由于肠道微生物数量多、种类复杂以及作用广泛等原因,该领域仍然有很多关键性的问题尚未解决[10].20世纪后叶,随着宿主动物与其肠道微生物全基因组测序技术的发展,元基因组和荟萃分析等技术的兴起,使得在分子水平上研究肠道微生物对宿主的影响成为可能.因为人和一些高等哺乳动物结构和功能上的复杂性,研究肠道微生物对宿主的影响上有诸多不便,因而选择合适的模式生物来研究肠道微生物对宿主的影响已成为趋势.
因为黑腹果蝇生活史短、个体小、易饲养、繁殖快、染色体少、突变型多以及表型明显等特点,已成为研究人员普遍选择的模式生物之一.果蝇肠道内定植的微生物相对简单,容易建立无/悉生果蝇,能为研究提供一个特别的模型[7].首先,果蝇受精卵表面包被着绒毛膜和卵黄膜的外壳,这层结构能够阻止外界微生物进入内部胚胎,即使通过产道时胚胎仍然为无菌状态,并且一直保持到幼虫孵化(25 ℃,产卵后12 h以内).但是自然分娩的哺乳动物经过产道出生,难免会有微生物的存在.其次,果蝇体外产卵,有利于建立无菌模型.收集果蝇12 h之内产下的卵,通过体表消毒法去除表面的微生物,然后接种在高压灭菌的食物中,即可建立无菌模型.再者,果蝇肠道结构与人有很大的相似性[11].人肠道由小肠、大肠和直肠三大段组成,果蝇肠道同样分为前肠、中肠和后肠;并且在肠道结构上也很相似,均包括肠粘膜、肠绒毛、分泌细胞和肌肉层等.最后,果蝇肠道微生物与人肠道微生物有很高的保守型和通用性.在人体肠道中主要优势菌群为厚壁菌门和拟杆菌门[2].研究已经确定厚壁菌门也是果蝇肠道菌落代表,主要包括乳杆菌科和肠球菌科[12].因此,相比较大型哺乳动物,无/悉生果蝇具有重要的科研价值,可作为一个很好的工具用于探索微生物和宿主之间的关系,更深入地了解肠道微生物的功能.本研究改进了GF果蝇操作步骤,提高了建立无/悉生果蝇的概率,从而解决了无菌动物来源问题,有助于本领域科研发展.
因为环境的不同,果蝇卵表面的细菌种类和数量也会不同.之前的文献报道,他们是只采用乙醇和次氯酸消毒,我们实验室在验证建立果蝇无菌体系的时候发现,该方法有时候能够得到无菌卵,但是对于有些果蝇培养环境中含有较多易形成孢子的革兰氏阳性菌时,该方法有时候不能够消毒彻底,得不到无菌卵,所以我们加上了一种消毒试剂——威露士.威露士的主要成分为对氯间二甲苯酚,对氯间二甲苯酚化学性质稳定,在室温下性质稳定.是一种广谱的防霉抗菌剂,对多数革兰氏阳性、阴性菌,真菌,霉菌都有杀灭功效.我们在此基础上,改变了次氯酸和乙醇浓度和处理时间,能够更有效地获得无菌卵的同时也保证了卵较高的成活率.
对氯间二甲苯酚即4-氯-3,5-二甲基苯酚是酚类化合物的一种衍生物,通过使蛋白质变性达到杀菌效果.对多数革兰氏阳性、阴性菌,真菌,霉菌都有杀灭功效,但它对细菌的抑制力要强于霉菌[13].1)苯环上的卤原子是比较稳定的,一般不会发生取代或消去反应(除非间位上有硝基).2)苯环上的甲基可以用高锰酸钾氧化成—COOH,然后高温与NH3反应生成酰胺,通过霍夫曼酰胺降解得到苯胺,苯胺氧化就可以得到硝基苯.3)酚羟基很不稳定,一般需要保护,或是最后生成羟基.
果蝇肠道内定植的微生物相对简单和容易建立无菌和悉生果蝇,它为我们提供了一个特别的模型.本研究改进了GF果蝇操作步骤,这个模型相对比较简单,容易操作,并且果蝇也很适合用来研究关于肠道微生物相关的一些信号通路和分子机制,从而能够使肠道微生物比较有挑战性的一个难题得以简化.我们用不同浓度酵母食物来统计GF、CR和GF+CR菌蛹和成虫发育的天数,肠道微生物可以促进宿主的发育,这也提示我们,肠道微生物可能通过调控宿主某些基因直接或者间接地参与调控宿主身体的发育.而果蝇,染色体结构相对简单,全基因组测序已经完成[14],并且通过这么多年的人工突变和筛选,现已经发现很多便于表型标记的遗传操作和分子标记等等.更重要的是,如增强子陷阱技术、定点同源重组技术、双组分异位基因表达系统、嵌合体分析技术及基因定点敲除技术等都可以在果蝇上使用[15],甚至有些技术只能够在果蝇上使用.果蝇作为一种研究信号通路的工具所具有的优势不言而喻.
之前,人们对肠道微生物功能的认知和研究主要集中在以下3个方面——营养作用、免疫调节及其抗感染功效[16].肠道微生物帮助人体消化食物、提供某些人体必需的营养,并参与和调控免疫反应[17-18].随着认知的深入,肠道菌群的特征与演变、肠道菌群与宿主的生理和疾病关系、粪菌移植、肠道微生物与宿主间信号识别与传递等领域也取得了一定的进展[19],但离我们完全解开肠道微生物的作用还相距甚远.近年来,随着对人体共生微生物研究的深入,特别是在人基因组和宏基因组计划的完成及精准医疗(Precision Medicine)等概念提出的情况下,人们发现微生物可能对一些器官的活动(如大脑)及心理活动和情绪(抑郁症等方面)的调控有着重要的影响[20-22],并且肠道微生物与某些疾病(如肥胖症、自生免疫疾病等)直接相关[23-24].所以,果蝇-细菌模型在研究这些问题上可以作为一个优秀的工具,来探索微生物和宿主之间关系,更深入地解析肠道微生物的功能,特别是利用无菌果蝇来揭示大脑与肠道功能等相关方面的研究.
[1] Hooper L V, Gordon J I. Commensal host-bacterial relationships in the gut[J]. Science, 2001, 292(5519): 1115-1118.
[2] Schnorr S L, Candela M, Rampelli S, et al. Gut microbiome of the Hadza hunter-gatherers[J]. Nature Communications, 2014, 5(3654):3654.
[3] Lee W J, Brey P T. How microbiomes influence metazoan development: insights from history andDrosophilamodeling of gut-microbe interactions[J]. Annual Review of Cell & Developmental Biology, 2013, 29(6):571-592.
[4] Rakoffnahoum S, Foster K R, Comstock L E. The evolution of cooperation within the gut microbiota[J]. Nature, 2016, 533(7602): 255-259.
[5] 刘威, 李玉娟, 刘晓梁, 等. 产气荚膜梭菌促进黑腹果蝇的生长和发育[J]. 昆虫学报, 2016, 59(5): 530-537.
[6] Bakula M. The persistence of a microbial flora during postembryogenesis ofDrosophilamelanogaster[J]. Journal of invertebrate pathology, 1969, 14(3): 365-374..
[7] Storelli G, Defaye A, Erkosar B, et al.LactobacillusplantarumpromotesDrosophilasystemic growth by modulating hormonal signals through TOR-dependent nutrient sensing[J]. Cell metabolism, 2011, 14(3): 403-414.
[8] Ryu J H, Kim S H, Lee H Y, et al. Innate immune homeostasis by the homeobox gene caudal and commensal-gut mutualism inDrosophila[J]. Science, 2008, 319(5864): 777-782.
[9] Zhernakova A, Kurilshikov A, Bonder M J, et al. Population-based metagenomics analysis reveals markers for gut microbiome composition and diversity[J]. Science, 2016, 352(6285): 565-569.
[10] Charroux B, Royet J. Gut-microbiota interactions in non-mammals: what can we learn fromDrosophila?[C]//Seminars in immunology. Academic Press, 2012, 24(1): 17-24.
[11] Falony G, Joossens M, Vieira-Silva S, et al. Population-level analysis of gut microbiome variation[J]. Science, 2016, 352(6285): 560-564.
[12] Wong C N A, Ng P, Douglas A E. Low‐diversity bacterial community in the gut of the fruitflyDrosophilamelanogaster[J]. Environmental microbiology, 2011, 13(7): 1889-1900.
[13] 张文福. 医学消毒学[J]. 北京:人民军医出版社 2002: 444-449.
[14] Guo L, Xie M Y, Yan A P, et al. Simultaneous determination of five synthetic antioxidants in edible vegetable oil by GC-MS[J]. Analytical and bioanalytical chemistry, 2006, 386(6): 1881-1883.
[15] Adams M D, Sekelsky J J. From sequence to phenotype: reverse genetics inDrosophilamelanogaster[J]. Nature Reviews Genetics, 2002, 3(3): 189-198.
[16] Maynard C L, Elson C O, Hatton R D, et al. Reciprocal interactions of the intestinal microbiota and immune system[J]. Nature, 2012, 489(7415): 231-241.
[17] Gibson G R. Dietary modulation of the human gut microflora using the prebiotics oligofructose and inulin[J]. The Journal of Nutrition, 1999, 129(7): 1438-1441.
[18] Flint H J, Duncan S H, Scott K P, et al. Interactions and competition within the microbial community of the human colon: links between diet and health[J]. Environmental Microbiology, 2007, 9(5): 1101-1111.
[19] Ramanan D, Bowcutt R, Lee S C, et al. Helminth infection promotes colonization resistance via type 2 immunity[J]. Science, 2016, 352(6285): 608-612.
[20] Heijtz R D, Wang S, Anuar F, et al. Normal gut microbiota modulates brain development and behavior[J]. Proceedings of the National Academy of Sciences, 2011, 108(7): 3047-3052.
[21] Hsiao E Y, McBride S W, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders[J]. Cell, 2013, 155(7): 1451-1463.
[22] Sampson T R, Mazmanian S K. Control of brain development, function, and behavior by the microbiome[J]. Cell host & microbe, 2015, 17(5): 565-576.
[23] Remely M, Tesar I, Hippe B, et al. Gut microbiota composition correlates with changes in body fat content due to weight loss[J]. Beneficial microbes, 2015, 6(4): 431-439.
[24] Zhao L. The gut microbiota and obesity: from correlation to causality[J]. Nature Reviews Microbiology, 2013, 11(9): 639-647.
(责任编辑 游俊)
The modification of germ-freeDrosophilamodel and the effectsof yeast on the development of hosts
HU Kunkun1,2, LI Yujuan2, LIU Wei2,3, JIN Shan1
(1.College of Life Sciences, Hubei University, Wuhan 430062, China;2.Science and Technology Center, Fenyang College of Shanxi Medical University, Fenyang 032200, China;3.Department of Medical Laboratory Science, Fenyang College of Shanxi Medical University, Fenyang 032200, China)
All metazoan including human inhabit a large number of microorganisms. The complexity and diversity of bacterial community restricts us to explore the underlying mechanism of the relationship of microbes and hosts. Therefore, it is necessary to use germ-free and/or gnotobiotic animal model in research, and fruit flyDrosophilaacted as this excellent model, due to its amenability to genetic study, lower microbiota complexity, and the easiness in manipulating germ free flies. At first, we optimized the protocol of germ-freeDrosophilamodel, and found that Walch solution cooperated with chloride and ethanol solution to remove the microbes on the surface of eggs, the eradication efficiency toEscherichiacoli,StaphylococcusaureusandCandidaalbicanswas 99.999%, and efficiently generated germ-freeDrosophilamodel, eggs survival rate increased from about 50% to 67.3%. Based on this model, we investigated the potential roles of yeast on hosts, and found that yeasts were required to promote the development of fruit flies in a dose-dependent manner. In the condition of poor nutrition (0.5% yeast) cases, conventional breeding ofDrosophilapupae and eclosion time were 6.9 d and 11.7 d. sterileDrosophilapupae and eclosion time were delayed to 7.8 d and 18.9 d. Indicated symbiotic microbes were required to promote the development ofDrosophila. In conclusion, the optimized protocol of germ-freeDrosophilamodel contributed to our knowledge of interaction of microbes and hosts.
Drosophilamelanogaster; germ-free model; gnotobiotic; development; yeast
2016-12-22
国家自然科学基金(31501175)、山西医科大学汾阳学院人才引进科研启动基金(1423)资助
胡坤坤(1991-),男,硕士生,E-mail:1197787891@qq.com;金珊,通信作者,E-mail:jinshan20032003@126.com
1000-2375(2017)05-0468-06
Q344+.3
A
10.3969/j.issn.1000-2375.2017.05.006

