肿瘤放射治疗并发放射性皮炎的相关因素及护理
彭丽娟, 周秀琴, 熊 曼
(中航工业3201医院 肿瘤内三科, 陕西 汉中, 723000)
肿瘤放射治疗并发放射性皮炎的相关因素及护理
彭丽娟, 周秀琴, 熊 曼
(中航工业3201医院 肿瘤内三科, 陕西 汉中, 723000)
目的 探讨肿瘤放射治疗并发放射性皮炎的相关因素及护理方法。方法 选择100例肿瘤放射治疗并发放射性皮炎患者设为观察组,实施护理干预; 另选取同时期100例肿瘤放射治疗未并发放射性皮炎患者设为对照组,比较2组临床基本资料,分析放射性皮炎发生的相关因素,对比观察组患者护理前后放射性皮炎发生程度及疼痛程度。结果 2组患者间合并高血压、糖尿病及体质量指数、肿瘤分期、使用补偿膜相比,差异有统计学意义(P<0.05); 经Logistic多元回归分析发现,合并糖尿病、肥胖、使用补偿膜是肿瘤放射治疗并发放射性皮炎发生的独立危险因素(P<0.05); 观察组护理后放射性皮炎发生程度较护理前降低(P<0.05), 且护理后VAS评分(2.1±0.4)分较护理前(4.7±1.5)分降低(P<0.05)。结论 肥胖、合并高血压、使用补偿膜是肿瘤放射治疗并发放射性皮炎的危险因素,应用护理干预措施可缓解患者疼痛,减轻皮炎发生程度,有利于预后。
肿瘤; 放射治疗; 放射性皮炎; 危险因素; 护理
随着医疗技术的日益进步,放射治疗已在临床广泛应用,取得了肿瘤局控收益,在延长患者寿命以及改善生存质量中具有重要作用[1]。但在放射治疗期间,由于放射剂量逐渐增加,除癌细胞受到破坏外,皮肤也会在一定程度上受到损伤,进而引发放射性皮炎[2-4]。放射性皮炎的早期临床症状表现为水肿、疼痛,晚期反应包括色素沉着、毛细血管扩张、皮肤纤维化,病情往往难以逆转[5]。
1 资料与方法
1.1 一般资料
选择本院2014年6月—2016年12月收治的100例肿瘤放射治疗并发放射性皮炎患者设为观察组,其中男61例、女39例,年龄27~76岁,平均(51.6±11.4)岁,疾病类型为乳腺癌40例、食道癌27例、肺癌20例、鼻咽癌13例。另选取同期就诊于本院的100例肿瘤放射治疗未并发放射性皮炎患者设为对照组,其中男59例、女41例,年龄25~77岁,平均(49.7±10.6)岁,疾病类型为乳腺癌38例、食道癌28例、肺癌19例、鼻咽癌15例。2组放射剂量均为50GY,且性别、年龄、疾病类型及放射剂量具有均衡性(P>0.05)。
1.2 方法
1.2.1 相关因素分析: 比较2组患者的一般资料,包括年龄、是否合并糖尿病及高血压、体质量指数、肿瘤分期、是否使用补偿膜等。
1.2.2 护理方法: 观察组实施相关护理干预。① 心理护理。放疗前加强交流,了解患者存在的心理问题,如焦虑、恐惧等,讲解放疗的相关知识及必要性; 放疗期间,密切观察患者体征变化,鼓励其说出内心想法,告知皮肤反应的处理方式及发生机制[6-7]。② 放疗前工作。首先向患者讲解预防放射性皮炎的方法,如放疗前摘除耳环、假牙、钥匙、钢笔、项链等金属制品,降低皮肤的损伤程度; 用软毛巾沾温水对照射区皮肤进行清洗,禁用热水浸浴或肥皂擦拭,避免冷热刺激,禁用刺激性消毒剂(乙醇、碘酒)涂擦,照射野禁止用胶布贴; 嘱患者穿宽松、柔软等棉织品衣物,减少衣物摩擦; 放射野避免日光直接照射[8-9]。③ 饮食护理。为避免患者在放疗中并发低蛋白症,应嘱患者多进食高蛋白、富含营养、高维生素的温凉食物[10]。④ 局部用药护理。针对患者放射性皮炎发生程度进行对症护理,对Ⅰ度皮肤反应患者涂抹0.2%薄荷粉,对Ⅱ度皮肤反应患者予0.5%洗必泰棉球擦洗后喷涂贝复剂,对局部感染者敷抗生素软膏[11]。
1.3 观察指标
① 分析危险因素。② 放射性皮炎分级。0级: 皮肤无显著变化; Ⅰ级: 脱发、出汗、脱皮减少,皮肤出现暗红色斑; Ⅱ级: 接触性疼痛,中度水肿,湿性脱皮且呈片状; Ⅲ级: 融合性湿性脱皮,皮肤发生凹陷性水肿; Ⅳ级: 皮肤发生坏死、出血及溃疡。③ 疼痛程度[12-13]。于护理前后采用视觉模拟评分量表(VAS)评分对观察组患者疼痛程度进行评估,范围0~10分,分数低表示疼痛轻[14]。
2 结 果
2.1 单因素分析
2组患者间合并高血压、糖尿病及体质量指数、肿瘤分期、使用补偿膜相比,差异有统计学意义(P<0.05), 见表1。
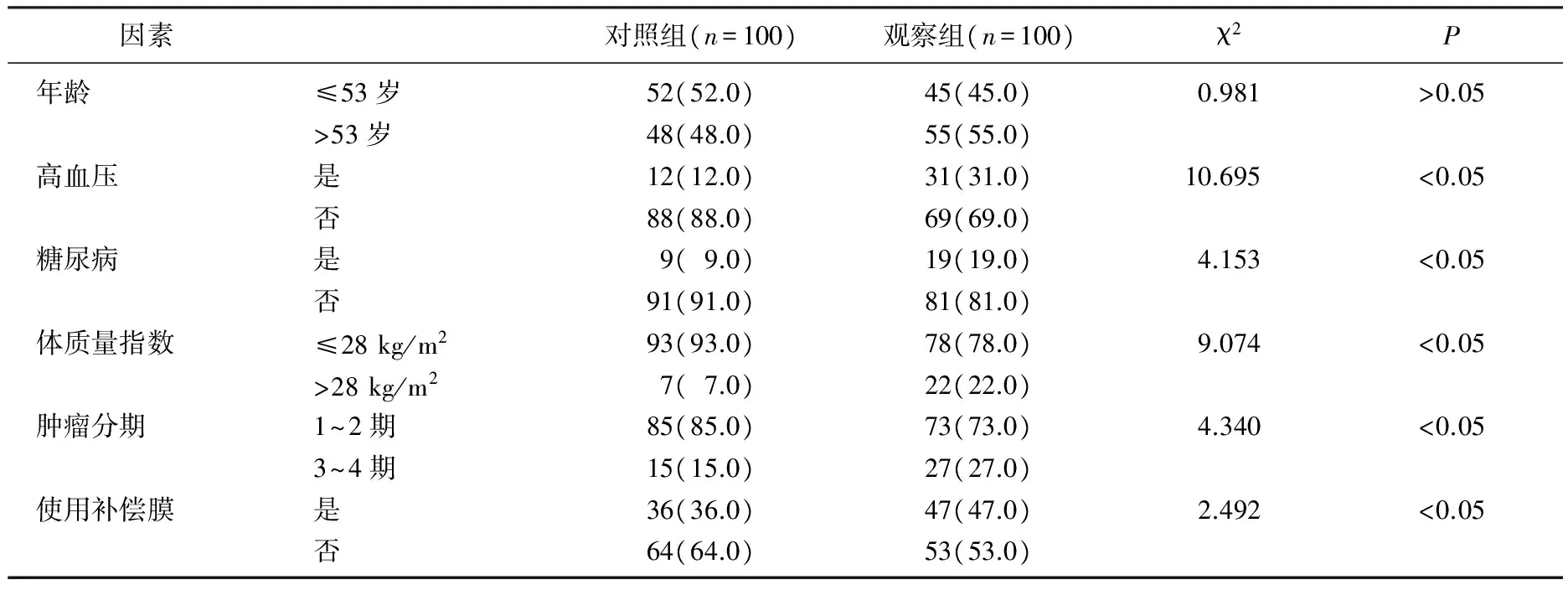
表1 肿瘤放射治疗并发放射性皮炎发生的单因素分析[n(%)]
2.2 多因素分析
经Logistic多元回归分析发现,合并糖尿病、肥胖、使用补偿膜是肿瘤放射治疗并发放射性皮炎发生的独立危险因素(P<0.05), 见表2。
2.3 放射性皮炎发生情况
护理后,观察组患者放射性皮炎发生程度较护理前降低,差异有统计学意义(P<0.05), 见表3。
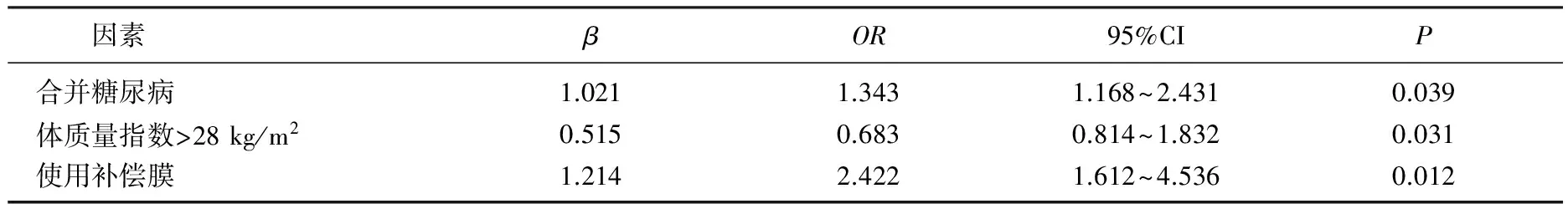
表2 肿瘤放射治疗并发放射性皮炎发生因素的Logistic分析

表3 观察组护理前后放射性皮炎发生情况[n(%)]
与护理前比较, *P<0.05。
2.4 疼痛程度
观察组护理前VAS评分为(4.7±1.5)分,护理后VAS评分为(2.1±0.4)分,护理后VAS评分低于护理前,差异有统计学意义(P<0.05)。
3 讨 论
放疗在杀伤肿瘤细胞的同时会损伤患者正常组织,促使放射野毛细血管出现反射性扩张,令淋巴回流发生障碍,皮肤局部出现红斑,或形成充血性反应,引发微循环障碍及血管损伤,即皮肤反应[15-16]。放射性皮炎的发生原因与诸多因素相关,本研究经Logistic多元回归分析发现,合并糖尿病、肥胖、使用补偿膜是肿瘤放射治疗并发放射性皮炎发生的独立危险因素(P<0.05), 使用补偿膜越频繁、越厚,则皮肤受损程度越严重[17]。除此之外,以下几点因素在放射性皮炎的发生及发展过程中也占重要位置: ① 精神心理因素。由于肿瘤患者缺乏对疾病的正确认识,加之皮肤发生炎症,容易受疼痛不适、经济压力等因素影响而产生沮丧、焦虑等负性情绪,降低治疗依从性,影响治疗进程,加重皮炎程度[18]。② 因各种电离辐射导致生物细胞(DNA)发生损伤,可对细胞新陈代谢造成干扰,或导致DNA错构产生突变,此外还可促使组织内过氧化物、氧自由基等分子电离而引发继发性损伤[19]。
本研究结果发现,护理后观察组患者放射性皮炎发生程度较护理前明显降低, VAS评分(2.1±0.4)分也较护理前降低,证实护理干预有利于减轻患者皮肤损伤程度,延迟放射性皮炎发生时间,并降低疼痛程度[20]。放射治疗的护理关键环节在于预防: 放疗前对患者进行相关心理疏导及健康知识宣教,促使患者做好充分的精神及心理准备; 强化饮食护理力度,促使患者机体抵抗力提高,加强营养[6]; 在放疗过程中随时监测患者皮肤变化,尤其是皮肤褶皱处,倾听患者是否有疼痛、瘙痒、干燥等主诉,若出现异常情况及时采取措施,避免延误放疗时机[21]; 局部合理用药具有杀菌效果确切、用药浓度高等特点,一方面有利于控制创面感染,抑制细胞生长繁殖,另一方面还可促进肉芽组织生长,化瘀解毒,促使创面快速愈合,进而可抗感染、消肿,预防局部继发感染; 换药时遵守无菌操作原则,对患者皮肤疼痛程度、肉芽生长速度、渗出液的量及性质、创面缩小及痂皮形成面积等做好记录,以便随时掌握患者病情进展,更改治疗方案。
综上所述,肥胖、合并高血压、使用补偿膜是肿瘤放射治疗并发放射性皮炎的危险因素,针对上述因素应用护理干预措施可缓解患者疼痛,减轻皮炎发生程度,利于预后。
[1] 马志跃, 余晓旭, 李彬, 等. 中西医结合治疗老年喉癌气管造瘘周围放射性皮炎的临床研究[J]. 现代中西医结合杂志, 2016, 25(3): 313-315.
[2] 颜明明, 陈画华, 杜育玲. 生茶油预防放射性皮肤损伤效果分析[J]. 国际护理学杂志, 2009, 28(1): 68-69.
[3] Trotti A, Colevas A D, Setser A, et al. CTCAE v3.0: development of a comprehensive grading system for the adverse effects of cancer treatment[J]. Semin Radiat Oncol, 2003, 13(3): 176-181.
[4] 王丹惠. 强化营养护理干预对放疗患者放射性皮炎的预防效果[J]. 实用临床医药杂志, 2016, 20(22): 169-170.
[5] 刘艳, 秦亚辉. 芦荟硅霜防治鼻咽癌放射壮皮炎的临床观察[J]. 护士进修杂志, 2011, 26(16): 1523-1524.
[6] 罗朝霞, 江华容, 陈大春, 等. 三种皮肤外用药在防治鼻咽癌患者放射性皮炎中的效果研究[J]. 中国实用护理杂志, 2016, 32(27): 2118-2122.
[7] 李洁霞, 梁妙玲, 张芸. 施肤宁在防治鼻咽癌放射性皮炎的临床观察和护理[J]. 中外医学研究, 2013, 11(36): 77-78.
[8] Szumacher E, Wig Jaton A, Franssen E, et al. PhaseⅡstudy assessingthe effectiveness of Biafine cream as a prophylactic agent forradiation induced acute skin toxicity to the breast in women undergoing radiotherapy with concomitant CMF chemotherapy[J]. Int J Radiat Oncol Biol phys, 2001, 51(1): 81-86.
[9] 李祎萍. 两种防护喷剂用于预防放射性皮炎的效果比较[J]. 实用临床医药杂志, 2016, 20(2): 146-147.
[10] 万永慧, 罗静, 褚玉新, 等. 放射性皮炎的临床分级与护理[J]. 护士进修杂志, 2016, 31(8): 737-739.
[11] 罗朝霞, 江华容, 陈大春, 等. 三乙醇胺防治鼻咽癌患者放射性皮炎的效果观察及护理[J]. 护士进修杂志, 2016, 31(1): 39-40.
[12] 李彩萍, 李淑珍, 张钦华, 等. 46例鼻咽癌放射性皮炎应用奥克喷的护理效果[J]. 中国医药指南, 2013, 11(34): 317-318.
[13] 王芳, 金丽芬, 戴艺, 等. 美皮康敷料治疗鼻咽癌放疗患者放射性皮炎的效果[J]. 国际护理学杂志, 2016, 35(13): 1869-1871.
[14] 姚洪芳. VI腔护理干预对鼻咽癌放疗口腔黏膜反应的影响[J]. 现代中西医结合杂志, 2013, 22(5): 552-553.
[15] 瞿舒裴, 左秋芳, 李静, 等. 积雪草苷霜治疗鼻咽癌放射性皮炎的效果[J]. 护士进修杂志, 2010, 25(4): 359-360.
[16] Jayathirtha M G, Mishra S H. Preliminary immunomodulatory activities of methanol extracts of Eclipta alba and Centella asiatica[J]. Phyto medicine, 2004, 11(4): 361-365.
[17] 李丹, 王国权, 郭颖, 等. 赛肤润治疗头颈部放射性皮炎疗效观察与护理[J]. 中国基层医药, 2014, 21(6): 945-946.
[18] 陈翠梅, 胡梅荣, 陈小琼, 等. 美宝湿润烧伤膏联合金因肽治疗鼻咽癌放射性皮炎效果的研究[J]. 当代护士, 2013(10): 86-87.
[19] Palatty P L, Azmidah A, Rao S, et al. Topical application of a san-dal wood oil and turmeric based cream prevents radiodermatitis inhead and neck cancer patients undergoing external beam radio-therapy: a pilot study[J]. Br J Radiol, 2014, 87(1038): 490-497.
[20] Katayama Y, Yamawaki S, Yoshimura M, et al. Severe acute ra-diodermatitis in a keloid patient with Takayasu S arteritis[J]. Plast Reconstr Surg Glob Open, 2015, 2(12): 270-270.
[21] 顾炜, 张家源. 放射性皮炎中医防治护理进展[J]. 中华现代护理杂志, 2014, 20(23): 2999-3001.
Relevant factors and nursing care of radiation dermatitis in patients treated by radiotherapy
PENG Lijuan, ZHOU Xiuqin, XIONG Man
(DepartmentofOncology, 3201stHospitalofChinaAviationIndustry,Hanzhong,Shaanxi, 723000)
Objective To analyze the related factors and nursing of radiation dermatitis. Methods A total of 100 radiation dermatitis patients treated by radiotherapy were as observation group given nursing intervention. At the same time, another 100 patients with radiation therapy in our hospital without concurrent radiation dermatitis were as control group, clinical basic information and related factors of radiation dermatitis were compared, and degree of radiation dermatitis and the degree of pain before and after treatment in the observation group were observed. Results There was a significant difference between the two groups in hypertension, diabetes mellitus and body mass index and tumor stage (P<0.05). Logistic multivariate regression analysis showed that diabetes mellitus, obesity and the use of compensatory membrane were independent risk factors for the development of radiation dermatitis by tumor radiotherapy (P<0.05). The degree of radiation dermatitis in observation group was significantly lower than nursing before, VAS score was (2.1±0.4) points, which was lower than (4.7±1.5) points than treatment before, the differences were statistically significant (P<0.05). Conclusion Obesity, combined with hypertension, the use of compensation film are risk factors of radiation dermatitis, and nursing intervention measures can help relieve pain for patients with dermatitis and reduce the degree of dermatitis, so it is favorable for prognosis.
tumor; radiation; radiation dermatitis; relevant factor; care
2017-03-24
陕西省汉中市科技局课题(20120435)
熊曼, E-mail: 2188244413@qq.com
R 473.73
A
1672-2353(2017)16-027-04
10.7619/jcmp.201716009

