放射性碘化氟维司群对激素依赖性人乳腺癌治疗作用研究
印国兵,曾 斌,刘 瑛,孙 璐
(1.重庆医科大学附属第二医院乳甲胰外科 400010;2.重庆医科大学研究生院 400010)
放射性碘化氟维司群对激素依赖性人乳腺癌治疗作用研究
印国兵1,曾 斌2△,刘 瑛2,孙 璐2
(1.重庆医科大学附属第二医院乳甲胰外科 400010;2.重庆医科大学研究生院 400010)
目的 探明碘化氟维司群对人乳腺癌细胞的生长抑制作用及对裸鼠重要脏器的影响。方法 明确碘化氟维司群对MCF-7细胞和MDA-MB-231细胞杀伤作用的不同;建立MCF-7细胞裸鼠移植瘤模型,采用不同方式给药,观察肿瘤、肝肾等重要脏器的情况。结果 MTT实验表明碘化氟维司群对MCF-7细胞和MDA-MB-231细胞具有相似的细胞毒作用,但前者稍强于后者,一过性接触实验表明碘化氟维司群能够与MCF-7细胞结合继续发挥肿瘤抑制效应,而在MDA-MB-231细胞则不然(P<0.05);经尾静脉注射碘化氟维司群后,肿瘤部位有放射性浓聚,占到注射总量的(4.33±0.28)%,瘤体先缩小后增大,血液中的放射性占到注射总量的(20.76±2.54)%,肝肾等脏器也有放射性分布,其分布符合雌激素受体分布状况;瘤体局部注射显示强大的肿瘤杀伤作用,放射性分布基本局限于瘤体区域。结论 碘化氟维司群对乳腺癌MCF-7细胞有良好的抑制作用,是放疗和内分泌治疗作用的叠加,且对裸鼠的一般状况及重要脏器的影响是可控的。
碘化氟维司群;乳腺肿瘤;MCF-7;MDA-MB-23;肿瘤移植;生长抑制
乳腺癌大部分属于激素依赖性肿瘤,体内雌激素可特异性地与雌激素受体(estrogen receptors,ER)结合,通过受体后效应对肿瘤细胞起抑制作用,具有高度的特异性。氟维司群是一种类固醇抗雌激素药物,临床上作为一类ER拮抗剂广泛用于乳腺癌的治疗,能较大程度地延缓肿瘤的生长,对于ER阳性晚期乳腺癌患者具有良好疗效。131I主要依靠β射线发挥放射治疗作用,射程以毫米计,对周围组织的损伤小,若将具有放疗作用的131I标记到氟维司群分子上,其将与乳腺癌细胞ER结合,就可能实现131I对乳腺癌的靶向治疗,而且是内分泌治疗和放射治疗的结合,极有可能产生协同效应,从而为乳腺癌治疗提供新的方向。
1 材料与方法
1.1 细胞株、裸鼠和主要试剂及其配制 MCF-7细胞和MDA-MB-231细胞(中国科学院典型培养物保藏委员会细胞库);21 d龄雌性BALB/C裸鼠(重庆医科大学实验动物中心);碘化氟维司群[1](131I-fulvestrant)采用改良氯胺T法于室温、pH值7.5、反应时间为5 min的条件下合成,于反应体系中加入4 ℃冰双蒸水促其析出为乳浊液,20 000 r/min 4 ℃低温离心获取沉淀,50 ℃烘干后精密称质量,以96%无水乙醇加4%二甲基亚砜(DMSO)溶解,放射比活度不低于10 μCi/μL;RMPI-1640培养液、无血清培养液(Hyclon公司)。
1.2 主要仪器设备 台式离心机(KA-1000/TGL-16G,国产);恒温烤箱(MIR160,日本);真空干燥器(CHRIST/ALPHA1-2,德国);微型旋涡混和器(VXH-3,上海);放射性活度探测器(RM905a,北京);紫外分光光度计(UV-265型,日本)。
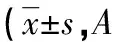
表1 不同剂量碘化氟维司群对A、C组MCF-7细胞在不同时间点的抑制作用值,n=3)
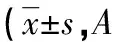
表2 不同剂量碘化氟维司群对B、D组MDA-MB-231细胞在不同时间点的抑制作用值,n=3)
1.4 人乳腺癌MCF-7细胞裸鼠移植瘤的建立[2-3]MCF-7细胞制成2×106个/mL单细胞悬液,于21 d龄BALB/C雌性裸鼠右肩皮下注射0.5 mL,饲养于清洁级屏障系统内设的独立通气笼具。
1.5 尾静脉注射碘化氟维司群后核素在体内分布及对移植瘤、各脏器的影响。
1.5.1 荷瘤裸鼠全身发射型计算机断层(ECT)显像及各主要脏器离体检查放射性活度 经尾静脉注射碘化氟维司群 200 μCi(0.1 mL),1 h后全身麻醉后行ECT扫描,检测时间为300 s。2 h后先摘除眼球取血1 mL,然后处死裸鼠,即刻取出重要脏器称质量,上机检测血液及各脏器放射强度。
1.5.2 尾静脉注射碘化氟维司群后移植瘤的变化及各脏器的影响 9只荷瘤裸鼠分为3组,经体表测量皮下移植瘤体积(长×宽×高)后,A、B、C 3组分别经尾静脉注射溶于含67%乙醇的碘化氟维司群200 μCi(约50 μL)、400 μCi(约100 μL)、100 μL 67%乙醇,每周测量肿瘤体积1次,并每天观察裸鼠一般状况,4周后处死,取重要脏器行苏木素-伊红(HE)染色,光镜下观察。
1.6 瘤体注射碘化氟维司群后移植瘤的变化 3只荷瘤裸鼠,经瘤体内及瘤体基底部多点注射碘化氟维司群200 μCi,24 h麻醉后行ECT扫描,1周后观察肿瘤变化。
2 结 果
2.1 MTT法检测不同浓度碘化氟维司群对人腺癌细胞的抑制作用 A组中各两两比较,差异有统计学意义(P<0.05),抑制作用明显,见表1;B组中各两两比较,差异有统计学意义(P<0.05),见表2;B组与A组同等条件下的值相比,差异无统计学意义(P>0.05);C组抑制作用弱于碘化氟维司群持续存在的A组;D组作用1 h后碘化氟维司群与MDA-MB-231细胞脱离接触,中断放射性损伤,各组生长抑制作用变得微弱,与B组比较差异无统计学意义(P>0.05)。
1.4.1 qRT-PCR检测全血中Tim-3、TGF-β、Smad3、Smad7、Foxp3 mRNA的表达
2.2 动物模型的建立 15只需建立移植瘤模型的裸鼠,14只在接种后4~6周成功长出移植瘤,一次成功率为93.33%,1只未长出,复种2×106个/mL MCF-7细胞后4周亦成功长出移植瘤。直径1 cm左右时即可用于实验。
2.3 经尾静脉注射碘化氟维司群后核素在体内的分布状况 碘化氟维司群注射入裸鼠体内后2 h,核素在血液中的量最大,达到总放射剂量的(20.76±2.54)%,其余脏器占比均较低,见表3。
2.4 荷瘤裸鼠全身ECT显像 可见肿瘤核素显像,但胸腹部脏器显像亦明显,甲状腺显像不明显,见图1。
2.5 经尾静脉注射碘化氟维司群后移植瘤的变化及其对各脏器的影响 A组肿瘤体积在两周内逐步缩小,但第3周开始恢复增大趋势;B组前3周均逐步缩小,第4周恢复增大;C组则维持持续增大的趋势,两两比较差异有统计学意义(P<0.05),见表4。
2.6 一般状况及主要脏器光镜下的形态学变化 各组裸鼠均能耐受尾静脉注射干预因子的作用,未出现死亡;A、B组给药次日开始有食欲缺乏、少动表现,持续约3 d后恢复正常;C组无明显异常表现。给药4周通过对移植瘤和脏器HE染色的观察显示,肝、肺、肾、甲状腺、心、小肠等组织均未出现明显损伤,而肿瘤组织则表现出细胞坏死。
2.7 瘤体注射碘化氟维司群后移植瘤的变化和核素显像结果
2.7.1 移植瘤的变化 瘤体局部注射碘化氟维司群后,3只裸鼠一般状况无明显改变,显示良好的耐受性,MCF-7细胞移植瘤均出现大面积坏死,显示碘化氟维司群对裸鼠移植瘤的强大杀伤作用。给药后72 h处死裸鼠,取肿瘤组织行HE染色观察,可见大面积肿瘤细胞核消失,并失去细胞形态,成为无定形的均匀红染组织,但在邻近正常组织处尚可查见少数残存的MCF-7细胞。
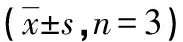
表3 各主要组织器官放射性活度(离体)测量值
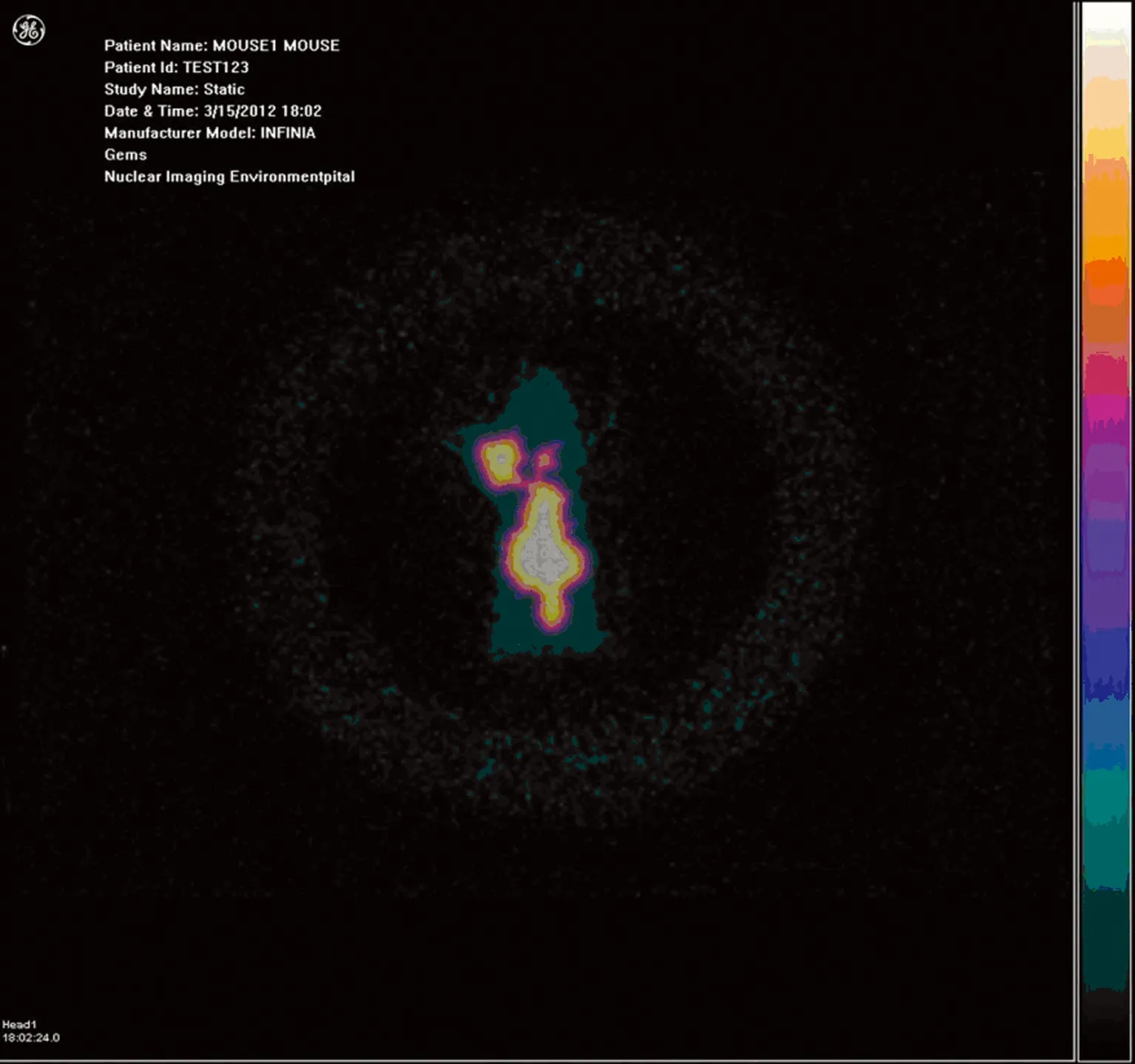
图1 荷瘤裸鼠全身ECT显像

表4 各组干预后肿瘤体积随时间(周)变化
a:P<0.05,两两比较
2.7.2 瘤体局部注射后ECT全身扫描结果 可见核素基本局限在肿瘤部位,未向全身其他部位扩散,见图2。

图2 瘤体局部注射碘华氟维司群的ECT全身扫描结果
3 讨 论
ER是预测乳腺癌内分泌治疗反应和判断乳癌预后一个重要标志,阳性者内分泌治疗反应和预后均好于阴性者[4]。多项研究表明,MCF-7细胞ER-α呈现过度表达或可诱导过度表达[5-8]。
钠碘同向转运体(NIS)利用细胞跨膜钠离子浓度梯度作为驱动力将碘转运至细胞内[9-11],而乳腺癌细胞能表达NIS[12],因此为碘放射治疗乳腺癌提供新的可能。
MTT实验结果发现在碘化氟维司群作用下,两种乳癌细胞均受到生长抑制,一过性接触实验表明两种乳腺癌细胞生长抑制作用均减弱,MCF-7细胞的生长抑制仍然明显强于MDA-MB-231细胞,推测为不论ER-α表达的情况如何,只要培养环境中存在一定剂量的放射性,则MCF-7和MDA-MB-231细胞均会受到放射损伤,表现生长抑制,当去除了培养液中的放射性物质后,MDA-MB-231细胞因无摄取碘化氟维司群的能力而完全脱离放射环境,但MCF-7细胞以其ER与碘化氟维司群的特异结合,从而继续承受放射损伤,其对肿瘤细胞的杀伤作用是放射治疗与内分泌治疗的叠加效应。
MCF-7细胞ER-α呈现过表达[5-8],同时,ER-α呈现全身广泛分布的特点[13-15]。氟维司群不良反应少,因而被视为乳腺癌内分泌治疗的“纯拮抗剂”,甚至有报道称其能下调ER的表达,潜在机制尚不清楚[16-18]。
静脉注射碘化氟维司群后,裸鼠移植瘤的生长表现先抑制后恢复增长的趋势,推测抑制作用是由于碘化氟维司群的放疗和内分泌治疗双重作用的结果;后期的恢复增长与药物在体内的浓度下降有关,包括放射性碘的衰变和氟维司群的生物代谢两方面。荷瘤裸鼠早期表现纳差、少动,肿瘤有生长抑制表现且镜下可观察到肿瘤组织坏死,但对各脏器的形态学检查未发现明显脏器损伤。推测原因在于肿瘤细胞和正常细胞对射线的敏感程度不同,肿瘤细胞更易遭受放射损伤,且损伤修复能力不如正常组织细胞。
瘤体局部注射碘化氟维司群后肿瘤大面积坏死,仅临近正常组织处可查见少许残留癌灶,ECT扫描显示核素集中于肿瘤部位,未向全身扩散。推测由于碘化氟维司群维持了氟维司群水溶性差的特性,局部注射后,碘化氟维司群在局部析出成为结晶,造成局部高放射剂量的环境,可充分发挥其放射性杀灭肿瘤细胞的作用;另外,结晶体虽然不能进入血液循环,但其在组织间隙发生物理位置变迁仍有可能,因而能够在更大的局部范围内发挥抗癌作用。
综上,碘化氟维司群对雌激素依赖性人乳腺癌细胞具有良好的生长抑制作用,其作用机制包括:(1)碘化氟维司群携带的131I对MCF-7细胞的放射性损伤;(2)碘化氟维司群与ER结合,阻断雌激素对MCF-7细胞的支持作用;(3)碘化氟维司群下调ER的表达。因而,笔者认为放射性碘化氟维司群可能成为临床治疗雌激素依赖性乳腺癌的一个新药,是放射治疗与内分泌治疗的协同治疗手段。
[1]印国兵,刘长安.以氟维司群为载体的放射性碘对激素依赖性乳腺癌治疗作用研究[D].重庆:重庆医科大学,2012.
[2]Wang L,Mi C,Wang W.Establishment of lymph node metastasis of MDA-MB-231 breast cancer model in nude mice.[J].Zhonghua Yi Xue Za Zhi,2015,95(23):1862-1865.
[3]Nofiele JT,Cheng HL.Establishment of a Lung metastatic breast tumor xenograft model in nude rats[J].PLoS One,2014,9(5):e97950-97950.
[4]Giacinti L,Giacinti C,Gabellini C,et al.Scriptaid effects on breast cancer cell lines[J].J Cell Physiol,2012,227(10):3426-3433.
[5]Liu L,Ma H,Tang Y,et al.Discovery of estrogen receptor α modulators from natural compounds in Si-Wu-Tang series decoctions using estrogen-responsive MCF-7 breast cancer cells[J].Bioorg Med Chem Lett,2012,22(1):154-163.
[6]Ko YM,Wu TY,Wu YC,et al.Annonacin induces cell cycle-dependent growth arrest and apoptosis in estrogen receptor-α-related pathways in MCF-7 cells[J].J Ethnopharmacol,2011,137(3):1283-1290.
[7]Mendoza RA,Enriquez MI,Mejia SM,et al.Interactions between IGF-I,estrogen receptor-α (ERα),and ERβ in regulating growth/apoptosis of MCF-7 human breast cancer cells[J].J Endocrinol,2011,208(1):1-9.
[8]Hong W,Chen L,Li J,et al.Inhibition of MAP kinase promotes the recruitment of corepressor SMRT by tamoxifen-bound estrogen receptor alpha and potentates tamoxifen action in MCF-7 cells[J].Biochem Biophys Res Commun,2010,396(2):299-303.
[9]Renier C,Do J,Reynaneyra A,et al.Regression of experimental NIS-expressing breast cancer brain metastases in response to radioiodide/gemcitabine dual therapy[J].Oncotarget,2016,7(34):54811-54824.
[10]Chatterjee S,Thaker N,De A.Combined 2-deoxy glucose and metformin improves therapeutic efficacy of sodium-iodide symporter-mediated targeted radioiodine therapy in breast cancer cells[J].Breast Cancer,2015,7:251-265.
[11]Poole VL,Mccabe CJ.Iodide transport and breast cancer[J].J Endocrinol,2015,227(1):R1-12.
[12]Kelkar MG,Senthilkumar K,Jadhav S,et al.Enhancement of human Sodium iodide symporter gene therapy for breast cancer by HDAC inhibitor mediated transcriptional modulation[J].Sci Rep,2016,6(18):19341.
[13]Jan KC,Ku KL,Chu YH,et al.Tissue distribution and elimination of estrogenic and anti-inflammatory catechol metabolites from sesaminol triglucoside in rats[J].J Agric Food Chem,2010,58(13):7693-7700.
[14]Younes M,Honma N.Estrogen receptor β[J].Arch Pathol Lab Med,2011,135(1):63-66.
[15]Ur Rahman MS,Cao J.Estrogen receptors in gastric cancer:Advances and perspectives[J].World J Gastroenterol,2016,22(8):2475-2482.
[16]James R,Thriveni K,Krishnamoorthy L,et al.Clinical outcome of adjuvant endocrine treatment according to Her-2/neu status in breast cancer [J].Indian J Med Res,2011,133(1):70-75.
[17]Mishra AK,Abrahamsson A,Dabrosin C.Fulvestrant inhibits growth of triple negative breast cancer and synergizes with tamoxifen in ERa positive breast cancer by up-regulation of ERβ [J].Oncotarget,2016,7(35):56876-56888.
[18]Fernandes SA,Gomes GR,Siu ER,et al.The anti-oestrogen fulvestrant (ICI 182,780) reduces the androgen receptor expression,ERK1/2 phosphorylation and cell proliferation in the rat ventral prostate[J].Int J Androl,2011,34(5 Pt 1):486-500.
The growth inhibition effect of131I-fulvestrant on the human breast cancer cells*
YinGuobing1,ZengBin2△,LiuYing2,SunLu2
(1.DepartmentofBreast,ThyroidPancreaticSurgery,theSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China;2.GraduateSchoolofChongqingMedicalUniversity,Chongqing400010,China)
Objective To elucidate the inhibitory effect of131I-fulvestrant on the growth of human breast cancer cells and the effect on the important organs.Methods MTT assay was used to clarify the difference in killing effects of the131I-fulvestranton on MCF-7 cells and MDA-MB-231 cells.Breast cancer MCF-7 cell xenografts in nude mice was establishied,and two different administration methods of the131I-fulvestrant in the MCF-7 cell to nude mice were given respectively.Organs and tumours of nude mice were observed.Results MTT assay demonstrated that131I-fulvestrant had similar cytotoxicity against MCF-7 cells and MDA-MB-231 cells,and the former was slightly stronger.Transient contact experiments showed that131I-fulvestrant could play a tumor suppressor effect on MCF-7 cells continually,but MDA-MB-231 cells wasn′t.After the injection of131I-fulvestrant via caudal vein,the radioactivity concentration on tumor site accounted for (4.33±0.28)% of the total injection,and the volume of the tumor reduced before gradually increasing again.Radioactivity in the blood accounted for (20.76±2.54)% of the total injection.Qrgans like liver and kidney also showed radioaction distribution.Its distribution was accorded with the distribution of estrogen receptor.Local injection of131I-fulvestrant got powerful killing effect on the tumor,and the distribution of the radioaction was mainly confined within the tumor.Conclusion131I-fulvestrant has a good inhibitory effect on MCF-7 breast cancer cells,which is a superposition of radiotherapy and endocrine therapy,and it is controllable on the general condition and important organs of nude mice.
131I-fulvestrant;breast neoplasms;MCF-7;MDA-MB-23;neoplasm transplantation;growth inhibition
重庆市自然科学基金资助项目(cstc2012jjA10042);重庆市卫生局科研基金资助项目(2011-2-175)。
印国兵(1974-),副主任医师,博士,主要从事乳腺甲状腺肿瘤治疗研究。
△通信作者,E-mail:719501555@qq.com。
10.3969/j.issn.1671-8348.2017.23.002
R73.33,R73.36
A
1671-8348(2017)23-3173-04
2017-03-18
2017-04-26)
·论 著·

