外源性心钠素对小鼠过敏性哮喘气道炎症的影响及其机制分析*
刘振宽,邢晓莉,李 娜
(天津市第五中心医院呼吸内科 300450)
论著·基础研究
外源性心钠素对小鼠过敏性哮喘气道炎症的影响及其机制分析*
刘振宽,邢晓莉,李 娜
(天津市第五中心医院呼吸内科 300450)
目的 探讨外源性心钠素对过敏性哮喘小鼠模型气道炎症的影响作用及其作用机制。方法 选取SPF级BALBc小鼠48只,采用随机数字表法分为对照组(等量生理盐水干预)、模型组(等量生理盐水干预)、实验组A(外源性心钠素0.5 μg/g)、实验组B(外源性心钠素0.5 μg/g+A71915)。模型组、实验组A、实验组B建模成功后给予对应处理措施,在最后一次激发实验后24 h,采集各组血清、支气管肺泡灌洗液检查炎症因子,采用HE染色观察肺组织病理变化,采用Western blot技术检测肺组织中锌指转录因子(GATA3)蛋白的表达水平。结果 模型组小鼠的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于对照组(P<0.05),实验组A的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于模型组、实验组B(P<0.05);模型组小鼠的肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平均高于对照组(P<0.05),实验组A的肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平均高于模型组、实验组B(P<0.05);模型组小鼠的肺组织中GATA3蛋白表达水平均高于对照组(P<0.05),实验组A肺组织中GATA3蛋白表达水平高于模型组、实验组B(P<0.05)。结论 外源性心钠素会进一步加剧过敏性哮喘小鼠模型的气道炎症反应,与激活炎性细胞、炎症因子释放及增强肺组织中GATA3蛋白表达有关。
心钠素;哮喘;小鼠;外源性;气道炎症;作用机制
过敏性哮喘是一种常见的慢性气道疾病,具有持续存在的气道炎症和气道高反应性等特征,多由嗜酸粒细胞、T 淋巴细胞、中性粒细胞、肥大细胞、气道上皮细胞等以及各种细胞组共同参与,但其作用机制仍不完全清楚[1-2]。有研究表明,心钠素在肺脏免疫及炎症反应的调节过程发挥着重要作用,进而参与了过敏性哮喘的发生和发展过程,但具体作用机制并不明确[3-4]。为此,本研究建立了过敏性哮喘小鼠模型,并分别给予外源性心钠素0.5 μg/g和等量生理盐水进行干预,检测了各组小鼠炎症因子水平及肺组织中锌指转录因子(GATA3)蛋白表达情况,并观察了小鼠肺组织病理变化,进一步探讨了外源性心钠素对过敏性哮喘小鼠模型气道炎症的影响作用及其作用机制。
1 材料与方法
1.1 材料

A:对照组;B:模型组;C:实验组A;D:实验组B
图1 HE染色观察各组小鼠的肺组织情况(HE染色,×200)
1.1.1 实验动物 选取48只SPF级BALBc小鼠,平均体质量(20.0±1.8)g,6~8周龄,购买自南京建成科技有限公司,动物许可证号(SCXK)2014-005,所有动物喂养于光照12 h,室温23~25 ℃,相对湿度45%~60%的实验环境中。
1.1.2 药品与仪器 卵清蛋白(OVA)溶液、小鼠心钠素、小鼠心钠素受体拮抗剂(A71915)均购自美国Sigma公司,小鼠GATA3抗体购自美国 Proteintech公司;白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)以及心钠素检测试剂盒均购自北京中杉金桥生物公司。酶标仪购自德国拜发仪器公司,型号为880;显微镜购自日本奥林巴斯生产,高速离心机购自德国IKA公司。
1.2 方法
1.2.1 分组及造模方法 将48只SPF级BALBc小鼠随机分作4组,即对照组、模型组、实验组A和实验组B,每组各12只小鼠,其中模型组、实验组A和实验组B建立过敏性哮喘模型,方法如下:第0、12天分别腹腔注射OVA溶液,剂量为每只0.1 mL,并于第18~25天连续雾化吸入浓度为5%的OVA溶液进行激发,每次雾化20 min。对照组以磷酸盐缓冲液(PBS)代替OVA溶液进行处理,其他与模型组相同。记录各组小鼠的反应情况,若出现精神异常(烦躁不安、易惊或精神萎靡、反应迟钝)、口唇发绀、呼吸急促或呼吸困难伴腹肌抽搐、大小便失禁等任何一种情况则表示造模成功。实验组A小鼠在每次雾化刺激前30 min经鼻滴入心钠素溶液(0.5 μg/g),其余操作不变;而实验组B小鼠在经鼻滴入心钠素溶液之前30 min经腹腔注射A71915(0.5 μg/g),其他操作与实验组A小鼠相同,模型组和对照组仅给予等量生理盐水进行干预。所有小鼠均在最后一次雾化激发实验24 h后进行肺功能检测,并收集支气管肺泡灌洗液和眼眶血约5 mL。
1.2.2 HE染色 将小鼠脱颈处死后取小鼠肺组织,以4% 中性甲醛溶液固定后作连续切片,HE 染色后进行病理检测。
1.2.3 Western blot技术 取部分小鼠肺组织制备蛋白样,并取约75 μg以10% SDS-PAGE进行电泳,分离后转移至孔径为 0.45 μm 的PVDF 膜,置于5% 脱脂奶粉中封闭2 h;随后加入一抗后 4 ℃孵育过夜,以0.5% TBS-T 溶液洗膜 3 次后再加入辣根过氧化物酶(HRP)标记的二抗进行反应,再以0.5% TBS-T 溶液洗膜 3 次后用化学发光底物试剂(Cell Signaling,Beverly,MA) 进行孵育,最后利用X 射线片显出条带,并采用软件进行吸光度值分析,计算GATA3蛋白β-actin的吸光度比值。
1.2.4 血液细胞学及肺泡灌洗液细胞学检查方法 检测并比较血液中嗜酸性粒细胞(EOS)、淋巴细胞、中性粒细胞;检测并比较各组肺泡灌洗液中EOS、淋巴细胞、中性粒细胞、IL-6、TNF-α。分别取 20 μL 灌洗液和血液与0.38 mL EOS 计数液混匀后在光学显微镜进行 EOS 计数。取灌洗液以1 000 r/min离心10 min后收集上清液,沉淀物涂片后固定,瑞姬染液染色后在显微镜下读取200 个白细胞,分别统计各类白细胞个数并计算各类白细胞所占百分比;上清液利用酶标仪采用酶联免疫吸附法测定IL-6和TNF-α水平,具体检测步骤严格按照试剂盒说明书进行。取少量血液涂片后固定,瑞姬氏染液染色后在显微镜下读取200 个白细胞,分别统计各类白细胞个数并计算各类白细胞所占百分比。
2 结 果
2.1 病理学观察 对照组小鼠支气管、肺泡结构清楚,未见炎症细胞浸润(图1A);模型组可见支气管黏膜充血水肿比较明显,周围组织间隙充满脱落的上皮细胞、大量的炎症细胞浸润在支气管组织周围(图1B);实验组A炎症反应程度较模型组更加严重(图1C),实验组B炎症反应程度较实验组A有所减轻(图1D)。
2.2 各组小鼠血液炎症细胞学检查水平比较 模型组小鼠的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于对照组(P<0.05);实验组A的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于模型组、实验组B(P<0.05);实验组B血液中EOS、淋巴细胞、中性粒细胞所占比例与模型组比较,差异无统计学意义(P>0.05),见表1。

表1 各组小鼠血液炎症细胞学检查水平比较,%)
a:P<0.05,与对照组比较;b:P<0.05,与模型组和实验组B比较。血液白细胞分类因为比较少,用百分比方便统计
2.3 各组小鼠肺泡灌洗液中炎症细胞、细胞因子水平比较 模型组小鼠的肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平均高于对照组(P<0.05);实验组A的肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平均高于模型组、实验组B(P<0.05);实验组B肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平与模型组比较差异无统计学意义(P>0.05),见表2。

表2 各组小鼠肺泡灌洗液中炎症细胞、细胞因子水平比较±s)
a:P<0.05,与对照组比较;b:P<0.05,与模型组和实验组B比较。灌洗液IL-6、TNF-α必须用计量单位表示,为单位一致,白细胞分类也用计量单位表示
2.4 各组小鼠肺组织中GATA3蛋白表达水平比较 模型组小鼠的肺组织中GATA3蛋白表达水平(0.422±0.115)均高于对照组(0.241±0.095),差异有统计学意义(P<0.05);实验组A肺组织中GATA3蛋白表达水平(0.609±0.146)高于模型组、实验组B(0.431±0.097),差异有统计学意义(P<0.05),实验组B肺组织中GATA3蛋白表达水平与模型组比较差异无统计学意义(P>0.05),各组间GATA3蛋白水平比较差异有统计学意义(F=51.209,P<0.01),见图2。
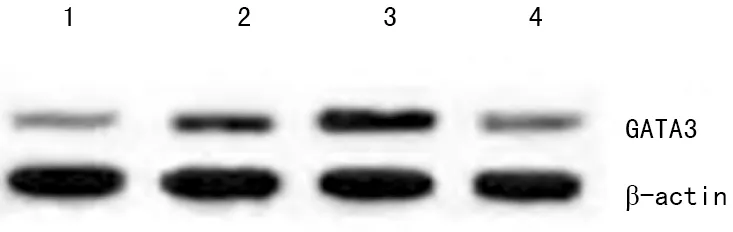
1:对照组;2:模型组;3:实验组A;4:实验组B
图2 Western blot检测结果
3 讨 论
过敏性哮喘是一种常见的顽固性慢性呼吸道疾病,多是由反复的呼吸道感染后吸入花粉、动物毛发等过敏原,或是食用引起过敏的食物或药物后诱发,具有气道炎症、气道高反应性和气道重塑等特征[5-7]。研究表明,气道炎症是导致气道高反应性和气道重塑的基础,而多种炎性细胞特别是EOS、肥大细胞和T淋巴细胞的浸润与气道炎症的发生和发展有着密切关系,但是对于过敏性哮喘的具体发病机制目前仍不完全清楚[8-9]。
心钠素又称心房利钠肽,是由心房肌细胞合成并释放的肽类激素,主要由28个氨基酸残基组成,其受体是细胞膜上的一种鸟甘酸环化酶[10-11]。心钠素是一种血管活性肽,其主要作用是使血管平滑肌舒张和促进肾脏排钠、排水,并且能调节细胞增殖和缩血管作用[12]。有研究发现,心钠素信号在呼吸系统中也广泛分布,并且发挥着重要的调节作用,如影响肺表面活性物质的产生和功能等[13]。也有研究表明,哮喘患者血浆中的心钠素水平较缓解期明显升高,但其与哮喘发病和发展的关系及具体机制目前尚不清楚[14]。为此,本研究建立了过敏性哮喘小鼠模型,并分别给予外源性心钠素0.5 μg/g、外源性心钠素0.5 μg/g+A71915、等量生理盐水进行干预。研究发现,实验组A小鼠的炎症反应较模型组更为严重,而实验组B小鼠在添加外源性心钠素拮抗剂后炎症反应明显较实验组A较轻,提示外源性心钠素与过敏性哮喘的发病和发展有着密切关系。
进一步观察发现,模型组小鼠的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于对照组,而实验组A的血液中EOS、淋巴细胞、中性粒细胞所占比例均高于模型组、实验组B。提示心钠素能激活过敏性哮喘小鼠血液中炎症细胞,且能提高淋巴细胞的中性粒细胞的比例,进而促进炎症反应的发展。模型组小鼠的肺泡灌洗液中EOS、淋巴细胞、中性粒细胞计数、IL-6、TNF-α水平均高于对照组,而实验组A的肺泡灌洗液中各项水平均高于模型组、实验组B,提示心钠素能激活过敏性哮喘小鼠肺组织中炎症细胞,且能提高淋巴细胞的中性粒细胞的比例,进而促进炎症反应的发展,其机制可能是提升IL-6、TNF-α等促炎症因子的水平。
有研究表明,特异性转录因子GATA3的表达与Th2细胞分化及功能成熟有着密切关系,其能促进局部IL-4细胞因子的合成分泌,并能形成有利于Th2细胞分化和成熟的微环境[15]。GATA3还能调节IL-5、IL-13等过敏相关性细胞因子的表达,并能诱导导嗜酸细胞在气道的趋化浸润,从而参与过敏性气道炎症反应的调节。本研究发现,模型组小鼠的肺组织中GATA3蛋白表达水平均高于对照组,而实验组A肺组织中GATA3蛋白表达水平高于模型组、实验组B,提示心钠素能促进肺组织中特异性转录因子 GATA3的表达,这可能也是心钠素参与过敏性哮喘发生和发展的机制之一。
本研究通过对过敏性哮喘小鼠添加心钠素干预后发现,心钠素确实能通过提升炎症细胞数量。促进GATA3的表达等机制来加剧过敏性气道炎症反应的发生和发展,而通过调节心钠素拮抗剂后可明显减轻此类反应,这也许能为寻找过敏性哮喘的新靶点提供一定的依据。但本研究限于研究样本的,对于心钠素在哮喘治疗中的潜能仍需作进一步的深入研究。
综上所述,外源性心钠素会进一步加剧过敏性哮喘小鼠模型的气道炎症反应,与激活炎性细胞、炎症因子释放及增强肺组织中GATA3蛋白表达有关。
[1]Just J,Saint-Pierre P,Gouvis-Echraghi R,et al.Childhood allergic asthma is not a single phenotype[J].J Pediatr,2014,164(4):815-820.
[2] Aumeunier A,Grela F,Ramadan A,et al.Systemic Toll-like receptor stimulation suppresses experimental allergic asthma and autoimmune diabetes in NOD mice[J].PLoS One,2010,5(7):e11484.
[3]马礼兵,高远,孙亚冰,等.心房钠尿肽在过敏性哮喘气道炎症和气道高反应中的作用[J].武汉大学学报(医学版),2016,37(3):371-376.
[4]高远,曾锦荣,马礼兵,等.心房钠尿肽信号通路在小鼠支气管哮喘发病中的作用及其机制[J].新乡医学院学报,2015,32(4):291-298.
[5]Bice JB,Leechawengwongs E,Montanaro A.Biologic targeted therapy in allergic asthma [J].Ann Allergy Asthma Immunol,2014,112(2):108-115.
[6]Hwang YJ,Yun MO,Jeong KT,et al.Uremic toxin indoxyl 3-sulfate regulates the differentiation of Th2 but not of Th1 cells to lessen allergic asthma[J].Toxicol Lett,2014,225(1):130-138.
[7]何冰,杨秀云.济南地区过敏性哮喘及鼻炎患者常见吸入性过敏原皮肤点刺试验结果分析[J].山东医药,2015,55(18):46-47.
[8]马颖,张玉兰.护理心理干预对哮喘患儿情绪及嗜酸性粒细胞的影响[J].中国药物与临床,2015,15(11):1670-1672.
[9]幸鹏,刘志刚,喻海琼,等.表观遗传机制和哮喘的发生[J].中国免疫学杂志,2016,32(5):757-759,763.
[10]周庆华.心房利钠肽与心血管疾病的临床研究进展[J].实用心脑肺血管病杂志,2014,22(6):5-6.
[11]洪兰,洪英姬,金红花.糖原合成酶激酶3β介导心房钠尿肽对H9c2心肌细胞线粒体保护作用的研究[J].中国现代医学杂志,2016,26(13):7-11.
[12]赵狄,练桂丽,Stott JB,等.Kv7通道在正常及高血压大鼠钠尿肽介导的血管舒张中的作用[J].中华高血压杂志,2015,23(1):66-68.
[13]Kumar M,Behera AK,Lockey RF,et al.Atrial natriuretic peptide gene transfer by means of intranasal administration attenuates airway reactivity in a mouse model of allergic sensitization[J].J Allergy Clin Immunol,2002,110(6):879-882.
[14]Ma LB,Xiang XD.Atrial natriuretic peptide/natriuretic peptide receptor A(ANP/NPRA) signaling pathway:A potential therapeutic target for allergic asthma[J].Med Hypotheses,2011,77(5):832-833.
[15]邵莉,曹兰芳,李晓丽,等.支气管哮喘小鼠支原体感染模型肺组织中T-bet,GATA-3和NF-κB转录因子的变化[J].诊断学理论与实践,2016,15(2):137-141.
Effect of exogenous atrial natriuretic peptide on airway inflammation in mice with allergic asthma and its mechanism*
LiuZhenkuan,XingXiaoli,LiNa
(DepartmentofRespiration,TianjinMunicipalFifthCentralHospital,Tianjin300450,China)
Objective To investigate the effect of exogenous atrial natriuretic peptide on airway inflammation in allergic asthma mice model and its mechanism.Methods A total of 48 SPF 48 BALBc mice were selected and randomly divided into the normal group (equal quantity normal saline intervention),model group (equal quantity normal saline intervention),experimental group A (exogenous atrial natriuretic peptide 0.5 μg/g) and experimental group B(exogenous atrial natriuretic peptide 0.5 μg/g+A71915).The model group,experimental group A and B were given the corresponding treatment measures after successfully constructing the model,at 24 after the last provocation test,serum and bronchoalveolar lavage fluid in each group were collected for detecting inflammation factors.The HE staining was used to observe the pathological changes of lung tissue,the expression level of GATA3 protein in lung tissue was detected by Western blot technology.Results The blood EOS,lymphocyte and neutrophil ratio in the model group were higher than those in the normal group (P<0.05),which in the experimental group A were higher than those in the model group and experimental group B (P<0.05);bronchoalveolar lavage fluid EOS,lymphocytes,neutrophil ratio,IL-6,TNF-α levels in the model group were higher than those in the normal group (P<0.05),alveolar lavage fluid EOS,lymphocyte,neutrophil count,IL-6 and TNF-α levels in the experimental group A were higher than those in the model group and experimental group B (P<0.05);the expression level of GATA3 protein in lung tissue of the model group was higher than that in the normal group(P<0.05),the expression level of lung tissue GATA3 protein in the experimental group A was higher than that in the model group and experimental group B (P<0.05).Conclusion Exogenous atrial natriuretic peptide can further aggravate airway inflammation reaction in allergic asthma mice model,which is related to the activation of inflammatory cells,the release of inflammatory cytokines and the increase of GATA3 protein expression in lung tissue.
atrial natriuretic factor;asthma;mice;exogenous;airway inflammation;action mechanism
10.3969/j.issn.1671-8348.2017.22.004
天津市卫生局资助基金项目(tj20150823)。 作者简介:刘振宽(1976-),主治医师,硕士,主要从事过敏性哮喘的研究。
R361+.2
A
1671-8348(2017)22-3036-03
2017-01-10
2017-03-20)

