尿毒症血液透析患者周围神经病的发生率及影响因素分析
于秀峙 陆石 冯学震 王葳 张果 徐守凤 苟薇 邹水红 韩银侠
·论著·
尿毒症血液透析患者周围神经病的发生率及影响因素分析
于秀峙 陆石 冯学震 王葳 张果 徐守凤 苟薇 邹水红 韩银侠
目的 探讨尿毒症性周围神经病的发生率以及影响因素。方法 收集解放军第455医院2011年1月至2012年12月386例维持性血液透析治疗的尿毒症患者,据其是否存在周围神经病变分成病变组(196例)与对照组(190例)。对比2组患者临床特征和血液检查结果,解析其与尿毒症性周围神经病发生的相关性。结果 结果显示,在尿毒症性周围神经病变组患者透析龄、血清C反应蛋白(C-reactive protein,CRP)、血清甲状旁腺素(parathyroid hormone,PTH)、尿素氮(BUN)、空腹血糖含量显著上升,而前白蛋白(prealbumin,PA)、白蛋白(albnmin,Alb)、血红蛋白(hemoglobin,Hb)浓度明显下降。结果提示,尿毒症性周围神经病的发生与CRP、PTH、BUN、空腹血糖含量的表达正相关,同时与透析频率、PA、Alb、Hb的表达负相关。纳入的两组患者性别、年龄、吸烟史、饮酒史、血压无显著差异,对比结果显示两组是否有周围神经病的发生与小分子物质如血肌酐(SCr)、血浆胆固醇、三酰甘油、血钾、血钙、血钠、血磷均无显著差异(P>0.05)。结论 尿毒症性周围神经病的发生可能与CRP、PTH、PA、Alb、Hb的表达量相关,但是它们是如何参与尿毒症性周围神经病的发生、发展有待进一步的探索。
尿毒症;C-反应蛋白;甲状旁腺素;尿素氮
尿毒症性周围神经病是尿毒症患者最常见的并发症之一,平均发病率约为50%左右,男性的发病率高于女性[1-3],但其具体发病机制并不明确,临床表现主要为感觉丧失、肌肉无力与萎缩、腱反射减退以及血管运动症状障碍[4]。目前,对于尿毒症性周围神经病的治疗方法主要为药物治疗、血液透析、肾移植等[5-8]。近年来研究发现,尿毒症性周围神经病严重程度与患者血钾、白蛋白(albumin,Alb)、氨基酸水平有关[9-10]。本研究通过对解放军第455医院2011年1月至2012年12月386例接受维持性血液透析治疗的尿毒症患者血清样本进行深入研究,检测分析其C-反应蛋白(c-reactive protein,CRP)、甲状旁腺素(parathyroid hormone,PTH)、前白蛋白(prealbumin,PA)、Alb、血红蛋白(hemoglobin,Hb)的表达量,揭示其与尿毒症性周围神经病的发生、发展的相关性,为临床诊治奠定理论基础。
资料与方法
一、研究对象与分组
选择2011年1月至2012年12月相继进入上海市解放军第四五五医院进行维持性血液透析治疗的尿毒症患者386例作为研究对象,依据纳入对象的临床表现及尿毒症周围神经病变的诊断标准,符合周围神经病变标准者设为病变组,共196例,男性108例,女性88例,年龄范围为25~75岁,平均年龄(58.8±10.6)岁;需要透析但无周围神经病变者设为对照组,共190例,男性103例,女性87例,年龄范围为26~75岁,平均年龄(59.4±11.6)岁。纳入标准包括:①充分告知其该研究目的和意义,患者自愿参加本项目研究,并签署知情同意书;②尿毒症及尿毒症性周围神经病的诊断严格符合诊断标准[3]。排除标准包括存在严重并发症者如肝功能衰竭、呼吸衰竭、多器官功能障碍综合征等。本研究已获得上海市解放军第四五五医院伦理委员会的批准,所有患者或其家属均知情并签署知情同意书。
二、方法
对2组患者的年龄、性别、饮酒史、吸烟史、血压情况、原发病、血液透析类型、血液透析时间、血液透析频率、是否定期血液滤过、是否定期进行血液灌流治疗、CRP、PTH、PA、Alb、Hb、红细胞(red blood cell,RBC)、血浆胆固醇(cholesterol,CHO)、三酰甘油(triacylglycerol,TG)、尿素氮(BUN)、血肌酐(SCr)、二氧化碳结合力(Carbon Dioxide Combining Power,CO2CP)、空腹血糖(fasting blood glucose,FBG)、血钾(K+)、血钙(Ca2+)、血钠(Na+)、血磷(P3+)等指标进行对比分析。采取单因素分析法,探讨尿毒症性周围神经病的发生率及其影响因素。
三、蛋白含量检测
清晨空腹采集静脉血2 ml,室温静置后离心分离血清,利用免疫比浊法检测血清中CRP、PTH、PA、Alb、Hb、RBC、CHO、TG、BUN、SCr、CO2CP、FBG、血钾、血钙、血钠、血磷含量。检测仪器为日立7600-020全自动生化分析仪,实验操作严格按照仪器及试剂盒说明书进行。吸烟史、饮酒史、尿毒症原发病、透析龄、血液透析频率、血液滤过情况和血液灌流治疗情况均通过医生询问和病历获取。血压>140/90 mmHg为高血压。血液滤过和灌流治疗的次数每项至少每月两次。
四、统计学处理
应用SPSS19.0和GraphPad统计软件进行分析。计量资料以均数±标准差形式表示,组间比较采用t检验;计数资料采用百分比形式表示,组间比较采用χ2检验。尿毒症性周围神经病发病的危险因素采用Logistic回归多因素分析。P<0.05为差异具有统计学意义。
结 果
一、尿毒症周围神经病的发生率
386例尿毒症患者中,尿毒症周围神经病患者196例,患病率占总人数的50.8%,提示尿毒症患者发生周围神经病变的概率大概为50.8%。病变组共196例,其中男性患者108例,女性患者88例,年龄范围为25~75岁,平均年龄(58.8±10.6)岁。对照组190例中男性103例,女性87例,年龄范围26~75岁,平均年龄(59.4±11.6)岁,2组性别(P=0.860)、年龄(P=0.417)比较无统计学意义,具有可比性。同时,尿毒症性神经病变组患者症状和体征变化主要有四肢远端麻木与烧灼感、自发性疼痛等症状,体征表现为上肢腱反射和感觉减退、下肢膝反射和跟腱反射变化。根据统计结果,下肢体征反应表现较为明显且具有标志性。(表1~2)
二、各影响因素分析
1.相关指标情况 2组吸烟史、饮酒史、血压情况均无显著差异(均P>0.05),原发病、血液透析频率、是否定期血液滤过和血液灌流治疗具有显著差异(均P<0.001)。(表3)

表1 2组患者基本信息[例(%)]

表2 病变组患者周围神经病变的症状体征变化[例(%)]

表3 相关指标在2组的分布情况[例(%)]
2.血液指标分析 2组患者的RBC、SCr、CHO、TG、血钾、血钙、血钠、血磷均无显著差异(P>0.05)。CRP、PTH、BUN、FBG值显著升高(P<0.001);PA、Alb、Hb、CO2CP值显著降低(P<0.001)。结果提示,原发病(糖尿病)、透析龄、CRP、血清PTH、BUN、FBG与尿毒症周围神经病变的发生呈正相关关系,而患者透析频率、血清中PA、Alb、Hb浓度与尿毒症周围神经病变呈负相关关系。简言之,CRP、血清PTH、BUN、FBG、PA、Alb、Hb与尿毒症性周围神经病变的发生相关。(表4)
三、尿毒症性周围神经病发病的危险因素分析
进一步考虑到是否存在多因素混合的影响,故将上文单因素分析中有统计学意义的因素进行多因素Logistic回归分析,结果显示,CRP(P=0.006)、BUN(P=0.001)、PTH(P<0.001)、透析龄>2年(P=0.015)是尿毒症性周围神经病发病的危险因素。(表5)
表4 2组血清学分析比较
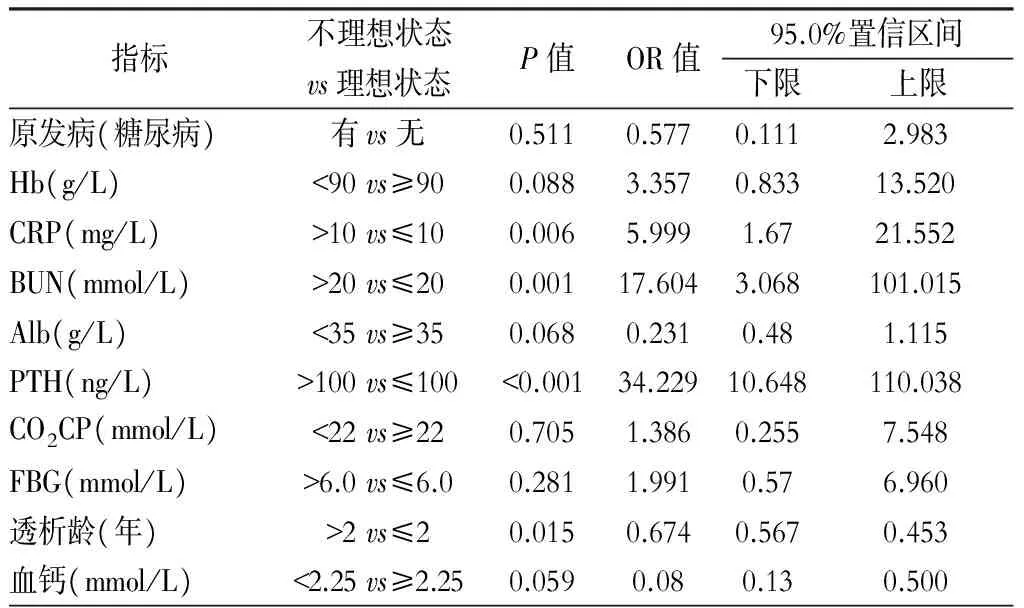
表5 影响尿毒症性周围神经病发病的Logistic回归多因素分析
讨 论
尿毒症性周围神经病好发于慢性肾衰竭期,6个月后即可发生此病,男性多见[2,11]。有研究发现,尿毒症性周围神经病变发病机制可能为以下几种:①电解质及微量元素等低分子尿毒素症毒素在体内积聚所致,例如高钾血症;②某些中分子物质如β2-微球蛋白、瘦素、PTH等对周围神经的毒性作用;③蛋白质结合的尿毒症毒素如酚等;④酶活性如受抑神经转酮酶及血液透析有关的并发症等因素有关[12-14],其中PTH作为一种中分子物质对周围神经有直接毒性作用[15],提示病变组的PTH浓度较非病变组高,统计结果也显示相应趋势,较非病变组、病变组血清PTH表达显著上升(85.7±2.31vs335.00±36.20,P<0.001)。研究表明,促红细胞生成素治疗有利于改善尿毒症及其他原因所致的神经病变[16],该研究的Hb病变组的含量较低,为(102.00±8.12)vs(87.00±5.13)(P<0.001),且差值存在统计学意义,印证了上述的观点。CRP在正常人血清中其含量极微;在组织受到损伤、炎症、感染或肿瘤破坏时CRP可以在数小时内急剧上升,可增高数倍或数百倍,本研究中CRP含量与尿毒症周围神经病呈正相关,与理论相符合。发生尿毒症周围神经病时,患者的肾功能受到损伤、营养不足,导致PA以及Alb的浓度下降,而PA与Alb的缺乏也使神经营养不足,更加重尿毒症周围神经病的发生。为了进一步确定各因素与该疾病的关系,该研究通过进行多因素回归分析发现,该疾病与是否存在糖尿病的原发病无显著的相关性,主要存在关联的是CRP、BUN、PTH及透析龄存在一定的关系。
综上所述,本研究为临床尿毒症周围神经病的诊断治疗提供了理论参考。但仍需要进一步探索该因素之间的内在关系及是否存在相互转化的作用。尿毒症患者除了以上小分子物质可对其进行预测外,残余肾功能及尿量也是其中不可缺少的指标。残余肾功能指肾组织毁损后健存的肾组织滤过和内分泌功能[17],可排泄及降解一些小分子物质,且能产生促红细胞生成素及活性维生素D3等物质来维持机体的恒量的毒素清除,可以减少该病引起的并发症;尿毒症时肾脏功能出现异常,导致机体不能通过肾脏产生尿液,使尿液排出量显著下降,机体的代谢废物不能从尿液排出而蓄积体内,引起毒性反应。尿量也会影响相应的小分子物质的含量,本文研究从主要的尿毒症产生的小分子上对尿毒症周围神经病变的相应关系进行研究,未纳入肾功能及尿量的影响因素是本文的一个遗憾,因此为了进一步探索尿毒症与周围神经病变之间的关系,我们可以对这两方面进行进一步研究。
[1] 赵璐杰, 李超林, 邱君, 等. 左卡尼汀联合血液透析治疗尿毒症性周围神经病变的临床疗效观察[J]. 中国血液净化, 2013, 12(7): 371-374.
[2] Aggarwal HK, Sood S, Jain D, et al. Evaluation of spectrum of peripheral neuropathy in predialysis patients with chronic kidney disease[J]. Renal Failure, 2013, 35(10): 1323-1329.
[3] Jedras M, Zakrzewskapniewska B, Gellert R, et al. Uremic neuropathy is more frequent in male patients[J]. Polskie Archiwum Medycyny Wewntrznej, 2001, 105(5): 391-398.
[4] Ghazan-Shahi S, Koh TJK, Chan CT. Impact of nocturnal hemodialysis on peripheral uremic neuropathy[J]. Bmc Nephrology, 2015, 16(1): 134.DOI:10.1186/s12882-015-0133-2.
[5] 任万军, 李燕, 刘子栋. 血液灌流、血液透析滤过治疗尿毒症性周围神经病的疗效观察[J]. 中国血液净化, 2004, 3(11): 590-591.
[6] 曹炎生, 詹悦. 卡马西平治疗尿毒症性周围神经病变的临床疗效观察[J]. 湖北师范学院学报(自然科学版), 2012, 32(3): 30-32.
[7] Ahonen RE. Peripheral neuropathy in uremic patients and in renal transplant recipients[J]. Acta Neuropathologica, 1981, 54(1): 43-53.
[8] Yatzidis H, Koutsicos D, Agroyannis B, et al. Biotin in the management of uremic neurologic disorders[J]. Nephron, 1984, 36(3): 183-186.
[9] Krishnan AV, Kiernan MC. Uremic neuropathy: clinical features and new pathophysiological insights[J]. Muscle&Nerve, 2007, 35(3): 273-290.
[10]Bergström J, Lindblom U, Nor e LO. Preservation of peripheral nerve function in severe uremia during treatment with low protein high calorie diet and surplus of essential amino acids[J]. Acta Neurologica Scandinavica, 1975, 51(2): 99-109.
[11]Silber MH, Ehrenberg BL, Allen RP, et al. An algorithm for the management of restless legs syndrome[J]. Mayo Clinic Proceedings, 2004, 79(7): 916-922.
[12]Brouns R, De Deyn PP. Neurological complications in renal failure: a review[J]. Clinical Neurology&Neurosurgery, 2004, 107(1): 1-16.
[13]Fong CS. Neurological complications in uremia[J]. Acta Neurologica Taiwanica, 2008, 17(2): 117-126.
[14]Al-Hayk K, Bertorini TE. Neuromuscular complications in uremics: a review[J]. Neurologist, 2007, 13(4): 188-196.
[15]Imam I, Salako BL, Akinola A. Peripheral neuropathy in Nigerian subjects with chronic renal failure[J]. Nigerian journal of medicine: journal of the National Association of Resident Doctors of Nigeria, 2003, 12(2): 72-75.
[16]Hassan K, Simri W, Rubenchik I, et al. Effect of erythropoietin therapy on polyneuropathy in predialyticpatients[J]. Journal of Nephrology, 2003, 16(1): 121-125.
[17]Lowenstein J, Grantham JJ. Residual renal function: a paradigm shift.[J]. Kidney International, 2017, 91(3): 561-565.
Occurrence and risk factors of uremia peripheral neuropathy in hemodialysis patients
YUXiu-zhi,LUShi,FENGXue-zhen,WANGWei,ZHANGGuo,XUShou-feng,GOUWei,ZOUShui-hong,HANYin-xia.
NephrologyCenterofthe455thHospitalofPLA,Shanghai200052,China
Correspondingauthor:LUShi,E-mail:shilu1024@163.com
Objective To investigate the occurrence and risk factors of uremic peripheral neuropathy. Methods 386 cases of uremia undergoing hemodialysis treatment were collected in our hospital from January 2011 to December 2012. According to the existence of uremic peripheral neuropathy, they were divided into the lesion group (190 cases) and non-lesion group (196 cases). To investigate the relationship between the clinical features, several blood indicators of the patients and the existence of uremic peripheral neuropathy, we tested all the sera of the 386 patients and made a detailed comparison subsequently. Results Our results found that the expression of dialysis age, C-reactive protein, PTH proteins, BUN, and GLU2+ were positively correlated with the existence of uremic peripheral neuropathy. However, the expression of dialysis frequency, pre-albumin, albumin, and hemoglobin had a negative correlation with the existence of uremic peripheral neuropathy. There were no significant differences between the two groups in sex, age, smoking history, drinking history, blood pressure. Results it show that the two groups whether occurrence of perpheralne uropathy with small mole cules such as SCr, CHO, TG, potassium, calcium, serum sodium, blood phosphorus had no signifi cant difference(P>0.05). Conclusions The occurrence of uremic peripheral neuropathy might be related to dialysis age and the expression of C-reactive protein, PTH, pre-albumin, albumin and hemoglobin. Our follow-up study might aim to explore the mechanisms of these proteins in the development of uremic peripheral neuropathy.
Uremia; C-reactive protein; Parathyroid hormone; Urea nitrogen
10.3969/j.issn.1671-2390.2017.08.008
基金名称:上海市长宁区基金项目(No.20104Y16001)
200052 上海,中国人民解放军第四五五医院肾内科
陆石,E-mail:shilu1024@163.com
2017-03-02
2017-07-02)

