彩色多普勒超声结合超声造影评估主动脉夹层TEVAR介入术后血管重塑
林水华
邱银汝 QIU Yinru
朱 亮 ZHU Liang
张源祥 ZHANG Yuanxiang
朱永宏 ZHU Yonghong
彩色多普勒超声结合超声造影评估主动脉夹层TEVAR介入术后血管重塑
林水华LIN Shuihua
邱银汝QIU Yinru
朱 亮ZHU Liang
张源祥ZHANG Yuanxiang
朱永宏ZHU Yonghong
目的应用彩色多普勒超声及主动脉超声造影观察DeBakey III型主动脉夹层(AD)腔内隔绝术(TEVAR)前后腹段血管,探讨术后血管重塑及血流动力学变化,为临床治疗提供除主动脉CT血管成像(CTA)以外的影像学评估手段。资料与方法选取30例Debakey III型AD患者,于术前、术后1 d及术后1个月采用彩色多普勒超声结合超声造影检查其腹段血管,动态观察真假腔大小、血流动力学特征、假腔内血栓化程度、远端破口及重要器官血供,结合CTA结果综合分析。结果腹段血管TEVAR术后1 d和术后1个月真腔内径、最大流速均较术前明显增大(P<0.05);假腔内径、最大流速均较术前明显减小(P<0.05);受累器官血供术前与术后近期比较变化差异无统计学意义(均P>0.05),且内径测值与CTA差异亦无统计学意义(P>0.05)。结论彩色多普勒超声结合超声造影从血流动力学及形态学评估DeBakey III型AD TEVAR术后血管重塑简单易行,重复性好,可弥补既往单从形态学上评估的不足。
动脉瘤,夹层;超声检查,多普勒,彩色;造影剂;体层摄影术,X线计算机;血管造影术;主动脉,胸;血管成形术;血流动力学
主动脉夹层(aortic dissection,AD)是一种病死率极高的心血管危重症,如何改进手术方式、提高手术成功率、改善远期疗效是目前国内外学者普遍关注的问题[1-2]。DeBakey III型AD的主动脉腔内隔绝术(thoracic endovascular aortic repair,TEVAR)因其具有操作简便、创伤小、手术时间短、失血量少、并发症少、术后恢复快、安全有效等特点,已成为DeBakey III型AD的首选治疗方法[3-4];但其仍面临着手术方式的改进、介入器械的革新、术后远期疗效的评估、是否再次手术等挑战[5]。AD术后血管重构常采用多层螺旋CT从主动脉结构的变化进行评估;但仅限于解剖结构方面,无法从血流动力学评估。近年来,随着彩色多普勒超声仪的发展及超声造影剂的更新换代,两者结合能清晰地探测真腔内的螺旋形和涡流形态以及血流通过破口时呈喷射状的湍流等血流动力学特征,并可反复观察,在AD介入术后腹段血管重构的观测中有很大优势[6]。目前国内外对腹主动脉瘤的研究相对较多,但对AD腹段血管的研究较少[7]。本研究拟分析彩色多普勒超声结合超声造影在DeBakey III型AD复杂型夹层术后血管重塑中的应用价值。
1 资料与方法
1.1 研究对象 前瞻性分析东莞康华医院2015年1月-2016年4月入院的AD患者共101例,随机选取30例资料完整的患者纳入研究,均为男性,年龄24~73岁,平均(46.50±3.53)岁。纳入标准:①术前经主动脉CT血管成像(CTA)检查,诊断为DeBakey III型AD复杂型夹层,夹层假腔累及范围大,假腔累及腹腔干、肠系膜上动脉、肾动脉及髂总动脉、股动脉者[8];②生命体征相对平稳者。排除标准:①DeBakey I型及II型AD患者;②DeBakey III型AD非复杂型夹层患者,包括主动脉壁间血肿及溃疡者;③血压较高且不稳定者或血压较低者(收缩压<60 mmHg)。所有患者均在急性期行TEVAR治疗,术前及术后均行腹段彩色多普勒超声和超声造影检查及全主动脉CTA检查。30例患者中,24~55岁22例(73.33%),56~73岁8例(26.67%);合并症:高血压29例(96.67%),糖尿病4例(13.33%),冠心病9例(30.00%),肾功能不全7例(23.33%),肥胖14例(46.67%),吸烟21例(70.00%)。
1.2 仪器与方法 采用Philips EPIQ彩色多普勒超声仪,心脏探头(频率为2.0~5.0 MHz)及腹部探头(频率3.5~6.0 MHz),声诺维造影剂即六氟化硫气体微泡,连接心电装置,血流声束夹角<60°,取样容积大小为2.0 mm。检查前一晚用开塞露通便,早晨禁食,检查前1 h服用西甲硅油40 ml以吸附胃内气体,提高图像质量,均采取屈膝卧位。对AD胸段以远的动脉分段包括:腹主动脉近段(腹腔干水平)、腹主动脉中段(肾水平)、腹主动脉远段(分叉前)[9-10],见图1。观察术前及术后真假腔(大小、血流性质、最大流速、累及范围)、破口(位置、破口处血流方向及频谱)(图2)、重要分支(腹腔干、肠系膜上动脉、左右肾动脉)起源于真腔还是假腔、受累器官血供、远端下肢血供,将判定结果与CTA作比较[9-10],真假腔内径测量方法见图3。
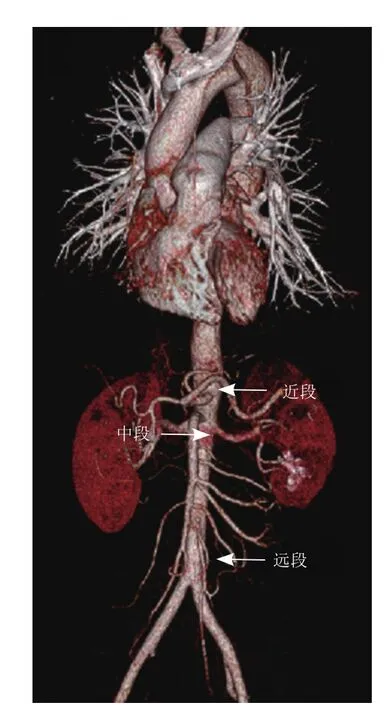
图1 男,33岁,正常主动脉分段。近段:腹腔干上缘;中段:较低一支肾动脉下缘;远段:双侧髂总动脉分叉前1 cm
1.3 统计学方法 采用SPSS 21软件,组间比较采用配对t检验,P<0.05表示差异有统计学意义。

图2 男,44岁,DeBakey III型AD。真、假腔分层血流(箭头示真腔血流,箭示假腔血流;A);破口血流(箭头,B);破口(箭头)的频谱(C);超声造影显示破口(箭头,D);超声造影显示夹层撕裂的内膜(箭头)及小破口(箭,E)
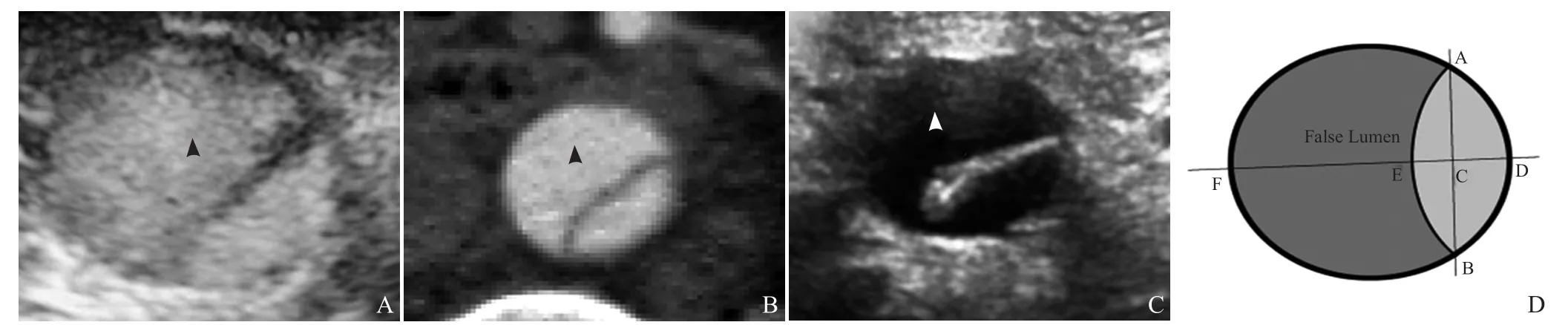
图3 男,52岁,DeBakey III型AD。超声造影显示短轴真假腔及撕裂内膜(箭头,A);主动脉CTA短轴真假腔及撕裂内膜(箭头,B);二维超声图显示短轴真假腔及撕裂内膜(箭头,C);模型图(真假腔测量,D),DE:真腔,EF:假腔
2 结果
2.1 彩色多普勒超声结合超声造影对腹段夹层的诊断效能 真假腔判断的敏感度和特异度分别为 94.31%、94.74%;破口识别的敏感度和特异度分别为 90.20%、94.32%;累及范围诊断的敏感度和特异度分别为93.44%、96.52%;重要器官血供诊断的敏感度和特异度分别为92.13%、93.55%。
2.2 术前及术后各观察值比较 采用彩色多普勒超声对Debakey III型AD术前、术后1 d、术后1个月的真假腔大小、最大流速、受累器官及下肢血供进行比较,术后1 d、术后1个月的真假腔内径(d1、d2)和真假腔最大流速(Psv1、Psv2),与术前真假腔内径(d0)和最大流速(Psv0)比较,差异有统计学意义(均P<0.05);代表双侧下肢血供的左、右股总动脉术后1 d、术后1个月的最大流速与术前比较,差异有统计学意义(均P<0.05);由假腔供血的受累器官术后1 d、术后1个月的最大流速与术前比较,差异无统计学意义(均P>0.05),且术后1 d与术后1个月各数值的变化不明显,见表1。与CTA比较,彩色多普勒超声结合超声造影测量各段内径差异无统计学意义(P>0.05),见表2。
表1 术前与术后的真假腔内径、最大流速、受累器官及下肢血供比较(±s)

表1 术前与术后的真假腔内径、最大流速、受累器官及下肢血供比较(±s)
注:同组内术后与术前比较,*P<0.05
指标 术前(mm) 术后1 d(mm) 术后1个月(mm) Psv0(m/s) Psv1(m/s) Psv2(m/s)腹主动脉上段真腔 8.20±2.12 11.20±1.40* 12.40±1.41* 74.90±6.31 91.90±9.19* 99.00±6.36*假腔 18.10±8.49 14.50±2.12* 12.40±4.24* 56.10±9.60 49.20±10.60* 45.40±14.10*腹主动脉中段真腔 8.60±2.13 12.60±0.71* 12.70±0.71* 73.80±2.83 89.91±8.49* 95.02±6.86*假腔 14.90±9.19 11.90±6.36* 11.02±7.10* 55.00±9.90 47.02±5.70* 42.03±2.10*腹主动脉下段真腔 9.40±3.54 13.60±3.54* 13.90±2.83* 71.50±7.78 85.01±9.19* 88.60±6.36*假腔 11.70±1.41 8.30±1.41* 8.121±0.71* 51.90±0.71 43.41±4.24* 40.30±4.24*受累器官血供 66.40±14.4 65.02±13.00 64.12±11.00左侧股总动脉 64.90±5.66 72.81±3.54* 75.31±1.41*右侧股总动脉 66.00±9.70 73.61±3.54* 76.30±4.24*
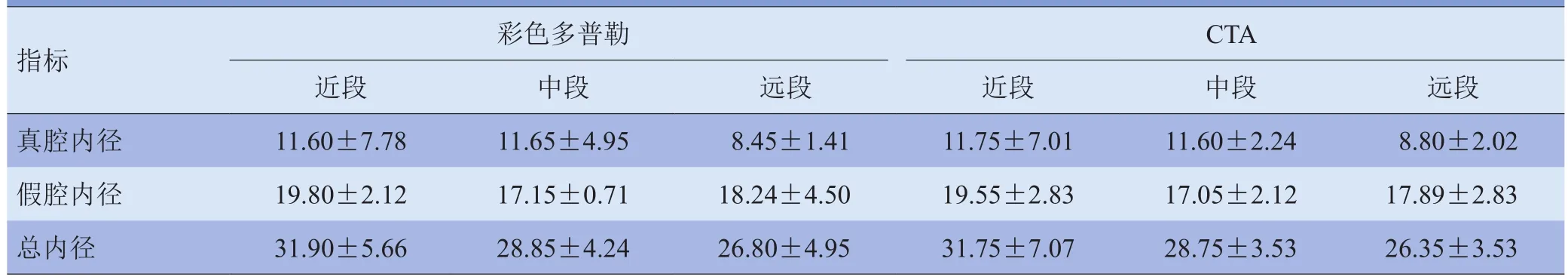
表2 彩色多普勒超声结合超声造影与CTA内径测量值比较(mm)
3 讨论
目前国内外对夹层的诊断及评估主要依靠多层螺旋CT,其解剖分辨率极高、速度快、检测时间短,图像质量不易受外界因素影响,加上强大的图像后处理功能,在AD的诊断与治疗中受到临床医师的青睐[11-12]。然而,多层螺旋CT费用高,增强CT所用的造影剂对肾脏有一定的损伤,并且仅从形态学方面获取夹层累及范围、真假腔大小和内膜片破口位置、大小、数量及假腔血栓化情况,无法从血流动力学方面对夹层进行更客观的评估(如真假腔压力、血流特征等)[13-14]。尽管经食管彩色多普勒超声可以更准确地诊断AD,判断破口的位置,评估真假腔大小[15];但是仅限于对主动脉弓及降主动脉近端夹层的观察,而且由于经食管超声检查为腔内操作,有一定的风险,国内经食管彩色多普勒超声在AD的诊断及随访中应用较少。而经胸彩色多普勒超声除可观察主动脉弓外,结合腹部超声探头还可以检测腹主动脉,其优点为:①快速、准确、无创、费用低;②可实时检测,无需造影剂,无放射性;③可床旁监测,无需院内转运,减少患者检查转运途中风险的发生[16];④可同时兼顾心脏诊断,对心脏腔内结构功能及主动脉瓣情况做进一步了解。随着AD介入治疗的广泛开展,对AD TEVAR术后主动脉重构的研究以评估介入术后的治疗效果引起国内外学者的广泛关注。但通过彩色多普勒超声对AD术后的评估研究较少。通过彩色多普勒超声的血流动力学对AD TEVAR术前、术后腹段及其以远真假腔血流动态进行定量观察,对破口血流方向、速度及频谱进行分析,可以为真、假腔压力的评估提供更直接的证据。
随着造影剂的改进,超声血管造影的临床应用越来越广泛。声诺维是一种安全的微气泡悬浮液制剂,能快速地通过呼吸经肺排出,其包被经肝脏代谢,不影响肾功能,可安全用于肾功能衰竭的患者,不良反应较碘造影剂少,在临床应用中具有广泛的前景[11,15]。Clevert等[17]应用超声造影检查腹主动脉瘤,不仅清晰显示瘤体的走行和瘤壁,还能观察血流是来自真腔还是假腔,可在一定程度上代替CTA。随后Clevert等[17]用彩色多普勒超声结合超声造影对腹主动脉瘤进行观察,提高了诊断的准确率,对有肾功能损伤、严重过敏体质及其他CTA检查禁忌证的患者可选择替代。超声血管造影在AD TEVAR术后观察中应用较少,但是其可增强对主动脉真假腔管腔内径边界大小的识别、真假腔的准确判断、内膜摆动的观察以及对细微破口的显示,进一步提供假腔内血栓化的影像及血流特征,为主动脉重构研究提供依据,提高了诊断率。
本研究应用彩色多普勒超声结合超声造影对DeBakey III型AD复杂型夹层术前、术后的形态学及血流动力学进行研究,评估AD各个时段主动脉重构的进程,侧重在胸段以远大血管的临床观察,具体观察内容及临床价值为:①真假腔内径及血流动力学特征:除可显示真假腔内径大小的形态学变化,还可显示真假腔内完全不同的血流动力学特征,往往真腔内血流表现为层流,被假腔压迫严重处可呈湍流;而假腔内血流多呈涡流状态[18];可以此判断真假腔及血管腔内重构特征。②真假腔频谱多普勒表现:真腔内为高阻力型频谱,且峰值流速高;假腔内为收缩期峰值流速低,舒张期血流反向的不规则频谱[19];可以指导临床合理选择降压药物,最大程度地降低心肌收缩时的dp/dt max,减少血流对主动脉内壁及破口处的剪切力。③破口特征的观察:因可重复、实时显示血流的走行和方向,对判断破口位置、大小有一定帮助;此外,还可测量破口的峰值流速,观察血流方向以及真假腔的分流量,以此判断当TEVAR术后主动脉夹层的近端破口封闭后,夹层远端的血流动力学改变。通过对破口血流方向及流量的观察,评价各个时间段的手术效果,同时也可观察近端主要的较大破口是否完全封闭。对远端破口转归的观察(入口还是出口),可为再次手术方式的选择提供依据。④动态评价腹段及以远重要器官血供:对比术前、术后重要器官血供(腹腔干、肠系膜上动脉、左右肾动脉、下肢),评估主动脉重构的影响。⑤指导再次手术:费用低,可重复性好,方便密切观察TEVAR术后复杂型夹层假腔大小的变化,筛选出需要行二期手术处理的病例。本研究结果显示,DeBakey III型AD复杂型夹层隔绝术封闭近端破口后,假腔压力降低,假腔内径逐渐缩小,最大流速下降,有利于血栓形成;真腔压力升高,真腔逐步扩大,最大流速增高,保证腹腔重要器官及下肢的血供,受累器官的血供短期内变化不明显,可能与夹层血管重塑是渐进、漫长的过程有关,为夹层介入治疗后近期主动脉重构的研究提供依据,指导进一步治疗。
然而,超声(彩色多普勒超声及超声造影)有其局限性:受个体因素(肥胖、肠气、配合度等)影响较大,因胸骨及肺气遮挡,降主动脉中远端难以探查到,而对于胸段夹层血管重塑进程不可评估,这也是本研究的局限性。在日常工作中应尽力创造条件,以提高影像的清晰度,如检查前一晚10点后禁食、检查前通便、检查前1 h使用吸附胃内气体的药物等。因本组中女性患者的病例数过少,对本病在女性患者中声像图表现及与男性患者的差异探索不够深入,这也是本研究的另一的局限性。
总之,彩色多普勒超声结合超声造影不仅从形态学上,且从血流动力学对DeBakey III型AD TEVAR术后的腹段及其远端血管重塑作出评估,并对真假腔内血流、重要器官的血供进行观察分析,相对CTA、数字减影血管造影,具有不可替代的临床应用价值,为指导二次介入手术提供参考。本研究从方法学探讨评估DeBakey III型AD远期疗效的价值,而夹层介入术后腹段破口血流方向及频谱、内膜片摆动幅度在夹层血管重塑中的临床意义有待进一步观察研究。
[1] Kamman AV, De Beaufort HW, Van Bogerijen GH, et al.Contemporary management strategies for chronic type B aortic dissections: a systematic review. PLoS One, 2016, 11(5):e0154930.
[2] Li D, Ye L, He Y, et al. False lumen status in patients with acute aortic dissection: a systematic review and Meta-analysis. J Am Heart Assoc, 2016, 5(5): 1-9.
[3] Patel AY, Eagle KA, Vaishnava P. Acute type B aortic dissection: insights from the international registry of acute aortic dissection. Ann Cardiothorac Surg, 2014, 3(4): 368-374.
[4] 竺挺, 符伟国, 王玉琦. 复杂主动脉瘤及主动脉夹层的腔内治疗策略. 中华外科杂志, 2011, 49(6): 491-494.
[5] Parsa CJ, Williams JB, Bhattacharya SD, et al. Midterm results with thoracic endovascular aortic repair for chronic type B aortic dissection with associated aneurysm. J Thorac Cardiovasc Surg, 2011, 141(2): 322-327.
[6] Cheng Z, Tan FP, Riga CV, et al. Analysis of fl ow patterns in a patient-speci fi c aortic dissection model. J Biomech Eng, 2010,132(5): 051007.
[7] 郑艳玲, 徐辉雄, 黄雪玲, 等. 腹主动脉瘤超声造影表现与CT血管成像的比较. 中华医学超声杂志(电子版), 2010,7(5): 783-788.
[8] Bhamidipati CM, Ailawadi G. Acute complicated and uncomplicated type III aortic dissection: an endovascular perspective.Semin Thorac Cardiovasc Surg, 2009, 21(4): 373-386.
[9] Yang S, Li X, Chao B, et al. Abdominal aortic intimal flap motion characterization in acute aortic dissection: assessed with retrospective ECG-gated thoracoabdominal aorta dualsource CT angiography. PLoS One, 2014, 9(2): e87664.
[10] Rodriguez JA, Olsen DM, Lucas L, et al. Aortic remodeling after endografting of thoracoabdominal aortic dissection. J Vasc Surg, 2008, 47(6): 1188-1194.
[11] Clevert DA, Minaifar N, Weckbach S, et al. Color Duplex ultrasound and contrast-enhanced ultrasound in comparison to MS-CT in the detection of endoleak following endovascular aneurysm repair. Clin Hemorheol Microcirc, 2008, 39(1-4):121-132.
[12] 姜亮, 王利伟, 殷信道, 等. 双源CT在急性主动脉夹层诊断中的价值. 中国医学影像学杂志, 2015, 23(1): 35-38, 40.
[13] Jánosi RA, Buck T, Erbel R, et al. Role of echocardiography in the diagnosis of acute aortic syndrome. Minerva Cardioangiol,2010, 58(3): 409-420.
[14] 赵珺, 景在平, 赵志青, 等. Debakey III型主动脉夹层腔内隔绝术后近期CT评估及价值. 中国医学影像技术, 2001,17(8): 731-733.
[15] Evangelista A, Avegliano G, Aguilar R, et al. Impact of contrast-enhanced echocardiography on the diagnostic algorithm of acute aortic dissection. Eur Heart J, 2010, 31(4):472-479.
[16] 赵昶, 李治安. 彩色多普勒超声在急诊主动脉夹层诊断中的应用价值. 中国医药, 2013, 8(7): 906-908.
[17] Clevert DA, Stickel M, Johnson T, et al. Imaging of aortic abnormalities with contrast-enhanced ultrasound. a pictorial comparison with CT. Eur Radiol, 2007, 17(11): 2991-3000.
[18] 王亮, 陆淸声, 冯睿, 等. DeBakeyIII型主动脉夹层血流动力学数值模拟分析初步研究. 介入放射学杂志, 2010, 19(9):683-687.
[19] 唐杰, 温朝阳. 腹部与外周血管彩色多普勒诊断学. 北京:人民卫生出版社, 2010: 313-342.
(本文编辑 张晓舟)
Evaluating Vascular Remodeling After Thoracic Endovascular Aortic Repair for Aortic Dissection by Color Doppler and Contrast-enhanced Ultrasound
PurposeTo evaluate the abdominal aortic remodeling in both morphology and hemodynamic changes before and after thoracic endovascular aortic repair (TEVAR)for aortic dissection (AD) of DeBakey type III by using color Doppler ultrasound and contrast-enhanced ultrasound, in order to provide a novel imaging method for clinical treatment in addition to aortic computed tomography angiography (CTA).Materials and MethodsThirty patients with complicate AD of Debakey type III were recruited. The abdominal vessels of patients were examined by color Doppler and contrast-enhanced ultrasound at different times including before TEVAR operation, and 1 day, 1 month after operation. The size of true and false lumen, hemodynamic characteristics, thrombosis in false lumen, distal tear sites and blood supply of vital organs were analyzed combined with CTA results.ResultsThe diameter and maximal blood flow velocity of true lumen at abdominal aorta 1 day, 1 month after operation were signi fi cantly increased compared with those before operation (P<0.05), but the diameter and maximal velocity of false lumen after operation were signi fi cantly decreased compared with those before operation (P<0.05). The blood supply of affected organs had no signi fi cant difference before and after operation (allP>0.05). The vessel diameter measurements were similar to those of CTA (P>0.05).ConclusionColor Doppler imaging combined with contrast-enhanced ultrasound is a simple, reproducible method to evaluate the vascular remodeling in hemodynamics and morphology after TEVAR for complicate AD of DeBakey type III, which can overcome the shortage of previous assessment only in morphology.
Aneurysm, dissecting; Ultrasonography, Doppler, color; Contrast media;Tomography, X-ray computed; Angiography; Aorta, thoracic; Angioplasty; Hemodynamics
东莞康华医院心内科 广东东莞 523000
朱永宏
Department of Cardiology, Dongguan Guarantee Hospital, Dongguan 523000,China
Address Correspondence to:ZHU Yonghong
E-mail: yonguoft@163.com
广东省东莞市重点社会科技发展项目(201450725000097)。
R445.1;R543.1
2016-12-14
修回日期:2017-03-16
中国医学影像学杂志
2017年 第25卷 第8期:593-597
Chinese Journal of Medical Imaging 2017 Volume 25 (8): 593-597
10.3969/j.issn.1005-5185.2017.08.009

