4种方法从葎草中制备的纳米纤维素性能
姜亚妮,周骥平,张 琦,赵国琦,许晓东
(1.扬州大学动物科学与技术学院,江苏 扬州 225000; 2.扬州大学机械工程学院,江苏 扬州 225000)
4种方法从葎草中制备的纳米纤维素性能
姜亚妮1,周骥平2,张 琦2,赵国琦1,许晓东1
(1.扬州大学动物科学与技术学院,江苏 扬州 225000; 2.扬州大学机械工程学院,江苏 扬州 225000)
以葎草(Humulusscandens)为原料,分别采用4种方法制备了纳米纤维素,分别为硫酸水解所制得的纤维素纳米晶须(sulfuric acid-cellulose nanocrystals,S-CNC)、盐酸水解法制得的纤维素纳米晶须(hydrochloric acid-cellulose nanocrystals,H-CNC)、大功率超声法制得的纤维素纳米纤维(ultrasound-cellulose nanofibrils,U-CNF)和高速搅拌法制得的纤维素纳米纤维(stirring-cellulose nanofibrils,S-CNF),然后采用透射电子显微镜(TEM)、傅利叶红外光谱仪(FTIR)、X射线衍射仪(XRD)、热重分析仪(TGA)分别对4种纤维素的形态、化学结构、晶体结构、热稳定性能进行了表征。结果表明,硫酸水解法和盐酸水解法制备的纳米纤维素呈棒状,大功率超声法和高速搅拌法制备的纳米纤维素呈网状;S-CNC具有最高的结晶度(70.05%),而S-CNF结晶度最低(58.94%);4种纳米纤维素均保持着纤维素Ⅰ型结构;U-CNF的热稳定性最佳,开始分解温度为261.9 ℃,而S-CNC的热稳定性最差,初始分解温度为217.8 ℃。
野生草本植物;葎草;纳米纤维素;硫酸水解法;盐酸水解法;高速搅拌法;大功率超声法
纳米纤维素(nanocellulose)主要可分为两种形态,具有棒状形态的称为纤维素纳米晶(cellulose nanocrystals )或纤维素晶须(cellulose whisker),而具有网状形态的称为纤维素纳米纤维(cellulose nanofibrils),其直径一般在1~100 nm[2]。纳米纤维素具有高的强度和模量、大的比表面积、低的比热系数、高的长径比、生物可降解性、亲水亲油等特性,这些独特的结构和性能使得纳米纤维素在物理、化学等方面具有特异性,能够明显改变材料的力学、电学、光学,甚至超导性和绝缘等性能[3-4],因此,纳米纤维素被广泛应用于建筑、造纸、食品、汽车、电子产品、生物材料、化妆品、医药、超精密仪器、航天、军工等领域[5]。纳米纤维素的形态和性能受植物种类、制备方法、工艺参数等多方面因素的影响。目前,纳米纤维素的制备方法主要有化学方法、机械方法和生物等多种制备方法[1]。
葎草(Humulusscandens),又叫拉拉秧,多年生茎蔓草本植物,株高1~5 m,茎和叶柄上有细倒钩,叶片呈掌状,茎部喜欢缠绕其它植物生长,常被作为一种侵略性的有害植物而被拔除[6-7]。葎草茎纤维含量高,若以葎草为原料制备出具有优异性能、高附加值的生物质材料,既可以变废为宝,又可以实现资源的高效利用。目前已有科研人员对葎草生长特性及营养状况进行分析研究[8-9],但尚未有从葎草中分离纳米纤维素的有关报道。本研究首次以葎草茎为原料,分别采用硫酸水解法、盐酸水解法、大功率超声和高速搅拌方法分别制备4种纳米纤维素,并对4种纳米纤维素的形态、结晶性能、化学结构和热稳定性进行比较和研究,为葎草中分离纳米纤维素的工艺优化提供新的理论和试验依据。
1 材料与方法
1.1 试验材料和药品
葎草茎(5月上旬,取江苏省扬州市野外长势良好的葎草,剪刀截取茎部)、硫酸、氢氧化钠、亚氯酸钠均为分析纯。
1.2 试验方法
1.2.1 硫酸水解法制备纤维素纳米晶须(sulfuric acid-cellulose nanocrystals,S-CNC) 将葎草茎颗粒用氢氧化钠溶液进行蒸煮,料液比为1∶15,氢氧化钠浓度为 4%,80 ℃温度下蒸煮2 h,以除去半纤维素。然后用酸化亚氯酸钠(pH=5)于80 ℃下处理3次,每次1 h,料液比1∶15,以获得纯化纤维素。
取葎草茎纯化纤维素,置于浓度为60%硫酸溶液中,保持45 ℃高速搅拌1 h。反应结束后加入大量去离子水终止反应,多次离心洗涤至中性,冷冻干燥得到干态S-CNC。
1.2.2 盐酸水解法制备纤维素纳米晶须(hydrochloric acid-cellulose nanocrystals,H-CNC) 取葎草茎纯化纤维素,置于浓度8 mol·L-1盐酸溶液中,85 ℃温度下高速搅拌2 h。后续步骤如上,最后冷冻干燥得到干态的H-CNC。
1.2.3 大功率超声法制备纤维素纳米纤维(ultrasound-cellulose nanofibrils,U-CNF) 配置浓度为0.3%的葎草茎纯化纤维素水溶液,于冰水浴中超声30 min(功率1 000 W),将溶液冷冻干燥,即可得到U-CNF。
1.2.4 高速搅拌法制备纤维素纳米纤维(stirring-cellulose nanofibrils,S-CNF) 配置浓度为 0.3%的葎草茎纯化纤维素水溶液,于冰水浴中高速搅拌30 min(转速15 000 r·min-1),将溶液冷冻干燥,即可得到S-CNF。
1.3 成分分析和结构表征
1.3.1 成分分析 萃取物、木质素含量的测定含量参照NREL/TP-510-42619[10],NREL/TP-510-42618[11]。α-纤维素含量测定参照TAPPI T203om-99[12],棕纤维含量的测定参照Wise等[13]的方法,半纤维素含量为棕纤维和α纤维素含量的差值。数据用3次重复的平均值±标准差表示。
1.3.2 结构表征 使用数码相机(S2900HD,FinePix Co,Ltd,Japan)拍摄不同阶段样品的宏观照片。采用场发射型扫描电子显微镜(FE- SEM,S-4800,Hitachi Co.,Ltd.,Japan)对不同化学处理后的样品的微观形貌进行观察:将一滴稀释后的样品溶液滴到玻璃片上,室温干燥并喷金处理后进行观察。采用透射电子显微镜(TEM,Tecnai 12,Philips Co.,Ltd.,Holland)对4种方法制备的不同纳米纤维素样品的微观形貌进行观察:一滴浓度约0.3%的CNC或CNF溶液滴到铜网上,用磷钨酸复染3 min,室温干燥后进行观察。将TEM照片用图像处理软件Image J(National Institute of Health,USA)进行处理,计算得到纳米纤维素的直径和长度。使用傅里叶变换红外光谱仪(FTIR,670-IR 670-IR+610-IR Varian,Varian Co.,Ltd.,USA),采用溴化钾压片法测试样品的官能团,扫描波数范围为400~4 000 cm-1。采用多晶X射线衍射仪(D8 ADVANCE,Bruker-AXS Co.,Ltd.,Germany)对样品的结晶结构进行观察,扫描角度(2θ)范围为10°~40°,结晶度(CI)的计算公式[14]如下:

式中:I002为结晶区的衍射强度,2θ约为22.5°,Iam为无定形区的衍射强度,2θ约为18.5°;采用热重分析仪(Pyris1TGA,PerkinElmer,Co.,Ltd.,USA)于氮气氛围下对样品的热稳定性能进行分析,加热温度从30到700 ℃。
1.4 数据统计分析
采用Excel2003软件中对数据进行数据的整理。利用SPSS13.0软件进行显著性分析。显著性水平为P<0.05。
2 结果与分析
2.1 成分分析
未经处理的葎草茎中α-纤维素含量为43.11%,半纤维素含量为22.95%,木质素含量为20.24%,灰分含量为7.36%,萃取物含量为3.60%(表1)。亚氯酸钠漂白后得到的纯化纤维素,其α-纤维素含量提高至84.91%,半纤维素含量降为6.82%,木质素含量降为3.27%。由此可见,化学处理可以有效地降低半纤维素和木质素的含量。这是由于半纤维素中的木聚糖与其它分子间的酯键在碱性条件下发生了皂化反应而断裂,使得木质素和半纤维素得以脱除。进一步的漂白反应中,亚氯酸根离子攻击与木质素苯环的苯醌结构,并与侧链的共轭双键发生了亲核反应,使得木质素最终被氧化、降解成可溶性的羧酸类化合物和二氧化碳。
2.2 形态分析
天然的葎草茎呈绿色,经碱处理后变成棕色,亚氯酸钠处理后得到的纯化纤维素呈白色(图1)。扫描电子显微镜(scanningelectronmicroscope,SEM)照片上可观察到,未经处理的HSS纤维表面很光滑,这是由于纤维束被果胶聚集在一起的原因。经过碱处理和亚氯酸钠处理后,纤维表面开始变得粗糙,这是因为化学处理破坏了纤维素、半纤维素和木质素之间的化学键连,纤维表面缺陷增加所致。同时,经化学处理后,纤维的直径越来越小,这是由于木质素和半纤维素被脱除后,被镶嵌于木质素-碳水化合物复合体其中的细小纤维被释放了出来。
纳米纤维素形貌受植物种类、制备方法、工艺参数的影响。盐酸水解法制备的H-CNC和硫酸水解法制备的S-CNC呈短棒状(图2),S-CNC和H-CNC的平均直径分别为11.24和11.87nm(图3),而平均长度分别为343.42和352.65nm,两者直径和长度都较为接近,说明盐酸水解法和硫酸水解法做制备的纳米纤维素在形貌上比较类似。大功率超声法和高速搅拌法制备的U-CNF和S-CNF形貌相似,其纤丝比较长,呈现出网状形态(图2),U-CNF和S-CNF的平均直径分别为12.54和20.31nm(图3)。这是由于强酸水解过程,穿插于纤维素长链中的无定形区被水解掉,剩余的结晶区纤维素呈现出长度较短的棒状结构,而大功率超声和高速搅拌法分别依赖于超声空化和搅拌形成的强烈剪切力作用,使得纤维达到开纤目的,但对于无定形区的影响很小,因此纤维保留了较长的网状纤丝结构。

表1 不同化学处理阶段葎草茎的化学组分Table 1 Chemical composition of Humulus scandens stems(HSS) at each stage of treatment
注:同列不同小写字母表示差异显著(P<0.05)。HSS,葎草茎。
Note: Different lowercase letters with the same column indicate significant difference among different stage of treatments at the 0.05 level. HSS,Humulusscandensstem.

图1 未经处理及不同化学处理阶段HSS的照片Fig. 1 Images of untreated HSS and HSS at different treated stages
注:1表示宏观照片;2表示扫描电子显微镜照片;a表示未经处理的HSS;b表示碱处理后的HSS;c表示纯化HSS。HSS,葎草茎。
Note:1, represent macrophotographs; 2, represent images of scanning electron microscope (SEM); a, untreated HSS; b, alkali treated HSS; c, purified HSS; HSS,Humulusscandensstem.
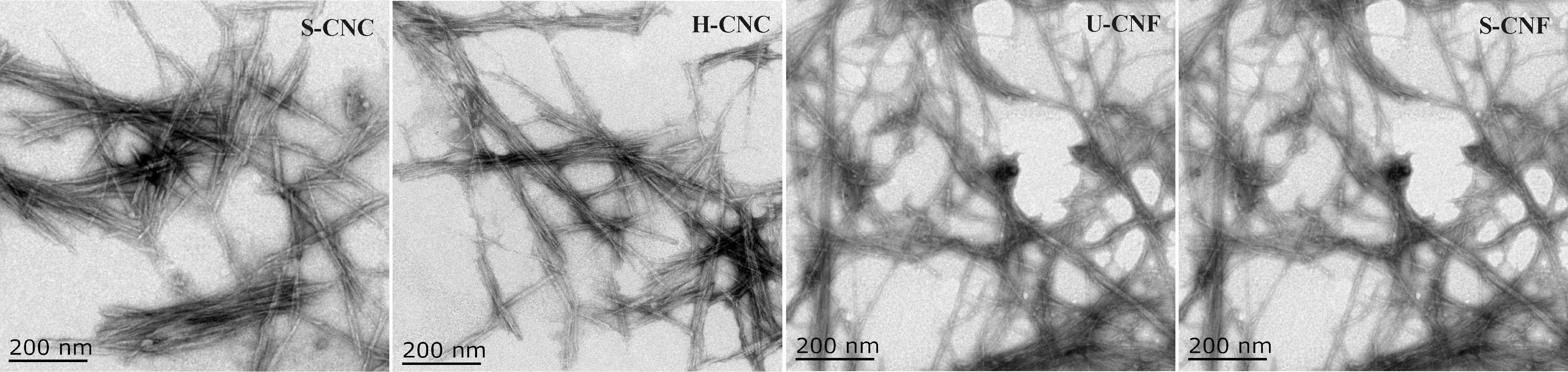
图2 4种方法制备纳米纤维素的透射电子显微镜照片Fig. 2 Transmission electron microscopy (TEM) images of nanocellulose prepared by four methods
注:S-CNC,硫酸水解法-纤维素纳米晶须;H-CNC,盐酸水解法-纤维素纳米晶须;U-CNF,大功率超声法-纤维素纳米纤维;S-CNF,高速搅拌法-纤维素纳米纤维。下同。
Note: S-CNC, sulfuric acid-cellulose nanocrystals; H-CNC, hydrochloric acid-cellulose nanocrystals; U-CNF, ultrasound-cellulose nanofibrils; S-CNF, stirring-cellulose nanofibrils; similarly for the fouowing figures.
2.3 红外光谱表征
由图3可以观察到,3 402 cm-1附近有一个很强的吸收峰,对应为羟基的O-H伸缩振动吸收峰[15]。2 900 cm-1附近的吸收峰,对应纤维素、半纤维素、木质素中的C-H键伸缩振动吸收峰[16]。1 741 cm-1附近的吸收峰,对应的半纤维素中的羰基和乙酰基的伸缩振动吸收峰。每一个图谱中出现的1 641 cm-1附近的吸收峰,代表样品中所含水分的吸收峰。1 517 cm-1代表木质素中C=C双键的伸缩振动吸收峰[17]。1 058和897 cm-1附近的吸收峰,代表纤维素C-O伸缩振动和糖苷键的C-H伸缩振动吸收峰[18]。
对比天然HSS纤维及4种方法所制备的纳米纤维素的FTIR图谱,纤维素的特征吸收峰并未发生明显改变,说明S-CNC,H-CNC,U-CNF,S-CNF的纤维素化学结构并未被改变或破坏,仍然保持着HSS纤维中纤维素的基本化学结构。
2.4 晶体结构表征
4种不同方法制备的纳米纤维素的X射线衍射光谱(X-ray Diffraction patterns,XRD)图显示,在2θ为22.5°和16°处,所有样品都出现了较为明显的特征衍射峰(图4),这两个峰位分别代表纤维素Ⅰ型结晶结构的(002晶面)和(101)晶面[19]。说明,4种制备方法所制备的纳米纤维均保持了Ⅰ型纤维素晶体结构。
纳米纤维素纤维的结晶度增加后,其纤维素分子间的结构更加有序和紧实,纤维的硬度和拉伸强度也随之增大,因此,CI值是纳米纤维素性能的重要指标(图4)。未经处理的HSS纤维的CI值为31.47%,低于天然HSS中纤维素成分的含量为43.11%(表1),这是由于纤维素由两部分组成,一部分为结晶态纤维素,另外一部分为非晶态纤维素。S-CNC和H-CNC的CI值分别为 70.05%和68.42%,表明硫酸水解法比盐酸水解法制备的纤维素纳米晶具有更高的结晶度。这是由于硫酸溶液中H+的浓度高于盐酸中H+的浓度,相同时间内能够更快、更有效地溶解纤维素无定形区,从而导致剩余结晶态纤维素含量更高,结晶度更高。大功率超声的实质是利用气泡短时间内崩溃产生的微射流使纤维达到开纤的目的。高速搅拌法则是利用水流所产生的冲击和剪切力使得纳米纤维最终得以分离。U-CNF和S-CNF结晶度分别为59.48%和58.94%,两者比较接近且都明显低于酸水解法制备的纳米晶的结度。该结果表明,大功率超声法和高速搅拌法所产生的力均可使纯化纤维素开纤,但对纤维素无定型区的影响较小,两种方法都无法明显的破坏无定形区或结晶区的结构,因此两种方法制备的U-CNF和S-CNF的结晶度较低且比较接近[20]。

图3 4种方法制备的纳米纤维素的平均尺寸和傅里叶红外光谱图Fig. 3 The average size and 4 transform infrared spectroscopy (FTIR) of the nanocellulose prepared using four methods
注:Untreated HSS,未经处理的葎草茎纤维;S-CNC,硫酸水解法-纤维素纳米晶须;H-CNC,盐酸水解法-纤维素纳米晶须;U-CNF,大功率超声法-纤维素纳米纤维;S-CNF,高速搅拌法-纤维素纳米纤维。下同。
Note:Untreated HSS,untreated humulus scandens stems; S-CNC,sulfuric acid-cellulose nanocrystals; H-CNC,hydrochloric acid-cellulose nanocrystals; U-CNF,ultrasound-cellulose nanofibrils; S-CNF,stirring-cellulose nanofibrils; similarily for the following figures.

图4 4种方法制备的纳米纤维素的X射线衍射光谱及结晶度图Fig. 4 X-ray diffraction patterns(XRD) and crystallinity of nanocellulose prepared by four methods
2.5 热稳定性表征
目前,很多热塑性材料的加工温度都超过了纳米纤维,当纳米纤维素进一步应用在增强型高分子材料时,其热稳定性就显得尤为重要了。图5为HSS原纤维、H-CNC、S-CNC、U-CNF、S-CNF的热重曲线,当温度从30 ℃升高到150 ℃时,所有样品均会出现一个微小的失重降解峰,这是由于样品中少量水分子的汽化造成的[5]。未处理的HSS样品在203.7 ℃开始发生热分解,而4种方法所制备的纳米纤维素的热分解温度均高于未经处理的HSS样品,这是由于化学处理过程中,热稳定性较差的果胶、木质素、半纤维素被脱出所致。S-CNC,H-CNC,样品的开始分解温度分别为217.8和245.3 ℃。S-CNC的开始分解温度远低于H-CNC,这可能是由于硫酸水解法制备的纳米纤维素晶须表面有残留的磺酸基,因此大幅降低了其热分解温度。U-CNF和S-CNF的初始解温度分别为262.7和261.9 ℃,两者比较接近,这是由于二者自身形貌、结晶度均比较接近所致。但相比之下,酸水解法制备的H-CNC及S-CNC的初始热分解温度则远低于大功率超声法和高速搅拌法所制备的U-CNF和S-CNF,这可能是由U-CNF和S-CNF的直径、长度和体积较大,反之相对比表面积则更小,因此热传递速率较慢所致。
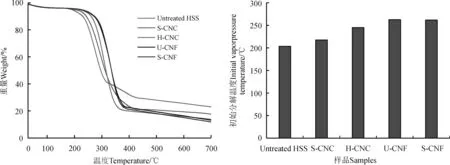
图5 四种方法制备的纳米纤维素的热重曲线Fig. 5 The thermal gravimetric analysis curves (TGA) and initial temperature of nanocellulose prepared by four methods
3 结论
以葎草茎为原料,对葎草成分进行了分析,并通过4种不同的方法制备了纤维素纳米晶和纤维素纳米纤维。结果表明,未经处理的葎草纤维中α-纤维素含量43.11%,化学处理可有效脱除半纤维素和木质素,使得纤维素含量提高到84.91%。通过4种方法制备的纳米纤维素S-CNC、H-CNC、U-CNF和S-CNF仍保持着与未经处理的纤维素一致的Ⅰ型纤维结构。硫酸水解法和盐酸水解法制备的S-CNC和H-CNC呈棒状,而大功率超声和高速搅拌法制备的U-CNF和S-CNF呈网状。硫酸水解法制备的S-CNC具有最高的CI值70.05%,但热稳定性最差,初始热分解温度最低,仅为217.8 ℃。大功率超声和高速搅拌法制备的U-CNF和S-CNF结晶度相对较低,分别为59.48%和58.94%,但热稳定性较比酸水解法制备的S-CNC和H-CNC更佳,其热分解温度可分别达到262.7和261.9 ℃。
References:
[1] 李伟,王锐,刘守新.纳米纤维素的制备.化学进展,2010,22(10):2060-2070. Li W,Wang R,Liu S X.Preparation of nanocrystalline cellulose.Progress in Chemistry,2010,22(10):2060-2070.(in Chinese)
[2] Klemm D,Heublein B,Fink H P,Bohn A.Cellulose:Fascinating biopolymer and sustainable raw material.Angewandte Chemie International Edition,2005,44:3358-3393.
[3] 卢麒麟,唐丽荣,林雯怡,黄彪,陈学榕,欧文,林占熺,林冬梅.巨菌草制备纳米纤维素及其表征.草业科学,2013,30(2):301-305. Lu Q L,Tang L R,Lin W Y,Huang B,Chen X R,Ou W,Lin Z X,Lin D M.Preparation and characterization of nano-crystalline cellulose fromPennisetumsinese.Pratacultural Science,2013,30(2):301-305.(in Chinese)
[4] 王飞.热带农作物废弃物制备天然纳米纤维素的研究进展.纤维素科学与技术,2013,21(1):78-85.
[5] Moran J I,Alvarez V A,Cyras V P.Extraction of cellulose and preparation of nanocellulose from sisal fibers.Cellulose,2008,15(1):149-159.
[6] 付广芝,高晓萍.外来园林危险性杂草——葎草.内蒙古林业调查设计,2012,35(1):120,123.
[7] 李孙荣,曹义山.葎草(Humulusscandens)的生物学特性及其防除研究初报.中国农业大学学报,1981,14(3):45.
[8] 段婧,刘金平.不同温度下雌雄葎草营养生长期的生长特性.草业科学,2013,30(3):418-422. Duan J,Liu J P.Gender differences of apparent traits ofHumulusscandensin response to temperature in the vegetative growth stage.Pratacultural Science,2013,30(3):418-422.(in Chinese)
[9] 樊星,王大伟,范宣,王思思,刘金平.支持物改变葎草形态可塑性和繁殖特性.草业科学,2015,32(9):1457-1462. Fan X,Wang D W,Fan X,Wang S S,Liu J P.Effects of external support on the morphological plasticity and reproductive strategies of climbingHumulusscandens.Pratacultural Science,2015,32(9):1457-1462.(in Chinese)
[10] Sluiter A,Ruiz R,Scarlata C.Determination of Extractives in Biomass (NREL/TP-510-42619).Golden:National Renewable Energy Laboratory,2008.
[11] Sluiter A,Hames B,Ruiz R.Determination of Structural Carbohydrates and Lignin in Biomass.Golden:National Renewable Energy Laboratory,2012.
[12] TAPPI Standard.T 203 om-93.Alpha-,beta- and gamma-cellulose in pulp.Atlanta, GA、TAPPI,1993.
[13] Wise L E,Murphy M,D’Addieco A A.Chlorite holocellulose,its fractionation and bearing on summative wood analysis and on studies on the hemicelluloses.Paper,1946,122(6):35.
[14] Segal L C,Creely J,Martin A E J,Conrad C M.An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer.Textile Research Journal,1959,29:786-794.
[15] Sain M,Panthapulakkal S.Bioprocess preparation of wheat straw fibers and their characterization.Industrial Crops & Products,2006,23:1-8.
[16] Alemdar A,Sain M.Isolation and characterization of nanofibers from agricultural residues——Wheat straw and soy hulls.Bioresource Technology,2008,99:1664-1671.
[17] Xiao B,Sun X F,Sun R C.Chemical,structural,and thermal characterizations of alkali-soluble lignins and hemicelluloses,and cellulose from maize stems,rye straw,and rice straw.Polymer,Degradation & Stability,2001,74:307-319.
[18] Sun R C,Tomkinson J,Wang Y X,Xiao B.Physico-chemical and structural characterization of hemicelluloses from wheat straw by alkaline peroxide extraction.Polymer,2000,41:2647-2656.
[19] Nishiyama Y,Sugiyama J,Chanzy H,Langan P.Crystal structure and hydrogen bonding system in cellulose Ⅰ(alpha) from synchrotron X-ray and neutron fiber diffraction.Journal of the American Chemical Society,2003,125:14300-14306.
[20] 谌恩华,吴华伟,李相前.结晶纤维素的降解.草业科学,2016,33(11):2367-2374. Shen E H,Wu H W,Li X Q.Advance in research on degradation of crystalline cellulose.Pratacultural Science,2016,33(11):2367-2374.(in Chinese)
(责任编辑 苟燕妮)
Comparative analysis of nanocellulose fromHumulusscandensstems using four isolation methods
Jiang Ya-ni1, Zhou Ji-ping2, Zhang Qi2, Zhao Guo-qi1, Xu Xiao-dong1
(1.College of Animal Science and Technology, Yangzhou University, Yangzhou 225000, China;2.College of Mechanical Engineering, Yangzhou University, Yangzhou 225000, China)
Sulfuric acid-cellulose nanocrystals (S-CNC), hydrochloric acid-cellulose nanocrystals (H-CNC), ultrasound-cellulose nanofibrils (U-CNF) and stirring-cellulose nanofibrils (S-CNF) were successfully isolated fromHumulusscandensstems (HSS) using sulfuric acid hydrolysis, hydrochloric acid hydrolysis, high power ultrasonic and high stirring, respectively. The morphology, chemical structure, crystal structure and thermal stability were characterized using scanning electron microscopy, transmission electron microscopy, Fourier transform infrared spectroscopy, X-ray diffraction patterns and thermal gravimetric analysis. The results suggested that the S-CNC and H-CNC prepared by acid hydrolysis had short rod-like shapes, while the U-CNFs and S-CNFs had reticular shapes. The S-CNC has the highest crystallinity (70.05%) while the S-CNF had the lowest crystallinity of the four kinds of nanocellulose; all maintained cellulose Ⅰ structure. The U-CNF had the best thermal stability with initial decomposition temperature of 261.9 ℃, but the S-CNC was the worst with the initial decomposition temperature of 217.8 ℃.
wild herb;Humulusscandensstems; nanocellulose; sulfuric acid hydrolysis; hydrochloric acid hydrolysis; high speed stirring; high power ultrasound
Zhou Ji-ping Email: jpzhou@yzu.edu.cn
10.11829/j.issn.1001-0629.2016-0524
2016-10-17 接受日期:2017-02-24
扬州大学高端人才基金;江苏省青年基金(BK20140486);江苏省高校自然科学研究基金资助项目(14KJB480007);中国博士后科学基金项目(2014560448)
姜亚妮(1984-),女,陕西西安人,在读博士生,主要从事纳米纤维素研究。E-mail:jiangyani0507@126.com
周骥平(1960-),男,江苏扬州人,教授,博士,主要从事草业机械方面的研究。E-mail:jpzhou@yzu.edu.cn
S564+.4;Q539+.3
A
1001-0629(2017)08-1748-07
姜亚妮,周骥平,张琦,赵国琦,许晓东.4种方法从葎草中制备的纳米纤维素性能.草业科学,2017,34(8):1748-1754.
Jiang Y N,Zhou J P,Zhang Q,Zhao G Q,Xu X D.Comparative analysis of nanocellulose fromHumulusscandensstems using four isolation methods.Pratacultural Science,2017,34(8):1748-1754.

