不同超声强度下微囊藻群体沉降及其上浮过程对光照和温度的响应
谭 啸,孙玉童,段志鹏,曾庆飞,郑雪莹,刘倩倩
(1:河海大学浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京 210098)(2:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
不同超声强度下微囊藻群体沉降及其上浮过程对光照和温度的响应
谭 啸1,孙玉童1,段志鹏1,曾庆飞2,郑雪莹1,刘倩倩1
(1:河海大学浅水湖泊综合治理与资源开发教育部重点实验室,河海大学环境学院,南京 210098)(2:中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008)
以太湖微囊藻群体为研究对象,研究低频超声作用下,4种超声强度和不同处理时间对微囊藻群体的抑制效应,试图得出最优超声参数,同时探讨超声处理后的微囊藻群体对光照和温度的响应. 结果表明,当超声强度为0.0353 W/cm3、处理时间为60 s时,藻细胞沉降量高达80%,且此时藻细胞浓度和叶绿素a浓度均保持不变,表明超声未破碎藻细胞,细胞内含物不会泄漏污染水质,因此作为最优超声参数. 随后,对超声处理后的微囊藻群体在不同光照和温度条件下进行恢复培养,结果表明光照和温度均能影响微囊藻群体的浮力恢复,但光照的影响更明显,当光照度为2000 lx时,藻细胞在培养120 h后漂浮率恢复至对照组水平. 超声后的藻细胞在较低温度(≤20℃)下漂浮率无显著变化,而在较高温度(25℃)下,培养72 h后漂浮率迅速升高,至120 h能恢复至对照组水平的80%左右. 因此,野外超声控藻应选择低光强、低温的时段,采用间歇式多次处理,抑制微囊藻群体上浮,使其彻底沉降.
微囊藻群体;超声强度;超声时间;沉降;漂浮率;光照;温度;太湖
频繁发生的微囊藻水华给饮用水安全、水产养殖、湖泊景观带来严重危害[1-3]. 人们采用了多种方法控藻[4-5],近年来,超声波作为一种环境友好型控藻技术得到广泛关注,其原理是超声波在水中的传播过程呈现正负声压的周期交变形成空化泡并产生“空化效应”,从而对藻细胞产生机械和自由基损伤[6-7]. 其中,机械损伤主要为伪空胞破裂时产生的冲击波和剪切力损害细胞膜和细胞壁[8-9];而自由基损伤主要是空化气泡破裂产生局部高温高压环境(可达5000 K, 100 MPa),使水分子分解成HO·和H·等自由基氧化藻细胞[7,10].
超声波控藻效果取决于其作用参数(频率、强度和处理时间). 有研究表明低频超声波(20~100 kHz)比高频超声波除藻效果更好,低频条件下空化泡有充足的时间在不破裂情况下产生最大的负压,从而在崩溃时产生更强的冲击波[11]. 超声波强度是影响控藻效果的又一重要因素,舒天阁等[12]采用不同超声强度处理铜绿微囊藻悬液,发现50 W除藻效率最大,随着声强的继续增加,除藻效率反而下降. 此外,Rajasekhar等[13]发现超声强度小于0.32 W/cm3,长时间(>5 min)处理会增加水体中藻毒素浓度. 因此,适当的超声处理能够有效去除藻细胞,同时降低环境风险和能耗. 许多研究者均发现采用低频低强度的超声控藻,即时去除效果显著,主要是通过破坏伪空胞,使其失去浮力下沉[5,14-16]. 然而,在适宜的培养条件下被超声破坏的伪空胞能够重新恢复. 李芸[17]观察超声后的鱼腥藻和微囊藻伪空胞的恢复情况,发现在温度和光照适宜时,鱼腥藻的伪空胞达到完全恢复需要5 d,而微囊藻只需2 d. Lee等[5]研究光照和曝气对超声后藻细胞恢复的影响,发现光照是主要的影响因素,只有光照充足时藻细胞才能恢复至处理前的状态. 由于悬浮颗粒物等的存在,会造成湖泊水下光场的垂直分布差异,且随着水深加大光强度逐渐减弱,除此之外,自然条件下温度也是变化的. 因此,研究超声处理后的藻细胞在不同光照和温度的恢复过程,试图找出最佳超声处理时间段,使超声后的藻细胞彻底不再上浮,能够显著提高超声控藻效果.
本文采集太湖微囊藻群体作为研究对象,选用低频超声波,设置不同的超声强度和时间,筛选最优参数,探讨在最优参数处理后藻细胞在不同光照和温度的光合活性响应及浮力恢复过程,为超声除藻提供理论支持和参数借鉴.
1 材料与方法
1.1 藻样采集
本实验使用的藻样取自太湖梅梁湾(31°24′N,120°13′E). 采样时间为2015年7月3日,采集水下0.5 m处的藻样,过0.15 mm孔径的筛网,选取留在筛网上的微囊藻群体,经过镜检发现主要为铜绿微囊藻(Microcystisaeruginosa). 将微囊藻群体按照叶绿素浓度为0.4 mg/L配置藻细胞悬液.
1.2 实验装置
水浴式超声处理装置(DAS50-GL1, DAS Corp)如图1所示. 该装置的频率为35 kHz,功率范围为20~40 W. 超声强度的计算参照标准量热法,计算公式为:

图1 超声装置示意图Fig.1 Diagram of the ultrasonic device
(1)
式中,Cwater为水的比热容(4.18 J/(kg·K)),Mwater为超声所用的水量(kg),ΔT/Δt为超声辐射时间内的水温变化率(℃/S),V为藻悬液体积(ml).
在超声装置上设置不同的功率水平,通过公式测算超声强度.
1.3 实验方法
实验设置4种超声强度,分别为0.0096、0.0193、0.0353和0.0433 W/cm3,将配置好的藻细胞悬液置于烧杯中,在上述超声强度下分别处理5、30、60、300和600 s,同时设定不进行超声处理的藻悬液为对照组. 随后,对藻液进行沉降分析、生长与生理分析.
选取上述实验的最佳超声参数处理后的藻液放入灭菌的25 ml 试管中,分别在3种不同光照度(0、200、2000 lx,光周期均为12 h∶12 h,温度设置为25℃)和不同温度(15、20、25℃,光照度均为2500 lx,光周期为12 h∶12 h)的培养箱中对藻细胞进行恢复培养120 h,设置未超声的藻液作为对照组,每隔24 h分别测定细胞漂浮率及光合活性变化.
1.4 分析方法1.4.1 细胞沉降率/漂浮率的计算 取超声处理后藻液15 ml于25 ml试管中静置沉降24 h,分层测定叶绿素a浓度. 即取试管上层藻液14 ml测定悬浮藻细胞的叶绿素a浓度(Chl.a悬浮),底层1 ml测定沉降藻细胞的叶绿素a浓度(Chl.a沉降),沉降率和漂浮率的计算公式分别为:
沉降率(%)=Chl.a沉降/(Chl.a悬浮+Chl.a沉降)
(2)
漂浮率(%)=Chl.a悬浮/(Chl.a悬浮+Chl.a沉降)
(3)
1.4.2 藻细胞光合活性测定 最大光化学效率(Fv/Fm)是衡量藻细胞光合作用状况的重要指标,其中,Fv=Fm-Fo,Fm是经过饱和脉冲高光强后发出的最大荧光,Fo是经过暗适应的藻细胞在低强度测量光条件下发出的初始荧光. 取藻悬液2 ml,暗适应15 min,采用AquaPen-C AP-C 100叶绿素荧光仪(饱和脉冲光强为3200 μmol (photons) /(m2·s))测定藻细胞叶绿素a荧光,并计算Fv/Fm.
1.4.3 藻细胞浓度测定 将藻液滴在血球计数板载玻片与盖玻片之间的计数室中,在显微镜下进行计数,然后换算成待测藻液的细胞浓度.
1.5 数据统计
用Origin 8.0软件进行数据处理、图形绘制,用SPSS 19.0软件进行数据统计分析.
2 结果
2.1 超声强度对微囊藻群体的沉降效果
不同超声强度下,藻细胞下沉达到最大量的超声处理时间各不相同. 在0.0096 W/cm3超声强度下,藻细胞达到最大沉降率的时间为300 s,此时沉降率为76.12%. 在0.0193和0.0353 W/cm3超声强度下,最佳超声处理时间是60 s,沉降率分别是75%和79.35%,而0.0433 W/cm3处理组的沉降率达到最大值74.75%的超声时间是5 s(图2). 比较各个超声强度的沉降率大小,可得出最优超声参数:超声强度为0.0353 W/cm3,处理时间为60 s.

图2 不同超声强度和处理时间的控藻效果(**表示显著差异,P<0.05;***表示极显著差异,P<0.01;下同)Fig.2 Comparison of ultrasonic effects under different intensity conditions for different time(** indicates significant difference at P<0.05; *** indicates significant difference at P<0.01, the same below)
本文观察了最优超声强度下(0.0353 W/cm3)藻细胞的浓度变化(图3). 当超声处理时间不超过60 s(最佳处理时间)时,藻细胞浓度无显著差异(P>0.05). 随着超声的继续进行,藻细胞浓度显著降低(P<0.05),其变化趋势与悬液中叶绿素a浓度变化一致.Fv/Fm是衡量藻细胞光合作用状况的重要指标,本研究表明藻细胞光合系统对超声非常敏感,Fv/Fm由初始值0.416降低至0.152,并且在超声60 s时,藻细胞光合活性下降率最大,达32.6%(图4).
2.2 光强对超声后微囊藻上浮的影响
未超声组藻细胞在无光照下呈现轻微上浮现象,而有光照时,藻细胞有轻微下沉趋势,但总体差异不显著(P>0.05);超声组藻细胞在光照度为200 lx和2000 lx下,均在培养72 h后漂浮率显著增加(P<0.05),培养至120 h,2000 lx光照度下超声藻细胞能恢复至与对照组无显著差异,而200 lx和0 lx光照度下超声处理组与对照组差异显著(P<0.05). 0 lx光照度下超声处理组藻细胞漂浮率为15%左右,200 lx光照度下超声处理组藻细胞的漂浮率恢复至对照组水平的70%. 从光合活性变化来看,在黑暗条件下,对照组藻细胞的Fv/Fm有轻微的减少趋势,超声组藻细胞在恢复培养的前48 h最大光合效率均较低,72 h后迅速增大,但是除2000 lx光照度外,超声组藻细胞Fv/Fm始终低于对照组(P<0.05)(图5).
2.3 温度对超声后微囊藻上浮的影响
比较超声组和对照组藻细胞在不同温度下的响应,发现未超声处理的藻细胞在15℃培养后下沉(沉降率达20%),而经25℃恢复培养后的藻细胞有轻微上浮,与恢复培养前相比,漂浮率升高约10%. 在温度为15℃和20℃条件下,超声组藻细胞在培养72 h内继续沉降,72 h后有轻微恢复,但漂浮率与恢复培养前相比无显著变化(P>0.05);在25℃条件下,藻细胞在恢复培养96 h后明显上浮,120 h后上浮约40%左右. 对照组藻细胞在不同温度下光合活性波动很小,而超声组藻细胞Fv/Fm在培养48 h后开始增加,在25℃条件下恢复培养120 h后光合活性接近未超声的状态(图6).

图3 藻细胞浓度随超声处理时间的变化(超声强度为0.0353 W/cm3)Fig.3 Changes of cell concentration at different treatment time (Ultrasound intensity=0.0353 W/cm3)

图4 Fv/Fm随超声处理时间的变化(超声强度为0.0353 W/cm3)Fig.4 Changes of Fv/Fm at different treatment time (Ultrasound intensity=0.0353 W/cm3)

图5 不同光照度下超声和未超声藻细胞恢复培养过程中上浮情况及其光合活性变化Fig.5 Changes of algae floating rate and photosynthetic activity under different light intensity conditions

图6 不同温度下超声和未超声藻细胞恢复培养过程中上浮情况及其光合活性变化Fig.6 Changes of algae floating rate and photosynthetic activity under different temperature conditions
3 讨论
3.1 最优超声强度与处理时间
超声波除藻的机理研究中,研究对象多是实验室培养的单细胞微囊藻,而野外微囊藻群体与单细胞相比,微结构、多糖含量和色素组成都较复杂[18],这可能会造成超声波对微囊藻群体和单细胞影响的差异. 本文选取太湖的微囊藻群体作为研究对象,发现在0.0353 W/cm3、60 s超声参数下,藻细胞沉降量最大(高达80%),这与Lee等[5]的研究结果类似. 已有研究[14-16]表明,超声对野外微囊藻群体的去除效果明显优于室内培养微囊藻(表1),表明野外微囊藻群体对超声更敏感. 徐鹏飞等[19]发现悬液中藻细胞浓度与悬液叶绿素浓度呈良好的线性关系,因此,可用叶绿素浓度间接反映藻细胞数量. 本研究发现当超声处理时间在60 s内,胞内叶绿素a浓度无显著变化,藻悬液叶绿素浓度变化与0.0353 W/cm3处理组的藻细胞浓度变化趋势一致,推测此时叶绿素a主要位于细胞内,未发生细胞内含物溶出. 因此,在0.0353 W/cm3、60 s超声条件下,藻细胞没有破碎,而可能是藻细胞内的伪空胞破裂或者群体打散,从而促使藻细胞下沉. Lee等[5]研究发现,28 kHz、120 W的超声条件下,3 s的超声处理就可以使伪空胞破裂,使80%的藻细胞下沉. 此外,藻细胞的光合活性对超声非常敏感,可能是超声破坏了类囊体膜上的色素蛋白和电子传递体[20-21]. 本研究结果表明低频、低强度和短时间的超声波可在不破碎藻细胞导致细胞内含物释放的情况下使微囊藻下沉,并且显著损伤微囊藻的光合系统,为水华应急处理提供了环境安全保障.
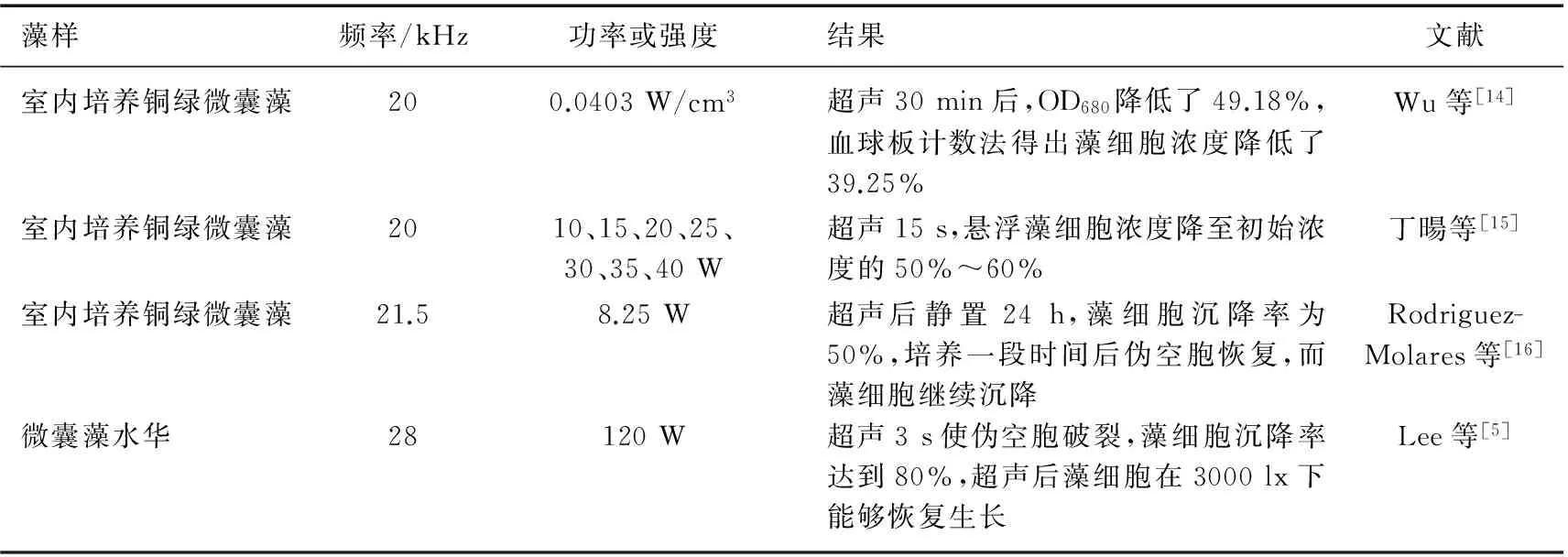
表1 低频、低强度超声除藻效果比较
3.2 光强与温度对超声后藻细胞浮力恢复影响的比较
蓝藻浮力调节存在两种机制:细胞内镇重物含量的改变,伪空胞的合成与破裂[22-23]. 糖类为主要镇重物[24],光照充足时,藻类通过光合作用积累糖类,使藻细胞质量密度增加,开始下沉[25];光照受限时,呼吸作用占主导,糖类被不断消耗,藻细胞因质量密度下降而上浮[26]. 本实验也发现在光照度为2000 lx时,悬液中的藻细胞有轻微下沉,而无光照时,悬液的藻细胞略有增加. 因此,未超声藻细胞的浮力调节可能是通过改变糖类含量实现的. 此外,超声除藻主要是通过超声产生的物理化学效应使伪空胞破裂和细胞下沉. 但是Rodriguez-Molares等[16]观察超声处理后铜绿微囊藻的沉降过程时发现藻细胞经超声处理后,伪空胞能够在24 h内重新形成. 超声处理后,藻细胞重新上浮的影响因素很多,Lee等[5]观察了光照和曝气对藻细胞上浮的影响,发现光照是主要的影响因素,只有光照充足时藻细胞才能上浮. Deacon等[27]研究了超声后藻细胞伪空胞的恢复,发现在无光条件下有少量的新伪空胞合成,光照度在0~1200 lx范围内,伪空胞合成的数量与光强呈线性关系,在光照度为2000 lx时新合成伪空胞的数量最大. 本实验也发现在无光照条件下藻细胞上浮率较小,可能是由于前期细胞内储存的物质与能量被呼吸作用消耗,伪空胞合成受抑制,而在有光照条件下,光合作用为伪空胞合成提供物质和能量[28].
周贝等[29]研究了温度对铜绿微囊藻细胞浮力的影响,发现温度低于20℃时铜绿微囊藻下沉,温度高于20℃时铜绿微囊藻上浮. 温度对藻细胞浮力的影响与糖类利用能力密切相关[30]. 当温度低于20℃时,藻细胞的生长代谢速率降低,但此时细胞仍具有较强的光合作用,因此光合作用产生的糖类大大超过了细胞需求,糖类累积后使细胞因质量密度增大而下沉;而在较高温度(20~30℃)时,细胞具有较高的生长速率,较强的光合作用产生了大量糖类,为细胞的快速生长分裂提供了物质基础,而较高的代谢速率及时分解了糖类,导致细胞质量密度减小,浮力增加[29]. 此外,关于温度对超声后藻细胞浮力的影响,有研究者发现在温度适宜时,被超声破坏的伪空胞经过一定时间后又会被合成,浮力恢复,鱼腥藻的伪空胞达到完全恢复需要5 d,而微囊藻则只需2 d[17]. Brookes等[31]研究表明,铜绿微囊藻蛋白含量随着温度的升高而增大,细胞内蛋白含量变化趋势与细胞内伪空胞数量一致. 本研究也表明随着温度升高,超声后藻细胞的浮力逐渐恢复. 结合光合活性变化来看,超声处理后在15℃和20℃温度下培养时藻细胞的光合活性逐渐恢复,糖类产量增加,但此时细胞代谢速率较低,糖类的分解速率小于积累速率,因此,藻细胞质量密度增加,细胞下沉. 在25℃培养时,超声后藻细胞光合活性也得到恢复,但是此时藻细胞的代谢速率较高,能及时分解光合作用产生的糖类,使藻细胞上浮.
本研究表明在较高光强(2000 lx)和温度(25℃)下恢复培养,超声处理的藻细胞能够上浮,这与Lee等[5]的研究结果一致. 在弱光(<200 lx)和低温(≤20℃)的恢复培养条件下,藻细胞基本无上浮. 因此,超声控藻应选择低光强、低温的时间段,使其彻底丧失上浮能力.
藻细胞漂浮率与光照度的回归斜率(8.823)明显大于漂浮率与温度的回归斜率(2.541),可见光照度对藻细胞的浮力恢复影响更大(图7),原因可能有以下两点:一是光照度调节光合速率,影响新伪空胞合成所需的物质和能量;二是超声处理过程中,可能部分伪空胞仅仅坍塌而未破裂,这些伪空胞内的气体受超声挤压而泄漏,使其空瘪,恢复生长后光合作用释放的氧气使这些伪空胞重新充气饱满[32].

图7 光照和温度对超声后藻细胞恢复的影响Fig.7 Changes of algae floatation at different light intensity and temperature conditions
4 结论
1)本研究中,最优参数为:超声强度0.0353 W/cm3,处理时间60 s. 此时藻细胞沉降量最大,藻细胞浓度和胞内叶绿素浓度均保持不变,表明超声未破碎藻细胞,细胞内含物不会泄漏污染水质.
2)超声处理后,较高光照度(2000 lx)和温度(25℃)更能促进微囊藻恢复生长并获得浮力,且光照的影响更大,建议野外超声除藻选择低光强、低温的时段,采用60 s间歇式多次处理,使微囊藻彻底沉降,丧失再悬浮能力.
[1] Li Yonghui, Li Yucheng, Wang Ningetal. Formation and control of the harmful ingredients during the decaying process of cyanobacteria from Lake Chaohu.JLakeSci, 2012, 24(4): 513-518. DOI: 10.18307/2012.0402. [李永慧, 李玉成, 王宁等. 巢湖蓝藻死亡衰败过程中典型有害成分形成及控制对策. 湖泊科学, 2012, 24(4): 513-518.]
[2] Shang Lixia, Ke Fan, Li Wenchaoetal. Laboratory research on the contaminants release during the anaerobic decomposition of high-density cyanobacteria.JLakeSci, 2013, 25(1):47-54. DOI: 10.18307/2013.0107. [尚丽霞, 柯凡, 李文朝等. 高密度蓝藻厌氧分解过程与污染物释放实验研究. 湖泊科学, 2013, 25(1): 47-54.]
[3] Song Changtai, Chen Cheng. The harm, causes and treatment methods of cyanobacteria in crab pond.FisheryGuidetobeRich, 2014, (20): 53-54. [宋长太, 陈诚. 蟹池蓝藻危害、产生的原因及处置方法. 渔业致富指南, 2014, (20): 53-54.]
[4] Svrcek C, Smith DW. Cyanobacteria toxins and the current state of knowledge on water treatment options: a review.JournalofEnvironmentalEngineering&Science, 2004, 3(3): 155-185. DOI: 10.1139/s04-010.
[5] Lee TJ, Nakano K, Matsumura M. Ultrasonic irradiation for blue-green algae bloom control.EnvironmentalTechnology, 2001, 22(4): 383-390. DOI: 10.1080/09593332208618270.
[6] Joyce E, Phull SS, Lorimer JPetal. The development and evaluation of ultrasound for the treatment of bacterial suspensions. A study of frequency, power and sonication time on culturedBacillusspecies.UltrasonicsSonochemistry, 2003, 10(6): 315-318. DOI: 10.1016/S1350-4177(03)00101-9.
[7] Koda S, Miyamoto M, Toma Metal. Inactivation ofEscherichiacoliandStreptococcusmutansby ultrasound at 500 kHz.UltrasonicsSonochemistry, 2009, 16(5): 655-659. DOI: 10.1016/j.ultsonch.2009.02.003.
[8] Frizzell LA. Biological effects of acoustic cavitation. Ultrasound: its chemical, physical, and biological effects. Weinheim: Wiley-VCH, 1988: 287-301.
[9] Cameron M, McMaster LD, Britiz TJ. Electron microscopic analysis of dairy microbes inactivated by ultrasound.UltrasonicsSonochemistry, 2008, 15(6): 960-964. DOI: 10.1016/j.ultsonch.2008.02.012.
[10] Mason TJ, Lorimer JP. Applied sonochemistry. The uses of power ultrasound in chemistry and processing. Weinheim: Wiley-VCH, 2002: 1-48.
[11] Liu Kezhai. The technology of repeatedly low-frequency and low-power ultrasonic irradiation for the treatment of blooms.EastChinaScience&Technology, 2015, (5): 18,20. [刘轲翟. 多频次低频率低强度超声波除 (控) 藻技术. 华东科技(学术版), 2015, (5): 18,20.]
[12] Shu Tiange, Yuan Baoling, Wang Shaorong. Studies on the removal ofMircocystisaeruginosaby low-power ultrasonic.JournalofHuaqiaoUniversity:NaturalScienceEdition, 2008, 29(1): 72-75. [舒天阁, 苑宝玲, 王少蓉. 低功率超声波去除铜绿微囊藻技术. 华侨大学学报: 自然科学版, 2008, 29(1): 72-75.]
[13] Rajasekhar P, Fan LH, Nguyen Tetal. Impact of sonication at 20 kHz onMicrocystisaeruginosa,AnabaenacircinalisandChlorellasp.WaterResearch, 2012, 46(5): 1473-1481. DOI: 10.1016/j.watres.2011.11.017.
[14] Wu X, Joyce EM, Mason TJ. Evaluation of the mechanisms of the effect of ultrasound onMicrocystisaeruginosaat different ultrasonic frequencies.WaterResearch, 2012, 46(9): 2851-2858. DOI: 10.1016/j.watres.2012.02.019.
[15] Ding Yang, Pu Yuepu, Yin Lihongetal. Parameters optimization of ultrasound algae removal technology and bloom removal study in Lake Taihu.JournalofSoutheastUniversity:NaturalScienceEdition, 2009, 39(2): 354-358. [丁暘, 浦跃朴, 尹立红. 超声除藻的参数优化及其在太湖除藻中的应用. 东南大学学报: 自然科学版, 2009, 39(2): 354-358.]
[16] Rodriguez-Molares A, Dickson S, Hobson Petal. Quantification of the ultrasound induced sedimentation ofMicrocystisaeruginosa.UltrasonicsSonochemistry, 2014, 21(4): 1299-1304. DOI: 10.1016/j.ultsonch.2014.01.027.
[17] Li Yun. Study on effect of algal control by low-frequency and low-power ultrasonic irradiation[Dissertation]. Fuxin: Liaoning Technology University, 2011. [李芸. 低频低强度超声波控藻效果研究[学位论文]. 阜新: 辽宁工程技术大学, 2011.]
[18] Zhang M, Shi XL, Yu Yetal. The acclimative changes in photochemistry after colony formation of the cyanobacteriaMicrocystisaeruginosa.JournalofPhycology, 2011, 47(3): 524-532. DOI: 10.1111/j.1529-8817.2011.00987.x.
[19] Xu Pengfei, Wang Ping, Liu Kun. Removal and inhibition of microcystin algae included in wastewater by ultrasonic method.EnvironmentalScience&Technology, 2014, 37(2): 48-52. [徐鹏飞, 汪苹, 刘堃. 超声波法对微囊藻的去除和抑制作用研究. 环境科学与技术, 2014, 37(2): 48-52.]
[20] Hao Hongwei, Chen Yifang, Wu Minshengetal. Studies on the inhibition of cyanobacteria’s growth by low-power and high-frequency ultrasound.ActaBiophysicaSinica, 2003, 19(1): 101-104. [郝红伟, 陈以方, 吴敏生等. 低功率高频超声抑制蓝藻生长的研究. 生物物理学报, 2003, 19(1): 101-104.]
[21] Shao Lulu. Algal control effect and mechanism of low intensity ultrasonic[Dissertation]. Ningbo: Ningbo University, 2012. [邵路路. 低强度超声波控藻效果及其机理研究[学位论文]. 宁波: 宁波大学, 2012.]
[22] Walsby AE. Gas vesicles.MicrobiologicalReviews, 1994, 58(1): 94-144.
[23] Kinsman R, Ibelings BW, Walsby AE. Gas vesicle collapse by turgor pressure and its role in buoyancy regulation byAnabaenaflos-aquae.JournalofGeneralMicrobiology, 1991, 137(5): 1171-1178. DOI: 10.1099/00221287-137-5-1171.
[24] Yang Bo. Research in character of gas vesicle and response of buoyancy regulation to nitrogen, phosphorus and temperature in cyanobacteria[Dissertation]. Changsha: Hunan Agricultural University, 2007. [杨波. 蓝藻伪空胞的特征及其浮力对氮磷和温度的响应机制研究[学位论文]. 长沙: 湖南农业大学, 2007.]
[25] Zhou Hong, Ren Jiuchang, Cai Xiaoming. The concept and measurement of diurnal light compensation point of submerged macrophyte.ActaScientiaeCircumstantiae, 1997, 17(2): 256-258. [周红, 任久长, 蔡晓明. 沉水植物昼夜光补偿点及其测定. 环境科学学报, 1997, 17(2): 256-258.]
[26] Kromkamp J, Walsby AE. A computer model of buoyancy and vertical migration in cyanobacteria.JournalofPlanktonResearch, 1990, 12(1): 161-183. DOI: 10.1093/plankt/12.1.161.
[27] Deacon C, Walsby AE. Gas vesicle formation in the dark, and in light of different irradiances, by the cyanobacteriumMicrocystissp..BritishPhycologicalJournal, 1990, 25(2): 133-139. DOI: 10.1080/00071619000650121.
[28] Dai Ran. Effects of nitrogen and light on the buoyancy ofMicrocystisandAnabaenaspiroides[Dissertation]. Harbin: Heilongjiang University, 2011. [代然. 氮及光对微囊藻和鱼腥藻浮力调节的影响[学位论文]. 哈尔滨: 黑龙江大学, 2011.]
[29] Zhou Bei, Bi Yonghong, Hu Zhengyu. Effects of temperature on the buoyancy ofMicrocystisaeruginosa.ChinaEnvironmentalScience, 2014, 34(7): 1847-1854. [周贝, 毕永红, 胡征宇. 温度对铜绿微囊藻细胞浮力的调控机制. 中国环境科学, 2014, 34(7): 1847-1854.]
[30] Jin Xiangcan, Chu Zhaosheng, Yang Boetal. Effects of temperature on growth, photosynthesis and buoyancy regulation of the cyanobacteriaMicrocystisflos-aquaeandPlanktothrixmougeoti.ActaScientiaeCircumstantiae, 2008, 28(1): 50-55. [金相灿, 储昭升, 杨波等. 温度对水华微囊藻及孟氏浮游蓝丝藻生长、光合作用及浮力变化的影响. 环境科学学报, 2008, 28(1): 50-55.]
[31] Brookes JD, Ganf GG. Variations in the buoyancy response ofMicrocystisaeruginosato nitrogen, phosphorus and light.JournalofPlanktonResearch, 2001, 23(12): 1399-1411.
[32] Wang Wei, Cong Haibing, Xu Yajunetal. Volume fraction of gas vesicle and floating characteristics of cyanobacteria in Lake Taihu under different pressures.EnvironmentalScience, 2014, 35(8): 2974-2979. [王巍, 丛海兵, 徐亚军等. 不同压力作用下太湖蓝藻气囊体积分数及上浮特性研究. 环境科学, 2014, 35(8): 2974-2979.]
Influence of ultrasonic intensity on sinking ofMicrocystiscolonies and their floating process under different light and temperature conditions
TAN Xiao1, SUN Yutong1, DUAN Zhipeng1, ZENG Qingfei2, ZHENG Xueying1& LIU Qianqian1
(1:KeyLaboratoryofIntegratedRegulationandResourceDevelopmentonShallowLakeofMinistryofEducation,CollegeofEnvironment,HohaiUniversity,Nanjing210098,P.R.China)(2:StateKeyLaboratoryofLakeScienceandEnvironment,NanjingInstituteofGeographyandLimnology,ChineseAcademyofSciences,Nanjing210008,P.R.China)
Inhibition effect of different ultrasonic intensities was investigated by usingMicrocystiscolonies from Lake Taihu, and the aim of this study was to obtain the optimal ultrasound parameters. The floating character ofMicrocystiscolonies after sonication was cultured under different illumination intensity and temperature conditions. Results showed that sonication for 60 s at 0.0353 W/cm3was an optimal parameter, which led to an immediate sedimentation (up to 80%) markedly. In the experiment, the algal cell concentration and chlorophyll-a concentration were unchanged, which suggested that algal cells remained intact and cell inclusions did not leak to contaminate water quality. Light and temperature played important roles in the floating process ofMicrocystiscolonies, but light was a more significant factor during the process. Under 2000 lx at 25℃,the floating rate of algal cells could restore to the normal level after 120 h, while the floating rate of algal cells after sonication did not change significantly at a relatively low temperature (≤20℃). In comparison, at a higher temperature of 25℃, the floating rate increased after 72 h which could restore to 80% of the level in control group after 120 h. Therefore, the ultrasonic control of algal blooms in lakes should choose a weak illumination intensity and low temperature condition.
Microcystiscolonies; ultrasonic intensity; exposure time; sedimentation; floating rate; illumination; temperature; Lake Taihu
国家自然科学基金项目(31470507)、中央高校科研业务费项目(2013B32414)和江苏省优势学科平台项目(PAPD)联合资助. 2016-07-25收稿; 2016-12-02收修改稿. 谭啸(1980~),男,博士,副教授; E-mail: biotan@163.com.
DOI 10.18307/2017.0514

