rs2507800、rs4880、rs1799895单核苷酸多态性与中国东北地区汉族妇女子痫前期相关性研究
杜 蒙 王启迪 王玉婷 安丽莎 曹小芳 邱 月 高 丹 郭昌龙*马 旭*
1.北京协和医学院研究生院(100730);2.国家卫生计生委科学技术研究所;3.中国医科大学盛京医院
rs2507800、rs4880、rs1799895单核苷酸多态性与中国东北地区汉族妇女子痫前期相关性研究
杜 蒙1,2王启迪2王玉婷3安丽莎2曹小芳2邱 月1,2高 丹2郭昌龙2*马 旭1,2*
1.北京协和医学院研究生院(100730);2.国家卫生计生委科学技术研究所;3.中国医科大学盛京医院
目的:探讨Ang-1rs2507800、SOD2rs4880及SOD3rs1799895多态性与中国东北地区汉族妇女子痫前期(PE)是否存在关联。方法:采用飞行时间质谱对181例PE患者(病例组)及203例健康孕妇(对照组)的上述3个位点进行分型,分型结果采用SPSS12.0软件进行统计分析。结果:病例组与对照组rs2507800、rs4880、rs1799895等位基因频率和基因型频率均无统计学差异(P>0.05)。对rs2507800、rs4880分别在显性、隐性模型下进行分析,两组仍无统计学差异(P>0.05)。结论:rs2507800、rs4880、rs1799895多态性与PE不相关。
子痫前期;ANG-1基因;SOD2基因;SOD3基因;单核苷酸多态性
子痫前期(PE)发生于妊娠期20周后,以新发高血压和蛋白尿为发病特征。PE被认为是一种胎盘源性疾病,发病机制目前尚不清楚,多数学者认为是由于滋养细胞侵入子宫肌层不足,螺旋动脉重塑障碍,导致胎盘缺血、缺氧,多种胎盘源性不良因子进入母体血液循环,引起系统性炎症反应,造成血管内皮损伤,引发各种临床症状[13]。PE的病理过程涉及遗传因素、免疫因素、生理因素及环境因素[4],发病的中心环节是母体全身弥漫性血管内皮细胞的激活及损伤[5]。胎盘或母体血清中血管生成因子及抗血管生成因子的相对平衡对维持血管内皮的正常十分重要[6]。有研究报道PE患者胎盘及血清中血管生成素1(Ang-1)的表达降低[7],其次,位于Ang-1基因3'-UTR miRNA-211靶位点的SNP位点rs2507800可影响该基因的表达[8],并且rs2507800 TT基因型频率在PE患者中降低,提示该位点与PE之间存在关联[9]。超氧化物歧化酶(SODs)是机体内的抗氧化酶类,参与体内氧自由基的清除,可分为三类:SOD1、SOD2、SOD3[10]。多项研究表明PE患者较正常孕妇胎盘及血清中氧化应激水平发生了明显变化[1113]。rs4880位于SOD2线粒体定位序列,可影响酶的活性[1415]。该位点与中国汉族人群TD2M相关[16],并且在罗马尼亚人群中的rs4880与PE相关[17]。rs1799895是位于SOD3肝素结合域的多态位点,甘氨酸(Gly)取代精氨酸(Arg)时可改变SOD3的分布,使其从脉管组织转移到细胞外液(如血浆)中[18]。SOD3基因多态性还与脑梗、原发性高血压存在关联[1920]。基于以上研究,本研究对Ang-1rs2507800、SOD2rs4880及SOD3 rs1799895多态性与中国东北地区汉族妊娠期妇女PE的相关性进行了研究。
1 对象与方法
1.1 研究对象
选择2012年10月-2013年6月在中国医科大学盛京医院妇产科住院治疗的PE患者181例(病例组)及同期健康孕妇203例(对照组)为研究对象,均来自于中国东北地区(黑龙江、吉林、辽宁省),病例组包括轻度PE患者97例,重度PE患者84例。所有研究对象均无酗酒、吸烟不良嗜好,无先天性疾病,无慢性高血压、肾功不全及糖尿病史。本研究经国家卫生计生委科学技术研究所伦理委员会审查通过,均与研究对象签订知情同意书。
1.2 研究方法
1.2.1 DNA提取 抽取外周血于EDTA抗凝管中,暂存于-20℃,利用蛋白酶K-SDS-酚/氯仿法抽取基因组DNA,利用Nanodrop 2000测定DNA浓度及纯度,-80℃保存备用。
1.2.2 基因分型 根据rs2507800(Ang-1)、rs4880(SOD2)、rs1799895(SOD3)位点信息,采用Sequenom公司Assay Designer3.1软件包设计扩增及延伸引物。应用飞行时间质谱对样本进行基因分型[21]。
1.3 统计学分析
采用SPSS12.0软件对数据进行分析。正态分布的定量资料以均数±标准差表示,组间比较采用t检验。各组基因型分布和等位基因频率比较采用卡方检验,P<0.05为差异有统计学意义。通过计算比值比(OR)和95%置信区间(95%CI),评价相关性。哈迪-温伯格平衡(HWE)检验利用OEGEHWE calculator计算,P>0.05时满足HWE。
2 结果
2.1 临床资料比较
病例组患者年龄、初产比率、收缩压(1mmHg=0.133kPa)、舒张压、产次、分娩孕周与对照组差异均有统计学意义(P<0.05)。见表1。
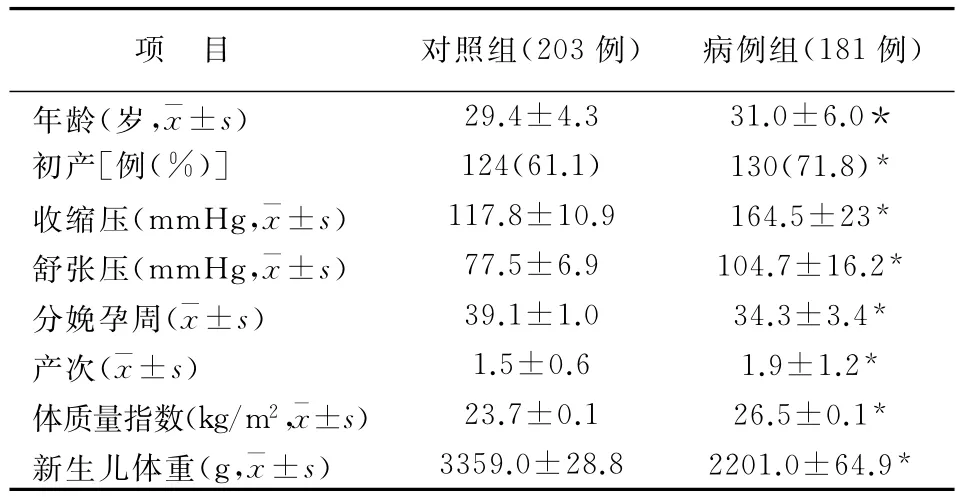
表1 两组研究对象临床资料比较
2.2 rs2507800、rs4880、rs1799895位点分型结果
由分型结果可知rs2507800、rs4880、rs1799895在对照组和病例组中的分型成功率分别为89.7%、94.5%,89.2%、96.1%,94.1%、97.2%。对照组中3个位点的基因型分布满足哈迪-温伯格平衡(P>0.05)。经卡方检验,rs2507800、rs4880、rs1799895等位基因频率及基因型频率两组差异均无统计学意义(P>0.05)。见表2。对rs2507800及rs4880分别在显性、隐性模型下进行分析,两组仍无统计学差异(P>0.05),见表3。
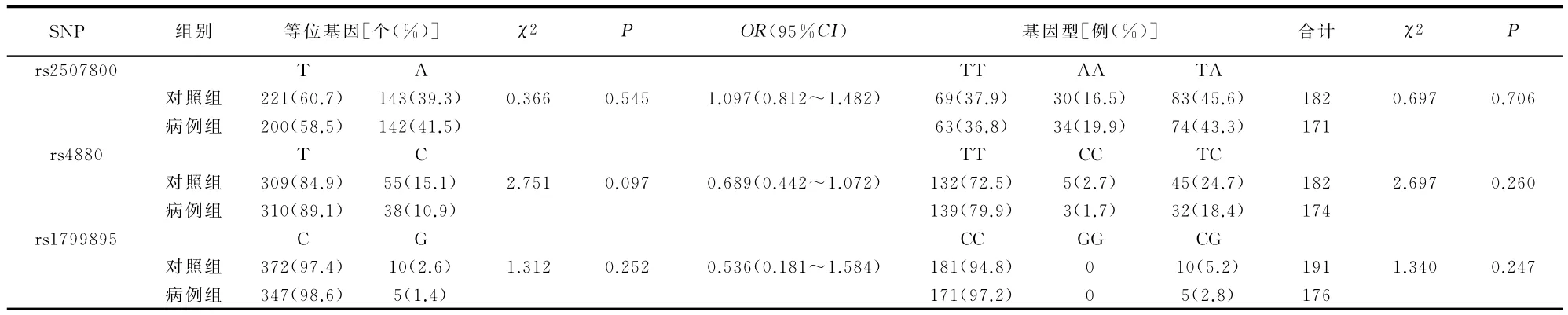
表2 两组rs2507800、rs4880、rs1799895位点的等位基因频率和基因型频率比较
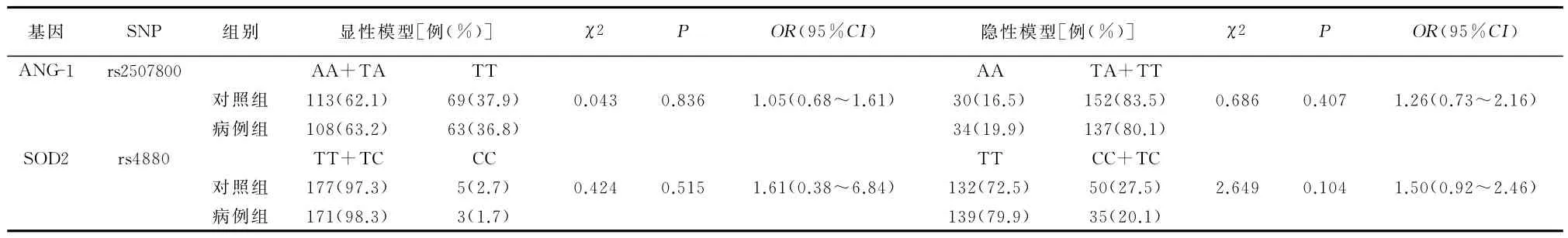
表3 两组rs2507800、rs4880位点的显性及隐性遗传模型分析
3 讨论
本研究对Ang-1、SOD2、S0D3基因上的3个多态位点rs2507800、r4880、rs1799895与中国东北地区汉族妇女PE之间的关系进行了初步探讨。结果表明在病例组和对照组中这3个位点的等位基因及基因型频率差异均无统计学意义,说明在本研究人群中这3个位点与PE不相关。
PE的发生涉及遗传、免疫、氧化应激及环境等多种因素的相互作用。Ang-1是一种分泌型糖蛋白,与Ang-2、Ang-3、Ang-4同属于血管生成素家族的成员,表达于血管重塑明显的器官,如胎盘、子宫、卵巢等[22]。其受体为内皮细胞特异性酪氨酸激酶受体Tie-2。Angs/Tie系统在调节内皮细胞存活、血管成熟及稳定方面发挥重要作用[23]。在小鼠模型中发现Ang-1或Tie-2基因纯和缺失的小鼠在胚胎发育的第11天左右死亡;胚胎血管重塑缺陷;内皮细胞与血管周围细胞的联系异常[24]。Ang-2基因过表达的小鼠与Ang-1或Tie-2基因缺失的小鼠有相似的表型,在出生前即死亡[25],这说明Ang-1与Ang-2的作用方式不同[23]。Ang-1通过募集周围内皮细胞并与之作用来促进内皮细胞重组,维持血管结构的完整性,并且可以抑制血管内皮屏障的激活,降低炎性介质的转移及渗漏。Ang-2作为Ang-1的拮抗剂与Tie-2结合发挥作用。Ang-2可以打破内皮细胞与血管周围细胞之间的联系,促进细胞的凋亡及血管退化,并且可以促进内皮细胞对炎症因子的响应能力[26]。在妊娠早期的胎盘中即有Ang-1、Ang-2的表达,随着妊娠进展,Ang-1的表达呈增加趋势而Ang-2及Tie-2的表达呈降低趋势。有多项研究比较了PE患者与正常妊娠期妇女胎盘及血清中Ang-1、Ang-2及Tie-2的表达水平,但因样本量较小等问题所得结果不一致[27]。Bi等[28]研究得知肾小球内皮细胞中,Ang-2可引起内质网应激的发生及细胞凋亡,而Ang-1可通过Tie-2/ERK1/2-p38MAPK信号通路来降低内质网应激对内皮细胞的损伤。Chen等[8]证实了位于Ang-1基因3'-UTR的多态位点rs2507800基因型TT可降低中风发生风险。Prabha等[9]证实了rs2507800基因型TT在PE患者中的频率较正常对照组降低,这与本研究中得到结论不一致。
氧化应激与PE的发病密切相关。氧化应激可触发白细胞、血小板在内皮的黏附,以及细胞因子、抗血管生成因子的释放[29]。正常情况下,体内产生的过量的自由基可以由体内的抗氧化系统清除。SODs可催化超氧阴离子为H2O2和H2O。超氧阴离子是其它活性氧生成的基础[30]。另外,NO具有抗炎、抗凝、舒张血管的作用,而超氧阴离子可迅速灭活NO,形成更稳定氧化能力更强的过氧亚硝基(ONOO-),氧自由基及硝基自由基会造成脂质、DNA、蛋白质过氧化,进而造成血管内皮及线粒体功能紊乱[31]。所以,及时清除机体内多余的超氧阴离子十分重要。PE患者较正常孕妇胎盘及血清中氧化应激水平发生了明显变化。Bakacak等[11]研究发现PE患者血清中氧化应激标志物丙二醛(MDA)水平显著增高而SOD活性显著低于正常孕妇组。Yan等[12]在对中国汉族人群PE患者胎盘组织的研究也支持这一结论。另外,与上述结论不一致,Das等[13]测定了50例PE患者及50例健康孕妇胎盘及血清中氧化应激水平指标TBARS、GSH含量及SOD活性,结果显示胎盘及血清中TBARS、SOD活性PE组较对照组明显升高,GSH含量在两组之间差异无统计学意义。Zhang等[32]研究了抗氧化酶Cu/Zn-SOD、MnSOD、GSTM1、GSTT1多态性与PE的关系,胎盘组织中相应的酶活性,并且测定了胎盘及母体血浆氧化应激标志物8-异前列腺素水平,结果显示胎盘Cu/Zn-SOD、MnSOD、GSTM1、GSTT1多态性与PE不相关且胎盘组织中各个酶活性较对照组无统计学差异。Kim等[33]在韩国人群中研究了母体氧化应激相关基因多态性与PE的关系,发现rs4880与PE不相关。而一项在罗马尼亚妇女中进行的研究显示rs4880及rs1799895与PE相关[17],这与在本人群中得到的结论不一致。
综合上述各研究结果,ANG-1、SOD2、SOD3在PE发病过程中发挥着重要的作用,但它们的作用方式可能涉及多层次,而不仅仅受基因本身多态性的影响。本研究未发现ANG-1、SOD2、S0D3多态位点rs2507800、rs4880、rs1799895与中国东北地区汉族妇女PE之间存在相关性。不同研究结果的差异一方面可能是由于不同种族之间存在遗传背景的差异,同种疾病可能与同一基因中不同的SNP位点关联;另一方面可能是由于PE是一种异质性很强的复杂疾病,发病涉及母体、胎盘、胎儿等众多因素的相互作用,而基因的多态性可能在PE的发生过程中仅仅起到微弱的作用。因此,仍需要在大样本,不同种族中研究ANG-1、SOD2、SOD3不同多态位点与PE的关系。
[1] Roberts JM,Escudero C.The placenta in preeclampsia[J].Pregnancy Hypertens,2012,2:72-83.
[2] Roberts JM,Hubel CA.The two stage model of preeclampsia:variations on the theme[J].Placenta,2009,30Suppl A:32-37.
[3] 谢幸,苟文丽.妇产科学[M].第8版.北京:人民卫生出版社,2013:64-71.
[4] Lorquet S,Pequeux C,Munaut C,et al.Aetiology and physiopathology of preeclampsia and related forms[J].Acta Clin Belg,2010,65(4):237-241.
[5] Kattah AG,Garovic VD.Pregnancy and Lupus Nephritis[J].Semin Nephrol,2015,35(5):487-499.
[6] Maynard SE,Karumanchi SA.Angiogenic factors and preeclampsia[J].Semin Nephrol,2011,31(1):33-46.
[7] Geva E,Ginzinger DG,Zaloudek CJ,et al.Human placental vascular development:vasculogenic and angiogenic(branching and nonbranching)transformation is regulated by vascular endothelial growth factor-A,angiopoietin-1,and angiopoietin-2[J].J Clin Endocrinol Metab,2002,87(9):4213-4224.
[8] Chen J,Yang T,Yu H,et al.A functional variant in the 3'-UTR of angiopoietin-1might reduce stroke risk by interfering with the binding efficiency of microRNA 211[J].Hum Mol Genet,2010,19(2):2524-2533.
[9] Andraweera PH,Dekker GA,Thompson SD,et al.A functional variant in ANGPT1and the risk of pregnancies with hypertensive disorders and small-for-gestational-age infants[J].Mol Hum Reprod,2012,18(6):325-332.
[10] Fukai T,Ushio-Fukai M.Superoxide dismutases:role in redox signaling,vascular function,and diseases[J].Antioxid Redox Signal,2011,15(6):1583-1606.
[11] Bakacak M,Kilinc M,Serin S,et al.Changes in Copper,Zinc,and Malondialdehyde Levels and Superoxide Dismutase Activities in Pre-Eclamptic Pregnancies[J].Med Sci Monit 2015,21:2414-2420.
[12] Yan JY,Xu X.Relationships between concentrations of free fatty acid in serum and oxidative-damage levels in placental mitochondria and preeclampsia[J].Zhong hua Fu Chan Ke Za Zhi,2012,47(6):412-417.
[13] Das B,Saha-Roy S,Das Gupta A,et al.Assessment of placental oxidative stress in pre-eclampsia[J].J Obstet Gynaecol India,2012,62(1):39-42.
[14] Tavtin Iu K.Clinical audiological parallels between the state of the hearing analyzer and the functional disorders of the nervous and cardiovascular systems in those working under noisy conditions with different parameters[J].Gig Tr Prof Zabol,1976,4(4):21-24.
[15] Shimoda-Matsubayashi S,Matsumine H,Kobayashi T,et al.Structural dimorphism in the mitochondrial targeting sequence in the human manganese superoxide dismutase gene.A predictive evidence for conformational change to influence mitochondrial transport and a study of allelic association in Parkinson's disease[J].Biochem Biophys Res Commun,1996,226(2):561-565.
[16] Li JY,Tao F,Wu XX,et al.Polymorphic variations in manganese superoxide dismutase(MnSOD)and endothelial nitric oxide synthase(eNOS)genes contribute to the development of type 2diabetes mellitus in the Chinese Han population[J].Genet Mol Res,2015,14(4):12993-13002.
[17] Procopciuc LM,Caracostea G,Nemeti G,et al.The Ala-9Val(Mn-SOD)and Arg213Gly(EC-SOD)polymorphisms in the pathogenesis of preeclampsia in Romanian women:association with the severity and outcome of preeclampsia[J].J Matern Fetal Neonatal Med,2012,25(7):895-900.
[18] Hartney JM,Stidham T,Goldstrohm DA,et al.A common polymorphism in extracellular superoxide dismutase affects cardiopulmonary disease risk by altering protein distribution[J].Circ Cardiovasc Genet,2014,7(5):659-666.
[19] Naganuma T,Nakayama T,Sato N,et al.Association of extracellular superoxide dismutase gene with cerebral infarctionin women:a haplotype-based case-control study[J].Hereditas,2008,145(6):283-292.
[20] Naganuma T,Nakayama T,Sato N,et al.A haplotypebased case-control study examining human extracellular superoxide dismutase gene and essential hypertension[J].Hypertens Res,2008,31(8):1533-1540.
[21] Tian W,Zhao L,Wang J,et al.Association analysis between HOXD9genes and the development of developmental dysplasia of the hip in Chinese female Han population[J].BMC Musculoskelet Disord,2012,13(59):2-4.
[22] 尹立阳,脱红芳,彭彦辉.血管生成素1对炎性反应机制的研究进展[J].医学综述,2011,17(22):3377-3379.
[23] Kappou D,Sifakis S,Konstantinidou A,et al.Role of the angiopoietin/Tie system in pregnancy(Review)[J].Exp T-her Med,2015,9(4):1091-1096.
[24] Suri C,McClain J,Thurston G,et al.Increased vascularization in mice overexpressing angiopoietin-1[J].Science,1998,282(5388):468-471.
[25] Maisonpierre PC,Suri C,Jones PF,et al.Angiopoietin-2,a natural antagonist for Tie2that disrupts in vivo angiogenesis[J].Science,1997,277(5322):55-60.
[26] Rudiger Liersch,Torsten Kessler,Wolfgang E,er al.Angiogenesis Inhibition(Rescent Results in Cancer Research)[M].Berlin Heidelberg:Springer-Verlag Berlin Heidelberg,2010:3-13.
[27] Kappou D,Sifakis S,Androutsopoulos V,et al.Placental mRNA expression of angiopoietins(Ang)-1,Ang-2and their receptor Tie-2is altered in pregnancies complicated by preeclampsia[J].Placenta,2014,35(9):718-723.
[28] Bi X,Niu J,Ding W,et al.Angiopoietin-1attenuates angiotensin II-induced ER stress in glomerular endothelial cells via a Tie2receptor/ERK1/2-p38MAPK-dependent mechanism[J].Mol Cell Endocrinol,2016,428:118-132.
[29] Matsubara K,Higaki T,Matsubara Y,et al.Nitric oxide and reactive oxygen species in the pathogenesis of preeclampsia[J].Int J Mol Sci,2015,16(3):4600-4614.
[30] D'Souza V,Rani A,Patil V,et al.Increased oxidative stress from early pregnancy in women who develop preeclampsia[J].Clin Exp Hypertens,2016,38(2):225-232.
[31] Hansson SR,Naav A,Erlandsson L.Oxidative stress in preeclampsia and the role of free fetal hemoglobin[J].Front Physiol,2014,5:516.
[32] Zhang J,Masciocchi M,Lewis D,et al.Placental anti-oxidant gene polymorphisms,enzyme activity,and oxidative stress in preeclampsia[J].Placenta,2008,29(5):439-443.
[33] Kim YJ,Park HS,Park MH,et al.Oxidative stress-related gene polymorphism and the risk of preeclampsia[J].Eur J Obstet Gynecol Reprod Biol,2005,119(1):42-46.
[责任编辑:张 璐]
Study of the correlation between rs2507800,rs4880,rs1799895 and preeclampsia in Han Chinese women from northeastern China
DU Meng1,2,WANG Qidi2,WANG Yuting3,AN Lisha2,CAO Xiaofang2,QIU Yue1,2,GAO Dan2,GUO Changlong2*,MA Xu1,2*
1.Graduate School of Peking Union Medical College,Beijing,100730;2.National Research Institute for Family Planning;3.Shengjing Hospital of China Medical University.
*
MA Xu,E,xumagroup@163c.om;GUO Changlong,guochanglong723@aliyunc.om
Objective:To explore whether ANG1rs2507800,SOD2rs4880and SOD3rs1799895associate with preeclampsia(PE)in Han Chinese women from northeastern China.Methods:The three single nucleotide polymorphisms in ANG1,SOD2and SOD3of 181pregnant women with PE and 203healthy pregnant women were genotyped by the Time of Flight Mass Spectrometry,and the results were analyzed by SPSS12.0.Results:There were no significant difference in allele frequency and genotypic distribution of the three SNPs between pregnant women with PE and healthy pregnant women(P>0.05).Significant differences were not observed in both dominant and recessive models for analyzing rs2507800and rs4880(P>0.05).Conclusion:rs2507800,rs4880and rs1799895are not associated with PE in Han Chinese women from northeastern China.
Preeclampsia;ANG 1gene;SOD2gene;SOD3gene;Single Nucleotide Polymorphisms
10.3969/j.issn.1004-8189.2017.04.003
2016-09-27
2016-11-09
*通讯作者:guochanglong723@aliyun.com

