蔗糖铁注射液过滤除菌前配制液的微生物限度检查方法研究
张永昕,曾佳艳,李莎恩,俞 发,王振华,李 耿(.广州中医药大学中药学院,广州 50006;.解放军第458医院,广州 5060;.广东天普生化医药股份有限公司,广州 5050)
蔗糖铁注射液过滤除菌前配制液的微生物限度检查方法研究
张永昕1,2*,曾佳艳3,李莎恩2,俞 发2,王振华1#,李 耿1(1.广州中医药大学中药学院,广州 510006;2.解放军第458医院,广州 510602;3.广东天普生化医药股份有限公司,广州 510520)
目的:建立蔗糖铁注射液过滤除菌前配制液的微生物限度检查方法。方法:按照2015版《中国药典》(四部)“通则1005”和“通则1006”微生物限度检查方法,分别采用平皿法和薄膜过滤法检查需氧菌(金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉)数、霉菌及酵母菌(白色念珠菌、黑曲霉)数,通过比较试验菌回收率来确定适宜的方法,并进行方法验证。结果:以平皿法进行试验,铜绿假单胞菌和枯草芽孢杆菌的回收率分别为2%、5%,用pH 7.0氯化钠-蛋白胨缓冲液稀释样品原液10倍后,试验菌回收率范围为88%~96%,但培养基颜色较深。以薄膜过滤法不加冲洗液进行试验,试验菌回收率范围为88%~95%;加入冲洗液后,试验菌回收率范围为91%~103%。经验证,加入冲洗液的薄膜过滤法回收率为50%~200%,符合规定。结论:本试验建立的薄膜过滤法较平皿法试验菌回收率高且加入冲洗液后,试验菌回收率更高,滤膜表面均无颜色较深的物质残留影响计数,适用于蔗糖铁注射液过滤除菌前配制液的微生物限度检查。
蔗糖铁注射液;配制液;微生物限度检查;薄膜过滤法;平皿法
蔗糖铁注射液是目前应用较为广泛的静脉铁剂之一,该制剂在临床上常用于口服铁剂效果不好而需要静脉铁剂治疗的患者,其改善患者贫血和缺铁症状的疗效优于口服多糖铁复合物,并能准确估算补铁剂量,不良反应发生率低于口服铁剂[1-3]。蔗糖铁注射液质量标准收载于《国家食品药品监督管理局标准》(标准文号YBH07292006),但现行国内外标准中均未收载蔗糖铁注射液过滤除菌前配制液(以下简称“蔗糖铁注射液稀配液”)的微生物限度检查方法,且未见相关文献报道。
根据2011年版《药品生产质量管理规范》(GMP)的要求[4],应当依据所有灭菌方法的灭菌效果确定产品灭菌前微生物污染水平的监控标准,并定期监控。企业在日常生产过程中应当做好微生物污染水平的监控工作,对产品的含菌量进行分析,及时发现不良趋势,并采取相应的措施确保产品的无菌保证水平[5-6]。因此,为了确保蔗糖铁注射液的无菌保证水平,需准确了解蔗糖铁注射液稀配液的微生物污染水平,以确保其微生物检查的有效性,故笔者参考2015年版《中国药典》(四部)“通则1005”和“通则1006”微生物限度检查法[6],建立了蔗糖铁注射液稀配液的微生物限度检查方法,并进行了方法学验证。
1 材料
1.1 仪器
ZW-600型集菌仪(温州维科生物实验设备有限公司);ZW-3B型开放式过滤集菌培养器(温州维科生物实验设备有限公司);CL-32L型高压灭菌器(日本ALP公司);JC303-4A型电加热隔水式培养箱(上海嘉程仪器设备厂);AC2-5S1型生物安全柜(新加坡ESCO公司)。
1.2 药品与试剂
蔗糖铁注射液稀配液[由广东天普生化医药股份有限公司自制,批号:36150903、36150904、36150905,规格:5 mL∶100 mg(铁)];聚山梨酯80(成都市科龙化学试剂厂,批号:2014092201);pH 7.0氯化钠-蛋白胨缓冲液(美国Merck公司,批号:VM680982514)。
1.3 试验用菌种
金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、铜绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、白色念珠菌(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003]均购自中国食品药品检定研究院。金黄色葡萄球菌、白色念珠菌为第3代,铜绿假单胞菌、枯草芽孢杆菌为第4代,黑曲霉为第2代。
1.4 培养基
胰酪大豆胨液体培养基(批号:VM631759410)、沙氏葡萄糖液体培养基(批号:VM565439333)均购自美国Merck公司;胰酪大豆胨琼脂培养基(批号:3103191)、沙氏葡萄糖琼脂培养基(批号:3104660)均购自广东环凯微生物科技有限公司。
2 方法与结果
2.1 菌液的制备
分别取经32.5℃在胰酪大豆胨液体培养基培养24 h的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌的培养物各1 mL,分别用pH 7.0氯化钠-蛋白胨缓冲液10倍稀释至每0.1 mL含≤100 cfu/mL的单一菌悬液(最终金黄色葡萄球菌共稀释106倍、铜绿假单胞菌共稀释106倍、枯草芽孢杆菌共稀释105倍),作菌落计数备用。取经22.5℃在沙氏葡萄糖液体培养基培养2 d的白色念珠菌培养物1 mL,用pH 7.0氯化钠-蛋白胨缓冲液10倍稀释至每0.1 mL含≤100 cfu/mL的菌悬液(共稀释104倍),作菌落计数备用。取经22.5℃在沙氏葡萄糖琼脂培养基培养7 d的黑曲霉培养物,加4 mL含0.05%聚山梨酯80的0.9%氯化钠溶液,将孢子洗脱,然后用管口带有薄的无菌棉花或纱布能过滤菌丝的无菌吸管吸出孢子悬液1 mL,置于无菌试管内,再用含0.05%聚山梨酯80的 pH 7.0氯化钠-蛋白胨缓冲液10倍稀释至每0.1 mL含≤100 cfu/mL的孢子悬液(共稀释103倍),作菌落计数备用[7]。
2.2 方法与结果
2.2.1 平皿法 (1)供试液。取样品稀配液(批号:36150903)适量作为供试液。(2)供试品对照组。取供试液1 mL,平行注入2个无菌平皿,倾注胰酪大豆胨琼脂培养基,待凝固后,在32.5℃培养箱中培养3 d,计数,测定供试品本底需氧菌数。取供试液1 mL,平行注入2个无菌平皿,倾注沙氏葡萄糖琼脂培养基,待凝固后,在22.5℃培养箱中培养5 d,计数,测定供试品本底霉菌及酵母菌数。(3)试验组。取供试液1 mL和“2.1”项下的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的单一菌悬液和黑曲霉孢子悬液各0.1 mL,分别注入平皿中,倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平板,待凝固后,在32.5℃培养箱中培养3 d,计数。取供试液1 mL和“2.1”项下的白色念珠菌菌悬液和黑曲霉孢子悬液各0.1 mL,分别注入平皿中,倾注沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平板,待凝固后,在22.5℃培养箱中培养5 d,计数。(4)菌液对照组。取“2.1”项下的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的单一菌悬液和黑曲霉孢子悬液各0.1 mL,分别注入平皿中,倾注胰酪大豆胨琼脂培养基,每株试验菌平行制备2个平板,待凝固后,在32.5℃培养箱中培养3 d,计数,测定所加试验菌数。取“2.1”项下白色念珠菌菌悬液和黑曲霉孢子悬液0.1 mL,分别注入平皿中,倾注沙氏葡萄糖琼脂培养基,每株试验菌平行制备2个平板,待凝固后,在22.5℃培养箱中培养5 d,计数,测定所加试验菌数。(5)回收率计算。试验菌回收率(%)=(试验组平均菌落数-供试品对照组平均菌落数)/菌液对照组平均菌落数×100%。(6)结果分析。平皿法试验菌回收率结果见表1。由表1可知,铜绿假单胞菌和枯草芽孢杆菌的回收率均<50%,不符合2015年版《中国药典》规定,不可采用此法直接进行微生物限度检查[8]。
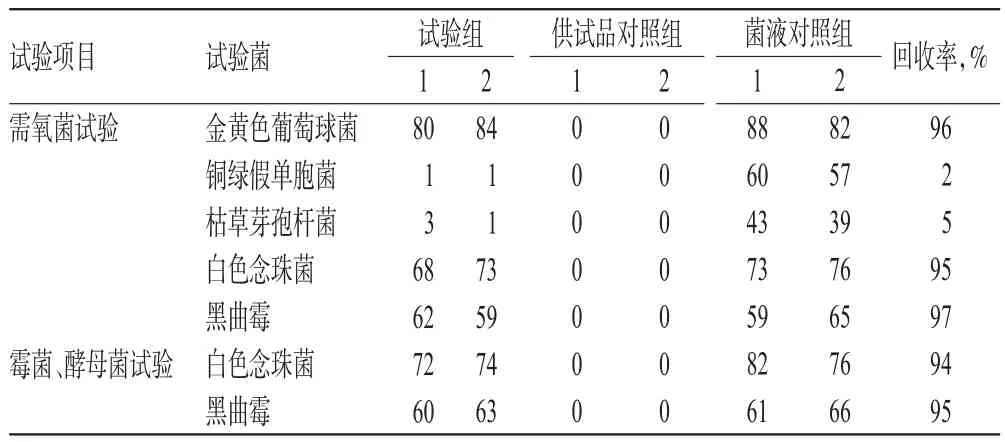
表1 平皿法试验菌回收率结果(CFU)Tab 1 Results of bacterial recoveries by plate method(CFU)
2.2.2 平皿法(即稀释法) 即对供试液进行稀释。取“2.2.1”项下供试液10 mL(批号:36150903),加pH 7.0氯化钠-蛋白胨缓冲液90 mL对其进行稀释,即得稀释供试液。试验组、菌液对照组、供试品对照组均按“2.2.1”项下相应步骤操作,结果见表2。由表2可知,铜绿假单胞菌和枯草芽孢杆菌的回收率均>50%,但是在试验中发现,加入稀释供试液的培养基颜色较深,对点计菌落数造成干扰。为了保证样品稀配液的检验量,故不采用平皿法进行样品稀配液的微生物限度检查。

表2 稀释法试验菌回收率结果(CFU)Tab 2 Results of bacterial recoveries by dilution method(CFU)
2.2.3 薄膜过滤法(a)(1)试验组。取“2.2.1”项下供试液(批号:36150903)10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,分别加入“2.1”项下的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的单一菌悬液和黑曲霉孢子悬液各0.1 mL,滤过,取出滤膜,菌面朝上分别贴于胰酪大豆胨琼脂培养基上,每种试验菌平行做2次,在32.5℃培养箱中培养3 d,计数。取供试液10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,分别加入“2.1”项下的白色念珠菌菌悬液和黑曲霉孢子悬液各0.1 mL,滤过,取出滤膜,菌面朝上分别贴于沙氏葡萄糖琼脂培养基上,每种试验菌平行做2次,在22.5℃培养箱中培养5 d,计数。(2)菌液对照组。同“2.2.1”项下相应步骤操作。(3)供试品对照组。取上述供试液10 mL,加入pH7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过,取出滤膜,菌面朝上贴于胰酪大豆胨琼脂培养基上,在32.5℃培养箱中培养3 d,计数,测定供试品本底需氧菌数。取上述供试液10 mL,加入pH7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过,取出滤膜,菌面朝上贴于沙氏葡萄糖琼脂培养基上,在22.5℃培养箱中培养5 d,计数,测定供试品本底霉菌及酵母菌数,结果见表3。由表3可知,试验菌回收率均在50%~200%内,符合2015年版《中国药典》的相关规定[8]。
2.2.4 薄膜过滤法(b)(1)试验组。取“2.2.1”项下供试液(批号:36150903)10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过,加入100 mL pH 7.0氯化钠-蛋白胨缓冲液进行冲洗,在冲洗液中分别加入“2.1”项下的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌的单一菌悬液和黑曲霉孢子悬液各0.1 mL,滤过,取出滤膜,菌面朝上分别贴于胰酪大豆胨琼脂培养基上,每种试验菌平行做2次,在32.5℃培养箱中培养3 d,计数。取上述供试液10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过,加入100 mL pH 7.0氯化钠-蛋白胨缓冲液进行冲洗,在冲洗液中分别加入“2.1”项下的白色念珠菌菌悬液和黑曲霉的孢子悬液各0.1 mL,滤过,取出滤膜,菌面朝上分别贴于沙氏葡萄糖琼脂培养基上,每种试验菌平行做2次,在22.5℃培养箱中培养5 d,计数。(2)菌液对照组。同“2.2.1”项下相应步骤操作。(3)供试品对照组。取上述供试液10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过,加入100 mL pH 7.0氯化钠-蛋白胨缓冲液进行冲洗,滤过,取出滤膜,菌面朝上贴于胰酪大豆胨琼脂培养基上,在32.5℃培养箱中培养3 d,计数,测定供试品本底需氧菌数。取供试液10 mL,加入pH 7.0氯化钠-蛋白胨缓冲液90 mL,混匀,滤过加入100 mL pH 7.0氯化钠-蛋白胨缓冲液进行冲洗,滤过,取出滤膜,菌面朝上贴于沙氏葡萄糖琼脂培养基上,在22.5℃培养箱中培养5 d,计数,测定供试品本底霉菌及酵母菌数,结果见表4。由表4可知,试验菌回收率均在50%~200%内,符合2015年版《中国药典》规定[7],且b方法试验菌回收率均高于a方法,因此采用b方法进行方法验证。
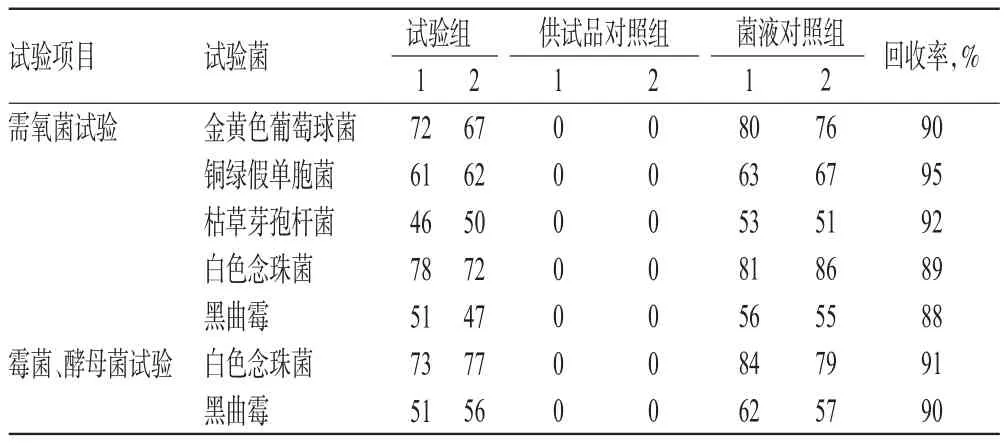
表3 薄膜过滤法(a)试验菌回收率结果(CFU)Tab 3 Results of bacterial recoveries by membrane filtration method(a)(CFU)
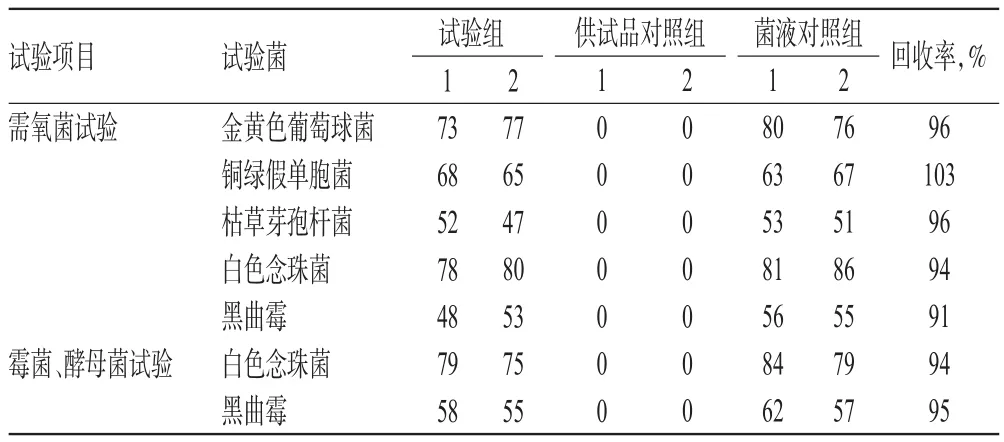
表4 薄膜过滤法(b)试验菌回收率结果(CFU)Tab 4 Results of bacterial recoveries by membrane filtration method(b)(CFU)
2.3 方法验证
取3批样品(批号:36150903、36150904、36150905)各适量,采用薄膜过滤法中(b)进行方法验证,结果见表5。由表5可知,试验菌回收率均在50%~200%内,符合2015年版《中国药典》规定[7],且重复性好,可以采用薄膜过滤法中(b)进行微生物限度检查。
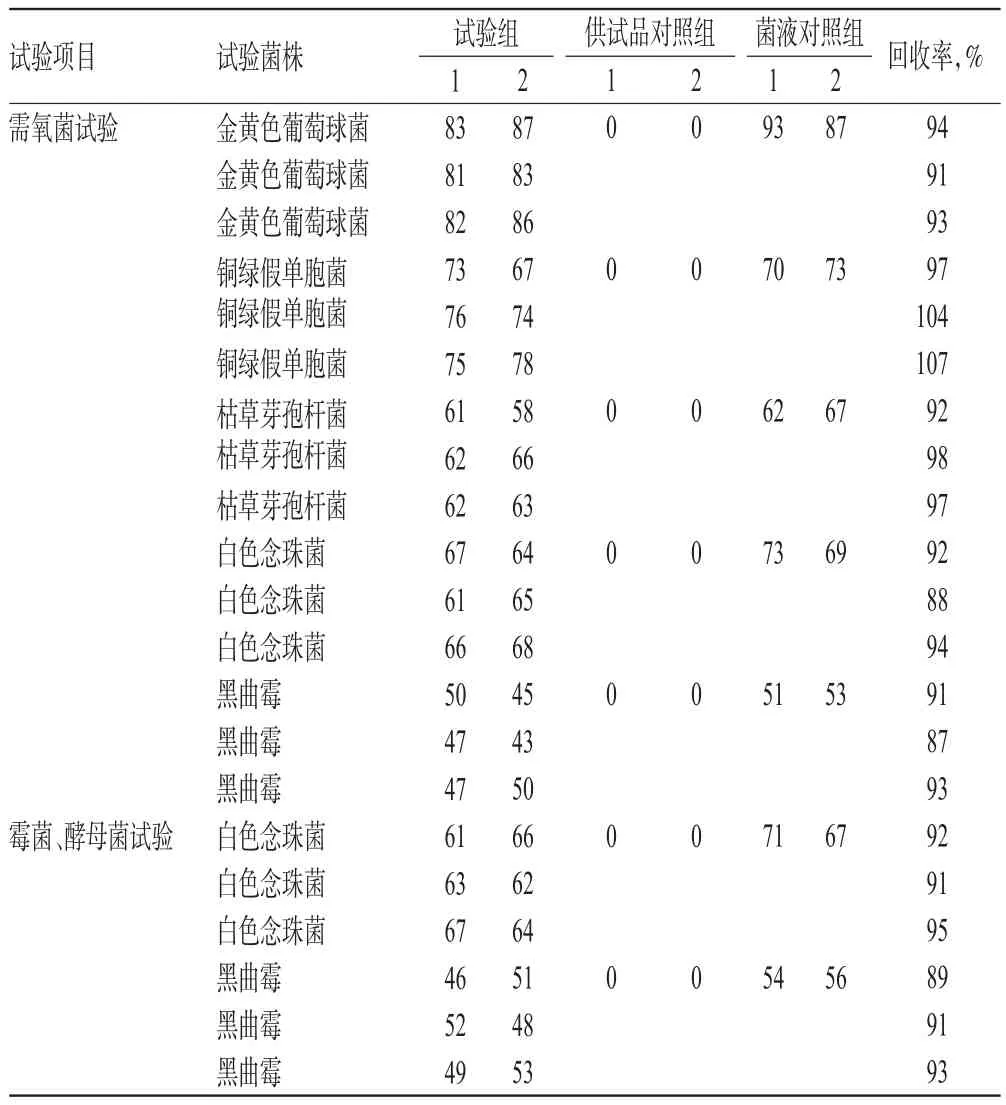
表5 薄膜过滤法(b)验证的回收率结果(CFU)Tab 5 Results of bacterial recoveries by membrane filtration method(b)validation(CFU)
3 讨论
3.1 蔗糖铁注射液稀配液中抑菌活性的消除
水溶性样品可用原液进行微生物限度检查,蔗糖铁注射液稀配液易溶于水,且用其原液检查简单方便,故笔者首先用其原液进行平皿法计数验证。结果,铜绿假单胞菌和枯草芽孢杆菌的试验菌回收率均<50%,说明该产品具有抑菌活性,这可能与其碱性较强有关(测得其pH为11.0),于是对样品原液稀释10倍,稀释后pH为7.32,则可以消除其抑菌活性[9-11]。
3.2 微生物限度检查方法的选择
蔗糖铁注射液稀配液稀释10倍后,由于pH的降低及其他可能的抑菌物质减少,采用稀释法,铜绿假单胞菌和枯草芽孢杆菌的试验菌回收率均符合要求,但因为供试液的颜色为棕黑色,加入供试液的培养基颜色较深,点计菌落数时对分辨菌落造成干扰,影响结果的准确性,故不采用该法。采用薄膜过滤法,试验菌回收率均能达到要求,且铜绿假单胞菌和枯草芽孢杆菌的试验回收率明显高于平皿法,说明薄膜过滤法能对抑菌物质进一步消除。其中,用100 mL pH 7.0氯化钠-蛋白胨缓冲液进行冲洗的薄膜过滤法,试验菌回收率最高,且滤膜几乎无棕黑色的物质残留,不影响计数。因此,确定蔗糖铁注射液稀配液的微生物限度检查方法为本文薄膜过滤法(b)[12-13]。
综上所述,本试验建立的薄膜过滤方法较平皿法试验菌回收率高,滤膜表面无颜色较深的物质残留影响计数,适用于蔗糖铁注射液稀配液的微生物限度检查。
[1] 王璐,李祥雯,侯燕.蔗糖铁注射液与复方阿胶浆用于产后贫血治疗的大样本随机对照研究[J].河北医药,2017,39(2):242-246.
[2] 彭鹏,邹文蓉.蔗糖铁注射液治疗缺铁性贫血临床观察[J].现代医药卫生,2010,26(1):13-14.
[3] 许志忠,朱再志,戚刚,等.静脉使用蔗糖铁与口服铁剂治疗肾性贫血对照研究[J].四川医学,2008,29(8):982-983.
[4] 国家食品药品监督管理局.药品生产质量管理规范[S].2011.
[5] Aronoff GR,Bennett WM,Blumenthal S,et al.Iron sucrose in hemodialysis patients:safety of replacement and maintenance regimens[J].Kidney In,2004,66(3):1193-1198.
[6] Charytan C,Levin N,Al-Saloum M,et al.Efficacy and safety of iron sucrose for iron deficiency in patients with dialysis-associated anemia:North American clinical trial [J].Am J Kidney Dis,2001,37(2):300-307.
[7] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:140-151.
[8] 杨晓莉,李辉,马英英,等.中国药典2015年版非无菌产品微生物限度检查法:微生物计数法解读[J].药物分析杂志,2016,36(6):1101-1107.
[9] 毛腾霄,熊雯,秦玉花.氧氟沙星凝胶微生物限度检查方法研究[J].中国药房,2015,26(18):2559-2561.
[10] 谭征,张建民,关晶,等.咳喘平颗粒《中国药典》2015年版微生物限度检查法的建立[J].北京医学,2016,38(8):837-840.
[11] 郑小玲,王征南,李珏.瑞他莫林软膏的微生物限度检查适用性试验[J].中国现代应用药学,2016,33(5):634-637.
[12] 张丹,张天兵,王宁,等.醋酸氯己定溶液微生物限度检查方法验证结果及应用[J].中国医院药学杂志,2009,29(19):1685-1688.
[13] 张文婷,刘绪平.牛黄上清胶囊微生物限度检查方法的建立[J].药物分析杂志,2009,29(11):1961-1963.
(编辑:刘 柳)
Study on the Method of Microbial Limit Test for Preparation Liquid of Iron Sucrose Injection before Filtration and Sterilization
ZHANG Yongxin1,2,ZENG Jiayan3,LI Sha’en2,YU Fa2,WANG Zhenhua1,LI Geng1(1.School of TCM,Guangzhou University of TCM,Guangzhou 510006,China;2.No.458 Hospital of PLA,Guangzhou 510602,China;3. Guangdong Techpool Biopharma Co.,Ltd.,Guangzhou 510520,China)
OBJECTIVE:To establish a method of microbial limit test for liquid preparation of Iron sucrose injection before filtration and sterilization.METHODS:According to the microbial limit test in the“1005”and“general rules 1006”of 2015 edition of Chinese Pharmacopoeia(vol.Ⅴ),plate method and membrane filtration method were used to measure total number of aerobic bacteria(Staphylococcus aureus,Pseudomonas aeruginosa,Bacillus subtilis,Candida albicans,Aspergillus niger)and total number of molds and yeasts(C.albicans,A.niger).The optimal test method was obtained by comparing the bacterial recoveries.RESULTS:By plate method,the recoveries of P.aeruginosa and B.subtilis were 2%and 5%.The test sample was diluted 10 times with pH 7.0 sodium chloride-peptone buffer solution,and the bacterial recoveries were in the range of 88%to 96%;but he medium was dark in color.By membrane filtration method,without rinse solution,the bacterial recoveries in the range of 88%to 95%. Add rinse solution,the bacterial recoveries were in the range of 91%to 103%.After validated,the recoveries of menbrane filtration method with tlushing tluid ranged 50%-200%,which was in line with the requnements.CONCLUSIONS:The membrane filtration method established in this experiment has higher bacterial recovery rate than the plate method.The bacterial recoveries rate were higher after adding rinse solution,and no dark substance in the surface of filter membrane affect the account.It can be used as the microbial limit test method for preparation liquid of Iron sucrose injection before filtration and sterilization.
Iron sucrose injection;Preparation liquid;Microbial limit test;Membrane filtration method;Plate method
R927.1
A
1001-0408(2017)24-3437-04
2016-12-22
2017-06-07)
*主管药师,硕士研究生。研究方向:医院药学、中药新技术。电话:020-61639857。E-mail:20691072@qq.com
#通信作者:副教授,博士。研究方向:药物制剂。电话:020-39358550。E-mail:wzh@gzucm.edu.cn
DOI10.6039/j.issn.1001-0408.2017.24.36

