9H-吲哚[4,5-b]并嘧啶类衍生物的合成研究
兰 帅,李向明
(1. 河北科技师范学院 化学工程学院,河北 秦皇岛 066000;2. 渤海大学 精细化学品研究所,辽宁 锦州 121000)
9H-吲哚[4,5-b]并嘧啶类衍生物的合成研究
兰 帅1,李向明2
(1. 河北科技师范学院 化学工程学院,河北 秦皇岛 066000;2. 渤海大学 精细化学品研究所,辽宁 锦州 121000)
7-甲(乙)基吲哚酮(1a,1b)与制备好的Vilsmeier-Haack试剂反应合成2-氯-3-甲酰基-7-甲(乙)基吲哚(2a,2b)和2-氯-3-乙酰基-7-甲(乙)基吲哚(3a,3b);将2a, 2b, 3a, 3b N甲基化得4a-4b, 5a-5b, 再将以上化合物与硝酸胍反应,以良好的收率合成吲哚并嘧啶类化合物(6a-6b,7a-7b),在此基础上探究与氨基胍反应尝试得到闭环化合物。以上制备过程具有反应条件温和、后处理简单等优点,为制备吲哚并嘧啶类化合物提供了简单方法。
甲基化;闭环;吲哚并嘧啶类化合物
众所周知,吲哚类化合物和嘧啶类化合物都具有良好的生理及药理活性[1]。吲哚并嘧啶类衍生物广泛存在于药物分子和天然产物之中,具有良好生物活性。此类化合物在抗真菌[2-3]、抗菌[4-6]、抗病毒[7]、抗肿瘤[8-9]等方面表现出良好生物药理活性。将含有吲哚环的不同种类化合物嵌入嘧啶环后形成新颖的吲哚并嘧啶类衍生物,此类化合物可广泛应用于新型医药与各类农药的研发等方面。
为了扩充以及探究此类化合物的合成方法及潜在的生物活性,我们以7-甲(乙)基吲哚酮为原料先后通过Vilsmeier-Hacck酰化反应以及烃烷基化反应得到N-甲基-2-氯-3-甲(乙)酰基-7-甲(乙)基吲哚。N-甲基-2-氯-3-甲(乙)酰基-7-甲(乙)基吲哚与胍发生缩合反应,经环化合成吲哚并嘧啶类衍生物(6a-6b, 7a-7b)。合成路线见图1。
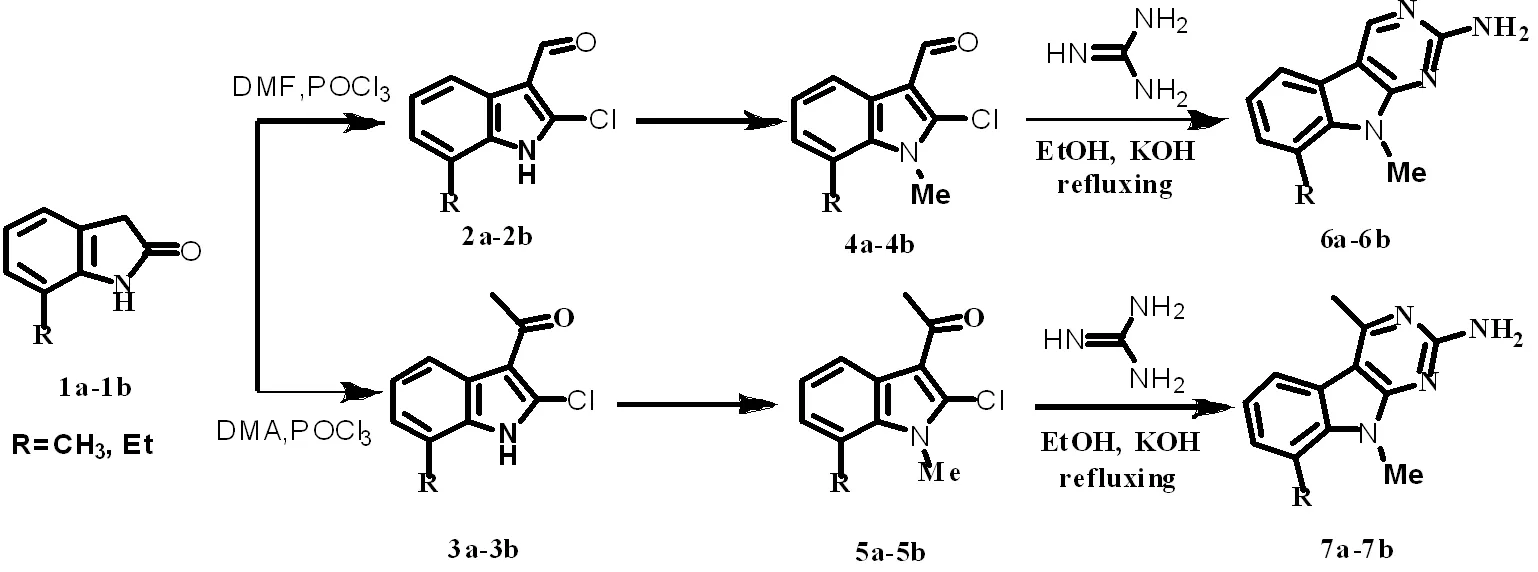
图1 吲哚并嘧啶类化合物的合成路线
Fig.1 The synthesis route of indole and pyrimidine derivatives
1 实验内容
1.1 7-甲(乙)基-2-氯-3-吲哚醛的合成
将20 mL CHCl2加入100 mL圆底烧瓶中,顺次滴加5.7 mL DMF和5.51 mL POCl3冰水浴剧烈搅拌2 h。再到上述混合液中慢慢滴加溶解了7-甲基吲哚酮18 mmol的一定量的CHCl2,室温搅拌,然后回流反应,TLC监控,反应完全后,分别用水萃取,用无水醋酸钠将萃取液调pH至6-7,搅拌过夜,抽滤,乙醇重结晶得得纯品。
1.2 N-甲基-7-甲(乙)基-2-氯-3-吲哚醛(酮)的合成
将10 mmol 7-甲(乙)基-2-氯-3-吲哚醛(酮),2.1 g, 15 mmol K2CO3,200 mL丙酮溶液,15 mmol烷基化试剂依次加入500 mL圆底烧瓶中,回流反应,TLC监测,反应结束后,除去丙酮,向体系中加水,待有沉淀析出后抽滤,重结晶得纯品。
1.3 N-取代-7-甲(乙)基-9H-嘧啶-[4,5-b]-吲哚-2-胺的合成
将1 mmol N-取代-7-甲(乙)基-3-乙酰基-2-氯吲哚,2 mmol硝基胍,2 mmol KOH,10 mL无水乙醇,依次加入25mL圆底烧瓶中,加热至回流,TLC监控。反应结束后加入冰水,抽滤,分离得到纯品。
2 结果与讨论
首先我们以N-取代-2-氯-7-甲(乙)基-1-H-吲哚-3-甲醛(4a-4b)为底物,在KOH存在下与硝基胍发生反应。制备N-取代-8-甲(乙)基-9H-嘧啶-[4,5-b]-吲哚-2-胺(6a-6b),得到较令人满意的结果。反应方程式如图2所示。
开始的时候我们使用NaOH作为碱性条件,但产量很低,仅为40%,后来我们改用KOH作为碱性条件,得到的收率良好。
在此基础上我们又讨论了投料比对反映的影响,1,7-二甲基-2-氯-1H-吲哚-3-甲醛与硝酸胍反应生成8,9-二甲基-9H-嘧啶并[4,5-b]吲哚-2-胺(6a)为例,所得结果见表1。
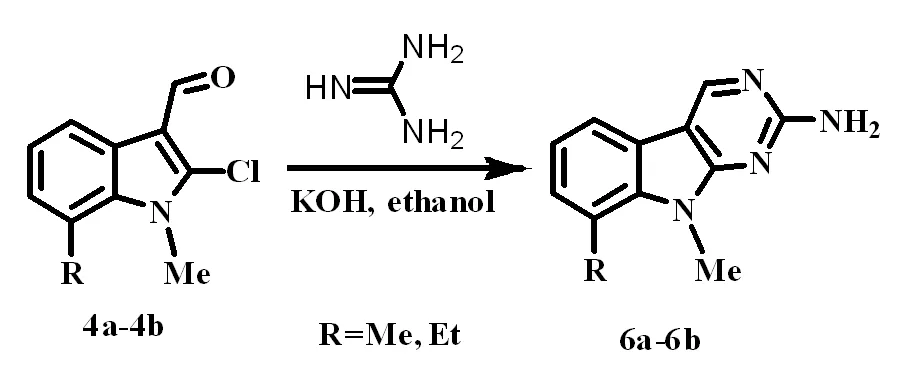
图2 N-甲基-8-甲(乙)基-9H- 嘧啶-[4,5-b]-吲哚-2-胺的合成路线Fig.2 The synthesis route of N-methyl -8-methyl(ethyl)-9H-pyrimido[4,5-b]indol-2-amine表1 投料比对反应产率的影响Table 1 Influence of the substrate ratio on the yield
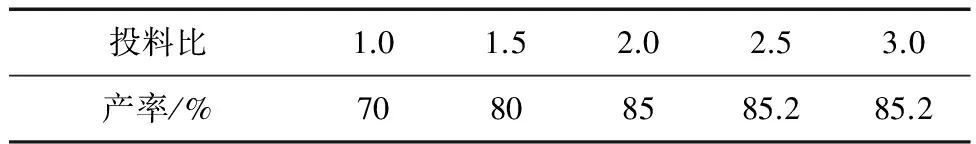
投料比1.01.52.02.53.0产率/%70808585.285.2
从报表1可以看出来当投料比提高,产率有所增加,但当收料比大与2.0是提高幅度并不明面,从节省原料的角度,为此我们选择投料比为2.0。
在上述反应的基础上,我们考虑N-取代-2-氯-7-甲(乙)基-1-H-吲哚-3-甲醛能与硝酸胍反应顺利闭环,那与氨基胍是否也能顺利闭环从而得到吲哚并嘧啶类产物。为此我们以N-甲基-2-氯-7-甲基-1-H-吲哚-3-甲醛为底物,按照上述实验方法,与氨基胍进行反应。反应结束后经提纯处理得淡黄色固体A。测得其核磁氢谱如图3。
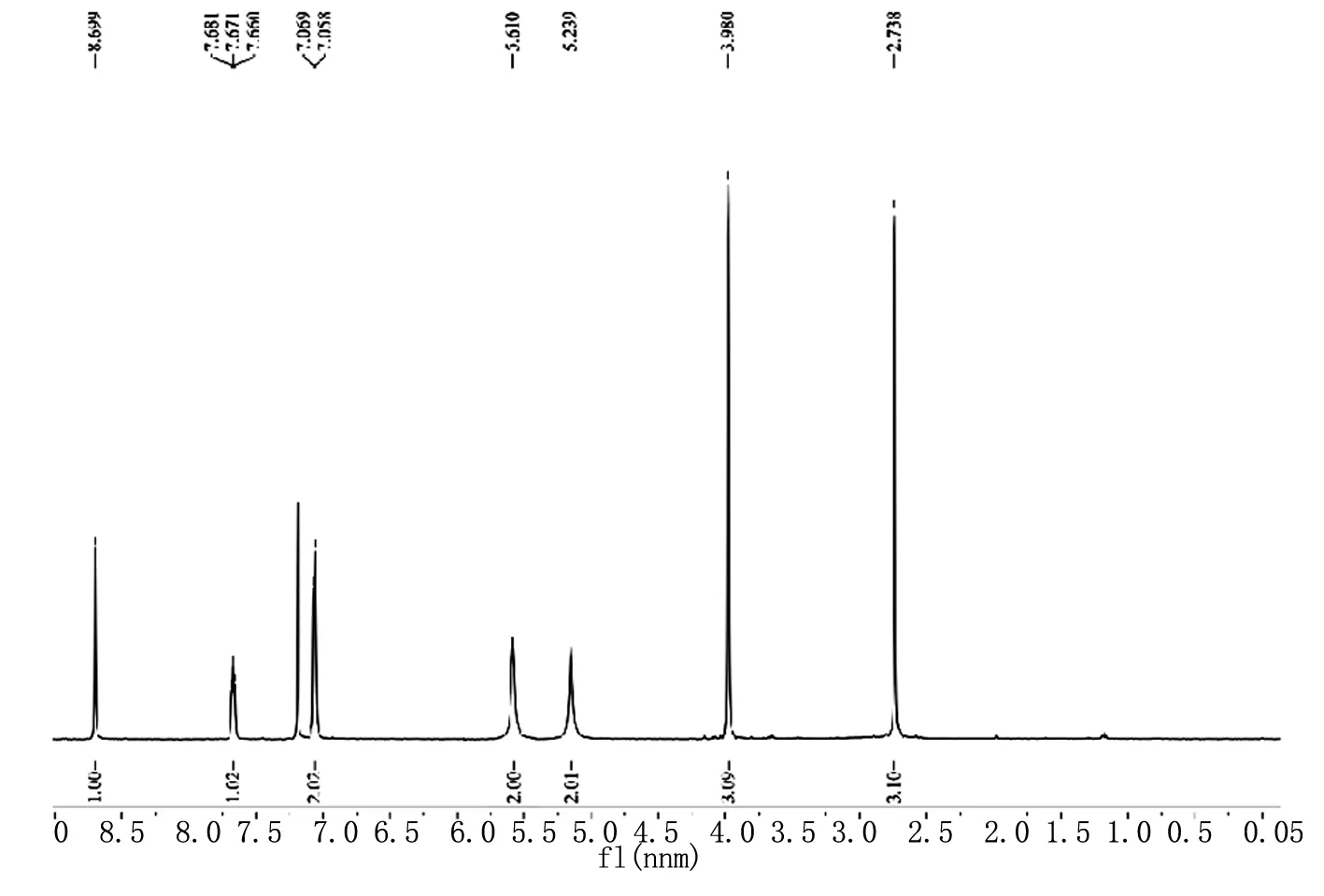
图3 化合物A的1H NMR谱图
Fig 31H NMR spectrum of compound A
从图3可以看出,在δ 5.610和5.239处分别出现了两个单钝峰,经过分析这两个峰归属为氨基和亚氨基上氢的质子吸收峰。显然,在δ 5.610和5.239处的氨基上氢的质子吸收峰,比预想的结构多了一个氨基的氢质子吸收峰。因此,我们判断底物与氨基胍没有发生闭环反应而是形成了一个反式的结构。反应过程如Scheme 4。
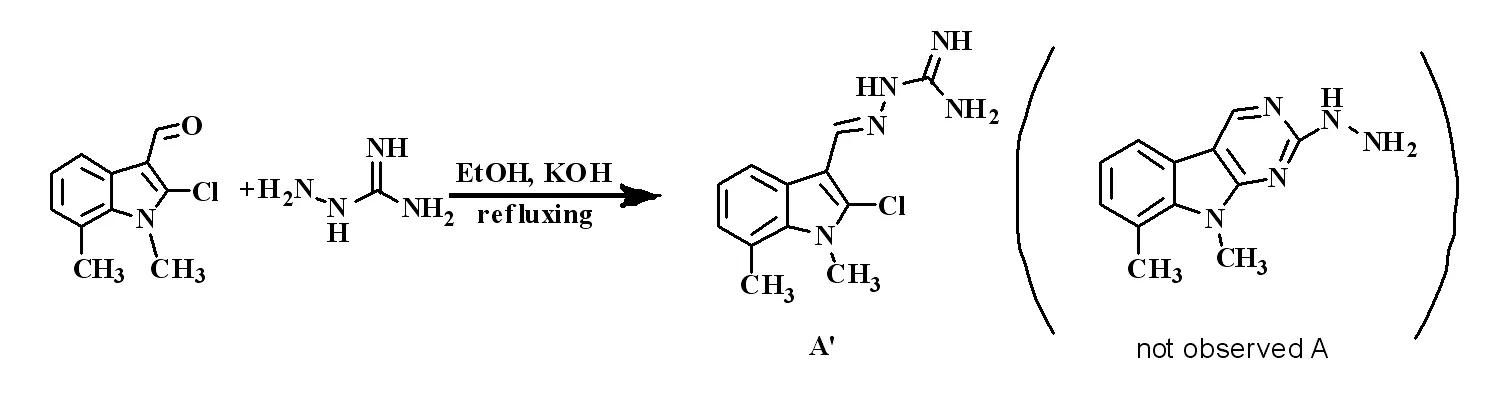
图4 化合物A的合成路线图
Fig.4 The synthesis route of compound A
我们考虑是由于底物与氨基胍在反应过程中形成反式结构而无法翻转,因此没有闭环,我们增加空间位阻已达到闭环的目的,为此我们在吲哚环上引入乙酰基。首先用底物与硝酸胍反应,成功得到吲哚并嘧啶类化合物N-甲基-4-甲基-8-甲(乙)基-9H-嘧啶并[4,5-b]吲哚-2-胺反应路线如图5。
在得到上述结果后,我们以N-甲基-2-氯-3-乙酰基-7-甲基吲哚为底物与氨基胍反应得到产物B。经过核磁鉴定我们发现当引入乙酰基后同样没有达到闭环的目的,而是得到了没有闭环的反式产物B'。其反应方程式如图6所示。
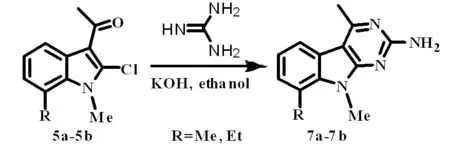
图5 N-甲基-4-甲基-8-甲(乙)基-9H-嘧啶 并[4,5-b]吲哚-2-胺的合成路线Fig.5 The synthesis route of N- methyl-4-methyl-8- methyl (ethyl)-9H-pyrimido[4,5-b]indol-2-amine
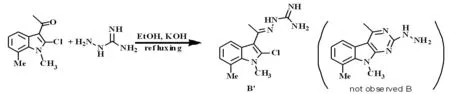
图6 化合物B的合成路线图
Fig.6 The synthesis route of compound B
为了使底物与氨基胍反应能顺利发生闭环反应,我们尝试延长反应时间,采用微波加热法,但都没有达到最终闭环的目的。考虑到甲基的空间位阻较小,如果引入苯甲基是否能顺利闭环;或是先把醛(酮)基保护,使氨基胍先与氯发生反应,脱去羰基保护后,再进行闭环反应,这个些实验构想我们将在以后的工作中继续研究。
3 结论
以N-甲基-2-氯-3-甲酰基-7-甲(乙)基吲哚和N-甲基-2-氯-3-乙酰基-7-甲(乙)基吲哚为原料,在氢氧化钾的碱性条件下,与硝酸胍发生闭环反应合成吲哚并嘧啶类化合物(6a-6b, 7a-7b),为吲哚并嘧啶类化合物的合成提供一种有效的方法而底物与氨基胍的闭环反应有待于进一步的研究。
[1] Fang D C. Theoretical studies on the mechanisms of [2+2] cycloaddition reactions[J].Pro Chem, 2012, 24(06): 879-885.
[2] Lilienkampf A, Karkola S, Alho-Richmond S, et al. Synthesis and biological evaluation of 17β-hydroxysteroid dehydrogenase type 1 (17β-HSD1) inhibitors based on a thieno[2,3-d]pyrimidin-4(3H)-one core[J].J Med Chem, 2009, 52: 6660-6671.
[3] Rashad A E, Shamroukh A H, Abdel-Megeid R E, et al. Synthesis, reactions, and antimicrobial evaluation of some polycondensed thienopyri-midine derivatives[J].Synth Commun, 2010, 40: 1149-1160.
[4]Al-Taisan K M, Al-Hazimi H M A, Al-Shihry S S. Synthesis, character-rization and biological studies of some novel thieno[2,3-d]pyrimidines[J].Molecules, 2010, 15:3932-3957.
[5]Salahuddin M, Kakad S, Shantakumar S M. Synthesis of some novel Thieno[2,3-d]pyrimidines and their antibacterial activity[J]. Eur J Chem,2009, 6(3): 801-808.
[6]Gaber H M, Bagley M C, Sherif S M. Antimicrobial investigations on synthetic ptolylazoderivatives of thienopyrimidinonebased on an ortho function-alized thiophenenucleus[J]. Eur J Chem,2010, 1: 115-123.
[7]Alagarsamya V, Solomonb V R, Meenac R,Ramaseshuc K V. et al. Design and synthesis of 2-methylthio-3-substituted-5,6-dimethyl- thieno[2,3-d]pyrimidin-4(3H)-ones as analgesic,anti-inflammatory and antibacterial agents[J]. Med Chem, 2007, 3(1): 67-73.
[8]Madding G D, Thompson M D. Regioselective syntheses of 2-amino-4,5-dialkylthiophene-3-carboxylates and their conversion to 3,4-dihydro-4- oxothieno[2,3-d]pyrimidine-2-carboxylates[J]. J Heterocycl Chem,1987, 24(3): 581-587.
[9]Chaykovsky M, Lin M, Rosowsky A, et al. 2,4-Diaminothieno[2,3-d]pyrimidines as antifolates and antimalarials. 2. synthesis of 2,4-diaminopyrido[4',3':4,5]thieno[2,3-d] pyrimidines and 2,4-diamino-8H-thiopyrano [4',3':4,5]thieno[2,3-d]pyrimidines[J]. J Med Chem,1973,16(3):188-191.
(本文文献格式:兰 帅,李向明.9H-吲哚[4,5-b]并嘧啶类衍生物的合成研究[J].山东化工,2017,46(12):44-46.)
A Facile Synthesis of Novel Indole-basedChalcones 9H-Pyrimido[4,5-b]indol-2-amine
LanShuai1,LiXiangming2
(1. School of Chemical Engineering Hebei Normal University of Science & Technology, Qinhuangdao 066000,China;2. Institute of Superfine Chemicals, Bohai University, Jinzhou 121000,China)
A facile synthesis of a series of novel indole-based pyrimidines derivatives (6a-6b, 7a-7b) are described, 2-chloro-7-methyl(ethyl)-1-substituted-indole-3-carbaldehyde(4a-4b), 1-(2-chloro-7- methyl(ethyl)-1-substituted-indol-3-yl) ethanone (5a-5b) were underwent the condensation reaction with guanidine nitrate in ethanol as solvent with the presence of potassium hydroxide as catalyst. The synthesis are characterized by mild conditions, simple work-up,and thus could be used as a useful methods. Under the same conditions, we get no closed-loop products, when using the substrates(4a-4b, 5a-5b) reacted with aminoguanidine.
methylation; closed-loop; indole-based pyrimidines derivatives
2017-05-05
兰 帅(1989—),吉林人,讲师,主要从事有机合成。
O626;TQ254.1
A
1008-021X(2017)12-0044-03

