加热方式及原料配比对介孔CeO2结构及其光催化性能的影响
王辉 邓黄秀 郝仕油
(1浙江师范大学行知学院,金华321004)(2浙江师范大学生化学院,金华321004)
加热方式及原料配比对介孔CeO2结构及其光催化性能的影响
王辉2邓黄秀2郝仕油*,1
(1浙江师范大学行知学院,金华321004)
(2浙江师范大学生化学院,金华321004)
以P123(聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物)为模板剂,Ce(NO3)3为反应原料,通过考察加热方式、加热温度、原料配比等因素,合成了结构性能较好、表面羟基含量较高的介孔CeO2材料。利用XRD,N2吸附-脱附,TEM,Raman,FT-IR等技术对合成样品的结构性能进行了表征,结果表明,当P123与Ce(NO3)3物质的量之比为1∶10,在110℃水热下合成的CeO2结构性能最好。以酸性橙7(AO7)为探针分子,对合成介孔CeO2的光催化性能进行评价。光催化结果证明,由于表面羟基含量较高、介孔及氧缺位的形成,所合成结构性能较好的CeO2,利用可见光可彻底催化降解溶液中的AO7。
合成因素;介孔CeO2;吸附;光催化;酸性橙7
0 引言
我国是酸性染料生产大国,且产量逐年增加。据统计,在生产和染色过程中,分别大约有1%~2%和1%~10%的未经严格处理的酸性染料随废水进入环境中[1],不但造成受纳水体和环境的严重污染,而且通过渗透或淋溶作用,对地下水及地表水造成次生污染,给人体及生态环境造成严重威胁。因此,如何采用相应方法,降低环境中酸性染料浓度,对生态环境保护、人类健康生活、经济可持续发展都具有重要作用。
由于具有操作简便、选择性低、吸附量高等优点,吸附法在去除酸性染料方面曾备受青睐[2-3]。然而,吸附法只能把酸性染料从液相转移至固相吸附剂,在重复使用吸附剂时可能存在二次污染。为了彻底消除酸性染料隐患,光催化技术应运而生,因为它可以把染料降解为无色、无危害的物质,如水、二氧化碳等。在所有的光催化剂中,TiO2研究较多[4-6]。然而,TiO2主要吸收紫外光(仅占可见光5%左右),使其在实际应用中受到较大限制[7]。因此,寻求其它高效光催化剂迫在眉睫。
作为n型半导体,CeO2与TiO2都具有宽禁带(3.1 eV左右)、无毒性、高稳定性等特点,且CeO2具有潜在可见光吸收[8]、结构独特、Ce3+/Ce4+可逆转换等性能,因而在光催化领域(特别是利用可见光催化降解有机污染物方面)可发挥重要作用。通过光催化机理研究,Ji等发现酸性橙7(AO7)在CeO2表面吸附至关重要,因为只有催化剂表面AO7被光激化后才能传递电子至Ce的4f轨道,然后把电子传递至CeO2表面的O2,形成活性物种O2·-,对AO7进行氧化降解[9-10]。在后续研究中,该课题组相关成员进一步证明酸性染料吸附量对催化降解效率的重要性[11]。为了提高可见光吸收,通常采用掺杂[12]、形成介孔[13]改变CeO2结构,从而提高其光催化降解染料效率。目前,大部分CeO2基光催化剂通过煅烧方式获得,导致其表面有机官能团含量降低,致使染料吸附量降低,从而严重影响光催化效率。近期,本课题组以P123为模板剂,通过低温(100℃)水热及乙醇萃取法合成了不同Fe掺杂介孔CeO2材料,由于该介孔材料表面富含羟基,致使染料(罗丹明B)吸附量增加,因而极大提高了CeO2的光催化效率[14]。
既然提高表面羟基含量有助于染料吸附,从而提高光催化效率,那么表面羟基含量受什么因素影响呢?据理论分析可知,材料表面羟基含量与反应原料配比、反应温度密切相关。因此,本研究以P123为模板剂,Ce(NO3)3为反应原料,合成介孔CeO2材料,考察P123与Ce(NO3)3配比、加热方式(水浴加热及水热反应)及其温度对合成材料光催化降解AO7效率的影响。结果证明,采用合适的原料配比及水热温度,有利于介孔材料结构改善及表面羟基含量提高,增加催化剂对可见光的吸收及对酸性染料的吸附,进而提高光催化降解效率。
1 实验部分
1.1 药品与材料合成
P123(化学纯,美国Sigma公司),Ce(NO3)3·6H2O (分析纯,上海国药化学试剂集团),无水乙醇(分析纯,上海国药化学试剂集团),NH3·H2O(质量百分比为28%,上海国药化学试剂集团),H2O2(质量百分比为30%,上海国药化学试剂集团),酸性橙7(化学纯,天津天顺化工染料有限公司),二次蒸馏水(自制),体相CeO2(质量百分比为99.9%,上海国药化学试剂集团),1,4-对本醌(分析纯,上海国药化学试剂集团)。
取1.16 g(0.2 mmol)P123溶于15 mL C2H5OH和7.5 mL去离子水中,40℃水浴搅拌40 min,形成溶液A;取1.736 g(4 mmol)Ce(NO3)3·6H2O溶于7.5 mL去离子水中,形成溶液B;把溶液B滴加至溶液A中,边滴加边搅拌,60 min后形成混合溶液;用一定浓度的NH3·H2O调节混合溶液pH值为9~10,继续搅拌20 min;室温下滴加5 mL 30%H2O2后,混合溶液转移至带聚四氟乙烯内衬不锈钢反应釜中,经不同温度(90、110、120℃)水热反应24 h、冷却、抽滤洗涤(水洗、乙醇洗涤各2次)、干燥后,获得氧化铈前驱体。前躯体经无水乙醇萃取除去P123后,即得介孔CeO2材料(1 g前驱物对应于80 mL无水乙醇,80℃回流12 h,回流萃取2次)。为了考察实验因素对介孔材料结构及羟基含量影响,本研究采用P123与Ce(NO3)3·6H2O物质的量比值分别1∶10,1∶20,1∶30的反应原料及水浴加热方式(90℃)进行对比实验。
1.2 样品表征
XRD图在X射线衍射仪(PW3040/60型)上获得,Cu Kα(λ=0.154 06 nm),40 kV,40 mA,扫描速度6°·min-1,扫描区间0.5°~5°。-196℃时N2吸附-脱附等温线在ASAP 2020型(美国Micromeritics公司)气体吸附仪上获得,测试压力范围为0.01~101 kPa。采用BET方法计算比表面积,利用吸附等温线数据和BJH方法计算孔径分布。TEM图像在透射电子显微镜(JEM-1230型,日本JEOL公司)上获得,工作电压为200 kV。拉曼数据在Renishaw公司RM1000型显微共聚焦激光拉曼光谱仪上获得,激光波长(He-Ne,ca.3 mW)为632.8 nm,扫描范围为200~700 cm-1。紫外-可见光吸收实验在Nicolet Evlution 500双光束型光谱仪上进行,扫描速率为240 nm·min-1,扫描范围200~800 nm。原位红外光谱图在Nicolet NEXUS670型傅立叶变换红外光谱仪上进行,采用KBr压片法,利用MCT检测器检测光谱信号,检测前样品在120℃下预处理2 h,以除去表面吸附水及其它不纯物质。
1.3 光催化实验
取0.05 g催化剂(介孔CeO2),50 mL AO7(0.05 mmol·L-1)溶液置于100 mL小烧杯中,磁力搅拌形成悬浊液后,用0.1 mol·L-1HCl或NaOH调节溶液pH值。室温避光搅拌1 h后,滴加0.5 mL 30% H2O2,在自然光下继续搅拌一定时间后,取上层清液离心,在AO7最大吸收波长484 nm处检测吸光度,根据方程式(1)计算AO7降解率。

式中A0、A分别为光催化前后AO7溶液的吸光度。
2 结果与讨论
2.1 样品结构性能表征
图1为水浴与水热法合成CeO2样品(反应原料P123与Ce(NO3)3的物质的量之比为1∶20)的XRD和N2吸附-脱附图。据图1a可知,两种加热方式获得的样品均为立方CeO2结构,因为晶相与ICDD卡(立方CeO2,PDF No.81-0792)比较后发现,衍射峰位置相同;而经水浴加热合成样品的XRD相应衍射峰强度低于水热合成样品的,且在高对称晶面(400),(331),(420)处衍射峰不明显,证明水热加热方式有利于CeO2晶体生长,因为水热反应在相同温度下可产生较大压力;此外,提高水热温度可提高衍射峰强度(对照曲线2与3),但继续提高温度,衍射峰强度变化不明显。从图1b可知,实验所得N2吸附-脱附等温线为Ⅳ型,证明样品为介孔结构,且在水热环境中生长的晶体中P123含量较大,因为萃取去除模板剂后样品对N2的吸附量较高,进一步证明水热条件有助于CeO2晶体生长;当提高水热温度至110℃后,样品对N2的吸附量略有提高,但水热温度超过110℃时,所合成样品的N2吸附量有所降低(如120℃时所合成样品的N2吸附量为112 cm3·g-1,低于110℃时的117 cm3·g-1),证明合适的温度有利于P123与CeO2前躯体结合。根据XRD与N2吸附-脱附结果,本研究确定水浴加热温度为110℃较合适。
据实验过程可知,P123首先溶解在乙醇水溶液中,当加入Ce(NO3)3溶液后,它与Ce3+,NH3·H2O相结合,并在H2O2作用下形成CeO2前躯体,前躯体经乙醇萃取除去P123后获得介孔CeO2材料。在上述反应过程中,反应原料P123与Ce(NO3)3配比对最终介孔材料结构具有重要影响。据此,本研究分别在P123与Ce(NO3)3物质的量比值为1∶10,1∶20,1∶30情况下合成了CeO2样品。不同物质的量比值下合成样品的XRD图谱(图2a)基本一致,但N2吸脱附等温线形状(图2b)略有差别,且不同样品对N2的吸附量不同。据图2b可知,当P123与Ce(NO3)3物质的量比值较大(即P123含量较高)时,所得样品对N2的吸附量较高,相应比表面积较大(图2样品1、2、3的比表面积分别为124、95、68 m2·g-1,最可几孔径分别为3.4、5.6、4.8 nm)。继续提高原料中P123含量(当P123与Ce(NO3)3物质的量比值为1∶5时)后,所获得前驱物非常难过滤,可能原因是产物为无定型。上述实验结果说明反应原料中P123含量对CeO2前躯体性能影响较大,当其含量过高时,会导致预产物晶化过低;而当其含量过低时,则会导致产物比表面积过低,不利于光催化效率提高。从以上实验结果可知,P123与Ce(NO3)3物质的量比值为1∶10时,所合成介孔产物结构最好。
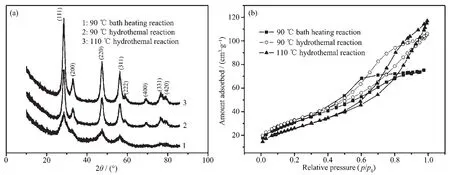
图1 不同加热方式下合成CeO2样品的XRD(a)和N2吸附-脱附(b)图Fig.1XRD patterns(a)and N2adsorption-desorption isotherms(b)of CeO2samples synthesized by different heating model
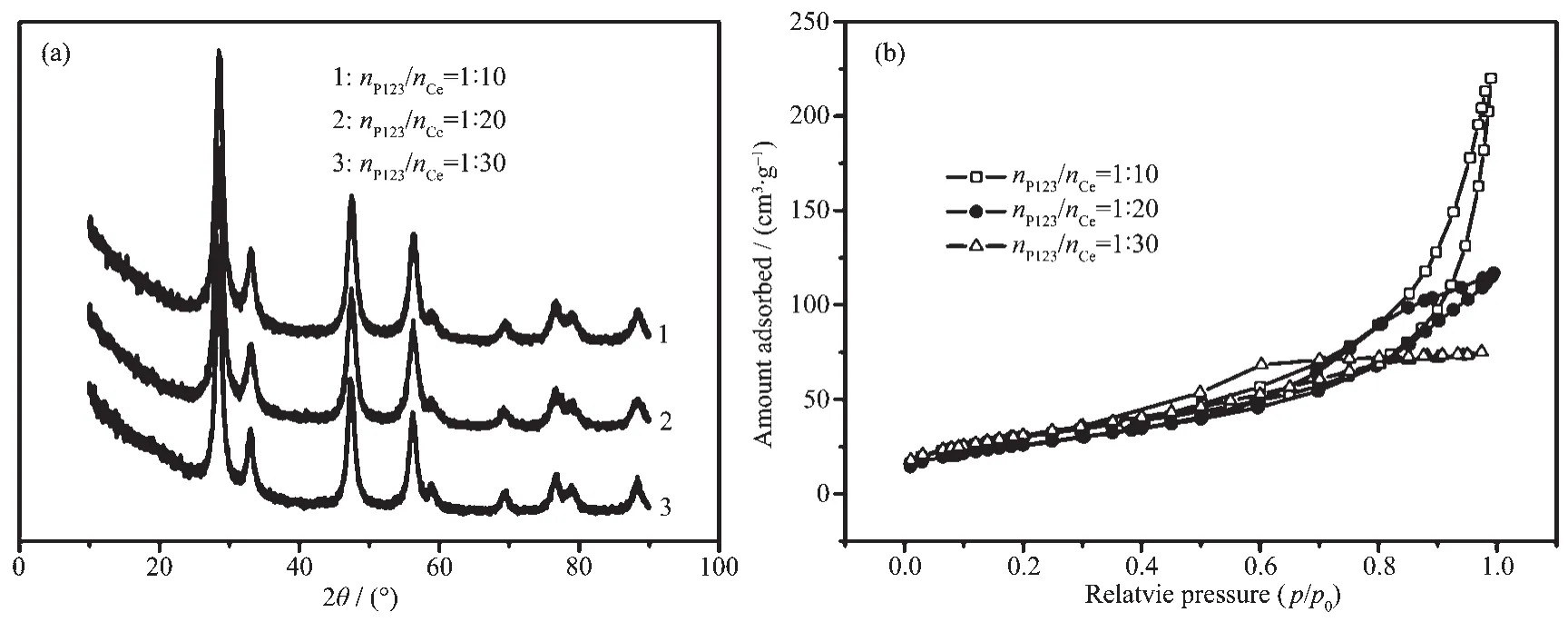
图2 110℃,在不同P123与Ce(NO3)3物质的量之比下合成CeO2样品的XRD(a)和N2吸附-脱附(b)图Fig.2XRD patterns(a)and N2adsorption-desorption isotherms(b)of CeO2samples synthesized by different molar ratios of P123 to Ce(NO3)3at the temperature of 110℃
为了证明萃取能有效去除模板剂P123,本研究对前驱物进行了煅烧实验(450℃煅烧2 h),所获得样品的N2吸脱附等温线见图3a。据图3a可知,萃取与煅烧所获得样品的N2吸脱附等温线形状基本相同,且N2吸附量相当,证明乙醇可有效去除模板剂。此外,用萃取方法获得样品的小角度XRD峰型与用煅烧法获得样品的一致(详见图3b),说明晶体结构一致。为了进一步证明晶体结构的一致性,本研究还对2种方法所合成的样品进行了TEM测试(详见图4)。据图4可知,用煅烧和萃取法获得样品的微观结构基本相同,为类蛀洞状介孔结构[15]。
众所周知,催化剂对光响应情况直接影响其光催化效率。图5为体相与介孔CeO2的紫外-可见光反射及其光学带隙图。据图5a可知,体相CeO2(b-CeO2)的光吸收强度低于介孔CeO2(m-CeO2)的,且形成介孔后有利于可见光的吸收。据文献报道可知,当形成介孔结构后,可提高材料比表面积,使光在介孔材料内可进行多次散射,因而吸收度增加[16]。由于对光吸收程度增加,m-CeO2的禁带宽度(2.7 eV)低于b-CeO2的(3.1 eV),相应结果见图5b。材料禁带宽度利用方程式(αhν)n=k(hν-Eg)[17]计算,式中α为吸收系数,k为与有效质量相关的参数,n为1/2(当电子直接跃迁时),hν为吸收能,Eg为禁带宽度。
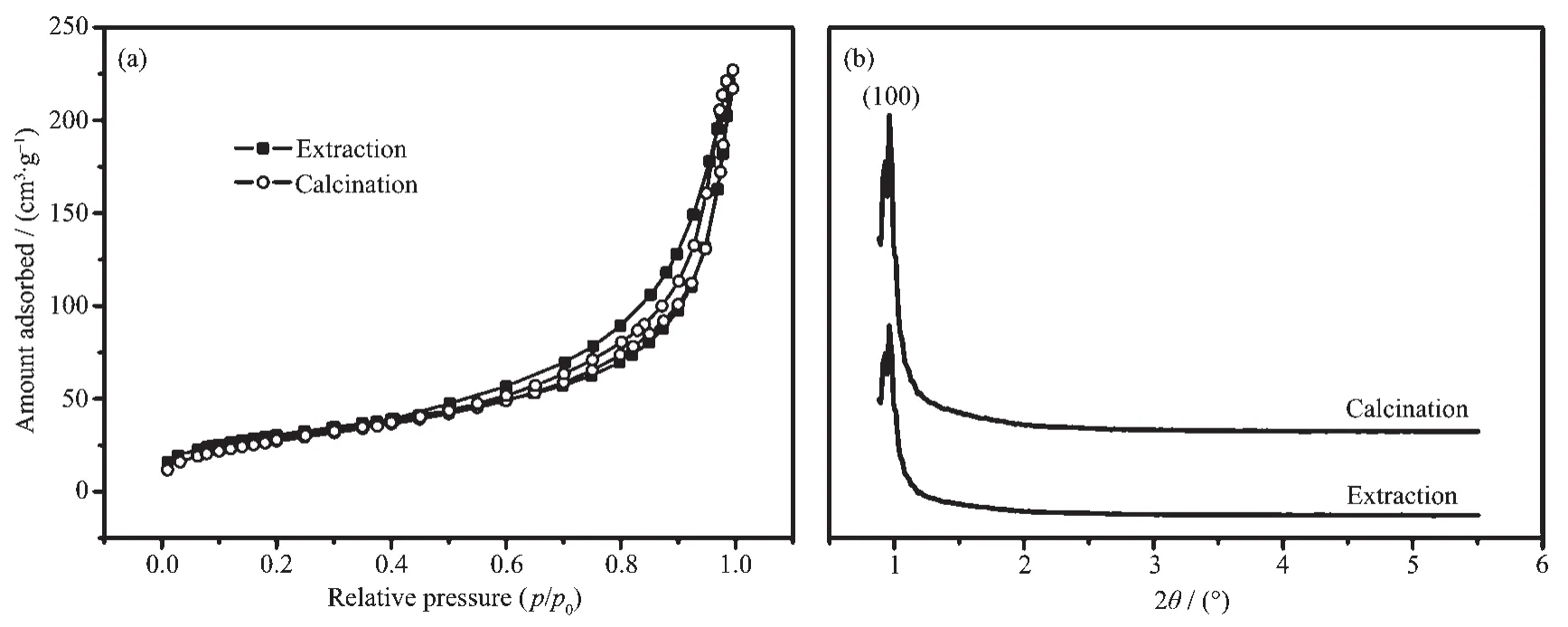
图3 110℃,P123与Ce(NO3)3物质的量之比为1∶10下合成CeO2样品的N2吸附-脱附(a)和小角度XRD(b)图Fig.3N2adsorption-desorption isotherms(a)and low-angle XRD patterns(b)of CeO2samples synthesized by the molar ratios of P123 to Ce(NO3)3of 1∶10 at the temperature of 110℃
体相与介孔CeO2的Raman光谱曲线见图6。据图6可知,b-CeO2在465 cm-1左右处有一尖锐峰,此峰归属于F2g模式的拉曼活性振动,与萤石结构振动相似;m-CeO2除在465 cm-1处有一F2g模式振动峰外,在597 cm-1左右处还有一宽肩峰,此峰是由氧缺位所致[18],而氧缺位形成的可能原因是介孔CeO2(特别是由萃取获得样品)中存在少量Ce3+取代Ce4+后所致[19]。据文献[20]可知,由于氧缺位能级(由氧缺位组成)介于Ce4f轨道与CeO2价带之间,导致m-CeO2禁带宽度小于b-CeO2的,因而利于m-CeO2对可见光的吸收。

图4 煅烧(a)与萃取(b)获得CeO2样品的TEM图Fig.4TEM images of CeO2samples synthesized by calcination(a)and extraction(b)
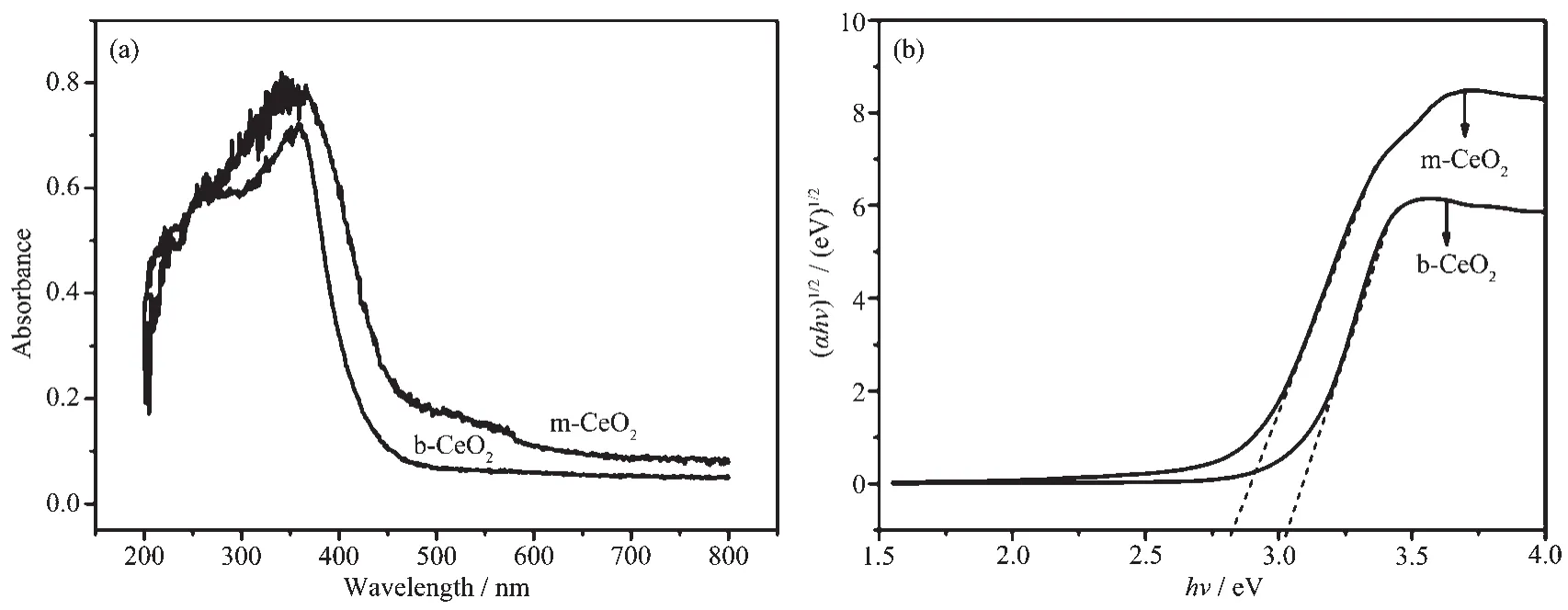
图5 体相与介孔CeO2的紫外-可见光吸收(a)及其光学带隙(b)图谱Fig.5UV-Vis spectra(a)and optical absorption edges(b)of bulk CeO2and mesoporous CeO2
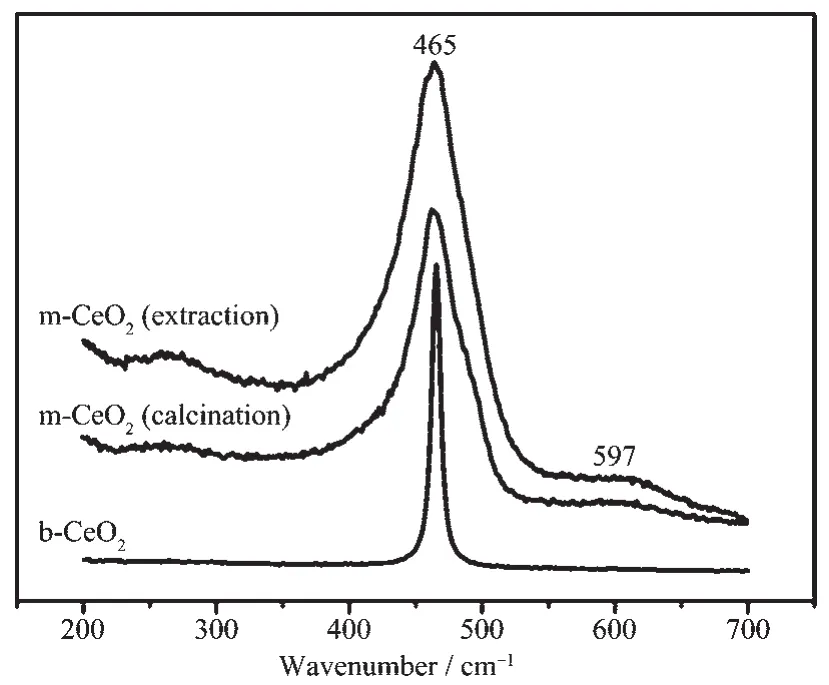
图6 体相与介孔CeO2的Raman光谱图Fig.6Raman spectra of bulk ceria(b-CeO2)and mesoporous ceria(m-CeO2)
2.2 光催化性能
在不同P123与Ce(NO3)3物质的量比值条件下,110℃水热合成的介孔氧化铈与体相氧化铈对0.05 mmol·L-1AO7光催化降解情况见图7。据图7可知,当pH=5时,m-CeO2的光催化降解效率高于b-CeO2,因为形成介孔后,氧化铈比表面积增加(本研究中采用的b-CeO2比表面积为3 m2·g-1),催化剂对光吸收强度提高(详见图5)。此外,由萃取方法获得的m-CeO2中具有一定浓度的氧缺位,而氧缺位有助于H2O2在催化剂表面吸附,产生相应活性物种(如O2,O2·-,OH·等)对AO7进行光催化降解[20]。由于氧缺位带负电,可使空穴向它定向移动,所以对光生电子与空穴的有效分离可起重要作用,从而提高m-CeO2的光催化效率。对比分析图7中相关曲线走势可知,随着反应原料中P123含量增加,所合成m-CeO2的光催化效率提高。为了解释此现象,本研究对不同物质量比值下所合成样品进行了原位红外实验,结果详见图8a。据图8a可知,所有样品在2 400~4 000cm-1范围内出现吸收峰,此峰归属于水和材料表面羟基伸缩振动[21],由于吸附水在实验前已被除去,所以此波段内出现的峰主要为m-CeO2表面上羟基振动所致。当P123含量增加,材料表面羟基浓度相应提高,在一定条件下对AO7吸附量也相应提高(详见图8b),所以催化剂光催化效率提高[14]。为了研究H2O2在光催化中的作用,本研究进行了对照实验(只加H2O2,不加催化剂,其它实验条件不变),结果证明H2O2在相同实验条件下对AO7无明显催化作用,与我们前期工作结果相似[20]。
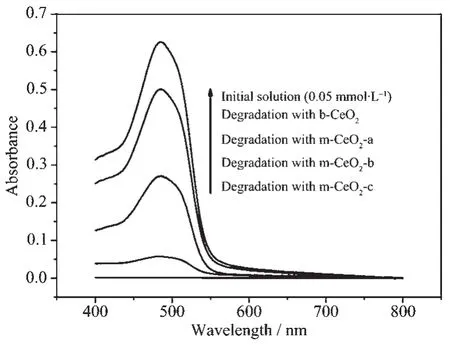
图7 pH=5时不同催化剂对0.05 mmol·L-1AO7的光催化降解性能(催化时间:2 h)Fig.7Degradation of 0.05 mmol·L-1AO7 over different CeO2catalysts under daylight irradiation at pH of 5(catalytic time:2 h)

图8 不同P123与Ce(NO3)3物质量比值下合成m-CeO2的原位红外光谱图(a)及它们暗反应吸附AO7 1 h后的紫外可见光谱图(b)Fig.8In situ FT-IR spectra of m-CeO2prepared by different molar ratios of P123 to Ce(NO3)3(a), UV-vis spectra of AO7 aqueous solution after adsorption on m-CeO2for 1 h(b)
催化体系酸碱性对催化剂表面羟基性能影响较大,从而影响光催化降解效率。不同pH值对CeO2光催化效率影响情况见图9,据图9可知:pH>6.8时的光催化效率小于pH<6.8的;当pH值位于5~7之间时,随着pH值增加,光催化效率降低;当pH<5时,随着pH值减小,光催化效率也有所降低。出现以上现象的主要原因是:CeO2的等电点为6.8[9],当pH<6.8时,随着pH值降低,CeO2表面羟基不断质子化形成-OH2+,与AO7中的磺酸基(-SO3-)以静电作用相结合,因而提高催化剂对AO7的吸附,所以光催化效率提高;而当pH<5时,随着体系酸性增加,AO7中的磺酸基也可质子化,削弱催化剂与AO7间的静电引力,导致光催化效率降低。因此,本研究合成的介孔CeO2对AO7光催化效率的最佳pH值为5。
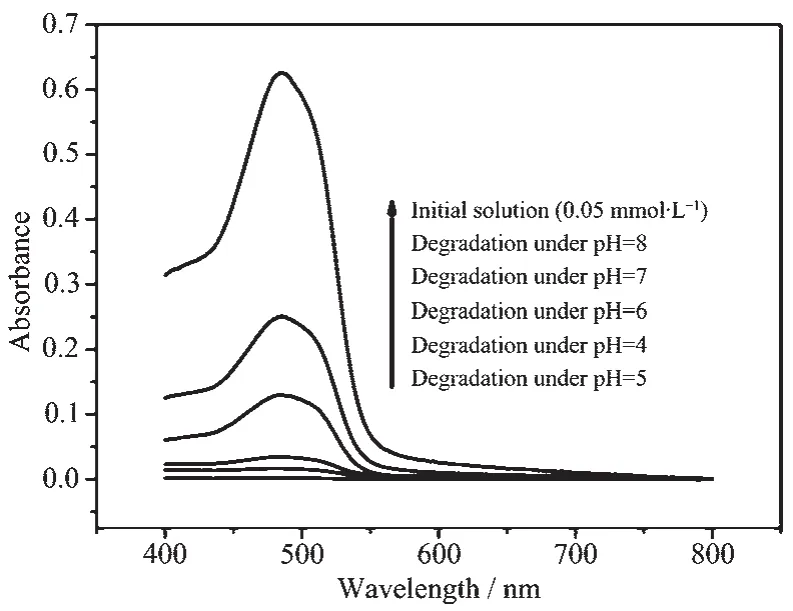
图9 pH值对CeO2光催化效率的影响(催化时间:2 h)Fig.9Effect of pH values on the photocatalytic efficiency of CeO2(catalytic time:2 h)
为了证明AO7是被介孔CeO2光催化降解,而不是被吸附,本研究对AO7、CeO2、光催化降解后回收的CeO2进行了红外光谱分析,结果见图10a。据图10a可知,回收CeO2的相关红外峰与初始CeO2的基本一致,并未发现AO7的相关特征峰。因此,红外分析表明AO7确实是被光催化降解。为了确定光催化活性物种,本研究在催化体系中加入不同活性物种捕获剂,结果表明1,4-对苯醌(超氧自由基捕获剂)对AO7的光催化降解影响较大,具体见图10b。据此,本研究认为超氧自由基是光催化降解AO7的主要活性物种。
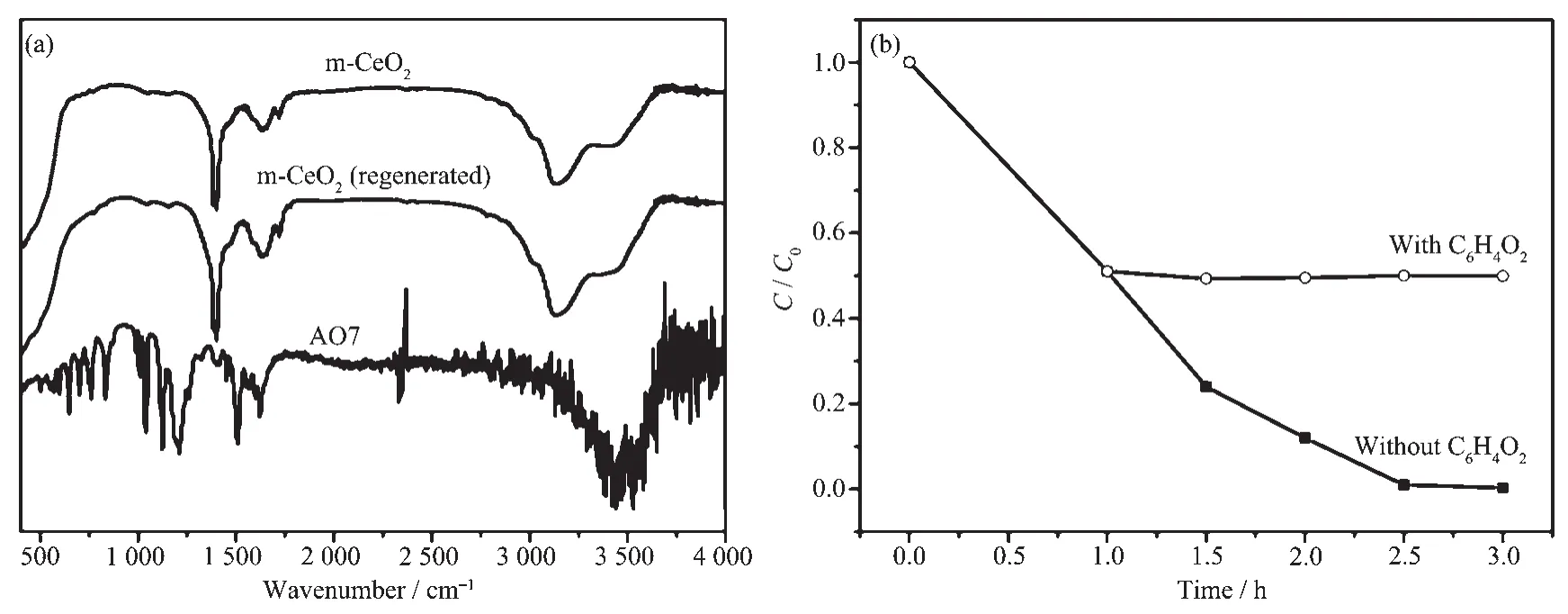
图10 AO7,m-CeO2和光催化后m-CeO2的红外光谱(a),C6H4O2对AO7光催化影响图(b)Fig.10FT-IR spectra of AO7,m-CeO2and the regenerated m-CeO2(a),effect of C6H4O2on AO7 photocatalytic degradation(b)
3 结论
通过考察影响介孔CeO2结构及其光催化性能因素(加热方式、加热温度、P123与Ce(NO3)3物质的量比值)可知:水热加热方式有利于CeO2晶体生长,当P123与Ce(NO3)3物质的量之比为1∶10,在110℃水热下合成的CeO2结构性能较好,表面羟基含量较高,因而光催化效果较佳。由于介孔有利于可见光吸收,所以介孔CeO2在可见光作用下对AO7有较好的催化效果。此外,介孔CeO2中形成的氧缺位有利于相关活性物种产生,因而导致光催化效率提高。
[1]Forgacs E,Cserhati T,Oros G.Environ.Int.,2004,30:953-971
[2]Li J,Ng D H L,Song P,et al.J.Ind.Eng.Chem.,2015,23: 290-298
[3]HAO Shi-You(郝仕油),DENG Huang-Xiu(邓黄秀),ZHANG Guo-Dong(章国栋).Chinese J.Inorg.Chem.(无机化学学报),2016,32:233-240
[4]Mao J,Lu H B,Habibi D,et al.Clean-Soil Air Water,2015, 43:1037-1043
[5]Dávila-Jiméneza M M,Elizalde-Gonzálezb M P,Díazb E G, et al.Appl.Catal.B:Environ.,2015,166-167:241-250
[6]Muthirulann P,Nirmala Devi C,MeenakshiSundaram M. Ceram.Int.,2014,40:5945-5957
[7]Silva A M T,Silva C G,Drazic G,et al.Catal.Today,2009, 144:13-18
[8]Fallah J E,Hilaire L,Romeo M,et al.J.Electron.Spectrosc. Relat.Phenom.,1995,73:89-103
[9]Ji P,Zhang J,Chen F,et al.Appl.Catal.B:Environ,2009,85: 148-154
[10]Ji P,Wang L,Chen F.ChemCatChem,2010,2:1552-1554
[11]Chen F,Shen X,Wang Y,et al.Appl.Catal.B:Environ., 2012,121-122:223-229
[12]Hu S,Zhou F,Wang L,et al.Catal.Commun.,2011,12:794 -797
[13]Ji P,Zhang J,Chen F,et al.J.Phys.Chem.C,2008,112: 17809-17813
[14]Hao S,Hou J,Aprea P,et al.Ind.Eng.Chem.Res.,2014, 53:14617-14622
[15]Kim S N,Son W J,Choi J S,et al.Microporous Mesoporous Mater.,2008,115:497-503
[16]Yu J C,Wang X C,Fu X Z.Chem.Mater.,2004,16:1523-1530
[17]Yoon M,Seo M,Jeong C,et al.Chem.Mater.,2005,17: 6069-6079
[18]Keramidas V G,White W B.J.Chem.Phys.,1973,59:1561-1562
[19]Hao S,Hou J,Aprea P,et al.Ceram.Int.,2016,42:7440-7446
[20]Hao S,Hou J,Aprea P,et al.Appl.Catal.B:Environ., 2014,160-161:566-573
[21]Pan D,Yuan P,Zhao L,et al.Chem.Mater.,2009,21:5413-5425
Efffect of Heating Model and Raw Material Ratios on the Structure and Photocatalytic Properties of Mesoporous CeO2
WANG Hui2DENG Huang-Xiu2HAO Shi-You*,1
(1Xingzhi College,2College of Chemistry and Life Sciences,Zhejiang Normal University,Jinhua,Zhejiang 321004,China)
Mesoporous CeO2materials with good structural properties and high loading of surface hydroxyl groups were synthesized using P123 as template and Ce(NO3)3as raw material via investigating the heating models,heating temperature and the ratios of raw material.The synthesized materials were characterized by XRD,N2adsorptiondesorption,TEM,Raman,and FT-IR technologies and the results showed that the structural properties of mesoporous CeO2prepared using the molar ratio of P123 to Ce(NO3)3of 1∶10 as reactants at the temperature of 110℃hydrothermal heating is the best.The photocatalytic performance of mesoporous CeO2was evaluated by the degradation of acid orange 7(AO7)from aqueous solution.The photocatalytic results presented that AO7 can be thoroughly degraded by the resulted mesoporous CeO2under the irradiation of visible light due to the high loading of hydroxyl groups and the formation of mesopores and oxygen vacancies.
synthetic factors;mesoporous CeO2;adsorption;photocatalysis;acid orange 7
O614.13;TF123.7
A
1001-4861(2017)02-0285-07
10.11862/CJIC.2017.040
2016-07-24。收修改稿日期:2016-12-12。
浙江省自然科学基金(No.LY14B070006,Y4110289)资助项目。*
。E-mail:sky54@zjnu.cn

