碳酸盐共沉淀法可控制备超高倍率锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2
郑卓 滑纬博 吴振国 向伟 钟本和 郭孝东*,,4
(1四川大学高分子研究所,成都610065)(2四川大学化学工程学院,成都610065)(3成都理工大学材料与化学化工学院,成都610065)(4伍伦贡大学超导与电子材料研究所,澳大利亚,伍伦贡2522)
碳酸盐共沉淀法可控制备超高倍率锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2
郑卓1滑纬博2吴振国2向伟3钟本和2郭孝东*,2,4
(1四川大学高分子研究所,成都610065)
(2四川大学化学工程学院,成都610065)
(3成都理工大学材料与化学化工学院,成都610065)
(4伍伦贡大学超导与电子材料研究所,澳大利亚,伍伦贡2522)
采用碳酸盐共沉淀法通过调节NH3·H2O用量来实现可控制备超高倍率纳米结构LiNi1/3Co1/3Mn1/3O2正极材料。NH3·H2O用量会对颗粒的形貌、粒径、晶体结构以及材料电化学性能产生较大的影响。X射线衍射(XRD)分析和扫描电镜(SEM)结果表明,随着NH3·H2O用量的降低,一次颗粒形貌由纳米片状逐渐过渡到纳米球状,且nNH3·H2O∶(nNi+nCo+nMn)=1∶2样品晶体层状结构最完善、Li+/Ni2+阳离子混排程度最低。电化学性能测试结果也证实了nNH3·H2O∶(nNi+nCo+nMn)=1∶2样品具有最优异的循环稳定性和超高倍率性能。具体而言,在2.7~4.3 V,1C下循环300次后的放电比容量为119 mAh·g-1,容量保持率为81%,中值电压基本无衰减(保持率为97%)。在100C(18 Ah·g-1)的超高倍率下,放电比容量还能达到56 mAh·g-1,具有应用于高功率型锂离子电池的前景。此NH3·H2O比例值对于共沉淀法制备其他高倍率、高容量的正/负极氧化物材料具有一定的工艺参考价值。
锂离子电池;正极材料;碳酸盐共沉淀法;超高倍率性能
0 引言
锂离子电池作为最有前景的新能源材料被广泛应用于便携式电子设备、大型储能设备、电动汽车(EVs)和混合动力汽车(HEVs)[1-3]。在实际应用中特别需要高功率密度的锂离子电池,但由于高倍率性能的正极材料缺乏,限制了锂离子电池的进一步发展。所以,制备具有超高倍率性能和高循环寿命的正极材料至关重要[4-5]。在目前这些正极材料中,层状结构的三元氧化物LiNi1/3Co1/3Mn1/3O2因其低成本、低毒性、容量高和电化学性能稳定等优点,被认为是最有可能替代LiCoO2的第二代锂离子电池正极材料[6-7]。目前合成LiNi1/3Co1/3Mn1/3O2的方法主要有固相法[8]、溶胶-凝胶法[9]、氢氧化物/碳酸盐共沉淀法[10-11]、水热法[12]和喷雾热解法[13]等。在这些方法中,共沉淀法被认为是一种最有效的方法来合成电化学性能优异的三元材料。相比于氢氧化物共沉淀法,碳酸盐共沉淀法的合成条件简单易行,且制得材料的二次颗粒为多孔微纳球形结构,可以提供更大的电解液-正极材料接触面积和较短的Li+扩散路径,故而表现出优异的电化学性能[14]。
目前几乎没有文献报道LiNi1/3Co1/3Mn1/3O2材料的超高倍率性能,而这方面电性能在锂离子电池的实际应用中十分重要,所以本实验采用碳酸盐共沉淀法通过调节NH3·H2O用量来实现可控制备超高倍率锂离子电池正极材料LiNi1/3Co1/3Mn1/3O2。在共沉淀法制备工艺中,氨水(NH3·H2O)作为配位剂与过渡金属离子配位(Ni2+、Co2+、Mn2+),从而降低瞬时沉淀([Ni1/3Co1/3Mn1/3]CO3)的过饱和度,降低晶核形成速率,使晶核有足够时间长大并在晶格内进行定向排列,最终使生成的共沉淀颗粒结晶致密,晶体化程度高[15]。另外,由于Ostwald熟化作用[16],在陈化过程中小晶粒消溶而大晶粒继续长大使得颗粒平均尺寸增大。并且NH3·H2O易与处在晶体边角的共沉积颗粒作用,从而使得晶体颗粒在长大的同时其形貌逐渐趋于圆整、光滑。因此,NH3·H2O在共沉淀反应体系中对颗粒的形貌、粒径、晶体结构具有较大的影响,并最终决定材料的电化学性能。
本文考察了一系列不同NH3·H2O用量对前驱体形貌以及材料成品电化学性能的影响,并从中优选出了一组最佳NH3·H2O用量值,此时制得的LiNi1/3Co1/3Mn1/3O2材料具有最优异的循环稳定性和超高倍率性能,具有应用于高功率型锂离子电池的前景。
1 实验部分
1.1 材料合成
将CoSO4·7H2O,NiSO4·6H2O,MnSO4·H2O溶于去离子水中,配成1.5 mol·L-1的混合溶液,以Na2CO3(3 mol·L-1)为沉淀剂,NH3·H2O(4.5 mol·L-1)为配位剂,在高速搅拌下(1 000 r·min-1)分别滴加到反应釜中,反应温度设定在50℃,反应pH=8.0,待反应沉淀完全之后,在60℃下陈化10 h,然后抽滤洗涤除去多余的SO42-和Na+,再在100℃下干燥12 h得到Ni1/3Co1/3Mn1/3CO3前驱体粉末。最后前驱体粉体与化学计量比的Li2CO3固相混合(Li2CO3过量5%),在空气气氛中以2.5℃·min-1的升温速率将温度升至550℃预烧6 h,再以2℃·min-1的升温速率将温度升至850℃煅烧12 h得到LiNi1/3Co1/3Mn1/3O2正极材料。本实验考察了不同NH3·H2O用量的情况,即nNH3·H2O∶(nNi+nCo+nMn)=1∶1、1∶2和1∶3,制得的样品分别编号为P1、P2、P3。
1.2 材料表征
X射线衍射(XRD)用于分析样品的晶体结构,采用菲利普公司的PW1730多晶转靶X射线仪(Cu Kα靶,λ=0.154 18 nm),工作电压40 kV,工作电流30 mA,扫描角度范围为10°~70°,扫描速度为2°· min-1。样品的形貌和颗粒尺寸用日本日立(Hitachi)S-4800扫描电子显微镜(SEM)进行表征和分析。样品的微观结构使用日本电子JEM-2100高分辨透射电镜(TEM)进行表征和分析。采用Quadrasorb SI型比表面分析仪(美国康塔公司)测试材料的比表面积。
1.3 材料的电化学性能测试
正极材料(LiNi1/3Co1/3Mn1/3O2)、乙炔黑、粘结剂(PVDF)按照质量比为80∶13∶7混合,并加入适量的N-甲基吡咯烷酮调均成浆。这些湿浆料首先涂覆在铝箔上,并在真空100℃下干燥10 h。在装成半电池之前,将这些涂有浆料的铝箔切成直径为14 mm的圆片,并在20 MPa下压实得到电池的正极片,每个片上的正极材料活性物质质量大概在3~4 mg· cm-2。将正极片、锂片(负极)、隔膜(Celgard 2400)和电解液在充满Ar气的手套箱中组装成CR2032扣式电池。电解液为LiPF6(1 mol·L-1)/EC-DMC(体积比为1∶1)。在室温下进行充放电性能测试,充放电电压为2.7~4.3 V,1C=180 mA·g-1。0.1C~1C的充放电机制:在相应的倍率下恒流充电到4.3 V,然后在4.3 V恒压充电30 min,再在相应的倍率下恒流放电到2.7 V。1C~100C的充放电机制:以1C恒电流充电到4.3 V,然后在4.3 V恒压充电30 min,再在相应的倍率下恒流放电到2.7 V。循环伏安测试(CV)的电压范围为2.7~4.3 V,扫描速度分别为0.1、0.2、0.4、0.6、0.8 mV·s-1。
2 结果与讨论
图1给出了3种不同NH3·H2O用量条件下制得的LiNi1/3Co1/3Mn1/3O2样品XRD图。从图中可以看出3种样品中都没有其他杂峰存在,所有的衍射峰均能很好地索引为六方α-NaFeO2结构,R3m空间群。3种样品的(108)/(110)和(006)/(102)两对峰分裂明显,说明均合成了纯相层状材料。用Jada6.0软件对3个样品进行精修计算,精修后的晶胞参数值列于表1。对于六方-NaFeO2结构,氧原子的最密堆积可认为是在[111]方向或[001]方向稍扭曲的面心立方结构,c/a值代表三角扭曲程度,如果立方结构不发生扭曲,则该理想立方结构的c/a值就为其值越大,说明层状结构越完整[17]。P2样品具有最大的c/a值(4.983 6),即具有更完整的层状结构,有序性更好。由于r(Ni2+)=0.069 nm与r(Li+)=0.076 nm很接近,所以Ni2+很容易进入Li层占据Li+位形成立方相NiO,阻碍Li+的扩散迁移,导致电性能恶化[18]。在XRD衍射谱中,(003)峰代表R3m层状结构,(104)峰代表R3m层状结构和Fm3m立方结构混合反射的总和,故I(003)/I(104)的比值被认为是反映Li+/Ni2+阳离子混排程度的重要指标[19],I(003)/I(104)值越大,阳离子混排程度越小。通常认为,I(003)/I(104)的比值大于1.2,则说明阳离子混排程度较小。由精修的晶胞参数数据可发现,3种样品的I(003)/I(104)的比值均大于1.2,且P2样品的值最大(1.4753),阳离子混排最小。氨水量对材料晶体结构的影响可归结于其对前驱体颗粒的影响,当合成体系中氨水量较多时,会导致过渡金属离子非均相沉淀,从而不利于材料中各组分的均一性[20];而当体系中氨水量较少时,会导致过饱和度太大,使晶核没有足够的时间长大并在晶格内进行定向排列,最终使得共沉淀颗粒晶体化程度较低。因此,只有当氨水量达到适中的比例时,制得的材料才具有稳定的晶体结构和较低的阳离子混排。
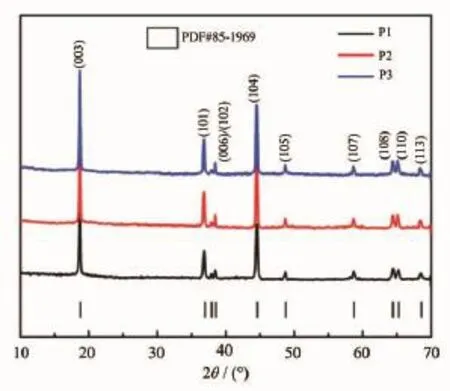
图1样品的XRD图Fig.1XRD patterns of the samples
图2 (a,b,c),(d,e,f),(g,h,i)分别为3种不同NH3·H2O用量条件下的前驱体SEM图。由图可看出当体系中氨水用量较高时(P1),制备得到的前驱体二次颗粒是由纳米片组成的微球形,如图2(a,b,c)所示;但随着体系中氨水用量的降低(P2),前驱体中的一次片状颗粒就逐渐向一次球状颗粒转变,如图2(d,e,f)所示,其前驱体中既有片状的一次颗粒也有球状的一次颗粒;随着氨水用量的进一步降低(P3),前驱体中的一次颗粒就完全变成了球状,如图2(g, h,i)所示。NH3·H2O用量对前驱体形貌和微观结构的影响可归结于体系中过饱和度的变化。当NH3· H2O用量较大时,整个共沉淀反应体系中过饱和度相对较低,降低了晶核的形成速度,保证了晶体足够的生长空间,且小粒子经溶解再沉积在大粒子上,使大颗粒继续长大,故一次颗粒生长成片状;而当NH3·H2O用量较小时,整个反应体系的过饱和度相对较高,形成很多细小的晶粒,细小晶粒的生长速度大于大晶粒,故大晶粒的生长速度反而降低了,使得一次颗粒变得细化,呈现为小球状。

表1 样品精修后的晶胞参数Table 1Refined lattice parameters of these samples

图2Ni1/3Co1/3Mn1/3CO3前驱体的SEM图Fig.2Low and high-magnification SEM images of the Ni1/3Co1/3Mn1/3CO3precursors
图3 (a,b,c),(e,f,g),(i,j,k)分别为P1、P2、P3样品的SEM图。由图可发现,制得的这3种样品都是由排布疏松的一次颗粒团聚而成的二次多孔微纳球形结构,大小在3~4 μm。P1样品的一次颗粒形貌与P2、P3样品略有不同,该样品一次颗粒为300 nm左右的纳米片,这与其前驱体中一次颗粒形貌有一定的延续性,而另外两样品为一次颗粒径约150 nm的类球形颗粒。一般认为,一次颗粒径越小,则Li+的扩散路径就越短。图3(d),(h)和(l)分别为这3种材料的N2吸脱附等温曲线,可发现均显示为典型的不可逆Ⅳ型吸附和H3滞后环,和文献中报道相似[21-22]。P1、P2和P3样品的比表面积分别为:8、12和11 m2·g-1,P2样品具有最大的比表面积。这种二次颗粒微纳多孔球结构有助于电解液在材料一次颗粒间的渗透,而较大的比表面积可提供更多的材料与电解液的接触面积,缩短离子/电子传输路径减少反应阻力,反应活性高,从而提高材料的倍率性能[14,23]。同时,由XRD精修结果可知P2样品的晶体层状结构最稳定,阳离子混排程度最低,再结合其最大的比表面积可合理地推断该材料的电化学性能应该最优异。
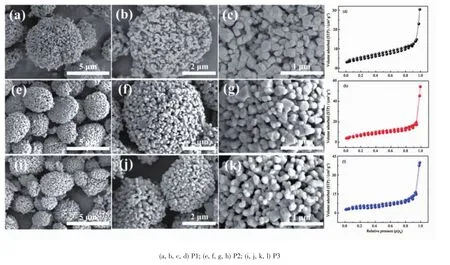
图3 样品的SEM图及N2吸附-脱附等温曲线Fig.3Low and high-magnification SEM images and N2adsorption-desorption isotherm of the samples
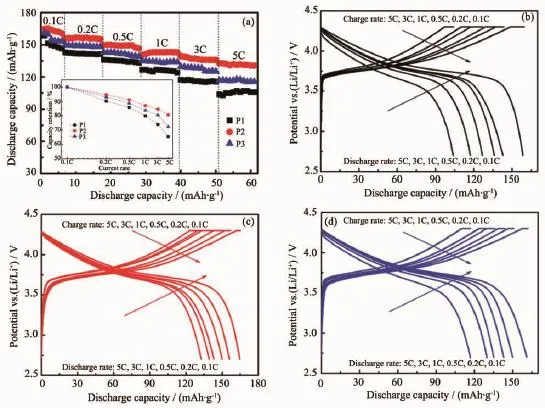
图4(a)样品在2.7~4.3 V的倍率循环性能图及不同倍率下的容量保持率(内嵌图);不同倍率下的充放电曲线图: (b)P1,(c)P2,(d)P3Fig.4(a)Rate capability of these samples between 2.7 and 4.3 V,and capacity retention at different rates(inset); Charge/discharge curves at different rates:(b)P1,(c)P2,(d)P3
图4 (a)给出了这3种样品在2.7~4.3 V下的倍率循环性能图。P2样品具有最佳的倍率循环性能和最高的放电比容量,在0.1C~5C时,其放电比容量分别为:165、157、150、143、138、132 mAh·g-1。内嵌图为这几种样品在不同倍率下的容量保持率,可发现P2样品的容量保持率最高,在0.2C、0.5C、1C、3C和5C相对于0.1C的容量保持率分别为:95.1%、90.9%、87.0%、83.9%和80.3%。倍率性能测试结果与前面的XRD研究相同,即P2材料的晶体层状结构在这3个样品中最稳定,阳离子混排也最小,则该样品相对于另外两样品而言,其晶体结构能承受更大电流而不被破坏,故而电性能最优。图4(b)、(c)和(d)分别为这3种材料在不同倍率下的充放电曲线图。随着倍率的增加,放电曲线变短、电压平台逐渐降低,其中P2样品的放电电压平台衰减最小,说明该电极材料的极化现象相对来说最不严重,材料晶体结构更加稳定。综合上述分析,可得出在本研究中碳酸盐共沉法体系的氨水用量比例控制在nNH3·H2O∶(nNi+nCo+nMn)=1∶2左右时,制得的材料晶体结构更加完整,电化学性能最优异。
图4的电化学性能结果表明P2样品具有最优异的倍率循环性能,故对此样品进行长循环性能和超高倍率性能测试。图5(a)为材料在2.7~4.3 V,1C下循环300次的情况。样品在首次的放电比容量为147 mAh·g-1,循环300次后的放电比容量为119 mAh·g-1,表现出优异的循环稳定性(容量保持率为81%)。更令人惊奇的是,相对应的中值电压保持率高达97%以上,基本没有衰减,充分证明了该材料的晶体结构十分稳定,不易发生晶型的不可逆转变(层状相立方相)[24]。另外,每一次充放电过程的库伦效率都是接近100%,说明电极材料的可逆性较好。图5(b)为材料的超高倍率性能测试。由图可看出样品在10C、20C、30C、40C、50C、60C、70C、80C、90C、100C的放电比容量分别为:119、108、100、93、87、81、76、70、64、56 mAh·g-1,表现出十分优异的超高倍率性能,具有应用于倍率型动力设备的前景,如电动工具、电动自行车以及纯电动(EVs)、可插电式混合动力(PHEVs)、混合动力(HEVs)汽车领域。图5(c)给出了样品在不同倍率下的放电曲线图,随着电流密度的增大,放电曲线变短,电压平台降低,说明极化现象随着倍率的增加而加剧。此样品的高倍率电性能优于文献中所报道的性能[25-27],其原因可归结于样品的一次纳米颗粒粒径小,可缩短离子/电子传输路径,提高反应效率,且二次颗粒微纳多孔球结构有助于电解液在材料一次颗粒间的渗透,增大电解液-电极材料接触面积,提供更多Li+活性位点,同时纳米孔也可起到纳米反应器的作用,缓冲由于Li+快速脱嵌过程中体积变化所产生的机械应力,保持纳米晶体结构单元的稳定性。图5(d)为纳米颗粒的TEM图,颗粒为类球形,边缘较圆润,颗粒径在150 nm左右,从HRTEM图可测出颗粒的晶格条纹间距为0.47 nm,与层状结构的(003)峰的晶面间距相一致[28]。
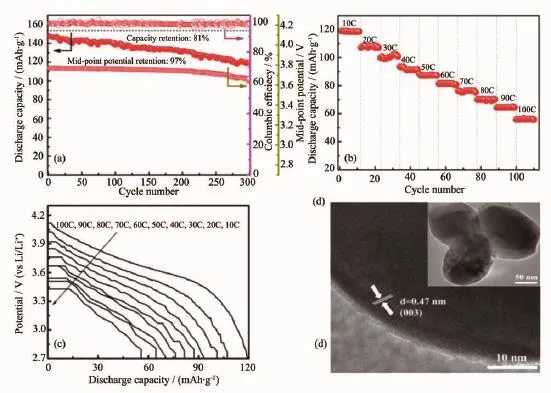
图5 P2样品:(a)在2.7~4.3 V,1C时的循环稳定性,库伦效率,中值电压;(b)超高倍率性能图;(c)不同倍率下放电曲线图;(d)TEM图Fig.5P2 sample of(a)long-term cycling performance,columbic efficiency,mid-point potential between 2.7 and 4.3 V at 1C; (b)ultra-high rate performance;(c)discharge curves at different rates(inset);(d)TEM image
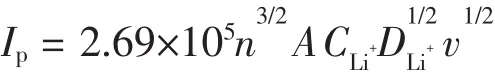
为了更进一步探索这3种样品电化学性能差异的原因,本实验采用循环伏安测试法(CV)对样品中Li+的脱/嵌反应做了相应测试。图6(a)(b)、(c)(d)和(e) (f)分别对应P1、P2和P3样品的情况。图6(a)、(c)和(e)呈现出典型的扩散控制反应,随着扫描速率的增加,氧化峰逐渐向高电位移动,还原峰逐渐向低电位移动。此外,随着扫描速度的增加,峰强值(Ip)也是逐渐增大的,并且氧化峰的Ip(cathodicpeaks)的峰强值始终比还原峰的Ip(anodepeaks)的峰强值要大一些,说明锂离子的嵌入和脱出动力学过程的不同。对于体相均一的体系,锂离子扩散系数可以由Randles-Sevcik公式[29-30]计算:在这里Ip为峰电流强度(mA),n为氧化还原电对的电子转移量(对于Li+为1),A为电极面积,CLi+为Li+在电极中的物质的量浓度(mol·cm-3),DLi+为Li+扩散系数(cm2·s-1),v为扫描速度(V·s-1)。P1、P2和P3样品的Li+的表观化学扩散系数通过Randles-Sevcik公式的dIp/dv1/2斜率计算拟合,分别如图6(b)、(d)和(f)所示。P1样品的DLi+扩散系数在脱出和嵌入时分别为9.38×10-9和4.48×10-9cm2·s-1,P2样品为8.84× 10-8和3.38×10-8cm2·s-1,P3样品为2.64×10-8和9.35×10-9cm2·s-1。P2样品具有最大的锂离子扩散系数,且该DLi+值相比于文献报道较好[31],这个结果与前面所述的电化学性能测试结果相吻合,同时也很好地解释了P2材料电化学性能优异的根本原因。

图6 不同扫描速度下的循环伏安(CV)图Fig.6Cyclic voltammogram(CV)curves at different scan rates
3 结论
NH3·H2O在共沉淀反应体系中会对颗粒的形貌、粒径、晶体结构以及电化学性能产生较大的影响,故本文采用碳酸盐共沉淀法通过调节NH3·H2O用量来实现可控制备超高倍率LiNi1/3Co1/3Mn1/3O2正极材料。研究结果表明,随着NH3·H2O用量的降低,一次颗粒形貌逐渐由纳米片状过渡到纳米球状,但材料的二次颗粒都是多孔微纳球形。在nNH3·H2O∶(nNi+ nCo+nMn)=1∶2时,样品具有最优异的循环稳定性和超高倍率性能,在1C下循环300次后,容量保持率为81%,中值电压基本无衰减(保持率为97%),在100C (18 Ah·g-1)时,放电比容量还能达到56 mAh·g-1。与此同时,CV测试结果也证明了nNH3·H2O∶(nNi+nCo+nMn) =1∶2材料具有较高的锂离子扩散系数(脱/嵌锂时分别为8.84×10-8和3.38×10-8cm2·s-1)。该NH3·H2O用量比例制得的材料电化学性能优异,尤其是超高倍率性能,有用于高功率型锂离子电池的前景,同时该NH3·H2O用量参数对于共沉淀法制备其他高倍率、高容量的材料具有一定的工艺参考价值。
[1]Tarascon J M,Armand M.Nature,2001,414(6861):359-367
[2]Manthiram A,Murugan A V,Sarkar A,et al.Energy Environ. Sci.,2008,1:621-638
[3]Dunn B,Kamath H,Tarascon J M.Science,2011,334(6058): 928-935
[4]HUA Wei-Bo(滑纬博),ZHENG Zhuo(郑卓),LI Long-Yan (李龙燕),et al.Acta Phys.-Chim.Sin.(物理化学学报), 2014,30(8):1481-1486
[5]Choi N S,Chen Z,Freunberger S A,et al.Angew.Chem. Int.Ed.,2012,51(40):9994-10024
[6]WANG Hai-Yan(王海燕),TANG Ai-Dong(唐爱东),HUANG Ke-Long(黄可龙),et al.Chinese J.Inorg.Chem.(无机化学学报),2008,24(4):593-599
[7]WEI Xuan-Ni(韦旋妮),LAI Qiong-Jie(赖琼钰),GAO Yuan (高媛),et al.Chinese J.Inorg.Chem.(无机化学学报), 2005,21(7):999-1003
[8]Yabuuchi N,Ohzuku T.J.Power Sources,2003,119-121(6): 171-174
[9]Gao P,Yang G,Liu H,et al.Solid State Ionics,2012,207(2): 50-56
[10]Lee M H,Kang Y J,Myung S T,et al.Electrochim.Acta, 2004,50(4):939-948
[11]Wang D,Belharouak I,Gary M K,et al.J.Mater.Chem., 2011,21(25):9290-9295
[12]Myung S T,Lee M H,Komaba S,et al.Electrochim.Acta, 2005,50(24):4800-4806
[13]Park S H,Oh S,Sun Y K.J.Power Sources,2005,146(1/2): 622-625
[14]Zheng Z,Guo X D,Chou S L,et al.Electrochim.Acta, 2016,191:401-410
[15]Liu Zhi-Min(刘智敏).Thesis for the Doctorate of Central South University(中南大学博士论文).2009.
[16]Yec C C,Zeng H C.J.Mater.Chem.A,2014,14(14):4843-4851
[17]Huang Z D,Liu X M,Oh S W,et al.J.Mater.Chem., 2011,21(29):10777-10784
[18]Cho Y,Oh P,Cho J.Nano Lett.,2013,13(3):1145-1152
[19]Conry T E,Mehta A,Cabana J,et al.Chem.Mater.,2012, 24(17):3307-3317
[20]Tan Xin-Xin(谭欣欣).Thesis for the Master of Central South University(中南大学硕士论文).2010.
[21]Wang F X,Xiao S Y,Chang Z,et al.Chem.Commun., 2013,49(80):9209-9211
[22]Zhang X J,Shi W H,Zhu J X,et al.Nano Res.,2010, 3(9):643-652
[23]Zheng Z,Wu Z G,Zhong Y J,et al.RSC Adv.,2015,5(47): 37330-37339
[24]Jung S K,Gwon H,Hong J,et al.Adv.Energy Mater.,2014, 4(1):94-98
[25]ZHANG Ji-Bin(张继斌),HUA Wei-Bo(滑纬博),ZHENG Zhuo(郑卓),et al.Acta Phys.-Chim.Sin.(物理化学学报), 2015,31(5):905-912
[26]Huang Z D,Liu X M,Zhang B,et al.Scripta Mater.,2011, 64(2):122-125
[27]HUA Wei-Bo(滑纬博),GUO Xiao-dong(郭孝东),ZHENG Zhuo(郑卓),et al.Chem.Res.Appl.(化学研究与应用), 2014,26(3):441-444
[28]Li J F,Xiong S L,Liu Y R,et al.Nano Energy,2013,2(6): 1249-1260
[29]Zhang T,Fu L J,Gao J,et al.J.Power Sources,2007,174 (2):770-773
[30]Cui L,Shen J,Cheng F,et al.J.Power Sources,2011,196 (4):2195-2201
[31]Wang L,Zhao J S,He X M,et al.Int.J.Electrochem.Sci., 2012,7(1):345-353
Controllable Preparation of Ultra-High Rate LiNi1/3Co1/3Mn1/3O2Cathode Through Carbonate Co-precipitation Method for Li-Ion Batteries
ZHENG Zhuo1HUA Wei-Bo2WU Zhen-Guo2XIANG Wei3ZHONG Ben-He2GUO Xiao-Dong*,2,4
(1Polymer Research Institute,Sichuan University,Chengdu 610065,China)
(2School of Chemical Engineering,Sichuan University,Chengdu 610065,China)
(3College of Materials and Chemistry&Chemical Engineering,Chengdu University of Technology,Chengdu 610065,China)
(4Institute for Superconducting and Electronic Materials,University of Wollongong,Wollongong NSW 2522,Australia)
The ultra-high rate nanostructured LiNi1/3Co1/3Mn1/3O2cathode is controllably prepared by the carbonate co-precipitation method through tailoring the amount of the NH3·H2O.The NH3·H2O has a great effect on morphology,particle size,crystal structure and electrochemical performance.Powder X-ray diffraction(XRD)and scanning electron microscopy(SEM)results indicate that the morphology of primary particle is changed from nano-plate to nano-sphere with the decreasing of the NH3·H2O,and the sample with ratio nNH3·H2O∶(nNi+nCo+nMn)= 1∶2 has the well-ordered-NaFeO2structure and the lowest cation mixing(Li+/Ni2+).Electrochemical results also confirm that the sample with ratio nNH3·H2O∶(nNi+nCo+nMn)=1∶2 has the best cycling stability and ultra-high rate capability.Specifically,it delivers a discharge capacity of 119 mAh·g-1between 2.7 and 4.3 V at 1C after 300 cycles with outstanding capacity retention of 81%,and the mid-point potential retention is 97%.This sample canstill deliver a high discharge capacity of 56 mAh·g-1even at the ultra-high rate 100C(18 mAh·g-1),which has the prospect to be applied in high power lithium ion battery.This nNH3·H2Oratio could provide some valuable reference for synthesizing other high-rate and high-capacity anode/cathode oxides.
lithium-ion battery;cathode material;carbonate co-precipitation method;ultra-high rate performance
O646.21
A
1001-4861(2017)02-0307-08
10.11862/CJIC.2017.010
2016-08-12。收修改稿日期:2016-10-15。
国家自然科学基金(No.21506133)和四川省科技支撑计划(No.2014GZ0077)资助项目。*
。E-mail:xiaodong2009@scu.edu.cn

