青梅果酒双酵母菌株混合发酵工艺优化
李艺勤,喻学淳,郑 蕾,袁华伟,蒋晓峰,胡永奇,沈才洪,,潘 明
(1.四川理工学院,四川 自贡 643000;2.泸州老窖股份有限公司,四川 泸州 646000;3.国家固态酿造工程技术研究中心,四川 泸州 646000)
青梅果酒双酵母菌株混合发酵工艺优化
李艺勤1,喻学淳2,3,郑 蕾2,3,袁华伟2,3,蒋晓峰2,3,胡永奇2,3,沈才洪1,2,3,潘 明1
(1.四川理工学院,四川 自贡 643000;2.泸州老窖股份有限公司,四川 泸州 646000;3.国家固态酿造工程技术研究中心,四川 泸州 646000)
以浓香型白酒发酵糟为微生物源,经青梅酒发酵试验,以酒精度和感官评价为指标,筛选出2株耐酸性好、发酵能力强的菌株,并对其进行分子生物学测序鉴定。鉴定结果表明,2株菌株均为酿酒酵母。根据2株酵母各自的发酵特性,采用双菌株混合发酵工艺进行青梅果酒的发酵。实验对菌种比例、接种量、碳源、pH值、温度共计5个涉及到青梅酒质量的主要工艺条件进行优化,确定优化后的青梅果酒发酵工艺为:以白砂糖﹕葡萄糖=4∶1(质量比)为混合碳源,初始pH值为5,混合酵母(10号酵母﹕16号酵母=3∶2,v/v),酵母接种量为4%,发酵温度为28 ℃,发酵7天后酒精度为12.5 %vol。与优化前相比,发酵周期缩短一半,青梅果香突出明显,酒体丰满,口感柔和,具有明显的果啤风味。
青梅果酒;混合发酵;工艺优化
引 言
青梅又名“酸梅”、“干枝梅”,是梅果子的统称,为蔷薇科樱桃属植物梅[1]。青梅原产我国,且是我国的一种特色资源,分布极为广泛,我国将青梅作为经济栽培作物而其他大部分国家和地区对青梅只是作为园林、园艺植物看待[2]。青梅不仅营养丰富,还具有许多保健功能,被国家卫生部正式列入“既是食品又是药品”的名单[3]。
在青梅的加工产品中,青梅酒作为一种比较新型的青梅产品,具有营养丰富、梅香浓郁、醇香可口等特点,还具有开胃生津、改善肠胃、延缓衰老、抗菌驱虫等保健作用,是一种良好的保健果酒[4]。目前青梅酒的发酵研究均是参照葡萄酒发酵工艺进行,所用菌种也来源于葡萄酒和啤酒生产的酵母[5],不能更好的体现青梅本身的风味。在果酒发酵中,酵母菌的作用对其风味的影响非常重要,因此筛选适用于青梅发酵的酵母菌是保证青梅果酒品质的关键因素[6]。
本研究从白酒酒糟中分离纯化得到20株酵母菌,从中筛选出适合于青梅果酒的酿酒酵母(10号与16号酵母菌),进行双菌株混合发酵。对所选菌株进行发酵工艺的优化,获得了风味表现良好的青梅原酒,为青梅果酒的发酵提供了一些技术参考。
1 材料与方法
1.1 材料与试剂
试验材料:冷冻新鲜青梅,实验室储存。青梅汁:新鲜青梅压榨取汁。白酒酒糟:取自四川省泸州市某酒厂。食用级白砂糖:深圳润友化学有限公司。食用级碳酸氢铵:成都仪科菌实验设备有限公司。
试验试剂:氢氧化钠、盐酸、丙三醇、酵母膏、蛋白胨、葡萄糖、琼脂。
基因组DNA快速抽提试剂盒(酵母):上海生工生物工程股份有限公司。
1.2 仪器设备
MLS-3751L-PC高压蒸汽灭菌锅(松下健康医疗器械株式会社),HZQ-X700C大型恒温振荡器(上海一恒科学仪器有限公司),SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司),98-1-C数显控温电热套(田径泰斯特仪器有限公司)、PHS-3C pH计(上海仪电科学仪器股份有限公司),UV-I800PC紫外可见分光光度计(上海美谱达仪器有限公司),DZKW-D-4电热恒温水浴锅(北京市永光明医疗仪器有限公司),SPX-150B生化培养箱(天津塞得利斯实验分析仪器制造厂),SIM-Q30UV实验室纯水系统(北京飞翔赛思科技有限公司)。
1.3 试验方法
1.3.1 酵母的分离纯化[7-8]
无菌条件下取适量的白酒酒糟加入无菌水中,用灭菌后的玻璃棒搅拌至样品彻底均匀悬浮,取1 mL悬浮液进行梯度稀释,然后将稀释液取适量涂布于PDA培养基(马铃薯葡萄糖琼脂培养基)上,于28 ℃培养箱中静置培养2~3 d,挑选目的菌落进行划线分离,每个样品挑取4~5株酵母菌,经过3次传代后获得纯种,接种于斜面上,随后用甘油管保存备用。
1.3.2 酵母菌的筛选
分别以1.3.1所保存的酵母菌为发酵菌种进行青梅果酒的初步发酵实验[9]。120 mL青梅浊汁用水稀释至800 mL,不添加其他物质改变其pH值,保持其自然pH值2.68,加入白砂糖控制其初始糖度为27%,接种不同的酵母菌种,接种量为2%,在28 ℃下发酵,12 d后进行感官评定,根据酒精度及感官评分选择合适的酵母菌种。
1.3.3 混合菌株的复配
将1.3.2选择的两株酵母菌各取一甘油管,在28 ℃下活化两小时,然后接种于YEPD培养基中,放入28 ℃培养箱中培养,将其制备成菌液浓度相同(3×107个/mL)的种子液。将两种种子液复配成不同比例的混合菌液,其中10号酵母菌种子液占混合菌液的体积比分别为20%、40%、60%、80%。接种混合菌液进行青梅果酒发酵,接种量为2%,其余发酵条件与1.3.2相同,12 d后进行感官评定,根据酒精度及感官评分选择合适的比例进行复配。
1.3.4 酵母菌的DNA鉴定[10-12]
将1.3.3中选择的两株酵母菌种经过四区划线法接种到YEPD培养基上28 ℃培养3 d,根据试剂盒的说明书提取基因组DNA,并进行PCR扩增。扩增引物为NL1:GCATATCAATAAGCGGAGGAAAAG,NL4:GGTCCGTGTTTCAAGACGG;PCR反应体系为:Template(基因组DNA20-50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,d NTP(各2.5 mM)1.0 μL,F(10 uM)、R(10 uM)各0.5 μL,酶0.2 μL,用双蒸水补齐至25 μL。PCR反应条件:94 ℃预变性4 min;94 ℃变性45 S,55 ℃退火45 S,72 ℃延伸60 S,30个循环;72 ℃修复延伸10 min,4 ℃保存。扩增产物由上海生工生物工程股份有限公司进行测序,将测序结果输入ww.NCBI.nlm.nih.gov利用BLAST软件,将测得的基因序列与Genbank数据库的序列进行同源性比较。用软件MEGA4.1进行序列分析,并采用Neighbor-Joining法进行系统发育分析,构建进化树。
1.3.5 发酵工艺的优化
1.3.5.1 碳源的种类选择[13]
以1.3.3选择的复配酵母为发酵菌种,分别以白砂糖、葡萄糖、果葡糖浆、麦芽糖为碳源,调整青梅汁初始糖度(以还原糖计)为27%,初始pH值为3.5,接种量为2%,温度为28 ℃,每天测定酒精度,酒精度达到要求后进行感官评定,根据试验数据确定较合适的发酵碳源。
1.3.5.2 混合碳源比例的选择
以1.3.3选择的复配酵母为发酵菌种,以1.3.5.1所选两种碳源的混合糖作为碳源进行发酵实验,按照0%、20%、40%、60%、80%、100%(其中一种占总混合糖的质量比)的不同比例调整青梅汁初始糖度(以还原糖计)为27%,初始pH值为3.5,接种量为2%,温度为28 ℃,每天测定酒精度,酒精度达到要求后进行感官评定,根据试验数据确定合适的碳源比。
1.3.5.3 酵母接种量的优化[14]
根据1.3.3选择的复配酵母为发酵菌种和1.3.5.2的混合碳源进行发酵实验,调整青梅汁初始糖度(以原糖计)为27%,初始pH值为3.5,按照1%、2%、3%、4%、5%的不同比例添加种子液,在28 ℃下进行发酵,每天测定酒精度,酒精度达到要求后进行感官评定,根据试验数据确定较适宜的接种量。
1.3.5.4 发酵温度的优化[15]
根据上述所确定的复配酵母、混合碳源、接种量进行发酵实验,调整发酵液初始糖度(以还原糖计)为27%,初始pH值为3.5,将发酵液置于12 ℃、16 ℃、20 ℃、24 ℃、28 ℃下进行发酵,每天测定酒精度,酒精度达到要求后进行感官评定,根据试验数据确定较适宜的发酵温度。
1.3.5.5 初始pH值的优化[16]
根据上述所确定的复配酵母、混合碳源和接种量和发酵温度进行发酵实验,调整发酵液初始糖度(以还原糖计)为27%,将发酵液的初始pH值分别调整为3、3.5、4、4.5、5,每天测定酒精度,酒精度达到要求后进行感官评定,根据试验数据确定合适的初始pH值。
1.3.6 感官评分标准
请5名评酒人员对青梅发酵原酒进行感官评定,评分标准见表1[16]。
2 结果与分析
2.1 酵母菌的筛选
用所筛选的20株酵母菌进行青梅果酒初发酵的酒精度和感官评价结果见表2。9号、18号的酒精度为0,表明其不能适应发酵液的低酸性环境,酵母菌无法正常生长并产生酒精;除9号、10号、15号、16号菌株酒精度可达到10 %vol以上外,其余菌株的酒精度均在10 %vol以下。在感官品评中发现,10号菌株发酵所得青梅酒口感丰富,甜酸平衡感好,但香气较淡,而16号菌株发酵所得青梅酒,果香味带着淡淡的发酵香气,香气丰富度较好,口感略差。综合两者结果可得,以10号和16号菌株进行复配,以期可以得到风味口感俱佳的青梅酒。
2.2 混合菌株的复配
将两株酵母菌进行不同比例的复配,所得青梅果酒的酒精度及感官评分结果见表3。不同比例下,酒精度均在12 %vol附近,差别不大。10号菌株所占比例越大,果香越浓郁,甜香感明显,口感圆润,16号菌株所占比例越大,发酵风味越明显,口感更为丰富。当复配比例为10号∶16号=6∶4时,果香与发酵香味达到很好地平衡,风味更具特色,酒体丰满,口感协调,青梅味突出,因此选择60%(10号菌株所占体积比)为酵母菌种的复配比例。

表1 青梅果酒的感官评分标准
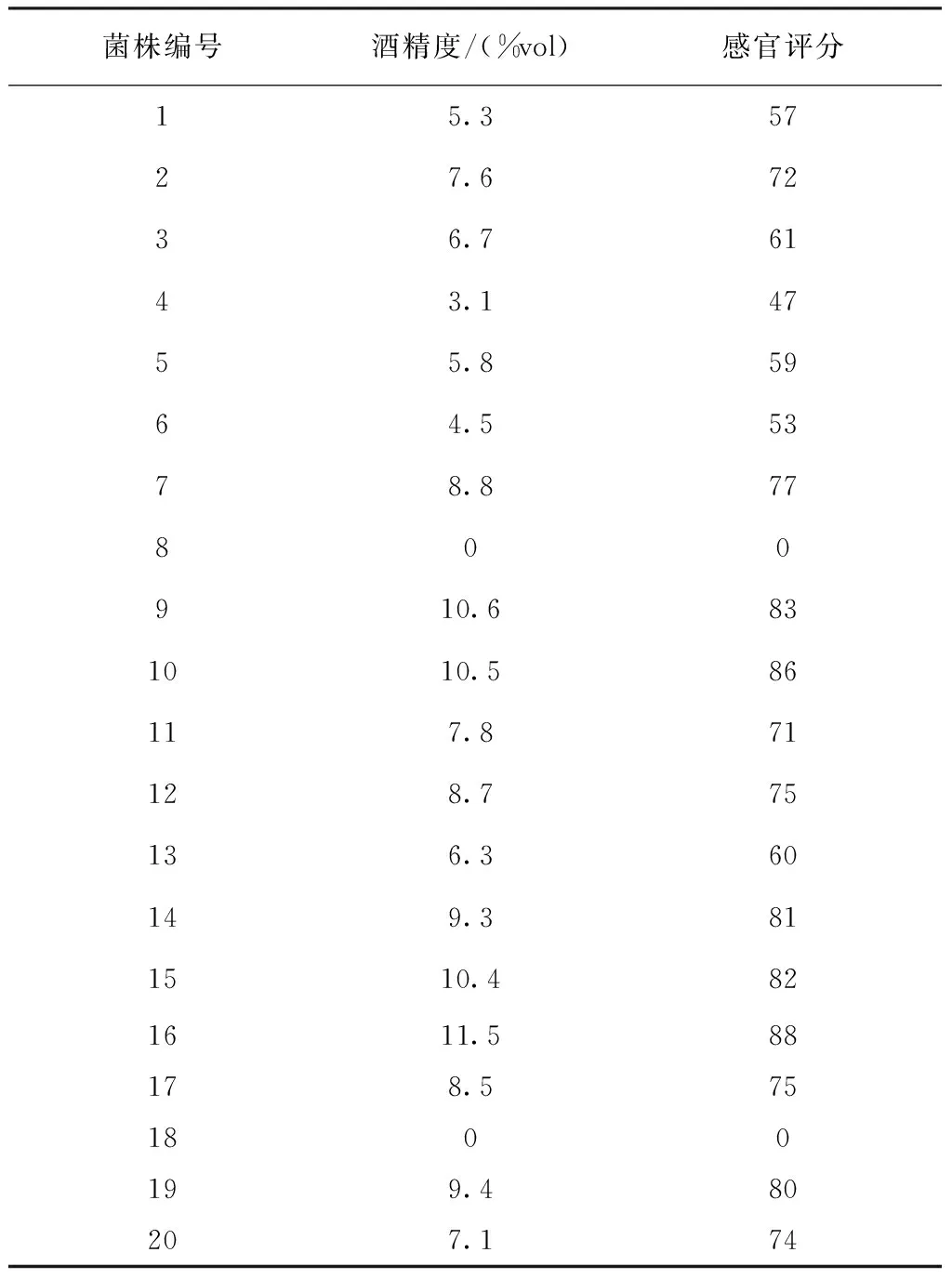
表2 不同酵母菌发酵青梅酒酒精度和感官评价结果
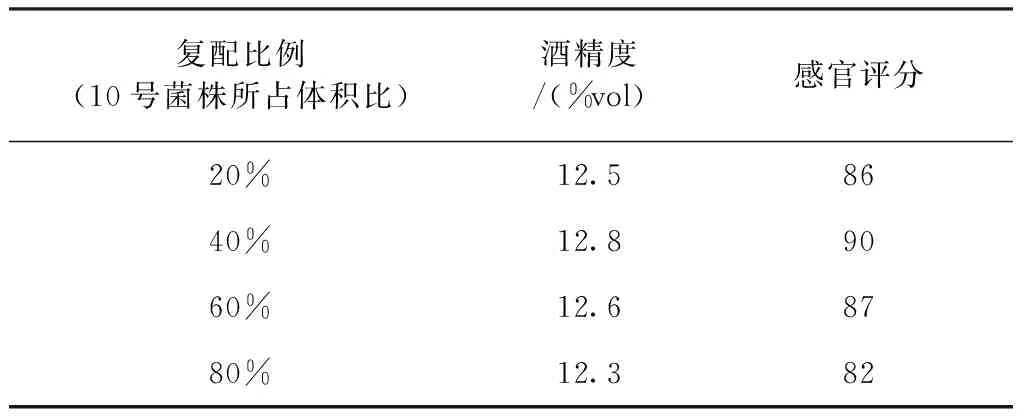
表3 不同比例下酵母菌发酵青梅果酒酒精度和感官评价结果
2.3 酵母菌的DNA鉴定

图1 两株酵母菌26S rDNA D1/D2可变区的PCR产物

图2 酵母菌基于26S rDNA D1/D2区序列的系统发育树注:IS269-1为10号酵母菌,IS269-2为16号酵母菌。
选取两株发酵效果最好的菌株提取基因组DNA,并以其为模板,对26S rDNA D1/D2可变区进行PCR扩增,由电泳结果图(图1)可知,提取的DNA样品都能被扩增DNA带,扩增片段在590 bp左右,由于是用正反双向测序的方法进行测序,两端的信号不稳定,会造成片段大小的差异。对获得的序列进行系统进化树构建(图2),选取的两株酵菌均为Saccharomyces cerevisiae类群,且其序列与GenBank中序列相似性均在100%,表明选取的两株酵菌与数据库中的序列有极高的相似性,并且它们之间的亲缘性非常近。鉴定发现选取的2株酵母均为为酿酒酵母(Saccharomyces cerevisiae)。
2.4 发酵工艺的优化
2.4.1 碳源种类的选择

图3 不同碳源发酵过程中酒精度的变化曲线
因青梅本身具有低糖高酸的特点,在其发酵过程中需补充碳源才能保证发酵的顺利进行,本实验选定白砂糖、葡萄糖、果葡糖浆、麦芽糖4种碳源进行发酵实验,结果如图3所示。由图3可知,发酵过程中酒精度逐渐上升,总体上,白砂糖为碳源时,酒精度上升速度最快,在第8天时达到12 %vol,但因其果香味淡,口感寡淡,发酵酒风味不佳,故选择另一种碳源与其进行混合发酵,以期改善其香气、口感。另外三种碳源整体发酵进程差别不大,且均在第7天达到最高,并保持不变,但葡萄糖作为碳源时,口感香甜,带有花香味,且酒度始终高于其余两种碳源,因此选择白砂糖和葡萄糖作为混合碳源。
2.4.2 混合碳源比例的优化
由图4可知,白砂糖所占比例越大,酒精度上升速度越快,其中40%与60%、80%与100%两两趋势相同,且80%与100%两条线几乎重合,酒精度整个过程基本保持一致。第4天开始,0%与20%两者的上升速度开始下降,与其他比例的差距渐渐拉大。白砂糖所占比例为80%时,发酵所得青梅果酒果香明显,青梅果酸味突出,口感最为协调,因此确定混合碳源的比例为白砂糖占混合碳源质量的80%。

图4 混合不同比例下发酵过程中酒精度的变化曲线注:0%、20%、40%、60%、80%、100%分别表示白砂糖占混合碳源的质量比。
2.4.3 酵母接种量的确定

图5 不同接种量下发酵过程中酒精度的变化曲线
由图5可知,接种量越多,酵母菌适应环境速度越快,酒精度上升速度越快,其中4%与5%两条线几乎重合,酒精度整个过程基本保持一致,在第6天时酒精度均为12 %vol,其后酒精度保持不变。2%与3%整体趋势相同,但3%接种量下的酒精度始终高于2%,且在第6天达到11.2 %vol,而接种量为2%的在第7天达到11.2 %vol。接种量为1%的发酵液在第3天开始,酒精上升速度开始减缓,与其他接种量的差距逐渐拉大,在第7天时,其发酵液酒精度仅为8.4 %vol,而其余发酵液酒精度均在11 %vol以上,其中以4%及5%酒精度最高。在4%的接种量下,酒精度的变化与5%差别较小,但其香气较5%要浓郁,且口感更为纯净,青梅果酸更明显,因此选择酵母菌的接种量为4%。
2.4.4 发酵温度的优化
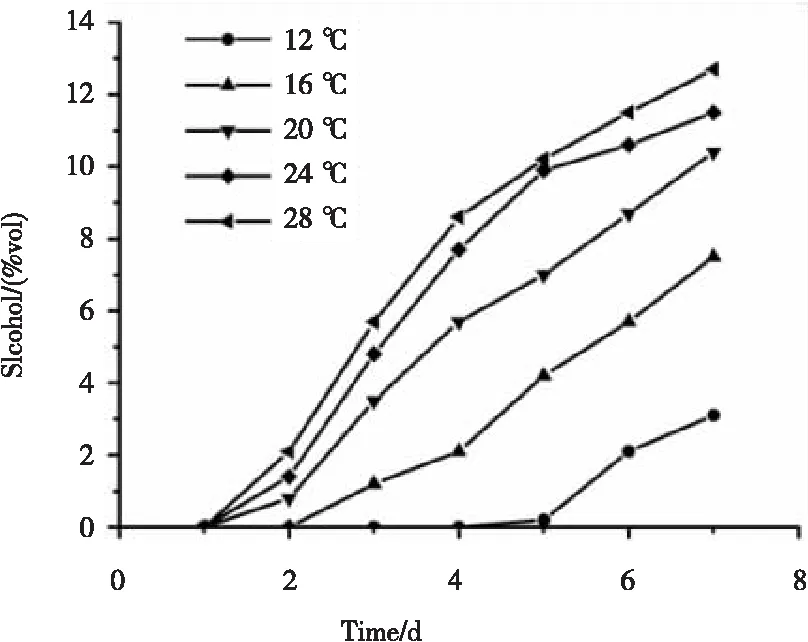
图6 不同温度下发酵过程中酒精度的变化曲线
由图6可知,随着发酵温度的升高,发酵液酒精度上升的速度越快,其中在24 ℃与28 ℃发酵温度下,两者酒精度的上升速度明显高于其他发酵温度。发酵温度在20 ℃时,酒精度稳步上升。12 ℃与16 ℃下酒精度增长缓慢,尤其在12 ℃下,酒精度在第4天才开始有所上升,说明混合酵母不适宜低温发酵,16 ℃下,酒精度在第2天后开始上升,酒精度增长较为缓慢。表明混合酵母在16 ℃~28 ℃下可以较好的生长并产生酒精,只是产酒速度存在差异。在前期实验中,研究发现,当其发酵温度超过28 ℃后,发酵过程中酒精易挥发带走部分香气,导致最终成品酒香气淡薄,口感寡淡,与李婀娜[13]、赵文红[17]等人的研究结果相同。发酵温度28 ℃时酒精度最高,达到了12.7 %vol,且其残糖量小,口感酸甜、平衡感较好,因此选择28 ℃为发酵温度。
2.4.5 初始pH值的确定
由图7可知,发酵过程中酒精度是逐渐上升的,总体上,初始pH值在4~5之间,酒精度上升曲线基本重合,而初始pH值为3及3.5时,酒度上升较慢,但初始pH值为3.5时,与4~5相差较小,且在第5天时与其他三条曲线重合,表明初始pH值在3.5~5之间时,对酒精度增长影响不大,并在第6天时酒精度达到12.5 %vol,其后不再上升,因此发酵可在第6天终止。在发酵过程中,发现pH值降至2.89时,混合酵母依然可以生长并产酒精,表明混合酵母耐酸性较好,且能够适应较广的酸性pH值范围。在整体感官上,初始pH值越大,香气舒适度越好,青梅风味越明显,越典型,口感上,初始pH值越小,青梅本身的酸味保留越多,酸度较大,酸甜平衡感略差,因此,初始pH值为5时,口感风味俱佳。
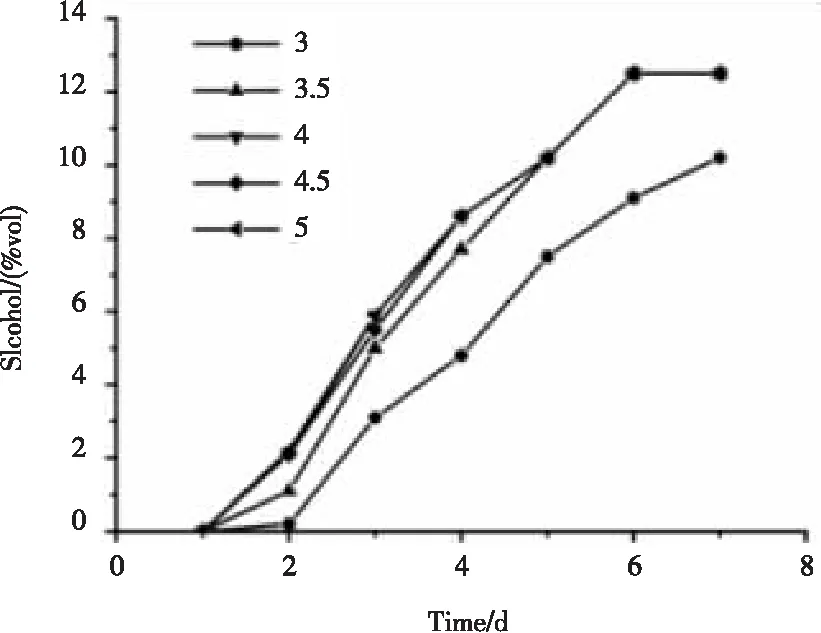
图7 不同初始pH值发酵过程中酒精度的变化曲线
3 结束语
以白酒酒糟为微生物源,经过青梅酒初发酵试验,以酒精度和感官评价为指标,筛选出2株耐酸性好、发酵能力强的酵母,其中10号菌株发酵所得青梅酒口感丰富,甜酸平衡感好,16号菌株发酵所得青梅酒,果香味明显,香气丰富度较好。以两株酵母菌作为菌种进行混合发酵,当种子液比例为10号酵母∶16号酵母=3∶2(v/v)时,所得青梅发酵酒青梅果香突出明显,酒体丰满,口感柔和,具有明显的果啤风味。
本研究对10号及16号酵母菌进行DNA的提取鉴定,结合26S rDNA D1/D2区序列相似性、系统发育树分析,结果表明,选取的两株酵菌为Saccharomyces cerevisiae类群,且其序列与GenBank中序列相似性均在100%,表明选取的两株酵菌与数据库中的序列有极高的相似性,并且它们之间的亲缘性非常近。
通过对发酵过程中的碳源和主参数(pH值、接种量、温度)进行优化,确定了青梅果酒发酵的优化工艺:以白砂糖:葡萄糖=4∶1(质量比)为混合碳源,初始pH值为5,混合酵母接种量为4%,发酵温度为28 ℃。在此优化条件下,青梅果酒发酵6天,酒精度达到12.5 %vol,青梅果香突出明显,酒体丰满,口感柔和。在优化的过程中发现,混合酵母在较大的温度范围及较广的酸性pH值范围下可以较好的生长并产生酒精,可以对酵母生长的pH、温度和产酒精的pH、温度进行进一步研究,并对本实验得到的两株酵母进行驯化,以得到能适应极端环境或变化较剧烈环境的菌种。
[1] 刘琼,张跃廷.青梅资源及其综合开发利用[J].酿酒,2001(6):68-69.
[2] 刘兴艳,蒲彪.我省青梅资源开发利用现状[J].四川食品与发酵,2004(4):21-23.
[3] 徐玉娟,肖更生,陈卫东,等.青梅的研究进展[J].食品工业科技,2005(1):185-187.
[4] 李海林,周建俭.青梅酒的生产工艺研究及产品的功能[J].中国酿造,2005(2):46-48.
[5] 李殿鑫,戴远威,姜文联.青梅的营养价值加工现状及发展前景[J].农产品加工:学刊,2012(8):110-112.
[6] 白卫东,沈颖,刘晓艳,等.青梅酒加工工艺及产品功能性研究进展[J].农产品加工:学刊,2013(4):10-12.
[7] 刘同杰,李云,吴诗榕,等.传统酸面团中细菌与酵母菌的分离与鉴定[J].现代食品科技,2014(9):114-120,148.
[8] 祝云飞,黄治国,邓杰,等.浓香型大曲中一株酵母菌的分离鉴定及其挥发性产物分析[J].四川理工学院学报:自然科学版,2016,29(1):7-12.
[9] 李艳,萧永坚,罗格罗.青梅果酒酵母的筛选与发酵工艺优化[J].酿酒科技,2016(2):65-68,71.
[10] 褚学英,惠丰立,李晓辉.大曲中主要酵母菌的分子鉴定[J].中国酿造,2008(5):27-29.
[11] 吕爱军,顾丹,胡秀彩,等.斑马鱼肠道中一株酵母菌菌株的鉴定与系统发育分析[J].菌物学报,2011(3):421-425.
[12] 李艾.耐高温酒精酵母的筛选及26SrDNA序列鉴定[J].唐山学院学报,2015(3):76-79,82.
[13] 李阿娜.青梅酒发酵工艺优化及发酵动力学研究[D].合肥:安徽农业大学,2010.
[14] 龚丽萍.发酵青梅酒的脱苦技术研究[D].四川:四川农业大学,2012.
[15] 叶倩雯.青梅酒发酵工艺研究及品质分析[D].广州:仲恺农业工程学院,2014.
[16] 钱敏,白卫东,沈棚,等.发酵型全果青梅酒的研制[J].中国酿造,2013(11):151-155.
[17] 赵文红,钱敏,白卫东,等.发酵青梅酒的研制[J].中国酿造,2009(1):164-166.
Study on the Optimization of Greengage Wine Fermentation Process by Two Strains of Yeast
LIYiqin1,YUXuechun2,3,ZHENGLei2,3,YUANHuawei2,3,JIANGXiaofeng2,3,HUYongqi2,3,SHENCaihong1, 2,3,PANMing1
(1.Sichuan University of Science & Engineering, Zigong 643000, China;2.LuzhouLaojiao Co., Ltd., Luzhou 646000, China;3.National Engineering Technology Research Center of Solid-state Brewing, Luzhou 646000, China)
Based on the fermented grains of Luzhou-flavor liquor as microbial source, according to the fermentation of greengage wine, two strains of yeast (acid proof and fast working strains) were selected with good alcohol accuracy and high scores of sensory evaluation, and carried on the molecular biology of sequencing identification. The identified results show that both of strains are saccharomyces cerevisiae. On the basis of their fermentation characters respectively, mixed fermentation of greengage wine with double strains was used. To optimize process conditions including fungus, carbon source, pH, inoculation quantity, temperature, and so on, greengage wine fermentation process optimization conditions were summed up as follows: white granulated sugar: glucose=4∶1 (mass ratio) for mixing carbon source, the initial pH value was 5, 4% mixed yeast (No.10 yeast∶No.16 yeast=3∶2, v/v) inoculation quantity, fermentation temperature was 28 ℃, the alcohol content was 12.5%vol after fermenting 6 days later. Comparing with previous process, greengage wine ,which the period of fermentation was shortened by half, was fresh plum aroma significantly, full-bodied, soft in texture, and obvious fruit beer flavor.
greengage wine; mixed fermentation; optimized process
2017-06-08
酿酒生物技术及四川省重点实验室项目(NJ2012-08)
李艺勤(1994-),女,湖北仙桃人,硕士生,主要从事果酒发酵方面的研究,(E-mail)492949482@qq.com; 潘 明(1966-),女,湖北麻城人,教授,博士,主要从事食品发酵工程方面的研究,(E-mail)panming106@163.com
1673-1549(2017)04-0010-07
10.11863/j.suse.2017.04.03
TB115
A

