多重微滴式数字PCR定量检测市售核桃乳中核桃、大豆源性成分
杨 硕,江 丰,刘 艳,李诗瑶,王鸣秋,马 弋,林 敏,张 莉*
多重微滴式数字PCR定量检测市售核桃乳中核桃、大豆源性成分
杨 硕,江 丰,刘 艳,李诗瑶,王鸣秋,马 弋,林 敏,张 莉*
(湖北省食品质量安全监督检验研究院,湖北 武汉 430000)
目的:为市售核桃乳中核桃源及主要掺杂物种大豆两种源性成分建立准确、快速定量检测方法。方法:从植物组织(核桃、大豆)或是植物蛋白饮料(核桃乳饮料)提取核酸后,主要采用多重微滴式数字聚合酶链式反应(polymerase chain reaction,PCR)技术,测算单位质量核桃和大豆的目的基因拷贝数比值,建立基因拷贝数与质量之间的关系,进而利用该比例关系换算出植物蛋白饮料中核桃和大豆的投料量,以实现对植物蛋白饮料中植物源性成分的定量检测。结果:基于多重微滴式数字PCR定量检测市售产品中大豆和核桃源性组分的方法,引物探针特异性好,目标物种间无交叉反应;灵敏度高,核桃中掺杂大豆的质量检测限为0.5%,相对误差为5.6%。将单一源性5 种不同质量下靶基因拷贝数之比与5 种不同比例混合源性靶基因拷贝数之比通过重复3 次检测,综合比较并拟合后得到单位质量下拷贝数(C大豆/C核桃=1.771 1)的换算比例值。在从商品超市中抽取的11 份不同品牌的核桃乳中(仅含核桃一种植物源成分),多重微滴式数字PCR方法检测显示:11 份样品均检出核桃源性成分,6 份样品检出大豆源性成分,其中4 份样品中大豆与核桃质量之比高于10%,判断存在掺杂使假;2 份样品大豆与核桃质量之比低于0.2%,极低的检出量推断为工艺沾染。结论:采用多重微滴式数字PCR准确、快速的定量方法可作为鉴别核桃乳中掺杂使假问题的有效手段。
核桃乳;多重微滴式数字PCR;投料比;掺杂使假
植物蛋白饮料天生具备的“天然、绿色、营养、健康”品类特征,符合饮料市场发展潮流和趋势,越来越受消费者喜爱,已经成为饮料市场上不可或缺的产品。2015年销量和销售额的年增长率分别达到21.6%和28%。预计到2019年,我国植物蛋白饮料市场规模将达到1 594亿 元左右。但随着市场需求激增和原料价格的上涨,部分生产企业为了减少生产成本,在植物蛋白饮料中掺入廉价的植物蛋白粉,或者掺入成本低廉的非产品标识的植物原料,以次充好、掺杂使假等问题日益突出,而食品安全监管检测机构缺乏对该类产品中掺杂物种的定量检测方法,使得植物蛋白饮料掺杂使假问题一直是行业监管难题[1]。目前关于食品中掺杂使假鉴定方法,国内文献记载较多的是蛋白质电泳技术、免疫学技术、色谱和质谱技术,以及基础分子生物学检测技术,但这些技术存在前处理复杂、自动化程度差、通量低、涉及多种生物学毒性试剂等缺陷,难以实现快速准确的食品质量安全监测[2]。数字微滴式聚合酶链式反应(polymerase chain reaction,PCR)技术,是在实时荧光PCR基础上发展起来的一种新的核酸检测及定量方法,它不依赖于标准曲线和参照样本,可直接测得样品中目标基因的绝对拷贝数,被称为“第3代PCR”技术[3-5]。目前已应用于微生物丰度检测[6]、病毒载量的绝对定量[7]、罕见基因突变检测[8],食品中源性成分鉴定[9]等方面,并且多项研究表明数字PCR方法比实时荧光PCR定量方法更方便、定量结果更准确、更灵敏[10-14]。鉴于此,该技术在食品安全检测领域中的应用潜力越来越受到关注,目前已有3 项出入境检验检疫行业标准制定计划项目获得立项并开展研究[15-17]。同时,基于多重微滴式数字PCR法的检测在转基因成分和动物源性成分定量中也有较成熟应用[18-19],但将多重微滴式数字PCR应用于植物蛋白饮料中植物源性成分检测,并利用本研究测定出的单位质量下靶基因拷贝数之比换算源性成分含量之比的定量检测研究内容尚属空白[20]。本研究以核桃乳为例,采用多重微滴式数字PCR技术,建立精准、快速的定量检测核桃乳产品中主要掺杂物种大豆[3]的实验方法,可作为现有方法技术之补充,为饮料行业食品安全监管提供技术支撑。
1 材料与方法
1.1 材料与试剂
核桃乳饮品由湖北省食品质量安全监督检验研究院在武汉市三家主流商超抽取的各品牌核桃乳(不含复合核桃乳饮料)共计11 批次。同时购买核桃、大豆、花生、芝麻、榛子、杏仁作为实验对照。
植物核酸提取试剂盒 美国Thermo Fisher公司;数字PCR实验用试剂、反应预混液、微滴发生油及相应耗材 美国Bio-Rad公司;琼脂糖凝胶 美国Sigma公司;PCR、实时荧光PCR实验用试剂、反应预混液、DNA Marker 天根生化科技(北京)有限公司;引物、探针 生工生物工程(上海)有限公司。
1.2 仪器与设备
Mag max96全自动核酸提取系统 美国Thermo Fisher公司;微滴式数字核酸检测分析系统、CFX96实时荧光定量PCR仪 美国Bio-Rad公司;核酸蛋白浓度测定仪 德国Qiagen公司。
1.3 方法
1.3.1 样品前处理
充分摇匀待检样品,吸取30~40 mL至离心管中,12 000 r/min离心3 min,弃上清液,留取100 mg沉淀待用。核桃乳产品基质性状较单一,通过离心沉淀组织耗时短,与下游的磁珠法提取核酸方法结合可在2 h内处理数10 份样品,且没有交叉污染风险。
将对照样品各取少量,充分碾碎,取100 mg组织放入离心管中,待用。
1.3.2 核酸提取
采用专用植物核酸提取试剂盒[21],全自动核酸提取设备提取基因组DNA,具体操作步骤参照相关试剂盒及设备使用说明书,根据实际情况略有调整。
1.3.3 DNA质量浓度测定
吸取DNA模板2.5 µL,放入核酸蛋白浓度测定仪中,测算质量浓度,质量浓度均在10~40 ng/µL,A260nm/A280nm在1.6~2.2之间,适宜后续实验。
1.3.4 定性PCR(通用ITS2基因扩增)验证模板质量
ITS是植物系统发育研究中应用最广泛的分子标记之一,大量国内外相关文献表明使用ITS2序列作为植物物种鉴定已十分成熟[22-24]。本实验采用ITS2通用引物参照文献[24],引物序列见表1,反应体系:PCR Mix(2×)12.5 μL,上游和下游引物各1.0 μL(10 μmol/L),模板DNA,加无菌双蒸水至25 μL。反应条件见表2。

表1 PCR引物及探针序列Table 1 Sequences of PCR primers and probes used in this study
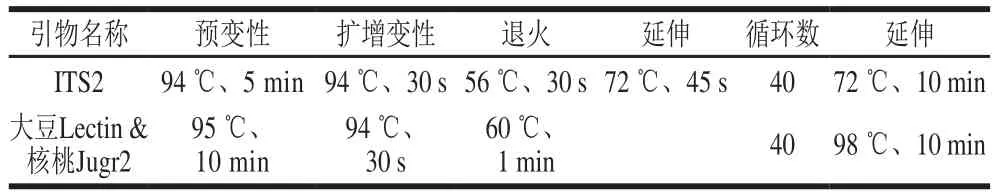
表2 PCR扩增反应条件Table 2 PCR reaction conditions
取6 μL PCR产物,在已加入Gelview的1.5%琼脂糖凝胶和1×TAE缓冲液中电泳40 min(100 V)。以600 bp ladder DNA Marker作为分子质量对照,于凝胶成像仪下观察结果。
1.3.5 特异性及检测限检测
分别提取大豆、花生、核桃、杏仁、榛子、芝麻6 种植物源基因组,用实时荧光PCR方法扩增大豆、核桃特异性靶标,靶标信息引用SN/T 1961.19—2013《出口食品过敏原成分检测 第19部分 实时荧光PCR方法检测大豆成分》[25]、SN/T 1961.2—2007《食品中过敏原成分检测方法 第2部分 实时荧光PCR方法检测花生成分》[26]、SN/T 1961.6—2013《出口食品过敏原成分检测 第6部分 实时荧光PCR方法检测胡桃成分》[27]、SN/T 1961.9—2013《出口食品过敏原成分检测 第9部分 实时荧光PCR方法检测杏仁成分》[28]、SN/T 1961.8—2013《出口食品过敏原成分检测 第8部分 实时荧光PCR方法检测榛果成分》[29]、SN/T 1961.12—2013《出口食品过敏原成分检测 第12部分 实时荧光PCR方法检测芝麻成分》[30]相关内容。
灵敏度检测两物种混合物中掺杂物种大豆源的检出水平。将大豆与核桃按质量0.1%~60%混合,实验重复3 次,测定该法的检测限。
1.3.6 单一源性和混合源性两物种单位质量基因拷贝数关系测算
分别称取大豆和核桃各5、10、20、40、60 mg,提取DNA后测得质量浓度上机检测拷贝数;将大豆按质量分数0.5%、1.0%、10%、30%、60%混合在核桃中,提取DNA后测得质量浓度上机检测拷贝数。将两组实验分别重复3 次,得出的大豆和核桃单位质量基因拷贝数之比(C大豆/C核桃),行F检验,比较两组拷贝数之比的差异性。
1.3.7 多重微滴式数字PCR检测并计算市售核桃乳中大豆源与核桃源成分投料比
采用多重微滴式数字PCR检测,适当调整扩增靶标的反应条件,由于所使用的数字PCR为双检测通道,在探针设计上,将核桃和大豆的报告基因分别采用FAM和HEX,猝灭基团BHQ标记。引物、探针序列见表1。
2 结果与分析
2.1 核桃乳产品的DNA提取效果及质量
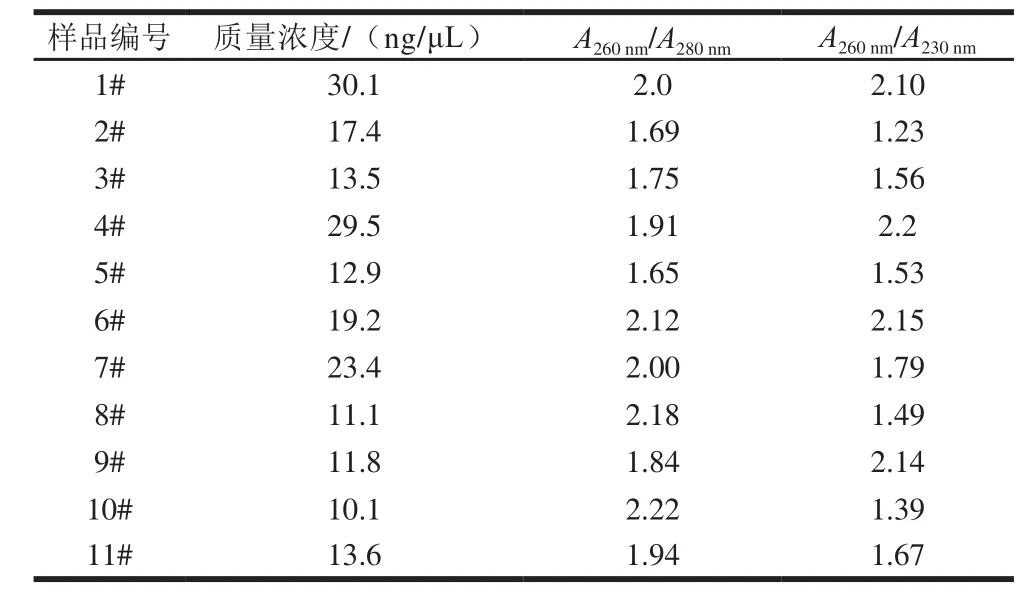
表3 DNA质量浓度测定及质控Table 3 DNA concentration and availability evaluation
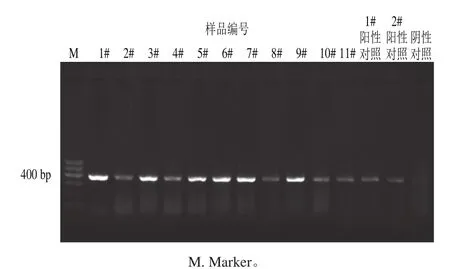
图1 11 份样品及阳性、阴性对照ITS2基因扩增结果Fig. 1 Electrophoresis images of ITS2 gene fragments amplified by PCR from 11 samples and positive and negative controls
核桃乳(露)中的DNA经过高温、高压、灭菌等多道加工工艺,核酸浓度和质量会受其影响,为保证下游实验有效性,对DNA模板进行质控十分必要。本实验采用植物通用引物扩增ITS2基因,判断模板质量可否满足实验条件。扩增前核酸浓度测定结果见表3,扩增结果显示:除阴性及空白对照外,所有样品均能扩增出380 bp的条带,如图1所示,提取的模板质量可适用后续实验。
2.2 引物探针特异性实验
实时荧光PCR对大豆和核桃靶基因扩增结果显示,核桃的引物探针特异性良好,核桃的引物探针只扩增出核桃源,且其他5 种源性均没有扩增,如图2所示。大豆的引物探针只对大豆有扩增,其余5 种源性均没有扩增,如图3所示。以上结果说明两组引物探针的特异性良好,可以用于后续的微滴式数字PCR定量检测实验。

图2 大豆引物、探针特异性实时荧光PCR检测Fig. 2 Specificity of soybean-specific primer and probe set used in real-time PCR

图3 核桃引物、探针特异性实时荧光PCR检测Fig. 3 Specificity of d walnut-specific primer and probe set used in real-time PCR
2.3 大豆和核桃单一源性质量与拷贝数的关系
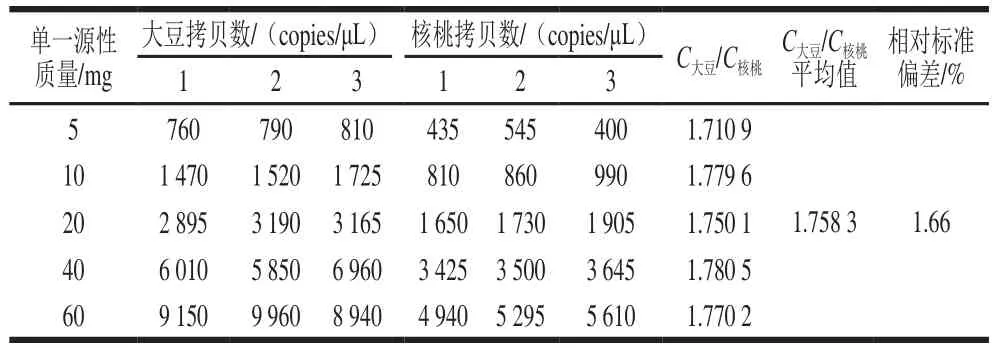
表4 单一源性不同质量与拷贝数关系Table 4 Relationship between the mass of pure samples of each species and gene copy number
为考察大豆、核桃的单位质量与拷贝数之间的关系,分别提取5 个不同质量梯度(5~60 mg)的大豆和核桃DNA。将提取的DNA进行微滴数字PCR检测基因拷贝数,以水为空白对照。由表4可以看出,大豆和核桃质量与拷贝数之间均呈明显线性关系。且根据5 个质量梯度计算出C大豆/C核桃平均值为1.758 3,相对标准偏差为1.66%,C大豆/C核桃的稳定性较高(表4)。线性拟合后C大豆/C核桃为156/88.08=1.771 1(图4)。
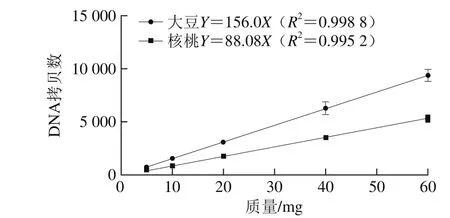
图4 线性拟合后单位质量大豆和核桃基因拷贝数之比Fig. 4 Linear curves of gene copy number against mass of soybean and walnut
2.4 两物种混合源性单位质量基因拷贝数关系及差异性比较
数字PCR分别检测大豆含量为0.5%、1%、10%、30%和50%的5 个样品中大豆和核桃基因拷贝数,进一步验证C大豆/C核桃的准确性和稳定性。表5显示,5 个不同大豆含量混合样品的C大豆/C核桃平均值为1.787 7,相对标准差为3.86%(表5)。将单一源性(表4)和混合源性(表5)的单位质量大豆与核桃基因拷贝数之比的两组数据行t检验双样本等方差假设(F检验显示方差齐),P值为0.405 0,说明C大豆/C核桃在单一源性和混合源性检测中没有显著差异。因此,在本实验后期待测样品检测中应用线性拟合后的C大豆/C核桃为1.771 1,用于换算源性成分投料比。

表5 混合源性样品中质量比与拷贝数关系Table 5 Relationship between the proportion of soybean added to walnut and gene copy number

表6 微滴检测结果Table 6 DNA copies detected by ddPCR
2.5 定量检测样品中核桃、大豆含量的多重微滴式数字PCR结果
分别对市售11 份纯核桃乳及大豆、核桃单一源、混合源质控样本采用数字PCR检测靶基因拷贝数,质控多重微滴式数字PCR结果见图5。样品检测结果显示:在抽检的11 份核桃乳中,均检出核桃成分,与产品标签信息吻合(图6),但有4 份检出一定比例的大豆成分(图7),而产品标签上未标示有大豆,说明该4 份产品实为核桃、大豆混合产品,进一步表明核桃乳产品中存在掺杂使假情况。两种源性基因浓度及利用上述拷贝数关系(C大豆/C核桃)为1.771 1比值换算投料比结果详见表6。
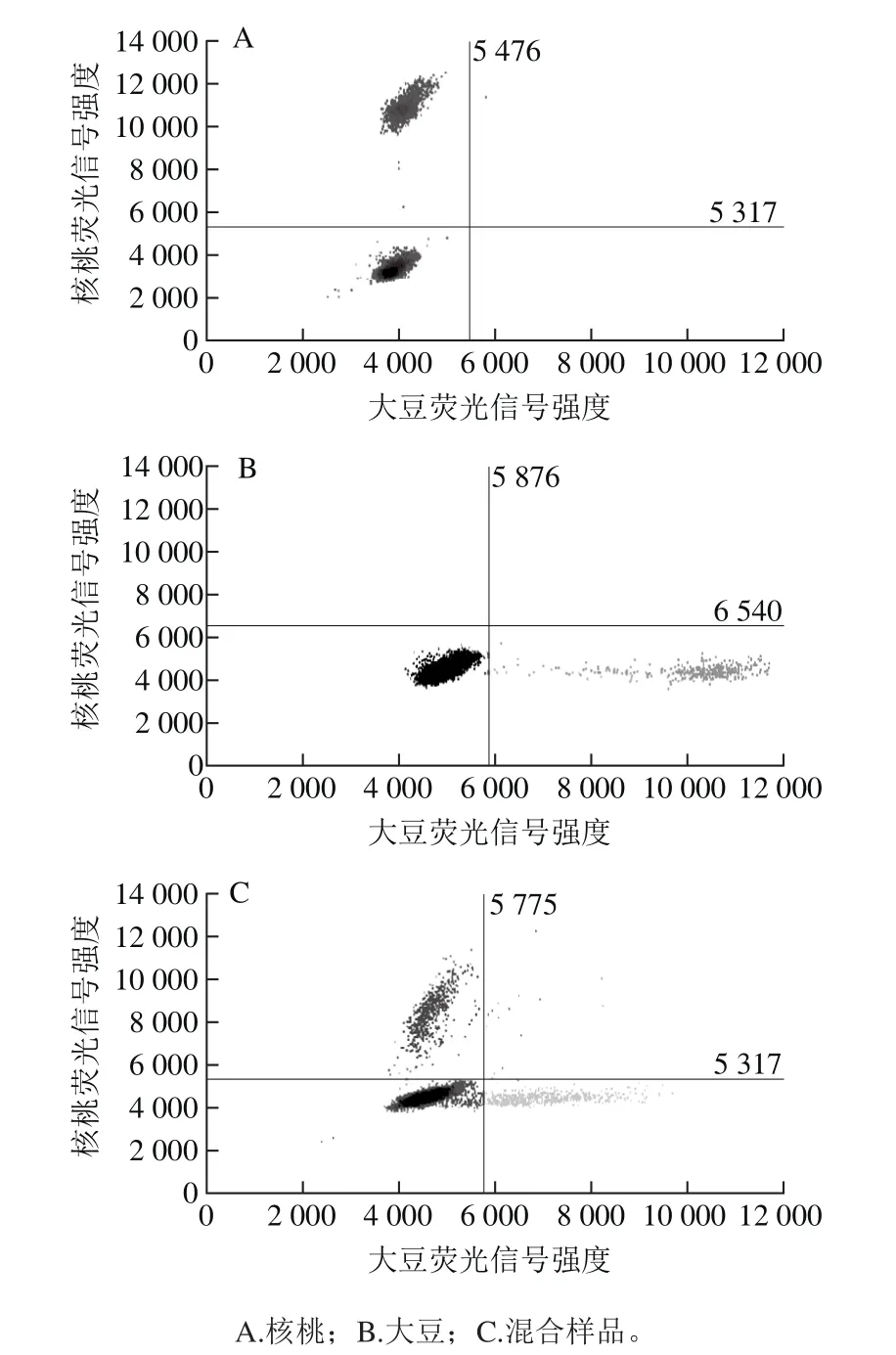
图5 多重数字PCR检测引物特异性Fig. 5 Specificity of primer and probe set used in 2D-ddPCR
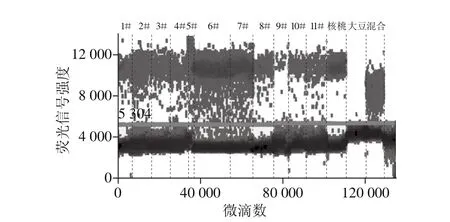
图6 1#~11#样品检出核桃阳性微滴一维图Fig. 6 ddPCR detection of walnut-derived ingredients in 11 samples

图7 1#~11#样品检出大豆阳性微滴一维图Fig. 7 ddPCR detection of soybean-derived ingredients in 11 samples
3 讨 论
作为绝对定量检测方法,多重微滴式数字PCR技术已经为食品安全定量检测带来全新的解决方案,其在食品安全检测领域产生的影响逐渐开始显现[5]。鉴于多重微滴式数字PCR方法是在同一个PCR反应中完成多个靶标基因拷贝数的检测,因此,靶标基因拷贝数比值既不受模板DNA量和PCR反应抑制物等的影响,也不受样品DNA降解和PCR扩增效率等的影响[20,31],在成分定量检测准确性方面比单重数字PCR方法更高[18]。在本研究中,通过采用多重微滴式数字PCR技术检测5 个不同大豆含量与固定核桃含量混合样品中的拷贝数比值发现:单位质量下C大豆/C核桃平均值为1.787 7,相对标准偏差为3.86%,从而建立了核桃中掺杂大豆的精准定量检测方法。
将多重微滴式数字PCR技术应用于植物蛋白饮料中植物源性成分分析检测对比现有方法有以下优点:第1,与特征性蛋白(蛋白质电泳技术、免疫学技术、色谱和质谱技术全部是基于特异性蛋白)检测相比较,更基本、更稳定、更灵敏的基因水平的检测更适用于深加工、低丰度的饮料类终端产品[32-34];第2,基于先进的数字PCR技术高灵敏度和特异性,尤其在本研究中,多重微滴式数字PCR测定核桃、大豆的靶基因浓度,使用的是同一个DNA样品、反应体系和反应条件,因而误差更小,定量结果更加接近真值;第3,在区分食品中非标示物种源性的检出是有意掺假还是无意沾染的问题上,定量PCR无法提供有效的解决办法,而数字PCR则可以通过对源性成分的拷贝数进行绝对定量,并依据拷贝数含量与质量的相关性,估算源性成分的质量比,从而可以将有意掺假和无意沾染区分开来[20,35]。在本研究中,同时检测两种植物源性各自的靶基因拷贝数,再综合基因拷贝数与质量之间的换算关系,即可直观判断一份产品中两者的质量比例关系。
另外,相比较与其他食品的基质特点,植物蛋白饮料类产品的核酸提取难度更甚。原因一是在生产加工过程中,各种工业化处理对植物原料的遗传物质破坏影响较大,二是产品本身含水量高,实质内含物占比低,这进一步稀释了核酸浓度,加大了提取的难度[36]。然而优质的DNA模板质量是保证下游实验有效性的关键,所以在本研究前期预实验中,专门比较摸索3 种主流的DNA提取方法,比较结果表明,针对植物蛋白饮料核酸提取达到最优效果的是专用植物核酸提取试剂与磁珠法提取核酸结合运用。饮料原液经高速离心得到的沉淀与专用裂解液充分混合,裂解液裂解细胞壁及细胞膜使核酸暴露到细胞外。加入磁珠并充分混合使核酸与磁珠结合,适时添加磁场,从而使核酸与体系中的其他成分分离。利用清洗液清洗,去除体系中的盐、蛋白质等杂质。最后利用洗脱液将结合到磁珠上的核酸重新溶解。该法具有简便、高效的特点,可在液体工作站上实现完全自动控制。特别适合食品安全监管中大批量检测的对高通量技术的要求。
表6和图7显示,在两份样品中各检出1 个大豆阳性微滴信号,低于该方法检测限,考虑为仪器噪声或实验操作原因,也可能是产品生产过程中的无意沾染,而带入的极低含量大豆。由于数字PCR的极高灵敏度,在本研究中有6 份样品显示检出大豆阳性微滴,而相比较与其中4 份样品中大豆核桃质量比值均在10%以上的情况,2 份样品的大豆核桃质量比低于0.2%,极显著低于前者,考虑到目前掺假行为多是经济利益驱动型掺假,掺杂含量较高,因此,当极低的核酸拷贝数检出时考虑为生产环节无意沾染而非恶意掺杂使假。
综上,本研究可作为核桃乳中掺入大豆源性定量检测的有效方法,也可为其他与食品鉴伪相关的方法研究提供参考依据。
[1] 钟其顶, 王道兵, 李国辉. 稳定碳同位素技术在苹果醋饮料掺假鉴别中的应用初探[J]. 饮料工业, 2016, 19(4): 14-17. DOI:10.3969/ j.issn.1007-7871.2016.04.005.
[2] 金萍, 丁洪流, 李培, 等. 2013年苏州地区肉及其制品掺假情况调查[J]. 中国食品卫生杂志, 2014, 26(2): 168-172. DOI:10.13590/ j.cjfh.2014.02.016.
[3] 魏晓璐, 黄鑫, 冯悦, 等. 核桃乳(露)饮品中花生、大豆成分的PCR检测方法[J]. 食品工业科技, 2014, 35(13): 288-295. DOI:10.13386/ j.issn1002-0306. 2014.13.054.
[4] 任君安, 黄文胜, 葛毅强, 等. 肉制品真伪鉴别技术研究进展[J].食品科学, 2016, 37(1): 247-257. DOI:10.7506/spkx1002-6630-201601043.
[5] 刘津, 刘二龙, 谢力, 等. 数字聚合酶链式反应技术在食品安全检测领域的研究应用进展[J]. 食品科学, 2016, 37(17): 276-281. DOI:10.7506/spkx1002-6630-201617046.
[6] DREO T, PIRC M, RAMSAK Z, et al. Optimising droplet digital PCR analysis approaches for detection and quantification of bacteria: a case study of fire blight and potato brown rot[J]. Anal Bioanal Chemistry, 2014, 406(26): 6513-6528. DOI:10.1007/s00216-014-8084-1.
[7] WHITE R A, QUAKE S R, CURR K. Digital PCR provides absolute quantitation of viral load for an occult RNA virus[J]. Journal of Virologic Methods, 2012, 179(1): 45-50. DOI:10.1016/ j.jviromet.2011.09.017.
[8] 冯兆民, 舒越龙. 数字PCR技术及其应用进展[J]. 病毒学报, 2017, 33(1): 103-107. DOI:10.13242/j.cnki.bingduxuebao.003088.
[9] FLOREN C, WIEDEMANN I, BRENIG B, et al. Species identification and quantification in meat and meat products using droplet digital PCR (ddPCR)[J]. Food Chemistry, 2015, 173: 1054-1058. DOI:10.1016/ j.foodchem.2014.10.138.
[10] 王珊, 李志娟, 苗丽. 微滴式数字PCR与实时荧光PCR检测羊肉制品中羊源和猪源性成分方法的比较[J]. 肉类工业, 2015(7): 38-41. DOI:10.3969/j.issn.1008-5467.2015.07.012.
[11] BOSMAN K J, NIJHUIS M, VAN HAM P M, et al. Comparison of digital PCR platforms and semi-nested qPCR as a tool to determine the size of the HIV reservoir[J]. Scientific Reports, 2015, 5: 13811. DOI:10.1038/srep13811.
[12] LUN F M F, CHIU R W K, ALLEN CHAN K C, et al. Microfluidics digital PCR reveals a higher than expected fraction of fetal DNA in maternal plasma[J]. Clinical Chemistry, 2008, 54(10): 1664-1672. DOI:10.1373/clinchem.2008.111385.
[13] MA J, LI N, GUARNERA M, et al. Quantification of plasma miRNAs by digital PCR for cancer diagnosis[J]. Biomark Insights, 2013, 8: 127-136. DOI:10.4137/bmi.s13154.
[14] WHITE R A, BLAINEY P C, FAN H C, et al. Digital PCR provides sensitive and absolute calibration for high throughput sequencing[J]. BMC Genomics, 2009, 10: 116. DOI:10.1186/1471-2164-10-116.
[15] 中国检验检疫科学研究院. 转基因大米定量检测[EB/OL]. (2015-10-20) [2015-10-20]. http://sn2.cnca.cn/standard/loginInform/zqyj_ lojin_other.jsp.
[16] 深圳市出入境检验检疫局. 转基因玉米成分定量检测微滴式数字PCR方法[EB/OL]. (2015-11-19) [2015-11-19]. http://sn2.cnca.cn/ standard/loginInform/zqyj_lojin_other.jsp.
[17] 国家认监委办公室. 国家认监委办公室关于下达2015年第三批SN制(修)订计划项目的通知[EB/OL]. (2016-03-01) [2016-03-01]. http://sn2.cnca.cn/standard/gl/informMessageAction!lookInform. action?infoId=859.
[18] 潘广, 章桂明, 黄新, 等. 应用双重数字PCR对转基因玉米成分进行定量方法研究[J]. 植物检疫, 2016, 30(3): 65-71.
[19] 胡佳莹, 姜羽, 杨立桃. 利用QuantStudioTM3D数字PCR分析转基因玉米MON863含量[J]. 农业生物技术学报, 2016, 24(8): 1216-1224. DOI:10.3969/j.issn.1674-7968.2016.08.013.
[20] 潘广, 程颖慧, 黄新, 等. 转基因玉米品系GA21拷贝数百分含量与质量百分含量关系研究[J]. 植物检疫, 2016, 30(6): 49-54.
[21] 赵宏群, 卢昕, 逄波. 高通量半自动细菌核酸提取与纯化体系的构建[J]. 疾病监测, 2016, 31(3): 256-259. DOI:10.3784/ j.issn.1003-9961.2016.03.017.
[22] PARVATHY V A, SWETHA V P, SHEEJA T E, et al. Detection of plant-based adulterants in turmeric powder using DNA barcoding[J]. Pharmaceutical Biology, 2015, 53(12): 1774-1779. DOI:10.3109/1388 0209.2015.1005756.
[23] COGHLAN M L, HAILE J, HOUSTON J, et al. Deep sequencing of plant and animal DNA contained within traditional Chinese medicines reveals legality issues and health safety concerns[J]. PLoS Genet, 2012, 8(4): e1002657. DOI:10.1371/journal.pgen.1002657.
[24] KUZMINA M L, JOHNSON K L, BARRON H R, et al. Identification of the vascular plants of Churchill, Manitoba, using a DNA barcode library[J]. BMC Ecology, 2012, 12: 25. DOI:10.1186/1472-6785-12-25.
[25] 国家质量检验监督总局. 出口食品过敏原成分检测 第19部分 实时荧光PCR方法检测大豆成分: SN/T 1961.19—2013[S]. 北京: 中国标准出版社, 2013.
[26] 国家质量检验监督总局. 食品中过敏原成分检测方法 第2部分 实时荧光PCR方法检测花生成分: SN/T 1961.2—2007[S]. 北京: 中国标准出版社, 2007.
[27] 国家质量检验监督总局. 出口食品过敏原成分检测 第6部分 实时荧光PCR方法检测胡桃成分: SN/T 1961.6—2013[S]. 北京: 中国标准出版社, 2013.
[28] 国家质量检验监督总局. 出口食品过敏原成分检测 第9部分 实时荧光PCR方法检测杏仁成分: SN/T 1961.9—2013[S]. 北京: 中国标准出版社, 2013.
[29] 国家质量检验监督总局. 出口食品过敏原成分检测 第8部分 实时荧光PCR方法检测榛果成分: SN/T 1961.8—2013[S]. 北京: 中国标准出版社, 2013.
[30] 国家质量检验监督总局. 出口食品过敏原成分检测 第12部分 实时荧光PCR方法检测芝麻成分: SN/T 1961.12—2013[S]. 北京: 中国标准出版社, 2013.
[31] MORISSET D, STEBIH D, MILAVEC M, et al. Quantitative analysis of food and feed samples with droplet digital PCR[J]. PLoS One, 2013, 8(5): e62583. DOI:10.1371/journal.pone.0062583.
[32] 张敬敬, 宋合兴, 刘博, 等. 核桃乳中掺大豆乳的鉴别研究[J]. 现代食品科技, 2013, 29(4): 881-884. DOI:10.13982/j.mfst.1673-9078.2013.04.042.
[33] 夏君霞, 房明虎, 王俊转, 等. 鉴别核桃饮料产品中添加其它坚果的研究[J]. 饮料工业, 2015, 18(2): 26-29. DOI:10.3969/ j.issn.1007-7871.2015.02.010.
[34] 李克宏, 白彦坤, 周巍, 等. 高效毛细管电泳检测植物蛋白食品中的特征蛋白质[J]. 食品科学, 2014, 35(12): 124-127. DOI:10.7506/ spkx1002-6630-201412024.
[35] 任君安, 邓婷婷, 黄文胜, 等. 微滴式数字聚合酶链式反应精准定量检测羊肉中掺杂猪肉[J]. 食品科学, 2017, 38(2): 311-316. DOI:10.7506/spkx1002-6630-201702049.
[36] 任君安, 王国兰, 程曦, 等. 果蔬汁饮料DNA提取方法的比较研究[J]. 食品科技, 2013, 38(2): 42-45. DOI:10.13684/j.cnki. spkj.2013.02.043.
Duplex Digital Droplet PCR for the Determination of Walnut-Derived and Soybean-Derived Ingredients in Walnut Protein Drink
YANG Shuo, JIANG Feng, LIU Yan, LI Shiyao, WANG Mingqiu, MA Yi, LIN Min, ZHANG Li*
(Hubei Provincial Institute for Food Supervision and Test, Wuhan 430000, China)
Objective: The aim of this study was to establish a new method for the rapid and accurate quantification of walnut-derived ingredients and adulterated ingredients, mainly derived from soybean, in commercial walnut beverage using droplet digital polymerase chain reaction (ddPCR). Methods: This method was based on the ratio between the numbers of target gene copies per unit mass of walnut and soybean, which could represent the relationship between gene copy number and the mass of plant materials. The soybean lectin gene and the walnut Jugr2 gene were chosen as the target genes according to the commercial inspection standard SN/T 1961-2013. The specificity of the assay was evaluated by testing DNA from six different species using the species-specific primers and probes. The results showed that there was no crossreaction among the target species and high sensitivity was observed. The ddPCR assay showed a limit of detection (LOD) for added soybean-derived ingredients in walnut protein drink was 0.5% with a relative error of 5.6%. The ratios of target gene copy numbers between soybean and walnut in pure samples of five different masses and between the two species in five mixtures with different proportions were determined three times, and the experimental data were fitted to a linear equation to calculate the ratio between gene copy numbers per unit mass soybean and walnut (Csoybean/Cwalnutratio = 1.771 1). Furthermore, we applied this method to test 11 commercial brands of walnut beverage, and it turned out that walnut-derived ingredients were detected in all these samples and 6 of them were found to also contain soybean-derived ingredients, out of which 4 were adulterated with more than 10% soybean and the others contained as low as 0.2% soybean, which may be unintentionally incorporated during the production process. Conclusion: The ddPCR assay can provide a rapid and accurate quantitative method for the identification of adulterated walnut beverage.
10.7506/spkx1002-6630-201716045
R155
A
1002-6630(2017)16-0280-07
2017-01-17
湖北省食品质量安全监督检验研究院自主立项科研项目(ZZLX2016009)
杨硕(1985—),女,工程师,硕士,研究方向为食品质量安全检测。E-mail:shuoshuo2015@foxmail.com
*通信作者:张莉(1978—),女,高级工程师,硕士,研究方向为食品质量安全检测与管理。E-mail:siyi-541@163.com
杨硕, 江丰, 刘艳, 等. 多重微滴式数字PCR定量检测市售核桃乳中核桃、大豆源性成分[J]. 食品科学, 2017, 38(16): 280-286. DOI:10.7506/spkx1002-6630-201716045. http://www.spkx.net.cn
YANG Shuo, JIANG Feng, LIU Yan, et al. Duplex digital droplet PCR for the determination of walnut-derived and soybeanderived ingredients in walnut protein drink[J]. Food Science, 2017, 38(16): 280-286. (in Chinese with English abstract)
10.7506/spkx1002-6630-201716045. http://www.spkx.net.cn
Key words: walnut protein drink; duplex digital droplet polymerase chain reaction (PCR); mass ratio; adulteration

