不同产地决明子蒽醌化合物组成及其抗氧化活性测定
龙远春,张 欣,万国栋,邓泽元,张 兵,*
不同产地决明子蒽醌化合物组成及其抗氧化活性测定
龙远春1,张 欣2,万国栋1,邓泽元1,张 兵1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.无限极(中国)有限公司,广东 江门 529156)
使用20%硫酸与氯仿同步水解萃取决明子总蒽醌,利用正交试验法优化得到提取工艺为:提取温度60 ℃、料液比1∶30(g/mL)、20%硫酸与氯仿溶剂体积比0.6、提取时间3 h。采用1,1-二苯基-2-三硝基苯肼法、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐法、铁离子还原法测定不同产地决明子总蒽醌的体外抗氧化活性。结果表明,印度决明子蒽醌抗氧化活性明显低于其他产地决明子,抗氧化活性总体顺序为河北>河南>安徽>江西>山东>印度。采用高效液相色谱法分析6 个产地决明子6 种蒽醌含量,除了印度与河南产地决明子外,其他产地决明子大黄酚与橙黄决明素均达到了《中国药典》对决明子蒽醌中大黄酚含量不少于0.2%,橙黄决明素含量不少于0.08%的要求。
决明子;蒽醌;抗氧化活性;高效液相色谱法
决明子为豆科植物决明(Cassia obtusifolia L.)的干燥成熟种子,味微苦,具有抗炎症、抗糖尿病、明目清肝、润肠通便等功效,是常用中药[1]。决明子含有蒽醌类化合物、萘、吡酮、多糖、蛋白质及氨基酸等多种活性成分[2]。国内外许多学者对决明子的活性成分进行的大量研究表明主要功效成分为决明子蒽醌和多糖[3]。微波辅助[4]、超声辅助[5]和超临界萃取[6]等现代天然产物提取技术已经被广泛用来提取决明子蒽醌类化合物。李佳等[7]利用超声辅助提取决明子游离蒽醌,并结合响应面试验设计优化提取工艺,研究乙醇质量分数、超声温度、超声时间及料液比对决明子游离蒽醌提取得率的影响。决明子蒽醌具有抗衰老、提高免疫力、降血压抗氧化等生物活性[8]。作为传统中药材,决明子在国内外都有大量种植。国内产地主要包括广西、湖北、江西、安徽、河南、河北、山东等,国外产地主要为东南亚国家如印度、泰国、越南等。决明子品质受生长种植环境影响显著,所以本实验首先利用正交试验优化得到酸结合有机试剂同步提取决明子总蒽醌的最优提取条件;然后比较不同产地决明子中主要活性成分蒽醌类化合物的含量并采用高效液相色谱(high performance liquid chromatography,HPLC)分析蒽醌组成;利用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)、铁离子还原法(ferric reducing antioxidant potential assay,FRAP)方法快速测定不同产地决明子蒽醌的抗氧化活性。通过比较不同产地决明子蒽醌含量、组成及其抗氧化活性,为更好开发利用决明子、指导决明子种植提供科学依据。
1 材料与方法
1.1 材料与试剂
成熟决明子产地分别为江西遂川、安徽高庙、河北任丘、河南邓州、山东日照、印度进口;DPPH、Fe3+-三吡啶三吖嗪(ferric-tripyridyltriazine,TPTZ)、ABTS、水溶性VE(Trolox)、浓硫酸、氯仿、1,8-二羟基蒽醌、甲醇、乙醇、醋酸镁、硫代硫酸钾、三水合醋酸钠、冰醋酸、盐酸溶液、FeCl3·6H2O(均为分析纯) 西陇化工股份有限公司;大黄酚、大黄素、大黄素甲醚、大黄酸、芦荟大黄素、橙黄决明素、磷酸(均为色谱纯)美国阿拉丁公司;甲醇、乙腈(均为色谱纯) 德国默克公司。
1.2 仪器与设备
ELx800酶标仪 美国BioTek公司;1260型HPLC仪美国安捷伦公司;722G可见分光光度计 上海精密仪器有限公司;TDL-5-A台式离心机 上海安亭科学仪器厂;恒温水浴锅 常州国华电器有限公司;FA24电子分析天平 上海舜宇恒平科学仪器有限公司;DR-1001旋转蒸发仪 郑州长城科工贸有限公司。
1.3 方法
1.3.1 单因素试验
提取温度的考察:固定料液比1∶20(g/mL),溶剂比(20%硫酸和氯仿的体积比,下同)0.4,提取时间为2 h,比较提取温度分别为40、50、60、70 ℃(氯仿的沸点为61.2℃)对总蒽醌得率的影响。
料液比的考察:固定溶剂比0.4,提取时间为2 h,提取温度60 ℃,比较料液比分别为1∶15、1∶20、1∶25、1∶30对总蒽醌得率的影响。
溶剂比的考察:固定提取时间为2 h,提取温度60 ℃,料液比1∶25,比较溶剂比分别为0.2、0.4、0.6、0.8对总蒽醌得率的影响。
提取时间的考察:固定提取温度60 ℃,料液比1∶25,溶剂比0.6,比较提取时间分别为1、2、3、4 h对总蒽醌得率的影响。
1.3.2 正交试验法优化决明子总蒽醌的提取工艺
决明子总蒽醌的提取工艺:准确称取5 g不同产地的干燥决明子粉末,采用体积分数20%硫酸溶液(以浓盐酸为基准)和氯仿同步水解及萃取决明子总蒽醌[9],控制一定的溶剂比、提取温度、料液比、提取时间对决明子总蒽醌进行提取。提取结束后分液,取下层液体挥干氯仿,用甲醇溶解并定容至25 mL,得到决明子总蒽醌溶液备用。
正交试验法优化决明子总蒽醌提取工艺:在单因素试验基础上,设计四因素三水平正交试验,选取江西产地样品提取总蒽醌,考察提取温度、料液比、溶剂比、提取时间对决明子总蒽醌得率的影响[10],如表1所示。

表1 正交试验因素与水平Table 1 Code and level of factors used for orthogonal array design
1.3.3 决明子总蒽醌体外抗氧化活性的测定
1.3.3.1 DPPH自由基清除率的测定
参照Wang Yuanfeng[11]和韦献雅[12]等的方法并进行适当调整,采用DPPH法测定决明子总蒽醌的抗氧化活性。样品测定:准确吸取100 μL的DPPH-甲醇溶液(0.065 mmol/L)与20 μL 7 个产地的决明子总蒽醌提取液或空白溶液混溶在96 孔板中,室温条件下避光振荡30 min,利用酶标仪于波长517 nm处测定其吸光度。每个样品设置3 个平行组,结果取其平均值。按公式(1)计算DPPH自由基清除能力:
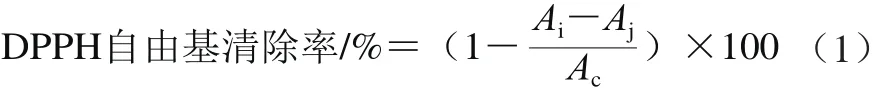
式中:Ai为样品溶液加DPPH试剂混合液的吸光度;Aj为样品溶液加甲醇的吸光度;Ac为DPPH溶液加样品的吸光度。
标准曲线的制作:以不同质量浓度(12、25、37、50、62、75、87 μg/mL)的Trolox清除DPPH自由基的能力作标准曲线,以清除率为纵坐标,Trolox质量浓度为横坐标。根据回归方程计算决明子总蒽醌的Trolox当量抗氧化能力(trolox equivalent antioxidant capacity,TEAC),结果以mg Trolox/g当量表示,以干质量计。
1.3.3.2 ABTS+·法测定抗氧化能力
参考van der Werf[13]和杨少辉[14]等的方法并进行适当调整,测定决明子总蒽醌清除ABTS+·的能力。样品测定:用80%乙醇溶液稀释ABTS工作液,使其在波长734 nm处吸光度为0.7,然后于96 孔板中分别加入200 μL ABTS稀释溶液和20 μL决明子蒽醌样品溶液,避光振荡6 min,于波长734 nm处测定吸光度。每个样品设置3 个平行组,结果取其平均值。ABTS+·清除率按公式(2)计算:

其中:A0为ABTS溶液和样品溶剂混合液的吸光度;Ai为ABTS溶液和样品溶液混合液的吸光度;Aj为80%乙醇溶液和样品溶液吸光度。
标准曲线制作:以不同质量浓度(25、50、75、125、150 μg/mL)的Trolox清除自由基的能力作标准曲线,以清除率为纵坐标,Trolox质量浓度为横坐标。根据回归方程计算决明子蒽醌的TEAC,结果以mg Trolox/g当量表示,以干质量计。
1.3.3.3 FRAP测定
参照Gao Jie[15]和Wootton-Beard[16]等的测定方法,并进行适当调整,测定不同产地决明子总蒽醌的FRAP。
样品测定:在96 孔板中,依次加入10 μL决明子蒽醌提取液和300 μL的TPTZ工作液,室温反应30 min后,用酶标仪测定593 nm波长处吸光度。
标准曲线的制作:配制质量浓度25、75、125、175、225 μg/mL的Trolox溶液,在96 孔板中,依次加入10 μL不同质量浓度的标准液和300 μL的TPTZ工作液,室温反应30 min后,用酶标仪测定593 nm波长处吸光度。以Trolox溶液质量浓度为横坐标,吸光度为纵坐标制作标准曲线,得到回归方程。决明子总蒽醌的FRAP结果以mg Trolox/g表示,以干质量计。
1.3.4 HPLC分析不同产地决明子总蒽醌的组成及6 种蒽醌含量的测定
色谱条件:Eclipse XDB-C18色谱柱(4.6 mm× 250 mm,5 μL);流动相A为乙腈,流动相B为0.1%磷酸溶液,柱温30 ℃;检测波长284 nm[17],进样量10 μL;梯度洗脱程序:0 min,65% A,35% B;10 min,70% A,30% B;25 min,80% A,20% B;32 min,100% A,0% B;35 min,100% A,0% B。
对照品溶液的制备:精密称取大黄酚1.5 mg、大黄素1.0 mg、大黄素甲醚1.2 mg、大黄酸4.3 mg、芦荟大黄素1.2 mg、橙黄决明素1.3 mg,用甲醇溶解并定容至10 mL备用[18]。
1.3.4.1 精密度实验
精密吸取江西产地决明子蒽醌样品溶液5 μL,重复进样6 次,根据蒽醌回归方程计算橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量,并算出各个物质含量的相对标准偏差(relative standard deviation,RSD)[19]。
1.3.4.2 重复性实验
精密称取江西产地决明子干燥粉末6 份各2.0 g,每份约0.5 g,精密称定,按正交试验优化方法提取总蒽醌,分别进样5 μL重复性实验。计算每份样品中橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量,并算出各个物质含量的RSD[20]。
1.3.4.3 稳定性实验
精密吸取江西产地决明子蒽醌样品溶液5 μL,分别在0、2、4、6、8、10、12 h进样,比较橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚的含量的变化,并计算其RSD[21]。
2 结果与分析
2.1 标准曲线的制作
精密称取干燥至恒质量的1,8-二羟基蒽醌[22]适量,用甲醇溶解,配制1 mg/mL的标准溶液,并保存在棕色容量瓶中。精密吸取标准溶液0.2、0.4、0.6、0.8、1.0 mL分别置于25 mL比色管中,用0.5%醋酸镁-甲醇溶液溶解,定容至刻度,摇匀,以0.5%醋酸镁-甲醇溶液为空白对照,于波长500 nm处测定吸光度。以吸光度作为纵坐标,标准样品质量浓度作为横坐标绘制标准曲线,得到直线回归方程为y=4.090 3x-0.008 5,R2=0.999 7。
2.2 提取工艺条件的选择
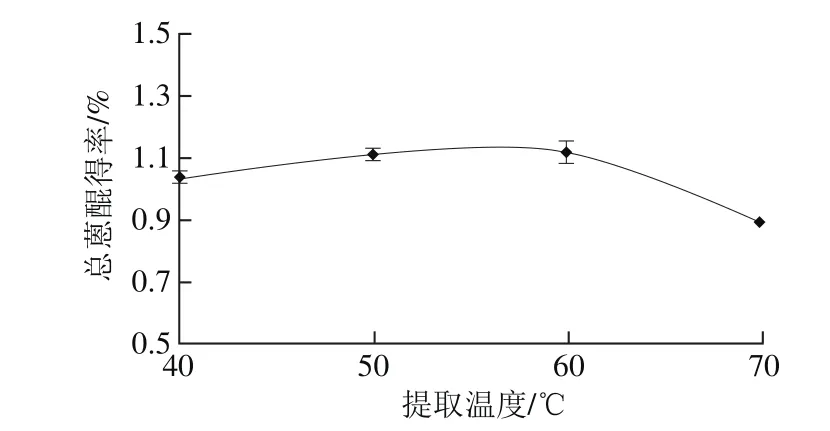
图1 提取温度对决明子总蒽醌得率的影响Fig. 1 Effect of temperature on the extraction yield of anthraquinones
2.2.1 提取温度对决明子总蒽醌得率的影响由图1可知,随着提取温度的升高,总蒽醌得率也随之升高,提取温度60 ℃时得率最大。继续升高提取温度,总蒽醌得率呈下降趋势,这可能是由于提取温度过高使得氯仿挥发过快,溶剂减少导致提取所得总蒽醌减少。故而选取提取温度50、60、70 ℃作为正交试验优化水平。
2.2.2 料液比对决明子总蒽醌得率的影响
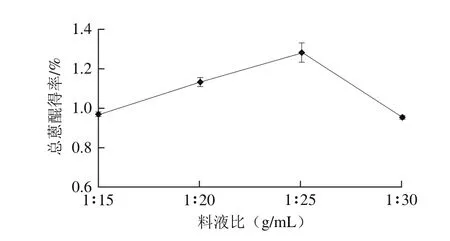
图2 料液比对决明子总蒽醌得率的影响Fig. 2 Effect of solid/liquid ratio on the extraction yield of anthraquinones
由图2可知,随着液体比例增大,总蒽醌得率随之增加,在料液比1∶25时,总蒽醌得率最大。继续增加液体比例,总蒽醌得率反而下降,原因可能是随着液体比例的增大,其他可以溶于硫酸-氯仿体系的化合物跟蒽醌类化合物产生竞争,溶液中溶出物增加,但杂质相应增加,导致蒽醌得率降低。选取料液比为1∶20、1∶25、1∶30设计正交优化试验。
2.2.3 溶剂比对决明子总蒽醌得率的影响

图3 溶剂比对决明子总蒽醌得率的影响Fig. 3 Effect of solvent ratio on the extraction yield of anthraquinones
由图3可知,随着20%硫酸与氯仿体积比增大,总蒽醌得率随之增加,溶剂比为0.6时,总蒽醌得率达到最大。当溶剂比大于0.6时,总蒽醌得率趋于平衡。主要原因可能是样品中的结合蒽醌已经被充分水解,继续加大酸的量不会提高总蒽醌得率。选取溶剂比为0.4、0.6、0.8设计正交优化试验。
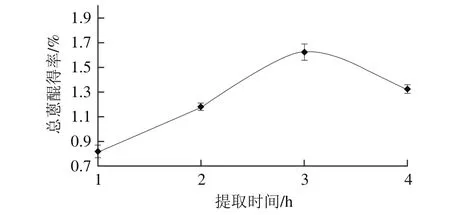
图4 提取时间对决明子总蒽醌得率的影响Fig. 4 Effect of extraction time on the yield of anthraquinones
2.2.4 提取时间对决明子总蒽醌得率的影响由图4可知,随着提取时间的延长,决明子总蒽醌得率不断增加。在提取时间3 h时蒽醌得率达到最大值,之后提取时间延长,总蒽醌得率下降。选取提取时间为2、
3、4 h设计正交优化试验。
2.2.5 正交试验设计方案及结果
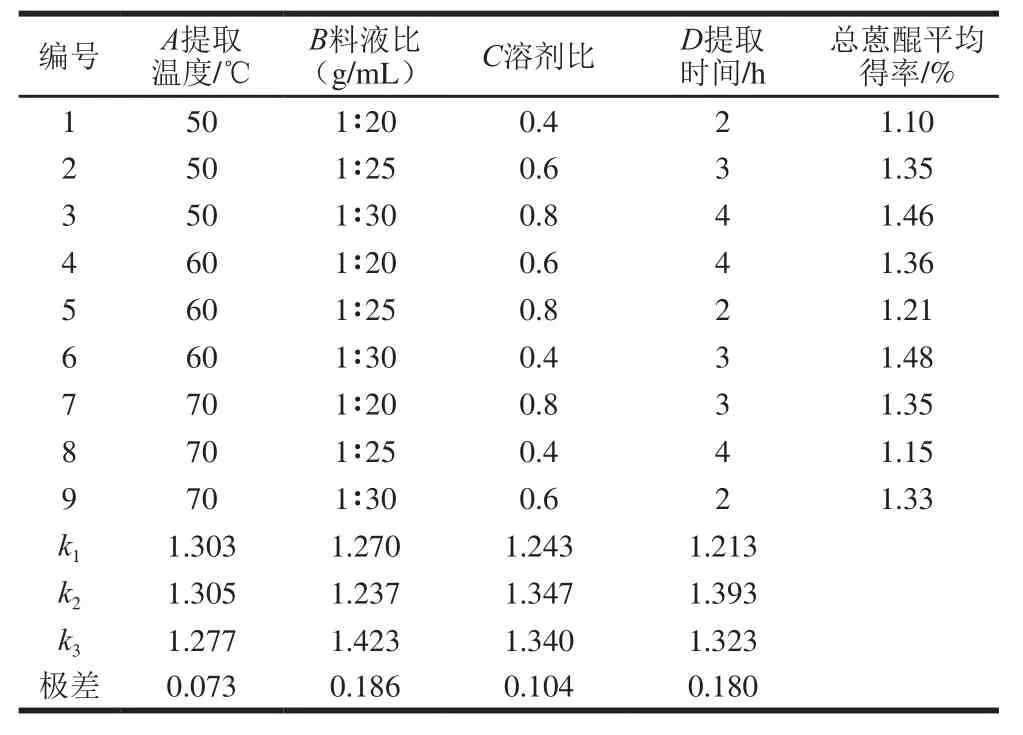
表2 正交试验设计及结果Table 2 Orthogonal experimental design with experimental results
由表2可知,经验证最优条件为A2B3C2D2,即提取温度60 ℃、料液比1∶30、溶剂比0.6、提取时间3 h。由极差分析[23]可知,影响决明子总蒽醌得率的因素主次顺序依次为B>D>C>A,即料液比>提取时间>溶剂比>提取温度。
2.2.6 不同产地决明子总蒽醌的提取与含量测定结果
利用优化提取条件,即提取温度60 ℃、料液比1∶30、溶剂比0.6、提取时间3 h,提取来自江西、安徽、河北、河南、山东、印度共6 个产地决明子的总蒽醌并测定其总蒽醌含量。
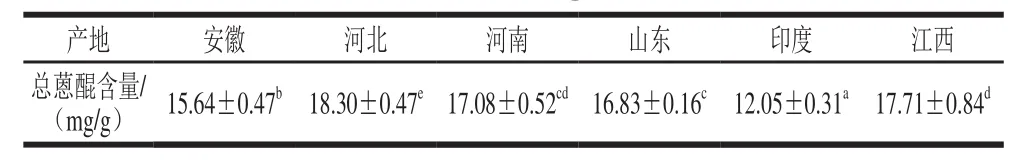
表3 不同产地决明子总蒽醌含量的比较Table 3 Comparison of anthraquinone contents of samples from different origins
从表3可知,不同产地决明子总蒽醌含量有一定差异性(P<0.05),其中河北产地决明子总蒽醌含量最高,印度产地的决明子总蒽醌含量最低。决明子总蒽醌含量受其种质及生长环境的影响,所以不同产地的决明子总蒽醌含量有差异。
2.3 决明子总蒽醌抗氧化活性测定结果
对不同产地决明子总蒽醌的DPPH自由基、ABTS+·清除能力,FRAP进行了测定,制作标准曲线,如表4所示。
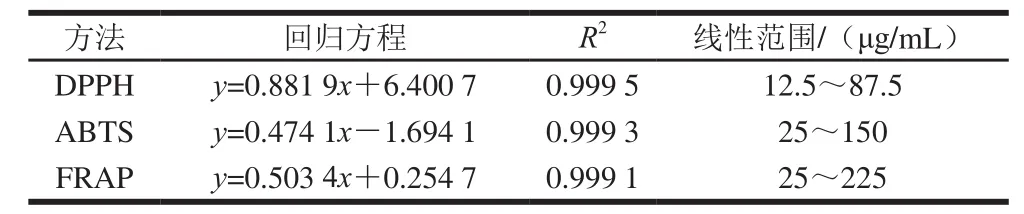
表4 Trolox清除DPPH自由基、ABTS+·及FRAP的回归方程、相关系数及线性范围Table 4 Regression equations, correlation coefficients and linear ranges for free radical scavenging and FRAP assays

表5 不同产地决明子总蒽醌体外抗氧化活性的测定Table 5 Antioxidant activity of anthraquinones extracted from samples from different regions
由表5可知,不同产地决明子蒽醌的抗氧化活性有一定差异,抗氧化活性能力总体顺序为河北>河南>安徽>江西>山东>印度。由表3可知,不同产地决明子总蒽醌的含量顺序为河北>江西>河南>山东>安徽>印度。其他4 个产地决明子总蒽醌含量约为印度决明子总蒽醌含量的1.5 倍。决明子总蒽醌的DPPH自由基、ABTS+·清除能力及FRAP的测定结果以抗氧化剂Trolox作为对照[24],由表4、5可知,ABTS法测体外抗氧化活性,每克干质量的安徽、河北、河南、山东、江西决明子的TEAC约为印度产地的2.5 倍。DPPH法测体外抗氧化活性,每克干质量的安徽、河北、河南、山东、江西决明子的TEAC约等于印度产地的2 倍。每克干质量的安徽、河北、河南、山东、江西决明子的总蒽醌FRAP约等于印度样品的2 倍。说明决明子总蒽醌的体外抗氧化能力与其含量呈一定的正相关性。
2.4 HPLC法测定决明子蒽醌的组成及其6 种蒽醌成分
2.4.1 不同产地决明子蒽醌类化合物组成的HPLC特征
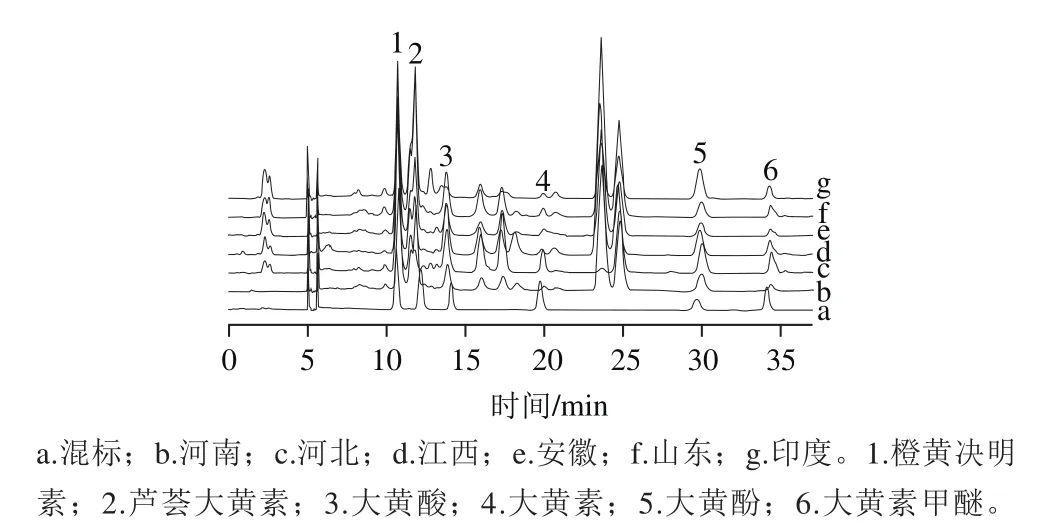
图5 不同产地决明子蒽醌组成及6 种蒽醌标品HPLC图谱Fig. 5 HPLC chromatograms of mixed standard solution of anthraquinones and anthraquinones extracted from samples from different regions
采用优化方法提取得到的决明子总蒽醌进行HPLC分析,吸取橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚标准溶液各1 mL混合得到6 个标准品的混合溶液。样品及混合标准品经0.22 μm的有机滤头过滤后进样,进样量为5 μL[25]。由图5可知,橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚出峰时间依次为10.801、12.506、13.145、19.462、29.982、34.031 min。不同产地的决明子蒽醌HPLC色谱峰组成相似。精确稀释1 mg/mL的橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚标准溶液母液到0.000 6~0.13 mg/mL范围的一系列标准溶液[26],进样量5 μL。以峰面积为纵坐标,蒽醌标准品质量浓度为横坐标制作标准曲线,6 种蒽醌成分的回归方程、相关系数及线性范围见表6。
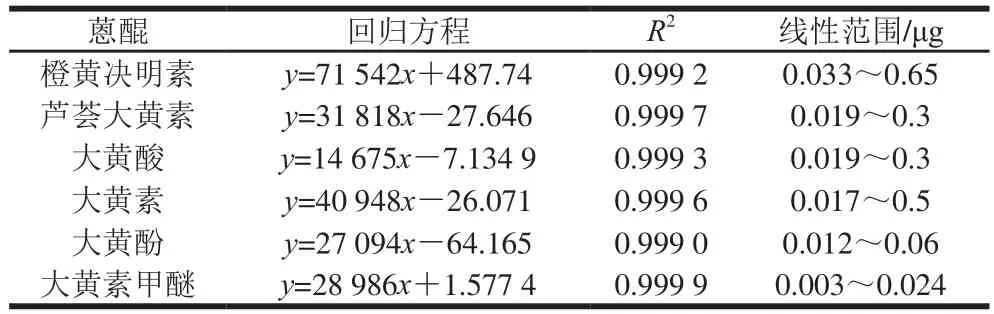
表6 6 种蒽醌成分的回归方程、相关系数及线性范围Table 6 Regression equations, correlation coefficient sand linear ranges for six anthraquinones
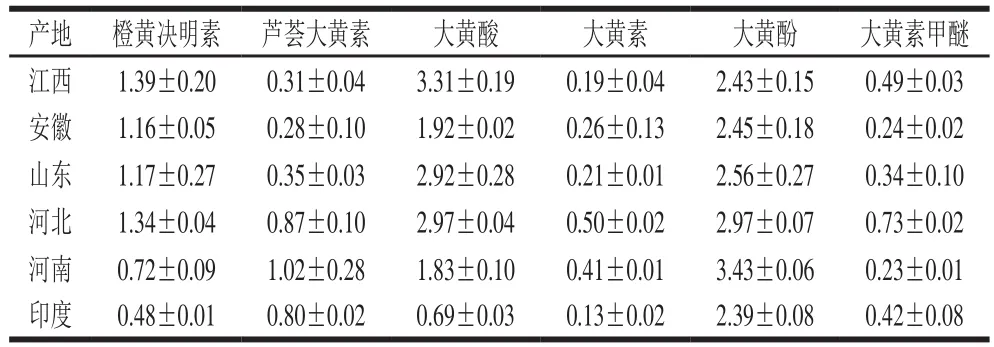
表7 HPLC分析不同产地决明子蒽醌类化合物组成及含量Table 7 Composition and content of anthraquinones in samples from different regionsmg/g
由表7可知,江西产地决明子的6 种蒽醌含量依次为大黄酸>大黄酚>橙黄决明素>大黄素甲醚>芦荟大黄素>大黄素,安徽产地决明子的6 种蒽醌含量依次为大黄酚>大黄酸>橙黄决明素>芦荟大黄素>大黄素>大黄素甲醚,山东产地决明子的6 种蒽醌含量依次为大黄酸>大黄酚>橙黄决明素>芦荟大黄素>大黄素甲醚>大黄素,河北产地决明子的6 种蒽醌含量依次为大黄酚>大黄酸>橙黄决明素>芦荟大黄素>大黄素甲醚>大黄素,河南产地决明子的6 种蒽醌含量依次为大黄酚>大黄酸>芦荟大黄素>橙黄决明素>大黄素>大黄素甲醚,印度产地决明子的6 种蒽醌含量依次为大黄酚>芦荟大黄素>大黄酸>橙黄决明素>大黄素甲醚>大黄素,并且大黄酚含量均达到了《中国药典》对决明子蒽醌中大黄酚含量(≥0.2%)的要求。除了印度与河南2 个产地外,其他4 个产地的橙黄决明素含量均达到了《中国药典》对决明子蒽醌中橙黄决明素含量(≥0.08%)的要求[27]。江西、安徽、山东、河北、河南、印度决明子的6 种蒽醌含量总和依次为(8.12±0.22)、(6.31±0.21)、(7.56±0.95)、(9.38±0.01)、(7.63±0.40)、(4.91±0.05) mg/g。
2.4.2 方法学考察结果
2.4.2.1 精密度实验结果
根据1.3.4.1节方法进行精密度实验,测得江西产地决明子中橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量的RSD分别为0.37%、0.87%、0.74%、0.48%、0.53%、0.12%,实验结果表明,仪器的精密度良好。
2.4.2.2 重复性实验结果
根据1.3.4.2节方法进行重复性实验,测得6 份江西产地决明子中橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量的RSD分别为1.99%、1.32%、1.66%、1.73%、1.41%、1.77%,实验结果表明,方法重复性良好。
2.4.2.3 稳定性实验结果
根据1.3.4.3节方法进行稳定性实验,测得决明子蒽醌样品溶液在放置0、2、4、6、8、10、12 h后橙黄决明素、芦荟大黄素、大黄酸、大黄素、大黄酚、大黄素甲醚含量的RSD分别为0.83%、0.65%、0.39%、0.33%、0.54%、0.36%,结果表明,决明子蒽醌样品溶液的6 种成分在12 h内性质稳定。
3 结 论
决明子作为一种药食两用的植物原材料[28],被众多学者研究开发利用。决明子中的蒽醌类化合物是一种主要活性物质[29],本实验使用20%硫酸与氯仿同步水解萃取决明子总蒽醌,并利用正交试验法优化其提取工艺,分析提取温度、料液比、溶剂比、提取时间对总蒽醌提取率的影响,由极差分析可知,影响决明子总蒽醌得率的因素主次顺序依次为料液比>提取时间>溶剂比>提取温度。优化得到的提取工艺为提取温度60 ℃、料液比1∶30、溶剂比0.6、提取时间3 h。同时,对不同产地决明子蒽醌的DPPH自由基、ABTS+·清除能力,FRAP进行了测定,结果表明,不同产地决明子蒽醌的抗氧化活性强弱有一定差异,其中产自印度的决明子蒽醌抗氧化活性明显低于其他产地蒽醌抗氧化能力,不同产地抗氧化活性总体为河北>河南>安徽>江西>山东>印度。虽然与TEAC相比,决明子蒽醌的抗氧化能力较弱,但作为一种天然的抗氧化剂也有一定的应用价值[30]。本实验采用HPLC法分析不同产地决明子6 种蒽醌含量,实验重复性及稳定性良好,结果表明6 个产地决明子中的大黄酚含量都达到了《中国药典》对决明子蒽醌中大黄酚含量(≥0.2%)的要求。除了印度与河南2 个产地外,其他4 个产地的橙黄决明素含量均达到了《中国药典》对决明子蒽醌中橙黄决明素含量(≥0.08%)的要求。
[1] 于晓敏, 陈素红, 谢自新, 等. 不同产地决明子脂肪油的成分检测与比较[J]. 中华中医药学刊, 2013, 31(5): 1012-1013. DOI:10.13193/ j.archtcm.2013.05.54.yuxm.050.
[2] 袁晓, 高俊飞, 舒楚金, 等. 不同产地决明子中9 种蒽醌类成分的测定[J]. 中草药, 2012, 43(9): 1773-1775.
[3] LIU C, LIU Q, SUN J, et al. Extraction of water-soluble polysaccharide and the antioxidant activity from Semen cassiae[J]. Journal of Food and Drug Analysis, 2014, 22(4): 492-499. DOI:10.1016/j.jfda.2014.01.027.
[4] 林丽萍, 杨鹏, 何辉良. 决明子蒽醌的超声法提取工艺优化[J]. 贵州农业科学, 2011, 39(6): 185-187. DOI:10.3969/ j.issn.1001-3601.2011.06.051.
[5] 黄祖林, 吴晓琼, 邱晓敏. 微波辅助提取决明子总蒽醌的工艺条件研究[J]. 中华中医药学刊, 2014, 32(3): 655-660. DOI:10.13193/ j.issn.1673-7717.2014.03.072.
[6] 银建中, 石文华, 胡大鹏, 等. 决明子有效成分的超临界CO2萃取工艺[J]. 化工装备技术, 2008, 29(3): 55-57. DOI:10.16759/j.cnki. issn.1007-7251.2008.03.009.
[7] 李佳, 吴朝霞, 张旋, 等. 响应面优化提取决明子游离蒽醌工艺[J].食品科学, 2011, 32(16): 192-195.
[8] 陈秋东, 徐志南, 于平, 等. 中药决明子中蒽醌类活性成分的生化研究进展[J]. 中药材, 2002, 25(6): 442-445. DOI:10.13863/ j.issn1001-4454.2002.06.032.
[9] 盛尊来, 李继昌. 响应面法优化大黄游离总蒽醌的提取工艺[J]. 食品工业, 2012(1): 86-89.
[10] 张吉祥, 欧来良. 正交试验法优化枣核黄酮的超声提取工艺研究[J]. 食品工业科技, 2012, 33(10): 280-283. DOI:10.13386/ j.issn1002-0306.2012.10.032.
[11] WANG Y F, MAO F F, WEI X L. Characterization and antioxidant activities of polysaccharides from leaves, flowers and seeds of green tea[J]. Carbohydrate Polymers, 2012, 88(1): 146-153. DOI:10.1016/ j.carbpol.2011.11.083.
[12] 韦献雅, 殷丽琴, 钟成, 等. DPPH法评价抗氧化活性研究进展[J]. 食品科学, 2014, 35(9): 317-322. DOI:10.7506/spkx1002-6630-201409062.
[13] VAN DER WERF R, MARCIC C, KHALIL A, et al. ABTS radical scavenging capacity in green and roasted coffee extracts[J]. LWTFood Science and Technology, 2014, 58(1): 77-85. DOI:10.1016/ j.lwt.2014.02.053.
[14] 杨少辉, 宋英今, 王洁华, 等. 雪莲果体外抗氧化和自由基清除能力[J].食品科学, 2010, 31(17): 166-169.
[15] GAO J, ZHANG T, JIN Z, et al. Structural characterisation, physicochemical properties and antioxidant activity of polysaccharide from Lilium lancifolium Thunb.[J]. Food Chemistry, 2015, 169: 430-438. DOI:10.1016/j.foodchem.2014.08.016.
[16] WOOTTON-BEARD P C, MORAN A, RYAN L. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially available vegetable juices before and after in vitro digestion measured by FRAP, DPPH, ABTS and Folin-Ciocalteu methods[J]. Food Research International, 2011, 44(1): 217-224. DOI:10.1016/ j.foodres.2010.10.033.
[17] 梁朔, 张振秋, 米宝丽, 等. HPLC法同时测定决明子中6 种蒽醌类成分[J]. 中成药, 2013, 35(3): 584-588. DOI:10.3969/ j.issn.1001-1528.2013.03.037.
[18] YANG C, WANG S, GUO X, et al. Simultaneous determination of seven anthraquinones in rat plasma by ultra high performance liquid chromatography-tandem mass spectrometry and pharmacokinetic study after oral administration of Semen cassiae extract[J]. Journal of Ethnopharmacology, 2015, 169: 305-313. DOI:10.1016/ j.jep.2015.04.008.
[19] 何永志, 严治学, AMPONSEM E, 等. HPLC-UV法测定草决明中五种蒽醌类化合物含量及其指纹图谱的建立[J]. 河北医学, 2014, 20(12): 1937-1941.
[20] 尚勇, 李芸, 刘永琦, 等. 大黄总蒽醌的提取纯化及含量测定[J].中兽医医药杂志, 2015(2): 28-30. DOI:10.13823/j.cnki.jtcvm.2015.02.008.
[21] 赵丽君. HPLC法同时测定牛黄上清丸中4 种蒽醌类化合物的含量[J]. 中国药房, 2016, 27(3): 402-404. DOI:10.6039/ j.issn.1001-0408.2016.03.40.
[22] 郭华, 侯冬岩, 回瑞华. 分光光度法测定中药中蒽醌类化合物的含量[J]. 药物分析杂志, 2009, 29(2): 326-329. DOI:10.16155/j.0254-1793.2009.02.031.
[23] 陈金玉, 曾健, 李春美. 龙眼核多酚提取工艺的正交试验优化及其分离纯化与结构表征[J]. 食品科学, 2015, 36(16): 31-37. DOI:10.7506/spkx1002-6630-201516006.
[24] 曾林晖, 邓泽元, 余修亮, 等. 蜂胶黄酮的超声波提取工艺优化及其抗氧化活性研究[J]. 食品工业科技, 2016, 37(12): 295-300. DOI:10.13386/j.issn1002-0306.2016.12.047.
[25] 王淑红, 杨春娟, 刘璐, 等. HPLC测定决明子中6 种游离蒽醌含量[J].哈尔滨医科大学学报, 2015, 49(1): 22-26.
[26] WANG Z, HU J, DU H, et al. Microwave-assisted ionic liquid homogeneous liquid-liquid microextraction coupled with high performance liquid chromatography for the determination of anthraquinones in Rheum palmatum L.[J]. Journal of Pharmaceutical and Biomedical Analysis, 2016, 125: 178-185. DOI:10.1016/ j.jpba.2016.03.046.
[27] 国家药典委员会. 中华人民共和国药典: 一部[M]. 2010年版. 北京:中国医药科技出版社, 2010: 135.
[28] 项昭保, 金光辉, 王光利. 决明子有效成分提取工艺和药理作用研究进展[J]. 食品工业科技, 2013, 34(2): 387-391. DOI:10.13386/ j.issn1002-0306.2013.02.017.
[29] 孔祥锋, 臧恒昌. 决明子化学成分及药理活性研究进展[J]. 药学研究, 2013, 32(11): 660-662. DOI:10.13506/j.cnki.jpr.2013.11.013.
[30] 陈秋东, 徐志南, 于平, 等. 中药决明子中蒽醌类活性成分的生化研究进展[J]. 中药材, 2002, 25(6): 442-445. DOI:10.13863/ j.issn1001-4454.2002.06.032.
Anthraquinone Composition and Antioxidant Activity of Semen Cassiae from Different Regions
LONG Yuanchun1, ZHANG Xin2, WAN Guodong1, DENG Zeyuan1, ZHANG Bing1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. Infinitus (China) Co. Ltd., Jiangmen 529156, China)
In this study, anthraquinones were obtained by the hydrolysis of Semen Cassiae with a mixture of 20% sulfuric acid and chloroform. By using an orthogonal array design method the optimal conditions for extraction were determined as follows: extraction temperature 60 ℃, liquid-to-solid ratio 1:30 (g/mL), 20% sulfuric acid-to-chloroform ratio 0.6, and extraction time 3 h. 1,1-Diphenyl-2-picrylhydrazyl (DPPH) and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS) radical scavenging and ferric reducing antioxidant potential (FRAP) assays were employed to determine the in vitro antioxidant activity of total anthraquinones extracted from Semen Cassiae from different regions. The results showed that the antioxidant capacity of total anthraquinones of Semen Cassiae from India was far lower than that of Semen Cassiae from any other selected region. The antioxidant activity of total anthraquinones extracted from Semen Cassiae from different growing regions was ranked as follows: Hebei > Henan > Anhui > Jiangxi > Shandong > India. The present study also determined 6 anthraquinone components in Semen Cassiae by HPLC. Results showed that the contents of both chrysophanol and aurantioobtusifolin in Semen Cassiae from all regions from India and Henan were not lower than 0.2% and 0.08%, respectively, which reached the levels stated in the Pharmacopeia of China.
Semen Cassiae; anthraquinones; antioxidant activity; high performance liquid chromatography (HPLC)
10.7506/spkx1002-6630-201716023
R284.1
A
1002-6630(2017)16-0145-07
龙远春, 张欣, 万国栋, 等. 不同产地决明子蒽醌化合物组成及其抗氧化活性测定[J]. 食品科学, 2017, 38(16): 145-151. DOI:10.7506/spkx1002-6630-201716023. http://www.spkx.net.cn
LONG Yuanchun, ZHANG Xin, WAN Guodong, et al. Anthraquinone composition and antioxidant activity of Semen Cassiae from different regions[J]. Food Science, 2017, 38(16): 145-151. (in Chinese with English abstract)
10.7506/ spkx1002-6630-201716023. http://www.spkx.net.cn
2016-10-14
食品科学与技术国家重点实验室青年基金项目(SKLF-QN-201519)
龙远春(1989—),女,硕士,研究方向为天然产物提取与应用。E-mail:757364102@qq.com
*通信作者:张兵(1984—),男,助理研究员,博士,研究方向为食品营养与健康。E-mail:zhangbingair@hotmail.com

