一种更灵敏的特异性检测H9亚型禽流感抗体的间接ELISA方法的建立
仉薇,侯力丹,宋洁,张爽,李芸,李晶,孙蕾,范文辉,刘文军
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国兽医药品监察所,北京 100081
一种更灵敏的特异性检测H9亚型禽流感抗体的间接ELISA方法的建立
仉薇1,2,侯力丹3,宋洁1,2,张爽1,李芸1,李晶1,孙蕾1,2,范文辉1,刘文军1,2
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101 2 中国科学院大学,北京 100049 3 中国兽医药品监察所,北京 100081
仉薇, 侯力丹, 宋洁, 等. 一种更灵敏的特异性检测H9亚型禽流感抗体的间接ELISA方法的建立. 生物工程学报, 2017,33(8): 1253–1264.
Zhang W, Hou LD, Song J, et al. Establishment of a high sensitive indirect ELISA for detecting specific antibodies against H9 subtype avian influenza virus. Chin J Biotech, 2017, 33(8): 1253–1264.
H9亚型禽流感在全球范围内广泛流行,控制其传播需监测H9亚型禽流感病毒的感染情况及疫苗的免疫效果。为了建立便于检测且灵敏特异的 H9亚型禽流感抗体间接 ELISA方法,本实验利用不同亚型之间变异较大的H9亚型禽流感病毒HA蛋白的头部球状区作为包被抗原,确定了最佳复合封闭液和抗体稀释液,提高了其特异性。结果显示建立的ELISA方法灵敏度高于血凝抑制试验 (HI),且与H3N2、H5N2、H7N9亚型流感病毒及新城疫病毒 (NDV)、鸡传染性支气管炎病毒 (IBV)、鸡传染性法氏囊病毒 (IBDV) 和产蛋下降综合征病毒 (EDSV) 的阳性血清均无交叉反应。另外,利用该方法及HI试验对200份临床鸡血清样本进行检测,两种检测方法的符合率达97%,且存在较高的相关性 (R2=0.981 1)。
H9亚型,禽流感病毒,血凝素蛋白,间接ELISA,血凝抑制试验
流感病毒属于正粘病毒科流感病毒属,根据核蛋白抗原性的不同分为A、B、C三型及在牛体内新发现的 D型流感病毒[1]。A型流感病毒的影响范围及危害最大[2],可引起禽类、哺乳动物及人类流感的发生。A型禽流感病毒根据其致病性高低可分为高致病性禽流感病毒(High-pathogenicity avian influenza virus,HPAIV)和低致病性禽流感病毒 (Low-pathogenicity avian influenza virus,LPAIV)[3-4]。H9亚型禽流感病毒属于LPAIV,可以引起家禽、水禽、野鸟等发生禽流感[5-7],是全世界分布最广的亚型[8],主要在亚洲、中东和北非等地流行,以产蛋减少及混合感染为特征,造成了养殖业巨大的经济损失[9-11]。除此之外,H9亚型禽流感病毒偶尔也感染人类,在中国大陆、中国香港、伊朗、孟加拉国和埃及等地都有分散病例[15-17],给人类的公共卫生安全带来了潜在的威胁。疫苗是目前控制流感的主要手段。因此及时准确地评估禽流感疫苗的免疫效果,并监测H9亚型禽流感病毒的流行情况是防控工作的重中之重[12]。
H9亚型禽流感病毒及其抗体的检测方法主要有:病毒的分离鉴定、血凝抑制试验 (HI)、神经氨酸酶抑制试验 (NI)、琼脂糖扩散试验(AGP)、中和试验 (NT)、酶联免疫吸附试验(ELISA)、RT-PCR及依赖核酸序列的扩增技术(NASBA) 等方法。其中,病毒的分离鉴定诊断比较确切[13],是目前确诊禽流感的首选方法,但该方法耗时较长,病毒从分离培养到最后分型需要 20 d左右,不适用于快速检测;HI和NI是对流感病毒抗体进行亚型鉴定的常用方法,但其灵敏度低,而且因血清中含有非特异性红细胞凝集物质和非特异性血凝抑制物质,故在诊断中还需要先进行预处理,操作过程复杂,且试验中需要用到大量的病毒作为标准抗原,因而在制备和使用过程中存在传播病毒的风险,需要在 P2甚至 P3级的实验室操作[14-15];AGP方法操作比较简单,结果容易判定,但其灵敏度和HI实验一样偏低[14];NT实验结果可靠,但其灵敏度低,操作繁琐,不适于大批量样品的检测[15]。本研究建立的间接ELISA与HI试验有很高的相关性,且其灵敏度远高于HI试验,能进行大量样品的分析并进行相对定量,操作中不使用病毒作为抗原,在普通的临床实验室就可以熟练操作,耗时较短,可用于大批量临床样品血清的检验,具有重要的临床应用价值。
1 材料与方法
1.1 主要材料与试剂
大肠杆菌 TOP10和 BL21、原核表达载体pET-32a(+)由本实验室保存;Pfu酶、Taq酶、限制性内切酶BamHⅠ、XhoⅠ、T4 DNA连接酶购自宝生物工程 (大连) 有限公司;质粒提取试剂盒、胶回收试剂盒、BCA蛋白定量试剂盒、TMB底物显色液购自天根生化科技 (北京) 有限公司;96孔酶标板购自上海源叶生物科技有限公司;Ni-NTA His Bind Resin购自北京全式金生物技术有限公司;蛋白预染 marker购自宝林科 (北京)生物科技有限公司;辣根过氧化物酶 (HRP) 标记的羊抗鸡 IgG购自达科为生物技术有限公司;H3N2、H5N2、H7N9阳性血清、H9N2禽流感灭活病毒、H9N2亚型禽流感病毒阳性血清及 SPF鸡阴性血清购自哈尔滨维科生物技术开发公司;NDV、IBV、IBDV、EDSV阳性血清购自中国农业大学畜禽疫病诊断中心。
1.2 包被抗原的原核表达及纯化
1.2.1 重组表达载体的构建
将H9N2禽流感病毒HA基因的头部球状区进行密码子优化后交由苏州金唯智生物科技有限公司进行人工合成。将人工合成的目的基因经BamHⅠ和 XhoⅠ双酶切后克隆至 pET-32a(+)载体,构建重组表达载体。转化大肠杆菌TOP10感受态细胞,涂布氨苄抗性 LB平板,挑取单个菌落进行菌落PCR及双酶切鉴定。鉴定所用引物为P-F:5′-GGATCCTGCGCCACCAACCTGGGC-3′,P-R:5′-CTCGAGTTAGGTGGTATTCAGACC-3′。将菌落PCR及双酶切鉴定阳性的克隆送至北京博迈德生物技术有限公司进行测序,选取测序正确的克隆提取质粒。
1.2.2 重组蛋白的表达
将重组表达载体转化至大肠杆菌 BL21感受态细胞,构建重组表达菌株,挑单菌落接种到10 mL氨苄浓度为50 μg/mL的LB培养基中,37 ℃、200 r/min培养8-10 h,作为种子。将该种子按照1∶100接种到500 mL氨苄浓度为50 μg/mL的LB培养基中,37 ℃、200 r/min培养至菌液OD600在 0.8-1.0之间,加入终浓度为 1 mmol/L的异丙基硫代半乳糖苷 (Isopropyl-beta-D-thiogalactopyranoside, IPTG),37 ℃条件下诱导5 h,留取诱导前及诱导后的菌体进行SDS-PAGE鉴定目的蛋白的表达情况。
1.2.3 重组蛋白的纯化与复性
用裂解液重悬菌体,超声破碎 (400 W,超声3 s,间歇4 s,20 min),将得到的上清和沉淀进行 SDS-PAGE。用 PBS (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,pH 7.2)、PBST-1 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,Triton X-100 0.05%,pH 7.2)、2 mol/L尿素、1 mol/L NaCl洗涤包涵体,洗涤后的包涵体用变性剂 (8 mol/L尿素,0.1 mol/L NaH2PO4,10 mmol/L Tris,pH 8.0) 进行变性,12 000 r/min离心10 min取上清,经0.22 μm滤膜过滤后,用 Ni柱进行亲和层析纯化,然后再利用Superdex 2000层析柱进行分子筛纯化,收集目的蛋白所在的洗脱峰,SDS-PAGE检测蛋白纯度。最后将纯化后的变性蛋白连续缓慢地滴入到复性液中,使其复性。用BCA蛋白试剂盒检测复性蛋白的浓度,并利用Western blotting检测其免疫原性。
1.3 间接ELISA方法的建立
1.3.1 间接ELISA的操作方法
用碳酸盐 (pH 9.6) 稀释纯化后的目的蛋白,包被96孔酶标板 (100 μL/孔) 4 ℃过夜,用PBST-2 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,Tween-20 0.05%,pH 7.2) 洗涤3次,之后用封闭液 (200 μL/孔)37 ℃封闭2 h,用PBST-2洗涤3次。将血清用抗体稀释液按照一定比例稀释后,每孔100 μL,37 ℃孵育1 h,用PBST-2洗涤5次。HRP标记的羊抗鸡IgG用抗体稀释液按一定比例稀释后,每孔100 μL,37 ℃孵育1 h,用PBST-2洗涤5次。每孔加入100 μL TMB显色液,37 ℃孵育15 min后加入50 μL/孔终止液 (浓度为 2 mol/L的硫酸水溶液)。最后用酶标仪测定450 nm下的吸光值 (OD450)。
1.3.2 间接ELISA反应条件的优化
最适抗原包被浓度及最佳血清稀释倍数的确定:参照方阵滴定法将纯化复性后的重组蛋白按照 50 ng/孔、100 ng/孔、200 ng/孔、300 ng/孔、400 ng/孔包被96孔酶标板,H9N2亚型禽流感病毒阳性血清及 SPF鸡阴性血清分别按照1∶10、1∶20、1∶40、1∶80、1∶160和 1∶320稀释,按照上述ELISA操作方法进行操作,以阳性血清OD450的值接近1,阴性血清OD450小于0.1,且P/N值最大时的抗原包被及血清稀释作为最适抗原包被量及最佳血清稀释倍数。
封闭液及封闭时间的选择:按照确定的最佳抗原包被量包被96孔酶标板,分别以1%明胶、1% BSA、5%脱脂乳、PBS和复合封闭液 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,山羊血清50 mL/L,明胶溶液5 mL/L,酪蛋白2 g/L,蔗糖10 g/L,pH 7.2),各200 μL对酶标板进行封闭,每种封闭液重复4孔,按照ELISA操作方法进行操作,根据阴阳血清的OD450值及P/N值选择最佳封闭液。选用最优封闭液,改变封闭时间,分别封闭0.5 h、1 h、1.5 h和2 h,根据阴阳性血清OD450值及P/N值,选择最佳封闭时间。
抗体稀释液的选择:按照确定的最佳抗原包被量包被96孔酶标板,用复合封闭液进行封闭,分别用1% BSA、2%脱脂乳、PBS和复合抗体稀释液 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,山羊血清20 mL/L,酪蛋白1 g/L,蔗糖5 g/L,Tween-20 0.05%,pH 7.2) 来稀释血清及二抗,按照ELISA操作方法进行操作,根据阴阳血清的 OD450值及 P/N值选择最佳抗体稀释液。
酶标二抗稀释倍数及最适二抗孵育时间的确定:根据优化的最佳抗原包被量、抗体稀释倍数、封闭液及封闭时间将酶标二抗按照1∶1 000、1∶5 000、1∶10 000、1∶20 000稀释后加入,按照ELISA操作方法进行操作。根据P/N值选择最佳二抗浓度。其他条件不变,选择最适二抗稀释倍数孵育,改变二抗孵育时间,分别孵育0.5 h、1 h、1.5 h和2 h,根据阴阳性血清的OD450值及P/N值,筛选最佳二抗孵育时间。
1.4 临界值的确定
取30份通过HI试验验证为阴性的临床血清按照 1∶80稀释并按照已经建立的间接ELISA方法进行检测,测定 OD450。根据公式+3s计算出阳性判定值,公式中的为 HI阴性样品的 OD450的平均值,s为 HI阴性样品的标准方差。当待检血清的 OD450平均值≥+3s,则判定为阳性,当OD450<+2s则判定为阴性,介于二者之间则判定为可疑样品。
1.5 特异性试验
按照建立的间接 ELISA方法对 H3N2、H5N2、H7N9亚型的禽流感病毒及NDV、IBV、IBDV和EDSV的阳性血清进行检测,同时设立阳性对照 (H9N2亚型禽流感病毒阳性血清) 和阴性对照 (SPF鸡阴性血清),根据得到的OD450值判定其是否与其他亚型及其他常见禽类病毒的血清有交叉反应。
1.6 灵敏度试验
挑选20例HI效价为24-25之间的阳性样品血清,分别对其进行16、32、64、128、256和512倍稀释,再用稀释后的血清分别进行HI试验和间接ELISA试验,统计不同稀释倍数下二者的阳性率,从而比较两种方法的灵敏度。
1.7 重复性试验
1.7.1 批内重复性试验
在同一时间,同一条件下,采用同一批次重组蛋白包被96孔酶标板,分别选取5份阳性样品血清及阴性血清,每份血清重复 7个孔,按已建立的间接ELISA方法进行测定。得出标准差 (s) 及平均值 (),之后运用统计学分析,计算变异系数 (cv)。变异系数能够衡量各观测值的变异程度,反映各观测值在单位均值上的离散程度。
1.7.2 批间重复性试验
采用不同批次重组蛋白包被96孔酶标板,在3个不同时间按已建立间接ELISA最佳反应体系及条件测定 5份阳性样品血清及阴性血清(每份重复4个孔) 的OD450值,计算标准差 (s)、平均值 (),求出各样品的变异系数 (cv)。
1.8 间接ELISA与HI的相关性试验
取200份临床血清样品,分别用HI和间接ELISA对其进行检测,HI试验血凝抑制效价大于24判定为阳性,间接ELISA OD450大于阳性临界值判定为阳性。计算二者之间的符合率,并且根据每个样品的血凝抑制效价及间接 ELISA的OD450值,得到二者之间的相关性公式。
2 结果与分析
2.1 包被抗原的原核表达及纯化
2.1.1 重组表达载体的构建
将构建的载体转化大肠杆菌,挑取单个菌落进行菌落PCR及酶切鉴定。PCR扩增产物经1%琼脂糖凝胶电泳分析,在731 bp处出现特异性片段的为阳性克隆 (图1A)。将阳性克隆的质粒用BamHⅠ和XhoⅠ双酶切,进行1%琼脂糖凝胶电泳,在5 900 bp及731 bp左右有特异性条带 (图1B),与预期的结果相符。测序结果表明,目的基因序列正确,且未发生碱基突变,重组表达载体构建成功。
2.1.2 重组蛋白的表达、纯化与复性
重组表达菌经IPTG诱导后,取全菌超声破碎后的上清和沉淀进行SDS-PAGE,重组蛋白主要以包涵体的形式存在。将包涵体进行洗涤、Ni柱亲和层析及分子筛纯化后,再进行复性,得到纯度极高的目的蛋白 (图2A)。用H9N2亚型禽流感病毒阳性血清作为一抗,以HRP标记的羊抗鸡IgG作为二抗进行Western blotting,结果显示,目的蛋白可以与禽流感病毒 H9N2亚型禽流感病毒阳性血清发生特异性反应(图 2B)。
2.2 间接ELISA方法的建立
2.2.1 反应条件的优化
根据得到的阳性血清和阴性血清OD450值及P/N值可以得出最适抗原包被浓度为200 ng/孔,最佳血清稀释倍数为1∶80 (图3A),最适封闭液为复合封闭液 (图3C),最适封闭时间为2 h(图3E),最佳抗体稀释液为复合抗体稀释液 (图3D),酶标二抗按1∶10 000稀释时效果最好 (图3B) 且最适的酶标二抗孵育时间为1 h (图3F)。
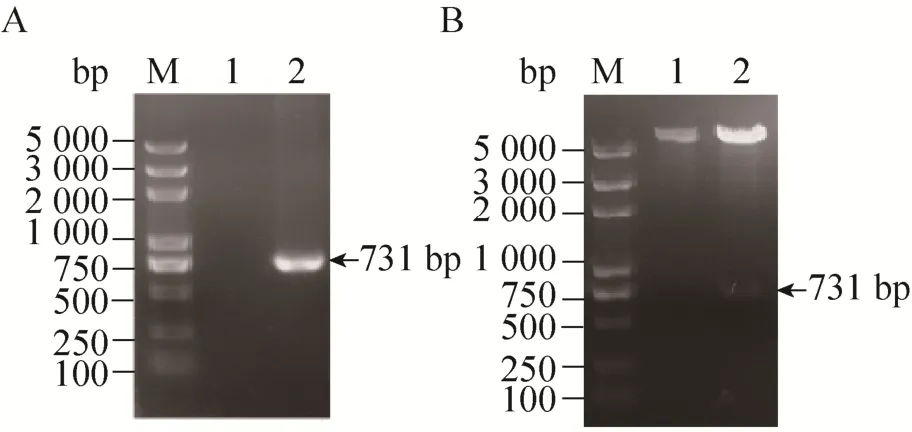
图1 菌落PCR及重组表达载体双酶切鉴定结果Fig. 1 The results of colony PCR and restriction enzyme digestion. (A) Colony PCR. M: DNA marker; 1:negative control; 2: PCR products. (B) Recombinant plasmid digested by restriction endonucleases. M: DNA marker; 1: negative control; 2: digested products.
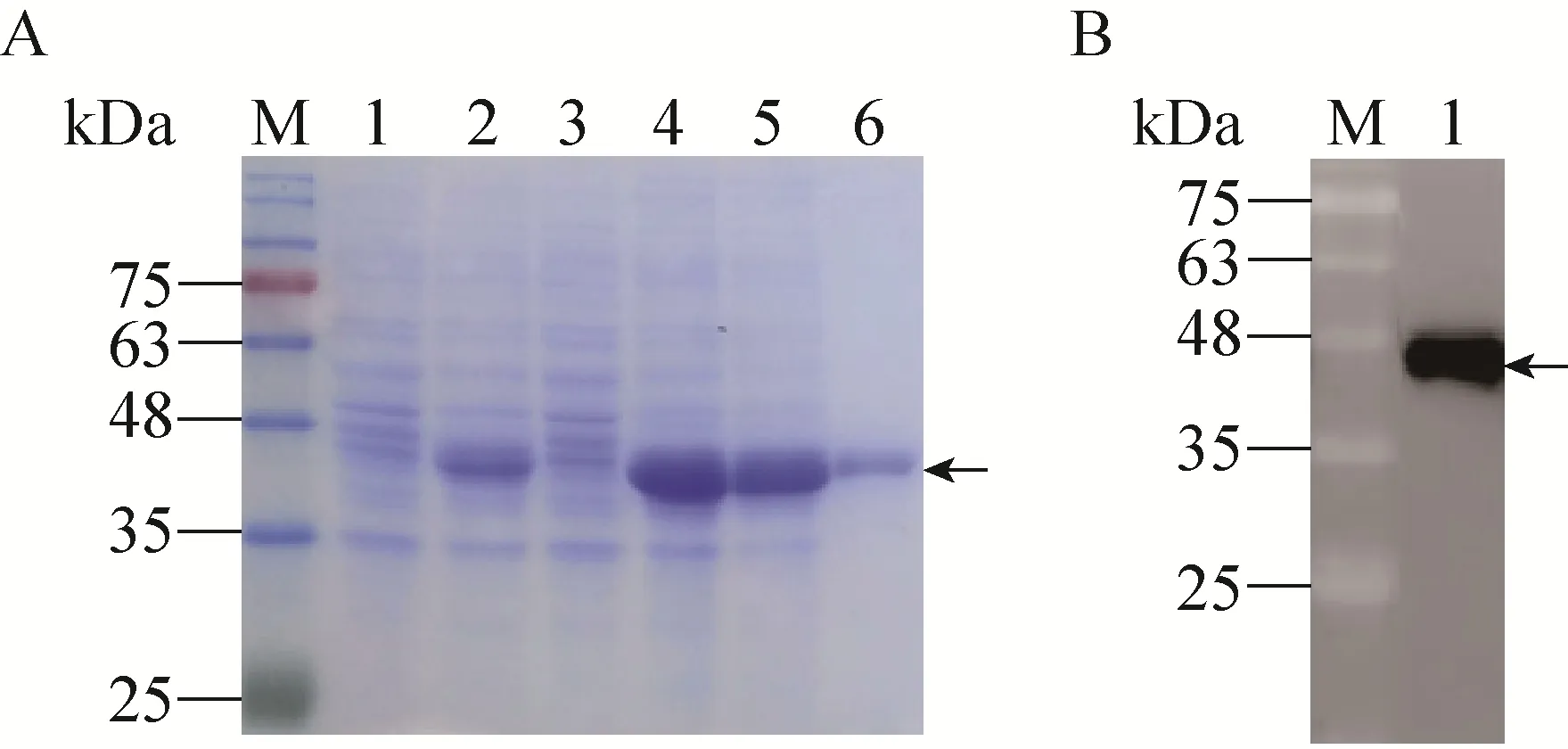
图2 重组蛋白的SDS-PAGE和Western blotting结果Fig. 2 SDS-PAGE and Western blotting analysis of the recombinant protein. (A) SDS-PAGE analysis. M: protein marker; 1: expressed products before IPTG induction; 2:expressed products after IPTG induction; 3: supernatant after lysis; 4: precipitation after lysis; 5: purified recombinant protein by nickel column; 6: purified recombinant protein by molecular sieve. (B) Western blotting analysis. M: protein marker; 1: purified protein.
2.2.2 ELISA判定标准的确定
用建立的 ELISA方法对 30份 HI检测为AIV阴性的样品血清进行检测,平均值为0.144,标准差为0.048 (表1)。当OD450≥+3s时,判定为阳性,OD450<+2s判定为阴性。根据以上公式可以确定,当 OD450≥0.289时判定为阳性,OD450<0.240时判定为阴性,介于二者之间则判定为可疑。
2.3 间接ELISA的特异性
将H3N2、H5N2、H7N9亚型AIV阳性血清以及NDV、IBV、IBDV和EDSV的阳性血清,按已经优化的间接 ELISA进行检测,同时设立阳性对照和阴性对照。结果显示,H3、H5及H7亚型禽流感病毒及其他常见禽类病毒的阳性血清的OD450均小于阳性判定值0.289 (表2),表明此间接 ELISA方法具有很好的特异性。

图3 ELISA工作条件的优化Fig. 3 Optimized working conditions of ELISA. (A) Concentration of antigen and dilution ratio of serum. (B)Dilution ratio of HRP-conjugated antibody. (C) Blocking reagent. (D) Antibody dilution. (E) Blocking time. (F)Action time of HRP-conjugated antibody.
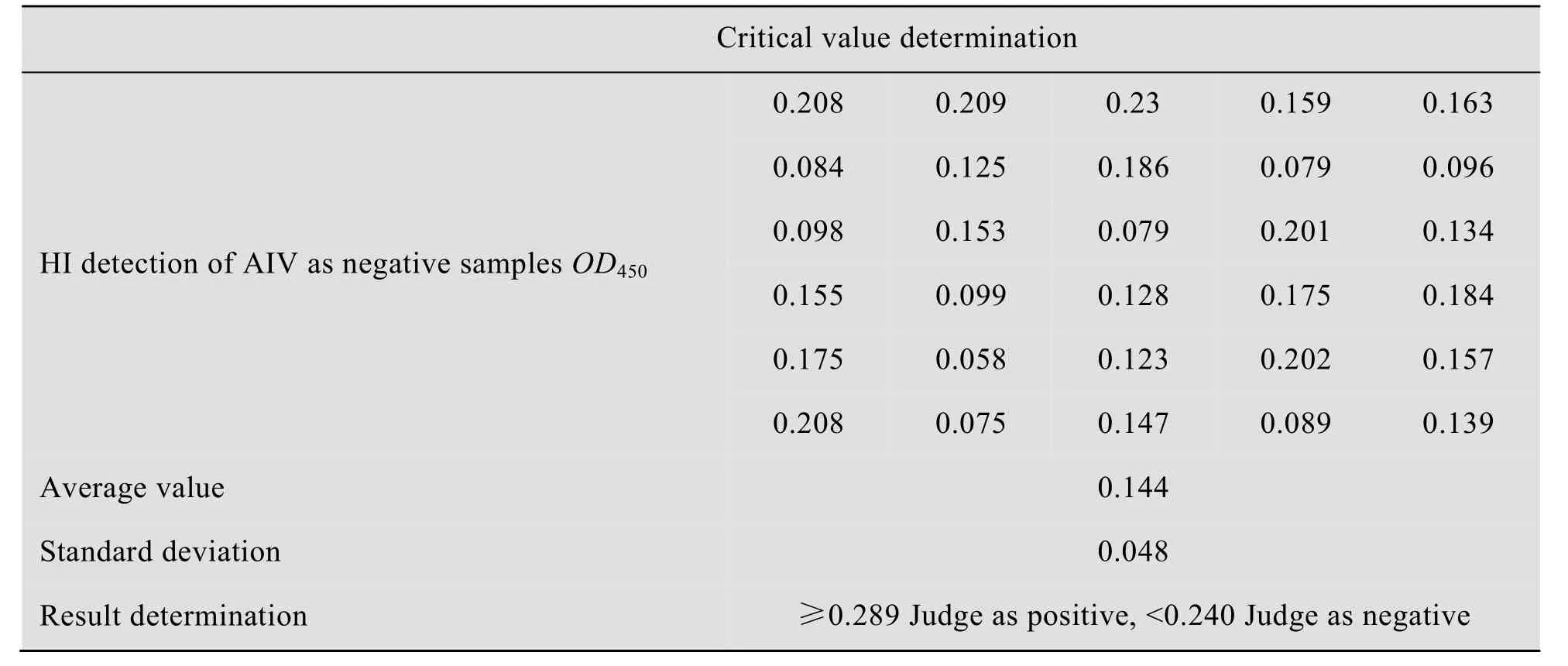
表1 间接ELISA判定标准的确定Table 1 Determination of the cut off value of the indirect ELISA

表2 间接ELISA的特异性Table 2 Specificity of the indirect ELISA
2.4 间接ELISA的灵敏度
将20份阳性血清按1∶16、1∶32、1∶64、1∶128、1∶256和 1∶512稀释,分别进行 HI试验和间接ELISA试验,结果显示HI试验阳性率分别为 60%、35%、0%、0%、0%和 0%,而间接ELISA试验的阳性率分别为100%、100%、100%、100%、40%和0% (表3)。由此可见,在同一稀释度时,间接 ELISA试验的阳性检出率高于HI试验,间接ELISA的灵敏度高于HI。
2.5 间接ELISA的重复性
2.5.1 间接ELISA的批内重复性
用同一批次的重组蛋白包被的96孔酶标板对不同血清样品进行测定,H9变异系数在1.720%-3.964%之间 (表4),均小于10%,说明同一样品在同一批试验中变异程度小,具有较好的批内重复性。
2.5.2 间接ELISA的批间重复性
在 3个不同时间,用不同批次的重组蛋白包被96孔酶标板检测5份阳性样品血清及阴性血清,变异系数在3.031%-7.077%之间 (表5),均小于 10%。说明同一样品在不同批次的试验中变异程度较小,具有较好的批间重复性。
2.6 间接ELISA与HI的相关性
选择常规的检测方法 HI与本研究建立的间接ELISA诊断方法同步检测200份临床鸡血清样品,结果显示二者符合率高达97% (表6)。
进一步分析200份鸡临床血清样品的HI及间接 ELISA结果发现,本研究建立的间接ELISA与HI血凝抑制效价存在很高的相关性,y=2.931 6x+2.590 7,R2=0.981 1,其中 x为 OD450值,y为HI效价取2的对数后的值 (图4)。

表3 间接ELISA的灵敏度Table 3 Sensitivity of the indirect ELISA

表4 间接ELISA的批内重复性Table 4 Intro-assay reproducibility of the indirect ELISA

表5 间接ELISA的批间重复性Table 5 Inter-assay reproducibility of the indirect ELISA

表6 间接ELISA与HI的符合率Table 6 Agreement between the indirect ELISA and HI test

图4 间接ELISA与HI的相关性Fig. 4 Correlation between the indirect ELISA and HI.The prediction equation is y=2.931 6x+2.590 7, R2=0.981 1,wherex is the OD450value. and y is the logarithm of HI titer to the base 2 of an individual serum sample.
3 讨论
H9亚型禽流感病毒虽然属于低致病性流感病毒,但因其暴发给养殖业造成的经济损失却不容小觑,H9亚型禽流感的防治问题一直是全球关注的难题。H9亚型流感病毒感染禽类后,虽然不会引起大规模死亡,但可引起轻度的呼吸道感染及产蛋率下降,且会破坏机体的免疫系统,导致家禽法氏囊淋巴滤泡数量减少、胸腺萎缩退化和骨髓细胞的变性和坏死,造成疫苗接种后的免疫抑制,免疫效果不理想。另外,H9亚型流感病毒的感染还会干扰其他疫苗的免疫效果,且易引起继发感染,最后导致家禽免疫力下降,死亡率上升[9-11]。H9亚型流感病毒还可能跨种间感染人类,进而转变为高致病性禽流感病毒[16-17],因此,H9亚型流感病毒的防控亟待解决。国内目前对 H9N2禽流感的防控措施主要为使用疫苗免疫,这在一定程度上控制了疫情的发展,但是个别地区仍有 H9N2疫情的发生[18-21],因此尽早掌握养殖动物的抗体水平,能更好地防控H9亚型流感病毒的传播和蔓延。
本研究建立的间接ELISA与HI试验的符合率高达97%,其灵敏度明显高于HI试验,且特异性较好,不与其他亚型禽流感病毒阳性血清发生交叉反应,与临床常见禽类疾病阳性血清也无交叉反应。此方法还具有较好的批内、批间重复性,能够在保证准确性及灵敏度的前提下节约大量的时间,更有利于大规模血清样本抗体效价的定性及定量检测。本研究建立的间接 ELISA方法利用原核表达的重组蛋白作为包被抗原,安全性较高,重组蛋白容易获得,能够大大降低生产成本,具有良好的临床应用潜力。
本研究选择H9N2亚型流感病毒HA蛋白的头部球状区作为包被抗原来检测血清中的抗体[22-23]。HA是构成病毒囊膜纤突的主要蛋白之一,在病毒吸附及穿膜过程中起着重要的作用,也是流感病毒引起机体产生中和抗体的主要抗原[24-25]。HA蛋白的头部球状区在不同亚型之间高度变异,是HA的主要抗原决定簇,可诱发机体产生中和抗体或引起细胞毒性 T淋巴细胞(CTL) 反应[26],因此选择该区域作为包被抗原将大大提高该间接ELISA的特异性,能够区分H9亚型与其他亚型禽流感病毒。
在ELISA实验中,封闭液和抗体稀释液的选择对整个实验的成败起到了关键性的作用。本研究对封闭液及抗体稀释液进行了优化,首次采用了特异性的复合封闭液和抗体稀释液。该复合封闭液与抗体稀释液与传统单一成分的封闭液和抗体稀释液相比,封闭效果更为特异、完全,能够有效封闭非特异性显色反应,减少了因封闭不完全造成的假阳性。即使阴性血清稀释倍数较低 (4倍),经该复合封闭液封闭后其OD450值仍低于0.1,优于其他几种传统的单一封闭液。原因可能是该复合封闭液中含有山羊血清,而本ELISA方法中所用二抗为HRP标记的羊抗鸡IgG,若包被抗原与二抗之间存在非特异性反应,则反应位点可被山羊血清提前封闭,避免了包被抗原中某些成分与二抗直接发生反应造成的非特异性显色。另外,在封闭液和抗体稀释液中还添加了蔗糖,蔗糖能够增强包被抗原的稳定性。
本研究对 200份临床鸡血清样品分别利用间接 ELISA和 HI方法进行检测,发现大部分HI效价相同的血清样本在 ELISA试验中的OD450(相同稀释倍数下) 值接近。进一步对大量数据进行分析整合,发现将HI效价取2的对数后的值与间接ELISA得到的OD450值呈线性相关,y=2.931 6x+2.590 7,R2=0.981 1,其中x为OD450值,y为HI效价取2的对数后的值。因此,用本方法可以根据ELISA得到的OD450值,初步估算其对应的HI效价。
本研究建立的ELISA方法具有良好的临床应用前景,在后续的研究中,我们将采用该ELISA方法对大规模的临床样品 (例如:同一亚型的不同毒株的感染血清) 进行检测,将获得的数据与HI结果比对,验证方法的可靠性。同时,进一步优化试验条件,增强ELISA试剂盒的稳定性,以期尽早获得稳定、灵敏、快速且便于临床应用的产品。
REFERENCES:
[1] Collin EA, Sheng ZZ, Lang YK, et al. Cocirculation of two distinct genetic and antigenic lineages of proposed influenza D virus in cattle. J Virol, 2015,89(2): 1036–1042.
[2] Nayak B, Kumar S, DiNapoli JM, et al.Contributions of the avian influenza virus HA, NA,and M2 surface proteins to the induction of neutralizing antibodies and protective immunity. J Virol, 2010, 84(5): 2408–2420.
[3] Ducatez MF, Becker J, Freudenstein A, et al. Low pathogenic avian influenza (H9N2) in chicken:evaluation of an ancestral H9-MVA vaccine. Vet Microbiol, 2016, 189: 59–67.
[4] Alexander DJ. An overview of the epidemiology of avian influenza. Vaccine, 2007, 25(30): 5637–5644.
[5] Cox NJ, Subbarao K. Global epidemiology of influenza: past and present. Annu Rev Med, 2000,51(1): 407–421.
[6] Brown IH. Summary of avian influenza activity in Europe, Asia, and Africa, 2006–2009. Avian Dis,2010, 54(S1): 187–193.
[7] Saito T, Lim W, Suzuki T, et al. Characterization of a human H9N2 influenza virus isolated in Hong Kong. Vaccine, 2001, 20(1/2): 125–133.
[8] Fusaro A, Monne I, Salviato A, et al. Phylogeography and evolutionary history of reassortant H9N2 viruses with potential human health implications. J Virol, 2011, 85(16): 8413–8421.
[9] Parvin R, Heenemann K, Halami MY, et al.Full-genome analysis of avian influenza virus H9N2 from Bangladesh reveals internal gene reassortments with two distinct highly pathogenic avian influenza viruses. Arch Virol, 2014, 159(7): 1651–1661.
[10] Li CJ, Yu KZ, Tian GD, et al. Evolution of H9N2 influenza viruses from domestic poultry in Mainland China. Virology, 2005, 340(1): 70–83.
[11] Alexander DJ. A review of avian influenza in different bird species. Vet Microbiol, 2000, 74(1/2):3–13.
[12] Liu D, Shi WF, Gao GF. Poultry carrying H9N2 act as incubators for novel human avian influenza viruses. Lancet, 2014, 383(9920): 869.
[13] Eisfeld AJ, Neumann G, Kawaoka Y. Influenza A virus isolation, culture and identification. Nat Protoc,2014, 9(11): 2663–2681.
[14] Shiraishi R, Nishiguchi A, Tsukamoto K, et al.Comparison of commercial enzyme-linked immunosorbent assay kits with agar gel precipitation and hemagglutination-inhibition tests for detecting antibodies to avian influenza viruses. J Vet Med Sci,2012, 74(9): 1217–1220.
[15] Katz JM, Hancock K, Xu X. Serologic assays for influenza surveillance, diagnosis and vaccine evaluation. Expert Rev Anti-infe. 2011, 9(6):669–683.
[16] Cameron KR, Gregory V, Banks J, et al. H9N2 subtype influenza A viruses in poultry in pakistan are closely related to the H9N2 viruses responsible for human infection in Hong Kong. Virology, 2000,278(1): 36–41.
[17] Lin YP, Shaw M, Gregory V, et al. Avian-to-human transmission of H9N2 subtype influenza A viruses:relationship between H9N2 and H5N1 human isolates. Proc Natl Acad Sci USA, 2000, 97(17):9654–9658.
[18] Huang YW, Li XD, Zhang H, et al. Human infection with an avian influenza A (H9N2) virus in the middle region of China. J Med Virol, 2015, 87(10):1641–1648.
[19] Lindh E, Ek Kommonen C, Vaananen VM, et al.Molecular epidemiology of H9N2 influenza viruses in Northern Europe. Vet Microbiol, 2014, 172(3/4):548–554.
[20] Lin ZP, Xu CT, Liu B, et al. Analysis of the phylogeny of Chinese H9N2 avian influenza viruses and their pathogenicity in mice. Arch Virol, 2014,159(10): 2575–2586.
[21] Wang Q, Ju L, Liu P, et al. Serological and virological surveillance of avian influenza A virus H9N2 subtype in humans and poultry in Shanghai,China, between 2008 and 2010. Zoonoses Public Health, 2015, 62(2): 131–140.
[22] Hancock K, Veguilla V, Lu X, et al. Cross-reactive antibody responses to the 2009 pandemic H1N1 influenza virus. New Engl J Med, 2009, 361(20):1945–1952.
[23] Mavrouli MD, Routsias JG, Maltezou HC, et al.Estimation of seroprevalence of the pandemic H1N1 2009 influenza virus using a novel virus-free ELISA assay for the detection of specific antibodies. Viral Immunol, 2011, 24(3): 221–226.
[24] Kodihalli S, Goto H, Kobasa DL, et al. DNA vaccine encoding hemagglutinin provides protective immunity against H5N1 influenza virus infection in mice. J Virol, 1999, 73(3): 2094–2098.
[25] Wilks S, De Graaf M, Smith DJ, et al. A review of influenza haemagglutinin receptor binding as it relates to pandemic properties. Vaccine, 2012,30(29): 4369–4376.
[26] Walker JA, Kawaoka Y. Importance of conserved amino acids at the cleavage site of the haemagglutinin of a virulent avian influenza A virus.J Gen Virol, 1993, 74(2): 311–314.
(本文责编 陈宏宇)
Establishment of a high sensitive indirect ELISA for detecting specific antibodies against H9 subtype avian influenza virus
Wei Zhang1,2, Lidan Hou3, Jie Song1,2, Shuang Zhang1, Yun Li1, Jing Li1, Lei Sun1,2,Wenhui Fan1, and Wenjun Liu1,2
1 CAS Key Laboratory of Pathogenic Microbiology and Immunology, Institute of Microbiology, Chinese Academy of Sciences,Beijing 100101, China 2 University of Chinese Academy of Sciences, Beijing 100049, China 3 China Institute of Veterinary Drug Control, Beijing 100081, China
H9 subtype avian influenza virus causes worldwide epidemic, resulting in enormous economic losses of poultry production. In the present study, an indirect ELISA method was established for more accurate and specific detection.The recombinant protein of the globular head domain of HA of H9 subtype avian influenza virus was used as antigen.Specific blocking buffers and dilution buffers were determined to increase the sensitivity and specificity. The sensitivity of ELISA was higher than that of hemagglutination inhibition (HI) test. The coating antigen is very specific and no cross-reactivity with positive serum against H3N2, H5N2 and H7N9 subtype influenza viruses, Newcastle disease virus,avian infectious bronchitis virus, avian infectious disease virus, and egg drop syndrome virus. Two hundred of clinical sera samples were examined. The results indicate the coincidence rate between ELISA and HI test reached 97%. In addition,there was a positive correlation between OD450values and the logarithm of HI titer to the base 2 of an individual serum sample (R2=0.981 1).
H9 subtype, avian influenza virus, hemagglutinin, indirect ELISA, hemagglutination inhibition test
December 16, 2016; Accepted: February 13, 2017
s:Wenhui Fan. Tel: +86-10-64807503; E-mail: fanwenhui78@aliyun.com Wenjun Liu. Tel: +86-10-64807497; E-mail: liuwj@im.ac.cn
Supported by: The National Key Research and Development Program of China (Nos. 2016YFD0500800, 2016YFC1200803).
国家重点研发计划项目 (Nos. 2016YFD0500800, 2016YFC1200803) 资助。
时间:2017-02-20
:http://www.cnki.net/kcms/detail/11.1998.Q.20170220.1415.001.html

