基因芯片早期检测中枢神经系统感染耐药基因
王海波,陈建,张春秀,管义祥,张强
·论著·
基因芯片早期检测中枢神经系统感染耐药基因
王海波,陈建,张春秀,管义祥,张强
目的 探讨基因芯片技术在早期快速检测中枢神经系统感染耐药基因的临床意义。方法 选取6种常见耐药基因的特异性DNA序列,设计并制作PCR引物及相应的探针,对60例中枢神经系统感染患者的脑脊液行基因芯片检测耐药基因及病原菌,将结果与传统脑脊液培养方法进行对比。结果 传统脑脊液培养方法确诊中枢神经系统感染24例;基因芯片方法确诊中枢神经系统感染30例,并鉴定出菌种及耐药基因,另有30例未鉴定出菌种,但仍多数检出了耐药基因。结论 基因芯片技术可以早期快速并灵敏的检测出中枢神经系统感染细菌的耐药基因,在早期明确诊断方面明显优于脑脊液细菌培养法。
基因芯片;中枢神经系统感染;耐药基因
中枢神经系统(CNS)感染是神经外科的常见病症,常常来势凶险,临床治疗难度大[1],需要早期足量使用有效抗生素。大多数情况下明确诊断CNS感染需要依靠脑脊液(CSF)细菌培养,而CSF细菌培养用时较长,还极易受外部情况影响,并且有的很难培养,所以CSF细菌培养的阳性率不足10%[2]。同时由于耐药基因 (drug resistance genes, DRGs )的存在,很多患者往往得不到及时有效的救治。现实中由于各种原因使得抗生素的大量使用,这导致菌株变异及出现耐药性,单纯依靠CSF细菌培养进行致病菌的鉴定明显滞后于临床治疗。现今找到最新的技术来解决早期快速准确诊断CNS细菌感染显得很迫切。基因芯片技术能在菌种不明的情况下快速准确诊断病原菌及DRGs,从而能解决如何选择最佳药物及怎样合理用药等难题[3],并且它具有快速、高效、操作简单、敏感度及准确性高等优点。本研究中我们设计及制作了小型基因芯片,同时选择CNS感染常见致病菌的DNA特异序列,探讨基因芯片早期检测CNS感染DRGs的临床意义。
1 资料与方法
1.1 病例选择及标本采集 根据南通大学附属海安医院神经外科常见CNS感染的高危因素并结合常见的临床CSF细菌感染症状选择实验病例。选择从2010年1月到2016年6月我院临床上高度怀疑CNS感染病例60例,其中24例CSF培养阳性,包括10例金黄色葡萄球菌(staphylococcusaureus,SA)、6例肺炎克雷伯菌(Klebsiellapneumoniae,KNP)、4例大肠杆菌(escherichiacoli,E.coli)以及4例肺炎双球菌(pneumococci,PC)。临床诊断CNS感染参考Harrison标准[4],检测的所有菌种是根据文献报道临床常见的致病菌确定,并结合神经外科开颅手术后CSF感染的特点[5]。主要有SA、KNP、E.coli及PC,同时选取它们的6个常见DRGs(meeA、OXA-23、SHV、CTX-M、TEM、PBPla)进行检测。取5~8 ml CSF送细菌培养,取2 ml CSF送基因芯片检测。所有CSF标本要求在1 h内送检。
1.2 主要仪器及试剂仪器 分子杂交箱(ThermoHybaid,德国),GenPix Pro 6.0图像扫描和分析软件(Axon Instruments/Molecular Devices Corp,美国),OmniGridTM 100微阵列点样(GeneMachine,美国), PMC-082芯片离心机(TOMY,日本),日立公司低温离心机, GenPix 400B共聚焦激光扫描仪(Axon Instruments,美国)。试剂:Dneasy Blood & Tissue Kit(Qiagen,美国),光学级醛基化修饰芯片(博奥生物有限公司,北京),Cy3-dUTP(pharmacia公司),引物与探针(上海Invitrogen公司合成)。
1.3 实验方法
1.3.1 CSF标本的细菌培养与药敏 细菌培养:选取接种环挑取浑浊CSF,后接种于巧克力琼脂平板或血琼脂平板上,在5% CO2培养箱中培养,设置35℃,24~48 h后涂片检查,观察菌群形态,鉴定何种细菌。药敏步骤:接种环挑取上述的菌落,接种于肉汤培养皿中培养24 h,将增殖菌移至备有各种抗生素溶液的20孔板中,6 h后根据颜色培养药敏结果。
1.3.2 基因芯片技术
1.3.2.1 CSF细菌DNA的提取 根据试剂盒操作说明书进行操作:选取CSF标本约2 ml在离心机中以8000xg离心10min,弃上清;加取等量灭菌生理盐水充分震荡,后悬浮沉淀,而后再次以8000xg离心10min,弃上清;加入180μL DNA裂解液,充分混匀震荡,37℃下温浴30min;加入25μL蛋白酶K,56℃下温浴30min;加入200μL乙醇,样本DNA通过离心柱提取。
1.3.2.2 引物设计及探针合成 在NCBI网站(http//www.ncbi.ulm.aih.gov/entrez)的Genbank数据库中筛选出6种DRGs的特异DNA序列,进行分析后,筛选靶序列。由Primer Premier 5.0软件设计菌株的PCR引物,选取细菌所共有的16S基因设计引物和探针来作为阳性对照物,所有引物和探针序列用Blast软件对探针进行比较分析,排除同源性,由上海Invitrogen公司合成(表1)。

表1 多重PCR引物及芯片杂交探针序列

(续表1)
1.3.2.3 聚合酶链式反应(PCR)扩增DNA 将提取的DNA用PCR扩增,加入一定浓度的Cy3-dUTP荧光标记物至反应底物中,使其混入PCR扩增产物中,杂交后作为激光扫描仪扫描检测的标记。实验分两组:第一组进行微生物检测,第二组进行DRGs检测;以实验用水为阴性对照。扩增条件:95℃预变性30min,95℃变性5min,56℃退火31min,72℃延伸30min,35个循环。在冰上进行反应液配置,每个样品重复3次。PCR产物分两份,一份用于行琼脂糖凝胶电泳;另一份避光保存于4℃冰箱,用于基因杂交。PCR产物予琼脂糖凝胶电泳后判定结果:制备2%的琼脂糖凝胶,待凝胶完全凝固,后将凝胶置入电泳槽中,电泳缓冲液超过胶面1cm,取10 uL PCR扩增产物和2 uL的6*上样缓冲液混合,把混合物加入样品槽中。盖上电泳槽,选用电压为150V,15min电泳时间。切断电源,打开槽盖,用BIO-RAD凝胶成像系统下自显影观察条带,并记录结果。
1.3.2.4 基因芯片的制备 首先对基片予活化处理,后用点样液将合成的Oligo(探针)稀释至浓度50mmol/L,并放入384孔板, 每孔10 uL。用点样仪点样探针于活化的基片上,点样矩阵为10*7,各点随机排列,每个探针位点重复3次(图1)。点样后将芯片洗净、固定,并离心甩干,于干燥箱中保存备用。
1.3.2.5 基因芯片杂交与结果判定 将杂交液与备用的Cy3荧光标记聚合酶链式反应产物按2∶1比例离心机下混匀后的混合液在48℃下进行2h热变性,待冰浴骤冷,加样在芯片上的点样区。封片后于42℃下水浴杂交2~3h,杂交结束后再清洗甩干,应用GenPix 400B共聚焦激光扫描仪(波长532nm)进行扫描。通过GenPix Pro 6.0图像扫描和分析软件提取每个探针位点的荧光信号强度值,除去低信号位点,探针信号大于cutoff值(SNR=3.0)的视为有效信号。
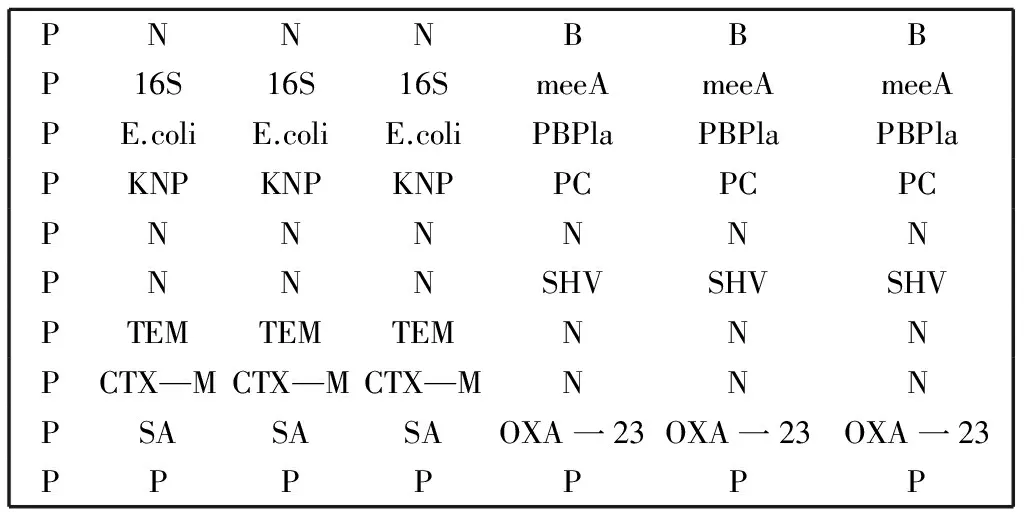
图1 DRGs检测芯片排布图
注:P:positioning probe;N:negative control probe; B:blank control
2 结 果
多重PCR:根据在Genbank数据库中筛选出的6种我院常见颅内CSF感染细菌的DRGs及四种常见细菌的特异DNA序列,设计出10对相应的引物,并将其应用于CSF标本致病菌DNA的扩增,扩增产物经琼脂糖凝胶电泳,可见相应的清晰条带(图1),显示设计的引物序列有效、特异。
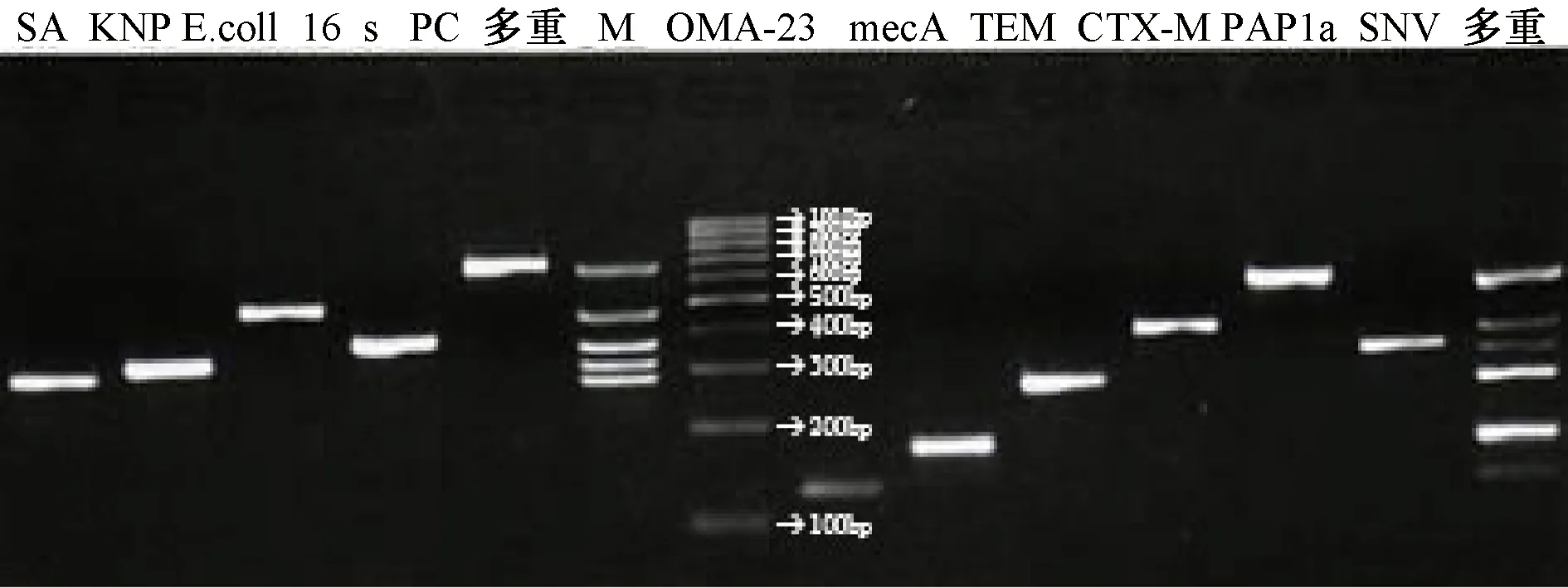
图1 常见CNS感染细菌基因检测的PCR产物电泳图Lane 1,Staphylococcus aureus; 2, Klebsiella pneumoniae;3, Escherichia coli; 4, 16S; 5, Streptococcus pneumoniae;6,multiplex PCR of bacteria;7, Marker; 8, OXA-23; 9, mecA; 10, TEM; 11, CTX-M; 12, PBP1a; 13, SHV;14, multiplex PCR of resistance genes
24例CSF培养阳性的标本均鉴定出与培养一致的菌种。CSF培养结果和基因芯片比较24例细菌培养阳性的CSF标本通过基因芯片均鉴定出菌种,并检出DRGs(图2A),其中SA10例,KNP6例,E.coli 4例,PC4例,与细菌培养结果一致。余下的细菌培养阴性的36例标本中仍有6例通过基因芯片鉴定出菌种及DRGs(图2B),其中SA2例,E.coli 4例。故基因芯片方法确诊CNS感染30例,并鉴定出菌种及DRGs;未检测出菌种的余下30例中有16例只检出16S基因,未检出菌种,但多数(12例)检测出DRGs(图2C);14例未检出16S基因及DRGs(图2D)。

图2 基因芯片检测举例A:Klebsiella pneumoniae+16S+CTX-M、TEM、SHV;B:Escherichia coli+16S+TEM;C:16S+mecA;D:negative
3 讨 论
CNS感染的病原菌众多[6-7],在医疗工作中,不同的菌种有不同的检测程序[8]。目前诊断CNS感染的“金标准”是细菌培养,同时还有很多临床医生依据临床、CSF常规、生化及血常规等综合指标来推测可能的病原菌感染[9]。而如今抗生素的广泛使用可引起致病菌株变异及产生耐药性,故抗生素治疗效果常常不理想。怎样选择合理有效的抗菌药物难度变大,故找到新的技术来解决如何快速、准确明确致病菌变的很紧迫。
基因芯片技术具有检测范围广、检测速度快、样品用量少等特点,同时病原体的遗传信息可以通过基因芯片技术准确、快速、高效地显示。目前它已被广泛使用于病原微生物的快速诊断、基因序列分析、基因分型、变异及耐药机制研究、分子流行病学调查和抗感染药物研制等方面[10-11]。基因芯片技术不仅可以快捷地检测出耐药性菌株,进行细菌诊断、鉴别诊断、耐药性监测,而且可以检测引起细菌耐药的基因突变。如今基因芯片技术发展迅猛,目前检测操作简便同时效率高,在特短时间内已能用特少量的样品检测获得多个基因的有效信息。标本中只要含有微量的DNA,甚至哪怕存在部分降解的DNA序列,通过PCR技术也可对样本实施扩增,最终检测出相应的致病菌[12]。抗菌治疗药物是影响CSF细菌培养检出率的最重要因素,而通过PCR技术扩增靶细菌,可明显减少这方面的影响。多种病原菌或DRGs可以通过多重PCR技术同时检测,针对大量样品序列可以一次进行检测和分析。
本课题通过基因芯片技术原理[13],进行了6个DRGs和4种细菌的检测,1d内完成了对可疑CSF标本的检测,这证明基因检测手段是十分高效的[14], 对CNS感染的病原菌进行早期检测非常适用。通过基因芯片技术确诊30例CNS细菌感染病例,未检测出菌种的余下30例中有16例只检出16S基因,未检出菌种,但多数(12例)检测出DRGs,其原因在于我们所制备的PCR底物不包括这些致病菌的特异性DNA序列,但这些细菌仍保留着16S rRNA基因[15]。有36例CSF标本培养阴性,提示未能培养出致病菌,而基因芯片技术鉴定出菌种且检测结果与CSF培养相一致,甚至于检测出CSF培养阴性的CNS细菌感染。这充分证明:基因芯片技术在早期诊断CNS感染上有显著优势。并且有阳性菌种鉴定结果的标本均未出现两种及以上的鉴定结果,这说明基因芯片技术特异性很高。
致病菌产生耐药性是微生物界的常见现象。在CSF培养阴性的情况下,DRGs检测结果是唯一可供参考的指标。菌种不明的情况下可以通过基因芯片技术早期快速检测出常见的DRGs,而后根据不同DRGs的作用机制,为早期正确合理使用有效抗生素指明方向[16]。通过对病原体耐药性的分子遗传学基础研究及同时对细菌耐药性检测及耐药机制研究表明:可通过不同机制细菌可以产生耐药性的基因改变。故找到耐药菌的DRGs,从而为临床治疗实现针对性用药提供理论依据,这变得非常重要及有意义。本研究中基因芯片的检测结果与药敏试验结果相印证,这证明了DRGs检测的可靠性。根据对DRGs的检测,还可避免选择耐药抗生素。基因芯片检测具有简便、快速、准确、稳定等优点,对于临床样本检测及流行病学的现场调查非常适用[17-18]。当然基因芯片技术目前也有许多缺点需要解决,但随着基因芯片技术的发展,对于CSF细菌培养阳性率低的疾病而言,基因芯片技术早期检测DRGs将有很好的应用前景。
[1] 张冰琰,陈晨,虞胜镭,等.成人开颅术后并发细菌性脑膜炎的危险因素分析[J].中华临床感染病杂志,2014,7:202.
[2] 张昆南,许自强,王朝东等.CSF中检测结核分枝杆菌特异性抗原对结核性脑膜炎的诊断意义[J].中华神经科杂志,201l,44:86-90.
[3] Thissen JB,Mcloughlin K,Gardner S,etal.Analysis of sensitivity and rapid hybridization of a multiplexed Microbial Detection Microarray[J].J Virol Methods,2014,201:73.
[4] 《应用抗菌药物防治外科感染的指导意见》撰写协作组.应用抗菌药物防治外科感染的指导意见(草案)Ⅻ-神经外科感染的防治[J].中华外科杂志,2004,42:823.
[5] 隗世波,刘青云,周游,等.神经外科患者颅内感染病原菌分布及耐药性分析[J].中华医院感染学杂志,2014,24:847.
[6] 申学明,王序,高安举,等.颅内感染患者病原菌分布与耐药性监测[J].中华医院感染学杂志,2016,26:3.
[7] Mccarthy M,Rosengart A,Schuetz AN,etal.Mold infections of the central nervous system[J].N Engl J Med,2014,371:150.
[8] 肖学文.结核分枝杆菌蛋白芯片法检测对结核病辅助诊断的应用[J].中国热带医学,2015,10:1238.
[9] Melvin AJ,Mohan KM,Schiffer JT,etal.Plasma and cerebrospinal fluid herpes simplex virus levels at diagnosis and outcome of neonatal infection[J].J Pediatr,2015,166:827.
[10] Kim YK,Lim SI,Cho YY,etal.The CSFV DNAChip:a novel diagnostic assay for classical swine fever virus[J].J Virol Methods,2014,204:44.
[11] Boch T,Reinwald M,Postina P,etal.Identification of invasive fungal diseases in immunocompromised patients by combining an Aspergillus specific PCR with a multifungal DNA-microarray from primary clinical samples[J].Mycoses,2015,58:735.
[12] Palka-Santini M,Puetzfeld S,Cleven BE,etal.Rapid identification,virulence analysis and resistance profiling of Staphylococcus aureus by gene segment-based DNA microarrays:Application to blood culture post-processing[J].J Microbiol Methods,2007,68:468.
[13] Nimse SB,Song K,Sonawane MD,etal.Immobilization techniques for microarray:challenges and applications[J].Sensors (Basel),2014,14:22208.
[14] Shi JR,Wu YD,Cai MT,etal.Rapid diagnosis of herpetic encephalitis in children by PCR-microarray technology for simultaneous detection of seven human herpes viruses[J].Eur J Pediatr,2010,169:421.
[15] 薛建哑,翁心华,朱利平,等.细菌l6S rRNA基因芯片的构建及其在细菌鉴定中的应用[J].第二军医大学学报,2007,28:919.
[16] Bruant G,Maynard C,Bekal S,etal.Development and validation of an oligonucleotide microarray for detection of multiple virulence and antimicrobial resistance genes in Escherichia coli[J].Appl Environ Microbiol,2006,72:3780.
[17] 李硕驰,李海鹏,汤海亮,等.生物芯片技术在中枢神经系统感染性疾病应用方面的研究进展[J].中南医学科学杂志,2016,5:586.
[18] Cenciarini-Borde C,Courtois S,La Scola B.Nucleic acids as viability markers for bacteria detection using molecular tools[J].Future Microbiol,2009,4:45.
(收稿2016-11-16 修回2016-12-21)
Early detection of resistance genes in the central nervous system infection by gene chip technology
WANGHai-bo,CHENJian,ZHANGChun-xiu,etal.
DepartmentofNeurosurgery,HaianHospitalAffiliatedtoNantongUniversity,Nantong226600,China
CHENJian
Objective To investigate the clinical significance of the gene chip technology for early detection of resistance genes in the central nervous system(CNS) infection .Methods Six kinds of common resistance gene-specific DNA sequences were selected to design and produce the corresponding PCR primers and probes to detect resistant genes and pathogens in 60 cases of cerebrospinal fluid(CSF) of patients with CNS infections,and cerebrospinal fluid culture results with the conventional method were for comparison.Results CSF confirmed the traditional culture methods were 24 cases of CNS infection,gene chip intracranial infections were diagnosed in 30 cases,intracranial infection pathogens and resistance genes identified,and another 30 cases of unidentified species,but most resistance genes still detected.Conclusion Gene chip technology can quickly and sensitive detect bacterial resistance genes in patients with CNS infections in early stage,and the technology is superior to cerebrospinal fluid bacterial culture for rapid clearly diagnosis.
gene chip;central nervous system infection;resistance gene
南通市社会发展科技计划资助项目(S10935)
22660南通 ,南通大学附属海安医院神经外科(王海波,管义祥,张强);南通大学附属医院神经外科(陈建);生物芯片上海国家工程研究中心研发部(张春秀)
陈建
10.3969/j.issn.1672-7770.2017.04.013
R446.5
A
1672-7770(2017)04-0291-05

