Rap2a在胶质瘤中的表达及其意义
王诗筌,王雷,施恒亮,朱炳鑫,朱玉辐,于如同
·论著·
Rap2a在胶质瘤中的表达及其意义
王诗筌,王雷,施恒亮,朱炳鑫,朱玉辐,于如同
目的 探讨Rap2a在胶质瘤中的表达及其意义。方法 应用Western blot检测Rap2a在胶质瘤组织中的表达情况;在胶质瘤细胞U251、U87中转染Rap2a质粒,应用细胞克隆形成实验和EdU实验检测过表达Rap2a对U251、U87细胞增殖的影响;应用流式细胞术检测过表达Rap2a对U251、U87细胞周期的影响。结果 Rap2a在胶质瘤组织中呈低表达;过表达Rap2a抑制了U251、U87的增殖;过表达Rap2a明显使细胞U251、U87的细胞周期阻滞在G0/G1期。结论 Rap2a的蛋白表达水平在胶质瘤组织中表达下调,过表达Rap2a抑制胶质瘤细胞的增殖能力。
胶质瘤;Rap2a;细胞周期;细胞增殖
胶质瘤是中枢神经系统最常见、死亡率最高的原发性脑肿瘤,是威胁人类生命最主要的疾病之一,约占全部原发性神经系统肿瘤的40%~60%,年发病率5~10/10万[1-2]。胶质瘤的发生是多种基因突变及异常表达的结果,包括原癌基因的活化、抑癌基因表达受抑制、细胞周期调节相关基因表达异常以及细胞代谢和信号传导等多种机制异常的病理过程。在胶质瘤中Ras信号通路是一个主要的致癌通路,Rap2a属于Ras超家族成员之一,在多种人类细胞中扮演着多种生物学功能,包括信号转导、细胞增殖、细胞侵袭和迁移等[3-4]。但是Rap2a在胶质瘤中的作用及其机制至今未见报道。本研究中主要探讨Rap2a在胶质瘤组织中的表达以及其意义。
1 材料与方法
1.1 材料
1.1.1 脑胶质瘤标本 手术标本取自徐州医学院附属医院神经外科2009年12月~2012年7月手术切除的人脑胶质瘤新鲜标本35例、脑外伤行内减压手术而取得的新鲜脑组织标本15例(所取标本已征得患者及其家属同意并通过医院伦理委员会的审查)。肿瘤标本均取自瘤中央,未电凝,无囊变坏死组织,取得后立即置于液氮中冻存备用。35例脑胶质瘤中,男19例,女16例,男女比例为1.18∶1。患者年龄最小为1岁6个月,最大为70岁,平均年龄为44.70岁。患者均为原发起病且第一次手术,术前均未行抗肿瘤治疗,术后病理结果证实均为胶质瘤,按2000年WHO胶质瘤分级标准分级,其中Ⅰ级1例,Ⅱ级11例,Ⅲ级12 例,Ⅳ级11例。
1.1.2 细胞系 U251和U87细胞系购自中国科学院上海细胞库;人脑胶质母细胞瘤单克隆成系,WHO 203年分级标准为Ⅲ级和Ⅳ级。细胞为贴壁生长,采用DMEM/F12培养基培养。
1.1.3 质粒、抗体和试剂pCI-Neo-myc-Rap2a真核表达载体及pCI-Neo-myc由日本Kariya教授馈赠。Rap2a、GAPDH抗体购自Abcam公司,myc-tag抗体购自Santa Cruz公司。DMEM/F12培养基购自美国GIBCO公司;FBS胎牛血清购自杭州四季青公司;ECL发光试剂购自中国碧云天生物技术研究所;EdU试剂盒购自广州锐博公司。
1.2 方法
1.2.1 细胞培养 将传代的细胞放入37℃、5%CO2饱和湿度培养箱中培养,6~7h后细胞贴壁生长,细胞培养2~3d后,处于对数生长期,即可传代或用于后续试验。
1.2.2 细胞转染 将处于对数生长期的目的细胞进行胰酶消化,制成细胞悬液接种于6孔板中,培养箱中培养,使其细胞融合达 60%~70%,使用转染试剂ployjet分别与myc空质粒和myc-Rap2a质粒混合,混合物静置20min后加入细胞中,6 h后换新鲜培养基继续培养,48 h后收集细胞提取蛋白或进行相关实验。
1.2.3 蛋白免疫印记法(Western blot) 将提取的组织或细胞总蛋白采用MicroBradford法测定蛋白浓度,根据所测的细胞浓度配平细胞总蛋白。将配平的蛋白样品在垂直电泳槽上通过聚丙烯酰胺凝胶电泳分离(5%浓缩胶,12%分离胶),以100V电压,电泳约2h。电泳结束后,根据蛋白样品上样情况和蛋白质分子量,切取适当大小的分离胶。取适当大小甲醇激活的PVDF膜,以半湿电转仪转膜,转膜电压100V,时间约为120min。转膜后的条带在3% BSA封闭液中封闭2h。用Rap2a(1∶500)、GAPDH(1∶1000)、Myc(1∶2000)一抗4℃孵育过夜进行免疫印迹;TBST洗涤后,将条带放入辣根过氧化物酶标记的二抗(1∶3000)中室温孵育2h。ECL发光化学试剂在胶片上显影条带。采用Image J软件进行分析蛋白条带灰度值和面积。
1.2.4 EdU实验 细胞转染48h后,采用EdU渗入法检测细胞增殖情况,方法如下:用细胞培养基按1∶1000的比例稀释EdU溶液(试剂A),制备适量50μM EdU培养基;每孔加入100μl 50μM EdU培养基孵育2h,弃培养基;PBS清洗细胞2次,每次5min。每孔加50μl 4%多聚甲醛,室温孵育30min,弃固定液;每孔加入50μl 2mg/ml甘氨酸,脱色摇床孵育5min,弃甘氨酸溶液;每孔加入100μl PBS,脱色摇床清洗5min,弃PBS;每孔加入100μl渗透剂(含0.5% Triton X-100的PBS),脱色摇床孵育10min,PBS清洗1次,5min。每孔加入200μl的1×Apollo染色反应液,避光,室温,脱色摇床孵育30min后,弃反应液;加入100μl渗透剂脱色摇床清洗3次,每次10min,弃渗透剂;每孔加入200μl甲醇清洗2次,每次5min,PBS清洗1次,每次5min;DAPI染核后,PBS洗涤即可进行显微拍照。
1.2.5 克隆形成实验 细胞转染48h后采用常规消化传代方法,制成单细胞悬液。细胞计数,并用培养基调节细胞浓度,并将细胞悬液倍比稀释。按照每皿500个细胞接种到直径60mm 的培养皿中,以十字方向轻轻晃动培养皿,使细胞分散均匀。培养皿置培养箱中持续培养12~14 d,中间根据培养液pH变化适时更换新鲜培养液。当培养皿中出现肉眼可见克隆时,终止培养,弃去培养液,PBS液小心浸洗2次。甲醇固定15min,弃甲醇后空气干燥。用0.1%结晶紫染液染色10min,流水缓慢洗去染液,空气干燥后进行拍照。
1.2.6 流式细胞术 细胞转染48h后进行如下处理,消化:用0.25%胰酶消化,离心(800rpm,5min);洗涤:用PBS液洗一次,弃上清;固定:加入-20 ℃预冷的70%酒精,冰浴30min;洗涤:用PBS液洗一次,弃上清;去除RNA:加入浓度50μg/ml的RNA酶,37℃,30min;洗涤:用PBS液洗一次,弃上清;染色:加PI染液(500μg/ml)避光染色30min;检测:300目尼龙滤膜过滤后上机检测。

2 结 果
2.1 Rap2a在胶质瘤中的表达情况 采用蛋白免疫印记技术检测15例非肿瘤脑组织及35例胶质瘤组织中Rap2a蛋白表达水平,结果如图(图1A)所示:Rap2a在脑胶质瘤组织中表达明显下调,两组间差异有统计学意义(P<0.05,图1B)。提示:Rap2a可能参与了胶质瘤的发生和发展过程。
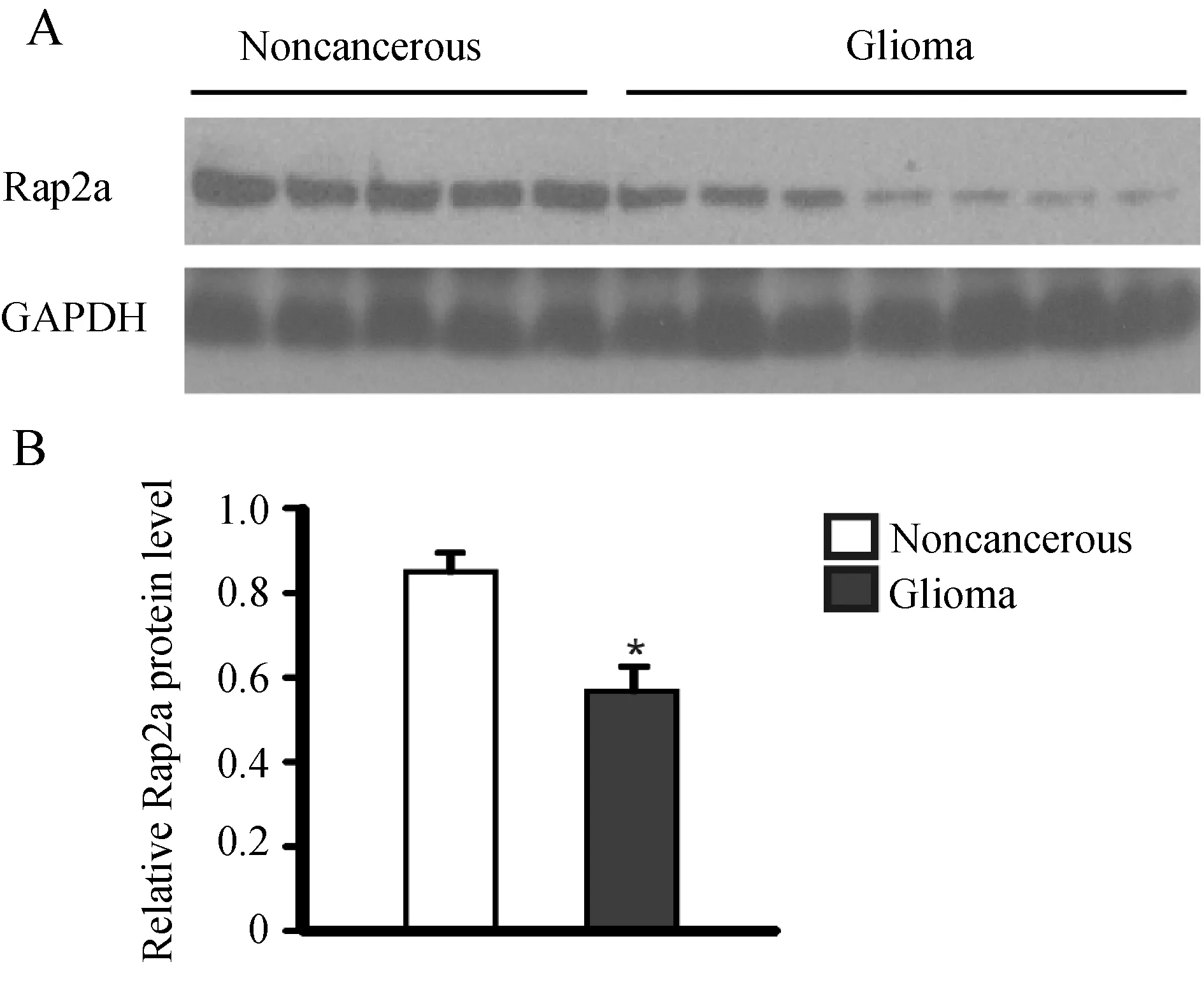
图1 A:应用蛋白免疫印记法检测非肿瘤脑组织以及胶质瘤组织标本中Rap2a蛋白表达水平;B:A图的统计分析图
2.2 Rap2a对胶质瘤细胞增殖的影响 分别通过Rap2a和Myc抗体检测转染Myc-Rap2a质粒48h后胶质瘤U87、U251细胞中Rap2a的蛋白表达水平,结果如图2显示:外源Rap2a过表达成功,且表达量明显高于内源的Rap2a水平,提示:Rap2a蛋白在胶质瘤细胞中过表达成功。
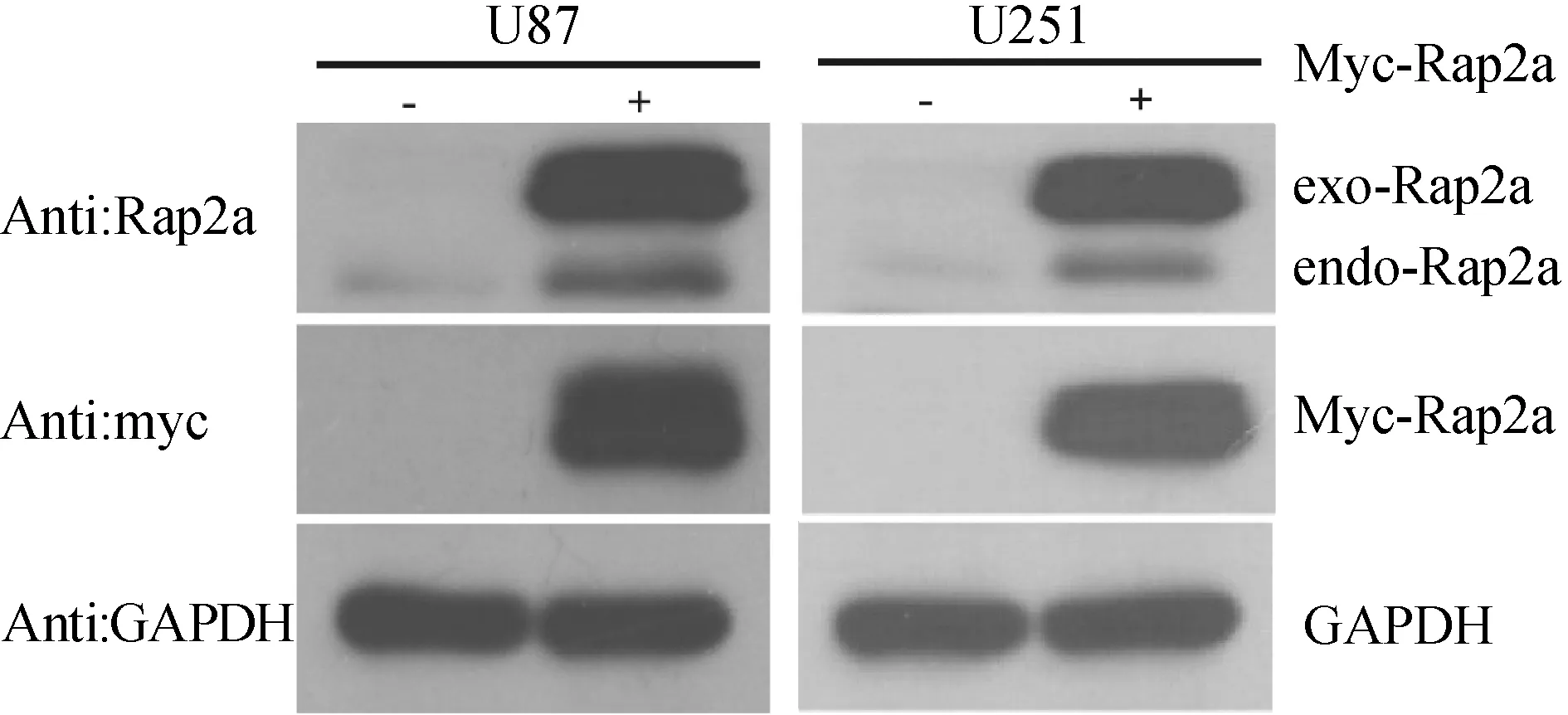
图2 蛋白免疫印记技术检测转染Myc-Rap2a质粒48h后胶质瘤U87、U251细胞中Rap2a的蛋白表达
首先采用细胞克隆形成实验检测过表达Rap2a对胶质瘤细胞增殖的影响,如图3A所示,转染Rap2a的细胞克隆形成数量明显比对照组降低,分别统计U87、U251两个细胞系形成的克隆数,结果显示,实验组与对照组相比具有统计学意义(表1,图3C,P<0.01;P<0.001)。结果表明:过表达Rap2a可以显著抑制胶质瘤U87、U251细胞的克隆形成能力。采用EdU实验验证Rap2a对胶质瘤细胞增殖的影响。如图3B所示, 转染Rap2a的细胞增殖能力明显比对照组低,分别计算U87、U251两个细胞系增殖的细胞数,结果显示,实验组与对照组见都存在统计学意义(如表2,图3D,P<0.01;P<0.01)。这些结果表明:过表达Rap2a可以抑制胶质瘤细胞增殖。

表1 转染Rap2a 48 h后细胞克隆形成实验检测细胞克隆形成率
注:实验组vs阴性对照组**P<0.01,***P<0.001

表2 转染Rap2a 48h后EdU实验检测细胞增殖率
注:实验组vs阴性对照组**P<0.01
2.3 Rap2a对胶质瘤细胞周期的影响 以上结果表明Rap2a可以抑制胶质瘤细胞的增殖能力,采用流式细胞术检测Rap2a对胶质瘤细胞周期的影响。分别在U251和U87中检测了转染空质粒和Rap2a质粒的胶质瘤细胞的周期分布。结果如图4A所示,在U251和U87中过表达Rap2a后,G0/G1期细胞比例明显升高,处于S期的细胞较对照组明显减少(图4B,P<0.05)。

A:细胞克隆形成实验检测过表达Rap2a对胶质瘤细胞U87和U251的影响;B:A图统计分析图;C:EdU实验检测过表达Rap2a对胶质瘤细胞U87和U251的影响;D:C图统计分析图图3 过表达Rap2a抑制胶质瘤细胞U87和U251的增殖(**P<0.01,***P<0.001)
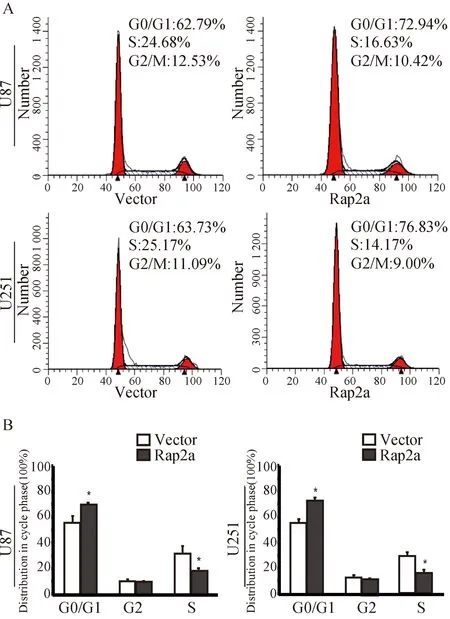
A:流式细胞术检测过表达Rap2a对胶质瘤细胞U87和U251周期的影响;B:A图的统计分析图图4 过表达Rap2a对胶质瘤细胞U87和U251周期的影响(*P<0.05)
3 讨 论
胶质瘤是颅内最常见的来自于中枢神经系统的神经胶质细胞或他们的前提细胞的原发性肿瘤,虽然手术和辅助治疗的进步,但恶性胶质瘤患者的平均中位生存期为12个月左右[5]。胶质瘤的发生时多种基因突变及异常表达以及细胞代谢和信号传导等多种机制异常的病理过程。近年来随着分子生物学的不断发展,对胶质瘤的发病机制有了更深入、更全面的认识。基因治疗已成为当今肿瘤治疗的热点,寻找对胶质瘤发生发展起重要调节作用的基因,并研究其调控肿瘤发生的信号通路对深入了解胶质瘤无限增殖和减缓凋亡的分子机制,发现新的治疗靶点提供了新的思路和理论支持[6]。
Ras作为原癌基因在胶质瘤的发生和发展过程中起着举足轻重的作用[7-10],Rap2a属于Ras小G蛋白超家族的成员之一,在多种人类细胞中发挥着各种各样的生物学功能,包括信号转导、细胞迁移和侵袭、细胞增殖等[3]。虽然Rap2a是原癌基因Ras超家族中的一员,但其在肿瘤的发生发展过程中的作用还存在争议。Prabakaran等[11]发现在滤泡状甲状腺癌中,Rap2a呈高表达,与甲状腺癌侵袭性密切相关。相反也有报道指出,在前列腺癌中低表达的Rap2a可以促进前列腺特异抗原(PSA)的表达,然而高表达的Rap2a则抑制前列腺特异抗原表达,从而影响前列腺特异抗原介导的转录和前列腺细胞的成长[12]。
本实验研究发现Rap2a在胶质瘤中表达下调(图1A,1B),提示Rap2a在胶质瘤中可能扮演抑癌基因的角色,并且过表达Rap2a(图2)可以诱导细胞G0/G1期阻滞(图4A,4B)而抑制胶质瘤细胞增殖(图3A-D)。
Choudhury等[13]发现未经编码的microRNA-376*通过抑制靶基因Rap2a影响胶质瘤的细胞的迁移和侵袭能力,同时利用RNAi技术干扰Rap2a促进了胶质瘤细胞的迁移和侵袭能力。2014年,Sayyah 等[14]证实,Rap1a是胶质瘤细胞增殖和肿瘤生长的关键调控因子,在体外实验中,Rap1a的缺失导致肿瘤质量比对照组减少70%以上。而Rehmann[15]在2013年的报道中,证实了Rap1和Rap2之间存在相互拮抗作用。
这些报道与本研究结果中发现过表达Rap2a抑制胶质瘤细胞增殖的结果相一致。但也有一些研究反对这种观点,在肺癌中,Rap2a作为一个癌基因参与肿瘤的迁移与侵袭[16]。这些结果提示Rap2a功能的多样性可能与组织细胞的不同和特殊的环境相关。
综合以上结果表明,Rap2a在临床胶质瘤组织中表达下调,提示Rap2a在胶质瘤中可能扮演抑癌基因的角色,其可能通过诱导细胞G0/G1期阻滞而抑制胶质瘤细胞增殖。Rap2有三种不同的同源亚基,即Rap2a、Rap2b、Rap2c,本研究中仅仅涉及了Rap2a对胶质瘤增殖影响。总之,本实验结果表明Rap2a可以抑制胶质瘤细胞的增殖,为胶质瘤的分子靶向治疗提供重要的参考与理论支持。
[1] Kleihues P,Louis DN,Scheithauer BW,etal.The WHO classification of tumors of the nervous system[J].J Neuropathol Exp Neurol,2002,61:215;discussion 226.
[2] Schechter CB.Re:brain and other central nervous system cancers:recent trends in incidence and mortality[J].J Natl Cancer Inst,1999,91:2050.
[3] Kooistra MR,Dubé N,Bos JL.Rap1:a key regulator in cell-cell junction formation[J].J Cell Sci,2007,120:17.
[4] Itoh M,Nelson CM,Myers CA,etal.Rap1 integrates tissue polarity,lumen formation,and tumorigenic potential in human breast epithelial cells[J].Cancer Res,2007,67:4759.
[5] Wen PY,Kesari S.Malignant gliomas in adults[J].N Engl J Med,2008,359:492.
[6] Lehner B,Park S.Cancer:exploiting collateral damage[J].Nature,2012,488:284.
[7] Bredel M,Pollack IF,Freund JM,etal.Inhibition of Ras and related G-proteins as a therapeutic strategy for blocking malignant glioma growth[J].Neurosurgery,1998,43:124.
[8] Nakada M,Niska JA,Tran NL,etal.EphB2/R-Ras signaling regulates glioma cell adhesion,growth,and invasion[J].Am J Pathol,2005,167:565.
[9] Read RD,Cavenee WK,Furnari FB,etal.A drosophila model for EGFR-Ras andPI3K-dependent human glioma[J].PLoS Genet,2009,5:e1000374.
[10] Ghazi SO,Stark M,Zhao Z,etal.Cell of origin determines tumor phenotype in an oncogenic Ras/p53 knockout transgenic model of high-grade glioma[J].J Neuropathol Exp Neurol,2012,71:729.
[11] Prabakaran I,Grau JR,Lewis R,etal.Rap2a is upregulated in invasive cells dissected from follicular thyroid cancer[J].J Thyroid Res,2011,2011:979840.
[12] Bigler D,Gioeli D,Conaway MR,etal.Rap2 regulates androgen sensitivity in human prostate cancer cells[J].Prostate,2007,67:1590.
[13] Choudhury Y,Tay FC,Lam DH,etal.Attenuated adenosine-to-inosine editing of microRNA-376a*promotes invasiveness of glioblastoma cells[J].J Clin Invest,2012,122:4059.
[14] Sayyah J,Bartakova A,Nogal N,etal.The Ras-related protein,Rap1A,mediates thrombin-stimulated,integrin-dependent glioblas-toma cell proliferation and tumor growth[J].J Biol Chem,2014,289:17689.
[15] Pannekoek WJ,Linnemann JR,Brouwer PM,etal.Rap1 and rap2 antagonistically control endothelial barrier resistance[J].PLoS One,2013,8:e57903.
[16] Wu JX,Zhang DG,Zheng JN,etal.Rap2a is a novel target gene of p53 and regulates cancer cell migration and invasion[J].Cell Signal,2015,27:1198.
(收稿2016-01-27 修回2016-06-11)
Study on expression of Rap2a and its effect on glioma cell proliferation
WANGShi-quan,WANGLei,SHIHeng-liang,etal.
theGenerateSchool,XuzhouMedicalCollege,Xuzhou221002,China
ZHUYu-fu
Objective To explore the expression and the function of Rap2a in glioma.Methods The expression level of Rap2a in glioma tissues was detected by Western blot.The colony formation and EdU assay were subjected for assessing the cell proliferation up on overexpression of Rap2a plasmid in U251 and U87 cells.The flow cytometry assay was used to analyse the effect of Rap2a on cell cycle of U251 and U87 cells.Results The expression level of Rap2a in glioma tissues was decreased comparing with the non-tumor tissues.Overexpression of Rap2a inhibited the proliferation of U251 and U87 cells.In addition,we found that overexpression of Rap2a arrested the cell cycle at G0/G1 phase.Conclusion The expression level of Rap2a in glioma tissues is down-regulated,and overexpression of Rap2a inhibits the proliferation of glioma cells.
glioma;Rap2a;cell cycle;proliferation
国家自然科学基金资助项目(81272777);江苏省2013年度普通高校研究生科研创新计划资助项目(CXLX13_994)
221002 徐州医学院研究生院(王诗筌,朱炳鑫);徐州医学院神经系统疾病研究所(施恒亮,于如同);徐州医学院附属医院脑科医院神经外科(王雷,施恒亮,朱玉辐,于如同)
朱玉辐
10.3969/j.issn.1672-7770.2017.04.010
R739.41
A
1672-7770(2017)04-0279-05

