牦牛DGAT1基因多态性及其与乳质性状关联分析
高小莉,胡江,郭淑珍,石斌刚,谢建鹏,罗玉柱,王继卿,牟永娟
牦牛DGAT1基因多态性及其与乳质性状关联分析
高小莉1,胡江1,郭淑珍2,石斌刚1,谢建鹏1,罗玉柱1,王继卿1,牟永娟2
(1甘肃农业大学动物科学技术学院/甘肃省草食动物生物技术重点实验室,兰州730070;2甘南州畜牧科学研究所,甘肃合作747000)
【目的】检测牦牛DGAT1基因多态性,评估基因突变对牦牛乳品质性状的影响,以期丰富牦牛重要经济性状的分子遗传研究基础。【方法】采用PCR-SSCP方法,检测甘南牦牛、天祝白牦牛、青海牦牛及野血牦牛DGAT1基因intron5-exon7和intron15-exon17区突变,分析基因突变对乳品质性状的影响。【结果】牦牛DGAT1基因intron5-exon7区发现c.562+32_c.562+33insCCGCCC的插入/缺失,等位基因、基因型MM频率最高为优势等位基因和基因型,各类群牦牛<0.5属中度或低度多态;intron15-exon17区检测到c.1249-23C>T和c.1336C>T的突变,其中exon17发现的c.1336C>T突变导致编码氨基酸p.Arg447Cys转变,等位基因频率最高为优势等位基因,甘南牦牛、天祝白牦牛和青海牦牛中基因型AA为优势基因型,野血牦牛基因型AB为优势基因型,各类群牦牛0.25<<0.5属中度多态;两区域3处突变位点构建出6种单倍型和11种单倍型组合,突变位点间存在连锁关系且接近于连锁平衡。关联分析表明,甘南牦牛intron5-exon7区基因型与乳质性状无显著相关;intron15-exon17区基因型BB个体乳品质性状最低,且乳蛋白率、乳脂率、总固体物质含量中显著低于其他基因型个体(<0.05);携带等位基因A的个体乳蛋白率、乳脂率、总固体物质含量及无脂固体含量显著高于未携带者(<0.05),携带等位基因C的个体乳脂率也显著高于未携带者(<0.05),而携带等位基因的个体乳脂率、总固体物质含量显著低于未携带者(<0.05);单倍型组合H1H3个体的乳蛋白率、乳脂率、总固体物质含量和无脂固体物质含量均较高,且乳脂率及总固体物质含量显著高于其他单倍型组合(<0.05),而H2H2单倍型组合个体则较低,除乳糖率以外的其他乳品质性状均显著低于其他7种单倍型组合(<0.05)。【结论】牦牛DGAT1基因intron5-exon7和intron15-exon17区为低度和中度多态,intron6存在c.562+32_c.562+33insCCGCCC的插入/缺失,intron15和exon17分别检测到c.1249-23C>T突变和c.1336C>T的非同义突变。intron15-exon17区突变影响甘南牦牛乳品质性状,选留携带等位基因的个体和淘汰携带等位基因的个体、或选留H1H3单倍型组合及淘汰H2H2单倍型组合个体,均可显著改善后代群体的乳品质。
牦牛;DGAT1基因;多态性;乳品质性状
0 引言
【研究意义】牦牛()分布在青藏高原及其周边高寒牧区,为牧民提供肉、乳和毛绒等畜产品,是当地重要的生产和生活资源。牦牛乳营养丰富,风味独特,其中乳脂率、乳蛋白率和总固体物质含量分别为5.45%—7.22%、4.86%—5.40%和16.91%—17.40%,均高于荷斯坦牛乳[1];牦牛乳是加工乳制品的重要原料,也是发展高原特色乳产业的主要来源。乳脂是乳的重要组成部分,高乳脂率是牦牛乳的主要特征,本研究检测牦牛乳脂性状候选基因,评估基因突变与乳品质性状间的关联程度,以期丰富牦牛乳品质性状分子遗传研究基础。【前人研究进展】乳脂肪中甘油三酯占95%以上,其合成受甘油-3-磷酸酰基转移酶(GPAT)、1-酰基甘油-3-磷酸酰基转移酶6(AGPAT6)、磷脂酸磷酸酯酶1(LPIN1)、二酰基甘油酰基转移酶(DGAT)等作用[2],其中是甘油三酯合成最后一步反应的关键酶[3]。DGAT基因包括和两种属于不同基因家族的基因类型。DGAT1基因属于酰基辅酶A胆固醇酰基转移酶(acylCoA: cholesterol acyltransferase, ACAT)基因家族,参与脂肪合成、储存及脂蛋白组装等过程,是影响产奶性状的重要功能候选基因[4]。牛DGAT1基因位于14号染色体,由17个外显子和16个内含子组成,编码489个氨基酸[5]。牛DGAT1基因第8外显子AA→CG的双碱基突变导致其编码多肽链中232位的赖氨酸残基突变为中性疏水性丙氨酸残基[6-7],命名为K232A。研究表明,K基因能增加荷斯坦奶牛乳脂率、乳蛋白率及乳脂量,而A基因对提高产乳量和乳蛋白量有作用[8-9];DGAT1基因启动子区的可变数目串联重复序列(VNTR)多态性对产乳性状也有一定影响[10-11]。另外,DGAT1基因突变也影响肉牛肌内脂肪含量[12-13],以及猪的脂肪沉积和背膘厚[14]。【本研究切入点】近年来,关于牦牛乳蛋白的遗传报道较多[15-16],但对其乳脂肪及其他乳品质性状的分子遗传机制研究较少。【拟解决的关键问题】本研究以DGAT1基因作为牦牛乳品质性状的候选基因,应用PCR-SSCP技术检测牦牛该基因相应区域的遗传突变,结合甘南牦牛乳品质性状测定数据,分析DGAT1基因突变与牦牛乳品质性状间的关联程度。
1 材料与方法
1.1 试验材料
样品于2015年7月进行采集。血样分为甘南牦牛314头,天祝白牦牛、青海牦牛各95头,野血牦牛(野牦牛与家牦牛杂交后代)37头。颈静脉采血10 mL,ACD抗凝、-70℃冻存;部分血样滴于FTA卡(Whatman, Middlesex, UK)常温保存。
对采集血样的甘南母牦牛,记录其年龄及产犊胎次,并早晚各采集乳样1次约25 mL、连续采集3 d,混合、冰袋冷却后放入冰盒,带回实验室测定乳品质性状。因甘南牦牛均在每年5—6月份产犊,因此,试验母牦牛泌乳月基本相同。
1.2 试验方法
1.2.1 乳品质性状测定 甘南牦牛乳品质性状测定包括乳蛋白率、乳脂率、乳糖率、总固体物质含量、无脂固体物质含量5项,送农业部动物毛皮及制品质量监督检验测试中心(兰州)采用福斯(FOSS)乳成分分析仪测定,其测定值见表1。
1.2.2 基因组DNA提取 冻存血样采用“苯酚-氯仿法”和FTA卡“两步法”提取基因组DNA。
1.2.3 引物设计及PCR扩增 根据GenBank公布的普通牛DGAT1基因序列(GenBank no. AY065621.1),应用DNAMAN软件设计特异性引物P1和P2(表2),分别扩增牦牛DGAT1基因intron5-exon7和intron15-exon17区。引物由北京六合华大生物科技有限公司合成。
PCR反应总体积20 μL,其中基因组DNA(100 ng·μL-1)1.0 µL(或FTA卡1.2 mm血样圆片1个),10 ×PCR Buffer 2.0 μL,上、下游引物各0.25 μmol·L-1,Taq DNA聚合酶(5U·μL-1)0.25 μL,Mg2+2.0 mmol·L-1,dNTP(10 mmol·L-1·M-1)0.4 μL,ddH2O加至20 μL。PCR扩增程序为94 ℃预变性 5 min,94 ℃变性30 s,63 ℃退火30 s(P1引物)或62 ℃退火30 s(P2引物),72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR扩增产物用1%琼脂糖凝胶电泳检测。
1.2.4 SSCP分析 取PCR扩增产物 2 μL灭菌离心管中,加入8 μL变性上样缓冲液(98%去离子甲酰胺、0.025%二甲苯氰、0.025%溴酚蓝、10 mmol·L-1EDTA),98 ℃变性10 min,冰水混合物中迅速冷却5 min,上样于非变性聚丙烯酰胺凝胶(Acr﹕Bis=37.5﹕1),0.5×TBE缓冲液电泳。电泳结束后银染显色并判定SSCP带型。P1和P2引物最佳SSCP电泳条件见表3。
1.2.5 等位基因序列测定 若等位基因存在纯合型个体,用PCR 扩增产物直接测序;若仅存在于杂合个体采用切胶测序。序列测定在上海生工生物工程有限公司完成。

表1 甘南牦牛乳品质性状测定

表2 牦牛DGAT1基因的扩增引物信息

表3 SSCP电泳条件
1.2.6 数据统计分析 应用MEGA4软件比对等位基因序列;Popgen32.0软件计算等位基因频率、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)并进行2检验;PIC软件计算多态信息含量(PIC);SHEsis软件分析两位点SNPs连锁不平衡及单倍型频率[18];SPSS 19.0软件的一般线性模型分析基因型、等位基因及单倍型组合对甘南牦牛乳品质性状的影响。因母牦牛不同群体和胎次对乳品质性状有较大影响[19],因此统计模型考虑群体和胎次因素:
Y =μ+Genotype +Parity+Group+e
Y =μ+Allele+Parity +Group+e
Y =μ+Haplotype+Parity +Group+e
其中Y为性状表型值为群体均值;为基因型效应Allele为等位基因效应;Haplotype为单倍型效应;y为胎次效应;Group为群体效应;e为随机误差。
2 结果
2.1 PCR扩增及产物SSCP检测
P1和P2引物扩增牦牛DGAT1基因intron5—exon7和intron15—exon17区域,扩增产物经琼脂糖凝胶电泳检测,扩增产物长度与目的片段一致,且无非特异性条带。两对引物的PCR产物SSCP检测结果分别见图1和图2。intron5—exon7区在牦牛群体中检测到2种SSCP带型,对应和两种等位基因,形成MM和NN两种基因型。intron15—exon17区在牦牛群体中检测到3种SSCP带型,对应、、等3种等位基因,形成AA、AB、BC、BB、AC和CC共6种基因型。
2.2 牦牛DGAT1基因等位基因序列比对
牦牛DGAT1基因intron5—exon7区等位基因序列测定及比对结果分别见图3和图4,其中等位基因存在c.562+32_c.562+33insCCGCCC的插入/缺失突变。intron15—exon17区等位基因序列测定及比对结果分别见图5和图6,该区域共检测到c.1249-23C>T和c.1336C>T的突变。其中exon17的c.1336C>T为非同义突变,导致第447位氨基酸由碱性的精氨酸(Arg)变为中性的半胱氨酸(Cys)。

图1 牦牛DGAT1基因intron5-exon7区SSCP检测

图2 牦牛DGAT1基因intron15-exon17区SSCP检测
2.3 牦牛DGAT1基因遗传多态性及单倍型分析
2.3.1 牦牛DGAT1基因群体遗传学分析 牦牛DGAT1基因intron5—exon7区基因型频率、等位基因频率及群体遗传多态性见表4。四牦牛群体中,等位基因、基因型MM频率67.37%—83.78%为优势等位基因和基因型;甘南牦牛和野血牦牛多态信息含量<0.25属低度多态,天祝白牦牛和青海牦牛0.25<<0.5属中度多态;各类群牦牛卡方检验均达到显著水平(<0.05),即偏离Hardy-Weinberg平衡状态。
牦牛DGAT1基因intron15-exon17区基因型频率、等位基因频率及群体遗传多态性见表5。四类群牦牛等位基因频率56.76%—69.11%为优势等位基因;甘南牦牛、天祝白牦牛和青海牦牛基因型AA频率38.95%—47.13%为优势基因型,野血牦牛基因型AB频率59.46%为优势基因型。各类群牦牛为0.3970—0.4988属中度多态。野血牦牛卡方检验达显著水平(<0.05),偏离Hardy-Weinberg平衡状态。
2.3.2牦牛DGAT1基因单倍型分析 牦牛DGAT1基因intron5—exon7与intron15—exon17区突变位点间连锁不平衡分析及单倍型类型见表6和表7。D’值和2值是衡量连锁不平衡的两个常用参数,其中连锁不平衡区域内重组事件的发生概率通过D’值反映,而连锁分析的效力与2相关。SLATKIN等[20]认为D’>0.8表示两个位点处于强连锁不平衡状态,ARDLIE等[21]认为2>0.33则这两个SNPs是紧密连锁且作为一个整体遗传。4类群牦牛DGAT1基因3个突变位点间0<D’<0.8 且2均接近0(2≈0),存在连锁关系且接近于连锁平衡,表明他们趋向于相互独立遗传。两扩增区域构建6种潜在的单倍型分别为H1、H2、H3、H4、H5和H6,其中H1型频率最高为0.534为主要单倍型,H5型频率最低为0.020;6种单倍型形成11种单倍型组合(牦牛个体数)分别为H1H1(186)、H1H2(122)、H1H3(80)、H2H2(19)、H2H3(19)、H3H3(8)、H4H4(47)、H4H5(34)、H4H6(20)、H5H5(4)和H5H6(2)。
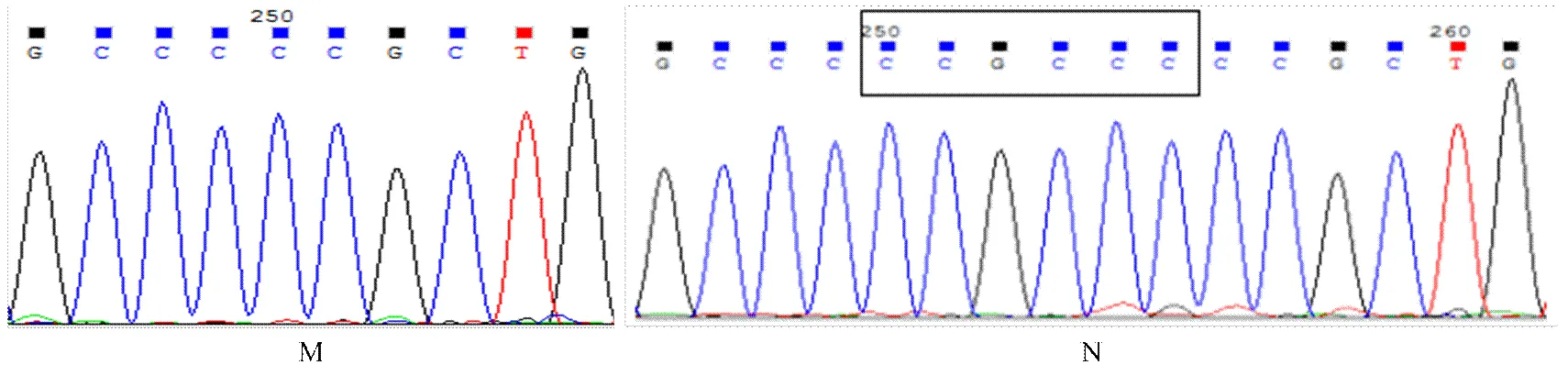
方框内为c.562+32_c.562+33insCCGCCC插入/缺失序列c.562+32_c.562+33insCCGCCC are represented with box
下划线部分为引物结合区,方框表示第6、7外显子区

箭头表明c.1249-23C>T和c.1336C>T突变位点 c.1249-23C>T and c.1336C>T are showed with arrows

下划线部分为引物结合区,方框表示第16、17外显子区

表4 牦牛DGAT1基因intron5-exon7区遗传多态性分析
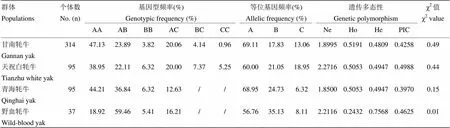
表5 牦牛DGAT1基因intron15-exon17区遗传多态性分析

表6 牦牛DGAT1基因突变位点间连锁不平衡系数D’及r2
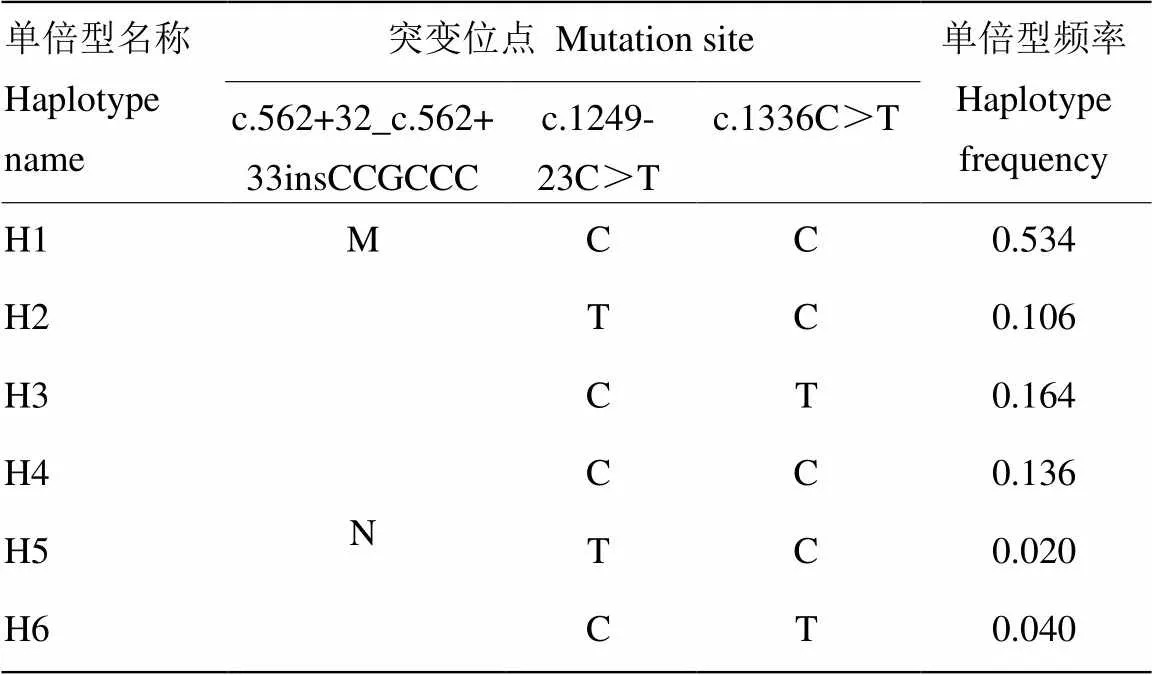
表7 牦牛DGAT1基因intron5-exon7与intron15-exon17区单倍型及频率
2.4 甘南牦牛DGAT1基因多态性与乳质性状相关性分析
2.4.1 甘南牦牛DGAT1基因intron5-exon7及intron15-exon17区突变与乳质性状相关性分析DGAT1基因intron5—exon7区基因型与甘南牦牛乳质性状相关性分析见表8。该区域MM和NN基因型与乳质性状无显著相关性(>0.05),即该区域突变对甘南牦牛乳质性状无显著影响。
DGAT1基因intron15—exon17区基因型及等位基因与甘南牦牛乳质性状相关分析见表9和表10。结果表明,该区域突变影响甘南牦牛乳蛋白率、乳脂率、总固体物质含量。甘南牦牛BB型个体乳蛋白率最低且显著低于AA、AB、AC型(<0.05),携带等位基因个体乳蛋白率显著高于未携带个体(=0.004),即等位基因有提高甘南牦牛乳蛋白率的趋势。甘南牦牛AC型个体乳脂率最高且显著高于其他个体(<0.05);携带等位基因及的个体乳脂率显著高于未携带者(=0.026),而携带等位基因的个体乳脂率显著低于未携带者(=0.022),即等位基因和有增加甘南牦牛乳脂率的趋势,而等位基因对乳脂率有不利影响。甘南牦牛AC型个体总固体物质含量最高且显著高于AB、BC和BB型(<0.05),携带等位基因的个体总固体物质含量显著高于未携带者(=0.001),而携带等位基因的个体显著低于未携带者(=0.013),即等位基因有提高甘南牦牛总固体物质含量的趋势,而等位基因对该性状有不利影响。该区域各基因型与甘南牦牛乳糖含量、无脂固体物质含量均无显著相关,而携带等位基因的个体无脂固体物质含量显著高于未携带者(=0.010)。综合上述分析结果,选择携带等位基因的个体或淘汰携带等位基因的个体,能够提高牦牛群体乳品质。
2.4.2 甘南牦牛DGAT1基因单倍型组合与乳质性状相关性分析 甘南牦牛DGAT1基因不同单倍型组合(个体数在7以上)与乳质性状相关性见表11。结果表明,不同单倍型组合与甘南牦牛乳蛋白率、乳脂率、总固体物质含量和无脂固体物质含量呈显著相关(<0.05)。综合各单倍型组合乳品质性状,H2H2单倍型组合个体的乳蛋白率、乳脂率、乳糖率、总固体物质含量和无脂固体物质含量均最低,并在除乳糖率以外的其他乳质性状中均显著低于其他7种单倍型组合(<0.05);H1H3单倍型组合乳脂率、总固体物质含量最高,也有较高的乳蛋白率及无脂固体物质含量,即选留H1H3单倍型组合及淘汰H2H2单倍型组合个体可显著改善后代群体的乳品质性状。
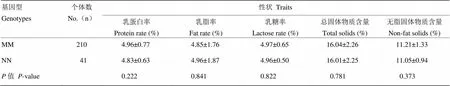
表8 甘南牦牛DGAT1基因intron5-exon7区基因型与乳质性状关联性分析

表9 甘南牦牛DGAT1基因intron15-exon17区基因型与乳质性状关联性分析
同列中不同小写字母表示差异显著 (<0.05)。下同
Different lowercase letters in the same line showed differ significantly (<0.05) . The same as below

表10 甘南牦牛DGAT1基因intron15-exon17区等位基因与乳质性状关联性分析
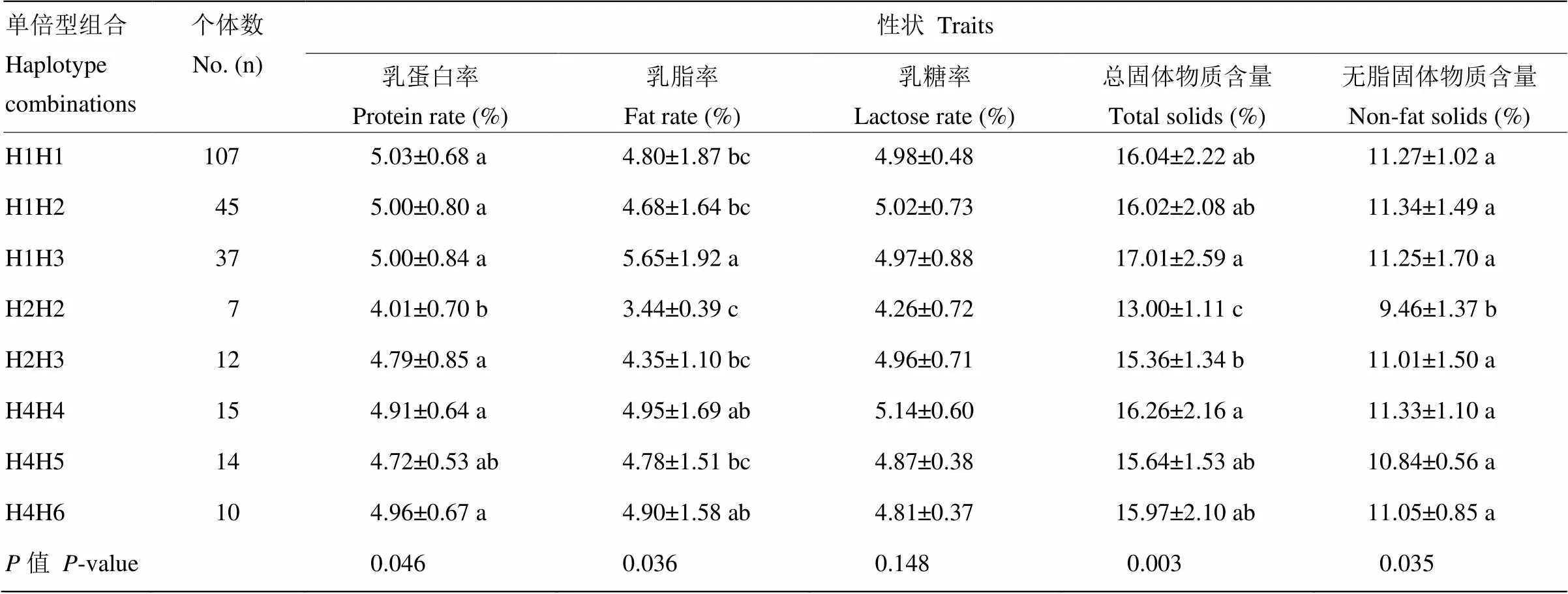
表11 甘南牦牛DGAT1基因单倍型组合与乳质性状关联性分析
同列中不同小写字母表示差异显著 (<0.05)
Different lowercase letters in the same line showed differ significantly (<0.05)
3 讨论
3.1 牦牛DGAT1基因检测区域多态性较丰富
不同物种DGAT1基因intron5—exon7及intron15—exon17区域均报道存在多态性。刘源等[22]在莱芜猪DGAT1基因第6外显子、朱春梅等[23]在萨能奶山羊该基因第15内含子、杨具田等[24]在藏绵羊第16—17外显子、ANGIOLILLO等[25]在山羊第16内含子均发现单核苷酸突变,而周军[10]在广西水牛DGAT1基因第17外显子检测到C>T的碱基突变导致丙氨酸(Ala)转变为缬氨酸(Val)。本研究检测的牦牛DGAT1基因序列在intron5—exon7区域发现1处插入/缺失突变,intron15—exon17区域发现2处SNPs突变位点,与其他物种该基因相应区域的研究结果类似。
本研究发现牦牛第17外显子c.1336C>T的突变导致编码蛋白的碱性精氨酸(Arg)变为中性半胱氨酸(Cys),刘洪瑜[26]在牛leptin基因发现第2外显子C>T突变,其导致编码蛋白由精氨酸突变为半胱氨酸,并改变了蛋白的二级、三级结构及其疏水性。Fujii等[27]在猪RYRI基因编码区中检测到C>T错义突变,使精氨酸变为半胱氨酸,从而改变了RYRI基因的结构和功能。本研究发现牦牛的精氨酸到半胱氨酸突变对其蛋白结构和功能的影响仍需进一步证实。
3.2 DGAT1基因intron15-exon17突变影响甘南牦牛乳质性状
属于乙酰辅酶A胆固醇乙酰转移酶1(ACAT1)和乙酰辅酶A胆固醇乙酰转移酶2(ACAT2)家族成员,是甘油三酯(TAG)合成最后一步反应的限制酶,在高等真核生物TAG代谢途径(如肠脂肪吸收、脂蛋白集合、脂肪形成和泌乳等)中发挥着重要功能。Smith等[28]报道敲除DGAT1基因的小鼠完全丧失泌乳能力,推测DGAT1基因是泌乳性状的功能候选基因。目前许多研究证实DGAT1基因第8外显子AA→CG的双碱基突变(命名为K232A)影响奶牛产奶量、乳脂及乳蛋白含量[29-30]。另外,在DGAT1基因5′调控区[23]及第8内含子区[31]均发现显著影响奶山羊及奶水牛乳品质性状的突变位点。
DGAT1基因突变影响不同物种的乳品质性状。本研究发现甘南牦牛DGAT1基因intron15—exon17突变影响其乳品质性状,等位基因有增加甘南牦牛乳脂率、乳蛋白率和总固体物质含量的趋势,等位基因也可增加其乳脂率,而等位基因对乳脂率、总固体物质含量有不利影响。朱春梅[23]报道西农萨能奶山羊DGAT1基因intron15的单核苷酸突变与乳脂率显著关性;De Freitas[32]研究发现水牛DGAT1基因第17外显子区两个SNPs位点与乳脂肪和蛋白质的比例显著相关,这与本研究结果类似。但孟莉[33]等在水牛DGAT1基因第17外显子区检测到1个SNP突变,且其对乳脂率及乳蛋白率无显著影响,与本研究结果不完全一致,这可能与不同物种、品种及突变位点有关。
3.3 DGAT1基因单倍型组合影响甘南牦牛乳品质性状
相对于单个SNP分析,单倍型分析在复杂性状的关联研究中具有更准确的统计效果,而且单倍型的传递比单个SNP传递更有效,所以单倍型分析已经成为研究复杂性状的优势选择和遗传关联分析的重要手段。本研究发现甘南牦牛H2H2单倍型组合个体的乳蛋白率、乳脂率、总固体物质含量和无脂固体物质含量均显著低于其他单倍型组合,H1H3单倍型组合乳脂率、总固体物质含量最高,也有较高的乳蛋白率及无脂固体物质含量。鲍斌等[34]在荷斯坦牛基因研究中发现不同单倍型组合对产奶量和乳蛋白率有显著影响;鞠志花等[35]研究中国荷斯坦牛κ-酪蛋白基因多态性与泌乳性状的关联性中发现H1H4单倍型组合对乳蛋白率和乳脂率均有有利影响,可作为选择高乳蛋白率和高乳脂率牛群的分子标记。本研究中甘南牦牛DGAT1基因单倍型组合关联分析结果与基因型及等位基因关联分析结果基本一致,相应单倍型组合也可作为选育提高牦牛乳品质性状的分子标记。
4 结论
本研究在4个牦牛群体DGAT1基因的intron5—exon7区发现c.562+32_c.562+33insCCCCGC的插入/缺失突变、intron15-exon17区检测到c.1336C>T、c.1249-23C>T 的SNPs,其中intron 17区域的c.1336C>T为非同义突变,两区域共发现6种潜在的单倍型。甘南牦牛intron15-exon17区突变及其与intron5-exon7区的单倍型组合均影响乳品质性状,选留携带等位基因的个体和淘汰携带等位基因的个体、或选留H1H3单倍型组合及淘汰H2H2单倍型组合个体,均可显著改善后代群体的乳品质。
References
[1] 张容昶, 胡江. 牦牛生产技术. 北京: 金盾出版社, 2002.
ZHANG R C, HU J.. Beijing: Jindun Publishing House, 2002.(in Chinese)
[2] BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle., 2008, 9(1):1-21.
[3] HARRIS C A, HAAS J T, STREEPER R S, STONE S J, KUMARI M.enzymes are required for triacylglycerol synthesis and lipid droplets in adipocytes., 2011, 52(4): 657-667.
[4] RAUT A A, KUMAR A, KALA S N, CHHOKAR V, RANA N. Identification of novel single nucleotide polymorphisms in the DGAT1 gene of buffaloes by PCR-SSCP.,2012, 35(3):610-613.
[5] GRISART B, COPPIETERS W, FARNIR F, KARIM L, FORD C, BERZI P. Positional candidate cloning of a QTL in dairy cattle: identification of a missense mutation in the bovinegene with major effect on milk yield and composition., 2002, 12: 222-231.
[6] GRISART B, FARNIR F, KARIM L, CAMBISANO N, KIM J J, KVASZ A. Genetic and functional confirmation of the causality of theK232A quantitative trait nucleotide in affecting milk yield and composition., 2004, 101(8): 2398-2403.
[7] WINTER A, KRAMER W, WERNER F A O, KOLLERS S, KATA S, DURSTEWITZ G, BUITKAMPJ, WOMACK J M, THALLER G, FRIES R. Association of a lysine-232/alanine polymorphism in a bovine gene encoding acyl-CoA: diacylglycerol acyltransferase () with variation at a quantitative trait locus for milk fat content., 2002, 99(14): 9300-9305.
[8] 毛永江, 陈仁金, 陈莹, 常玲玲, 施雪奎, 杨章平, 施健, 黄回华. 南方地区中国荷斯坦牛基因多态性与泌乳性状的关联分析. 中国农业科学, 2010, 43(14): 2990-2995.
MAO Y J, CHEN R J, CHEN Y, CHANG L L, SHI X K, YANG Z P, SHI J, HUANG H H. Analysis of association betweengene and milking traits in Chinese Holstein in the south of China., 2010, 43(14): 2990-2995. (in Chinese)
[9] THALLER G, KRÄMER W, WINTER A, KAUPE B, ERHARDT G, FRIES R. Effects ofvariants on milk production traits in German cattle breeds., 2003, 81(8): 1911-1918.
[10] 周军. 水牛基因的克隆及SNP分析[D]. 北京: 中国农业大学, 2005.
Zhou J. Cloning, SNP analysis of thegenein water buffalo[D]. Beijing: China Agriculture University, 2005. (in Chinese)
[11] KÜHN C, THALLER G, WINTER, BININDA-EMONDS A R P, KAUPE B, ERHARDT G, BENNEWITZ J, SCHWERIN M, FRIES R. Evidence for multiple alleles at thelocus better explains a quantitative trait locus with major effect on milk fat content in cattle., 2004, 167(4): 1873-1881.
[12] THALLER G, KÜHN C, WINTER A, EWALD G, BELLMANN O, WEGNER J, ZUHLKE H, FRIES R., a new positional and functional candidate gene for intramuscular fat deposition in cattle., 2003, 34(5): 354-357.
[13] JEONG J, KWON E G, IM S K, SEO K S, BAIK M. Expression of fat deposition and fat removal genes is associated with intramuscular fat content in longissimus dorsi muscle of Korean cattle steers., 2012, 20: 2044-2053.
[14] 刘源. 猪基因和基因多态性及其与背膘厚的关系[D]. 泰安: 山东农业大学, 2006.
Liu Y. Polymophisms ofandgenes and associations with Backfat Thickness in pigs[D]. Taian: Shandong Agricultural University, 2006. (in Chinese)
[15] 毛永江, 钟光辉, 郑玉才, 彭先文, 杨章平, 王永, 江明峰. 中国牦牛乳蛋白遗传多态性及其与泌乳性能相关性研究. 中国农业科学, 2004, 37(2): 291-295.
MAO Y J, ZHONG G H, ZHENG Y C, PENG X W, YANG Z P, WANG Y, JIANG M F. Genetic polymorphisms of milk protein and their relationships with milking performances in Chinese Yak., 2004, 37(2): 291-295. (in Chinese)
[16] 崔艳华, 曲晓军, 董爱军, 马莺. 牦牛κ-酪蛋白新遗传变异体及进化分析. 哈尔滨工业大学报, 2012, 44(2): 120-123.
CUI Y H, QU X J, DONG A J, MA Y. The new variant and phylogenetic analysis of the κ-Casein gene() in yak., 2012, 44(2): 120-123. (in Chinese)
[17] HU J, ZHOU H, SMYTH A, LUO Y Z, HICKFORD J G H. Polymorphism of the bovinegene., 2010(37): 3389-3392.
[18] SHI Y Y, HE L. SHEsis, A powerful software platform for analyses of linkage disequilibrium, haplotype construction, and genetic association at polymorphism loci., 2005, 15(2): 97-98.
[19] 陈艳珍. 影响牛乳成分含量变化的因素. 乳业科学与技术, 2005, 27(4): 186-188.
CHEN Y Z. Factors affecting the content of milk components., 2005, 27(4): 186-188. (in Chinese)
[20] SLATKIN M. Linkage disequilibrium--understanding the evolutionary past and mapping the medical future., 2008, 9(6): 477-485.
[21] ARDLIE K G, KRUGLYAK L, SEIELSTAD M. Patterns of linkage disequilibrium in the human genome., 2002, 3(4): 299-309.
[22] 刘源, 姜运良, 武英, 魏述东, 杨晓慧. 莱芜猪基因的多态性研究. 畜牧兽医学报, 2007, 38(3): 214-218.
LIU Y, JIANG Y L, WU Y, WEI S D, YANG X H. Study onpolymorphisms in Laiwu pigs., 2007, 38(3): 214-218. (in Chinese)
[23] 朱春梅. 西农萨能奶山羊和基因多态性与产奶性状关系的研究[D]. 杨凌: 西北农林科技大学, 2010.
ZHU C M. Study on relationship between polymorphism of,genes and milk production traits in Xinong Saanen dairy goat[D]. Yangling: Northwest Agriculture and Forestry University, 2010. (in Chinese)
[24] 杨具田, 臧荣鑫, 徐红伟, 蔡勇, 卢建雄, 曹忻, 霍生东, 刘根娣, 吴建平. 甘南藏系绵羊基因16-17外显子多态性分析. 畜牧兽医学报, 2011, 42(6): 875-879.
YANG J T, ZANG R X, XU H W, CAI Y, LU J X, CAO X, HUO S D, LIU G D, WU J P. Polymorphism at 16-17exon of DGAT1gene in tibetan sheep of Gannan tibetan prefecture., 2011, 42(6): 875-879. (in Chinese)
[25] ANGIOLILLO A, AMILLS M, URRUTIA B, DOMÉNECH A, SASTRE Y, BADAOUI B, JORDANA J. Identification of a single nucleotide polymorphism at intron 16 of the caprine acyl-coenzyme A: diacylglycerol acyltransferase 1 () gene., 2007, 74(1): 47-51.
[26] 刘洪瑜. 牛脂肪代谢相关基因遗传分析及其与秦川牛经济性状关联分析[D]. 杨凌: 西北农林科技学, 2009.
LIU H Y. Genetic analysis of bovine genes related with lipid metaboloism and their association with economic traits in qinchuan cattle[D]. Yangling: Northwest Agriculture and Forestry University, 2009. (in Chinese)
[27] FUJII J, OTSU K, ZORZATO F, LEON S, KHANNA V K, WEILER J E, O’BRIEN P J, MACLENNAN D H. Identification of a mutation in porcine ryanodine receptor associated with malignant hyperthermia., 1991, 253(5018): 448-451.
[28] SMITHS J, CASES S, JENSEN D R, CHEN H C, SANDE E, TOW B, SANAN D A, RABER J, ECKEL R H, FARESE JR R V. Obesity resistance and multiple mechanisms of triglyceridesynthesis in mice lacking., 2000, 25(1): 87-90.
[29] Signorelli F, Orru L, Napolitano F, Matteis G D, Scata M C, Catillo G, Marchitelli C, Moioli B. Exploring polymorphisms and effects on milk traits of the,andgenes in four cattle breeds., 2009, 125(1): 74-79.
[30] Sun D, Jia J, Ma Y, Zhang Y, Wang Y, Yu Y, Zhang Y. Effect ofandon milk yield and milk composition in the Chinese dairy population., 2009, 40(6): 997-1000.
[31] 樊月圆, 王强, 张永云, 杨忠, 富国文, 汤守锟, 田建云, 李卫真. 德宏奶水牛基因多态性及其与产奶性状的相关性分析. 家畜生态学报, 2011, 32(6): 27-32.
Fan Y Y, Wang Q, Zhang Y Y, Yang Z, Fu G W, Tang S K, Tian J Y, Li W Z. The polymorphisms ofand its association with milk production traits in Dehong milk buffalo., 2011, 32(6): 27-32. (in Chinese)
[32] de Freitas A C, de Camargo G M, Stafuzza N B, Aspilcuetaborquis R R, Venturini G C, Dias M M, Cardoso D F, Tonhati H. Genetic association between SNPs in thegene and milk production traits in murrah buffaloes., 2016, 48(7): 1421-1426.
[33] 孟莉, 陈立, 苗永旺, 张永云, 赵素梅, 霍金龙, 李卫真. 水牛基因第17外显子多态性及其与乳成分含量的关联性分析. 云南农业大学学报(自然科学), 2013, 28 (2): 190-195.
Meng L, Chen L, Miao Y W, Zhang Y Y, Zhao S M, Huo J L, Li W Z. Polymorphism in the exon 17 ofgene and its association with milk composition traits in Buffalo ( Bubalus bubalis)., 2013, 28(2): 190 -195. (in Chinese)
[34] 鲍斌, 房兴堂, 陈宏, 张润锋, 严林俊, 张海军. 中国荷斯坦牛基因遗传多态性与泌乳性状的相关分析. 中国农业科学, 2008, 41(6): 1872-1878.
Bao B, Fang X T, Chen H, Zhang R F, Yan L J, Zhang H J. Polymorphisms ofgene and its association with milk performance traits in Chinese Holstein cattle., 2008, 41(6): 1872-1878. (in Chinese)
[35] 鞠志花, 王洪梅, 李秋玲, 黄金明, 李建斌, 安利国, 杨桂文, 仲跻峰, 王长法. 中国荷斯坦牛κ-酪蛋白基因4和第5外显子多态性与泌乳性状的关联分析. 中国农业科学, 2009, 42(9): 3279-3287.
Ju Z H, Wang H M, Li Q L, Huang J M, Li J B, An L G, Yang G W, Zhong J F, Wang C F. Polymorphisms of κ-Casein gene exon4 and 5 and its association with milk performance traits in Chinese Holstein cattle., 2009, 42(9): 3279-3287. (in Chinese)
(责任编辑 林鉴非)
Polymorphisms ofGene and Their Association with Milk Quality Traits in Yak
GAO XiaoLi1, HU Jiang1, GUO ShuZhen2, SHI BinGang1, XIE JianPeng1, LUO YuZhu1, WANG JiQing1, MU YongJuan2
(1College of Animal Science and Technology, Gansu Agricultural University/Gansu Key Laboratory of Herbivorous Animal Biotechnology, Lanzhou 730070;2Gannan Institute of Animal Science, Hezuo 747000, Gansu)
【Objective】In this study, polymorphisms of yak DGAT1(diacylglycerol acyltransferase 1) gene were investigated and their effects on some milk quality traits were estimated so as to enrich the molecular genetic data for yak. 【Method】 Mutations in intron5-exon7 and intron15-exon17 of DGAT1 gene were checked by PCR-SSCP in 4 yak populations (Gannan yak, Tianzhu white yak, Qinghai yak and Wild-blood yak), and the effects of mutations on the milk quality traits were analyzed in Gannan yak.【Result】The c.562+32_c.562+33insCCGCCC was found in intron5-exon7 of yak DGAT1 gene ,and alleleand genotype MM were the dominant allele and genotype, and each yak population was moderately or low polymorphic (<0.5). The 2 SNPs (c.1249-23C>T and c.1336C>T) were found in intron15-exon17, and nucleotide substitution c.1336C>T at exon 17 resulted in p.Arg450Cys change. Allelewas the dominant allele, the genotype AA in Gannan yak, Tianzhu white yak and Qinghai yak and AB in Wild-blood yak were the dominant genotype, respectively. Each yak population was moderately polymorphic (0.25<<0.5). Total 6 haplotypes and 11 haplotype combinations were constituted by mutations in these two regions, and there was a linkage relationship between 3 mutations and closed to linkage equilibrium. The association analysis showed that the genotype in intron5-exon7 was not significantly correlated with the milk quality traits in Gannan yak. The milk quality traits of genotype BB were the lowest, and the milk protein rate, fat rate, total solids percentage were lower than those of other genetypes (<0.05), and individuals with possessing allelehad higher milk protein rate, fat rate, total solids percentage and non-fat solids percentage than those no-possessing (<0.05), and yaks with allelealso showed higher milk fat rate than those no-possessing (<0.05), but individuals with alleleshowed lower milk fat rate and total solids percentage than those no-possessing (<0.05) in intron15-exon17 ofgene in Gannan yak. Individuals with haplotype combination H1H3 had higher milk protein rate, fat rate, total solids percentage and non-fat solids percentage, and the milk fat rate and total solids percentage were higher than those of other haplotype combinations (<0.05), while those with haplotype combination H2H2 were lower, in addition to the lactose rate, the other traits were lower than other combinations (<0.05). 【Conclusion】The intron5-exon7 and intron15-exon17 of yakgeneare low and moderately polymorphic, and the c.562+32_c.562+33insCCGCCC in intron6 and 2 SNPs (c.1249-23C>T, c.1336C>T) in intron15 and exon17 were detected, respectively. The mutations in intron15-exon17 ofgene may affect some milk quality traits of Gannan yak, and selecting yak with alleleand haplotype H1H3, or eliminating ones with alleleand haplotype H2H2 can improve the milk quality of Gannan yak.
yak;gene; polymorphism; milk quality traits
2017-02-16;接受日期:2017-06-19
国家自然科学基金(31160451)、甘肃省农业生物技术研究与应用开发项目(GNSW-2013-9及GNSW-2016-29)、甘肃省杰出青年科学基金(1210RJDA008)
高小莉,E-mail:838353222@qq.com。通信作者胡江,E-mail:huj@gsau.edu.cn

