苹果白兰地酿造中酿酒酵母与异常汉逊酵母的相互作用
曾朝珍,康三江,李明泽,张霁红,张海燕,张 芳
(甘肃省农业科学院农产品贮藏加工所,甘肃兰州730070)
苹果白兰地酿造中酿酒酵母与异常汉逊酵母的相互作用
曾朝珍,康三江,李明泽,张霁红,张海燕,张 芳
(甘肃省农业科学院农产品贮藏加工所,甘肃兰州730070)
通过构建酿酒酵母与异常汉逊酵母在富士苹果汁中的共培养发酵体系,采用两种酵母混合接种和顺序接种的发酵方式,比较不同培养体系中的生物量和发酵力的变化,分析两种酵母之间的相互作用。结果表明,共培养发酵体系中,异常汉逊酵母的生长受到了酿酒酵母生长的抑制,酿酒酵母的接种方式对共培养体系发酵力的影响大于异常汉逊酵母。
苹果白兰地; 酿酒酵母; 异常汉逊酵母; 混菌发酵; 相互作用
传统食品发酵中大都具有多种微生物共同参与发酵的特征,微生物间的相互作用对食品的质量起着至关重要的作用[1]。非酿酒酵母曾被认为是果酒酿造过程中的腐败酵母,对酒的品质起到不利的作用[2],但是随着对果酒酿造研究的深入,非酿酒酵母对果酒品质至关重要的作用已得到肯定[3]。苹果白兰地是以苹果汁为原料经酿酒酵母发酵并蒸馏后得到的一种新型水果类白酒[4],单一菌种发酵对苹果白兰地酒的品质虽有一定程度的保证,却降低了苹果白兰地酒产品的独特性和风味的多样性。多种酵母在发酵过程中的相互协作,可以有效增加苹果白兰地酒风味的多样性,但也可能影响苹果白兰地酒质量的稳定性[5-7]。混菌发酵中微生物之间的相互作用最终导致在发酵不同阶段酵母菌特定的生长规律,通过鉴别培养基了解这种动态的变化规律有利于苹果白兰地酒自然发酵过程中的微生物学控制,也可以为后续发酵风味的调节提供依据。本文研究异常汉逊酵母与酿酒酵母间的相互作用特征,不仅可为苹果白兰地的酿造工艺提供理论基础,而且对实现苹果白兰地液态发酵的稳定性和可操控性打下坚实的基础。
1 材料与方法
1.1 材料与仪器
菌种:酿酒酵母32168和异常汉逊酵母31399,由中国工业微生物菌种保藏管理中心(CICC)提供。
培养基:种子培养基为麦芽汁培养基;发酵培养基为富士苹果汁。
试剂:蛋白胨、酵母浸粉、生化试剂,北京奥博星生物技术有限责任公司;葡萄糖、分析纯,天津凯通化学试剂有限公司。
仪器设备:2WY-2102型恒温培养箱、ZHJHC11128型超净工作台,上海智城分析仪器制造有限公司;TD50002型电子天平,余姚市金诺天平仪器有限公司;B204LED型生物显微镜,重庆奥特光学仪器有限公司;YXQ-LS-75G型立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂;Breville-BJE500F型榨汁机,澳大利亚铂富公司。
1.2 试验方法
1.2.1 酿酒酵母与异常汉逊酵母的相互作用研究
(1)酿酒酵母与异常汉逊酵母的纯培养及共培养体系中生长特征的测定。在苹果汁发酵培养基中分别接入异常汉逊酵母和酿酒酵母及混合接入发酵培养基中,接种浓度均为1×106cfu/mL,在25℃下厌氧静置发酵直至发酵结束。
(2)不同接种比例对酿酒酵母与异常汉逊酵母相互作用的影响。在苹果汁发酵培养基中接入异常汉逊酵母和酿酒酵母,异常汉逊酵母接种浓度为1×106cfu/mL,酿酒酵母接种浓度分别为1×104cfu/mL、1×105cfu/mL、1×106cfu/mL,即酿酒酵母与异常汉逊酵母分别以1∶1、1∶10、1∶100的比例,在25 ℃下厌氧静置发酵直至发酵结束。
(3)接种方式对酿酒酵母与异常汉逊酵母相互作用的影响。①将异常汉逊酵母与酿酒酵母分别以1×106cfu/mL、1×105cfu/mL同时接入苹果汁发酵培养基中进行混合发酵(同时接种),作为对照;②先接入浓度为1×106cfu/mL的异常汉逊酵母培养2 d,以达到其旺盛生长期,后接入浓度为1×105cfu/mL的酿酒酵母进行混合发酵(顺序接种Ⅰ);③先接入浓度为1×105cfu/mL的酿酒酵母培养1 d,以达到其旺盛生长期,后接入浓度为浓度为1×106cfu/mL的异常汉逊酵母进行混合发酵(顺序接种Ⅱ)。
(4)接种量对酿酒酵母与异常汉逊酵母相互作用的影响。在不同培养方式条件下,将酿酒酵母与异常汉逊酵母以6%、7%、8%的不同接种量接入到苹果汁发酵培养基中进行酒精发酵,在25℃下厌氧静置发酵直至发酵结束。
1.2.2 分析方法
酵母菌落总数的测定:参照GB 4789.2—2010[8]菌落总数计数方法,直接采用稀释涂布YPD平板测定发酵过程中两种酵母的数量变化。
酵母发酵力的测定[9]:采用失重法,以二氧化碳挥发产生的失重来衡量酵母发酵力的大小,每隔24 h称重1次,直至发酵结束。
2 结果与分析
酿酒酵母与异常汉逊酵母的相互作用研究。
2.1 酿酒酵母与异常汉逊酵母的纯培养及共培养体系中生长特征的测定
在苹果汁发酵培养基中等量(接种量6%,接种比例1∶1)接种异常汉逊酵母和酿酒酵母,并以各自的纯培养为对照,在25℃条件下发酵7 d后,测定纯培养及共培养体系中不同酵母的生物量及二氧化碳失重量,结果见图1、图2、图3。

图1 纯培养及共培养体系中异常汉逊酵母细胞总数的变化
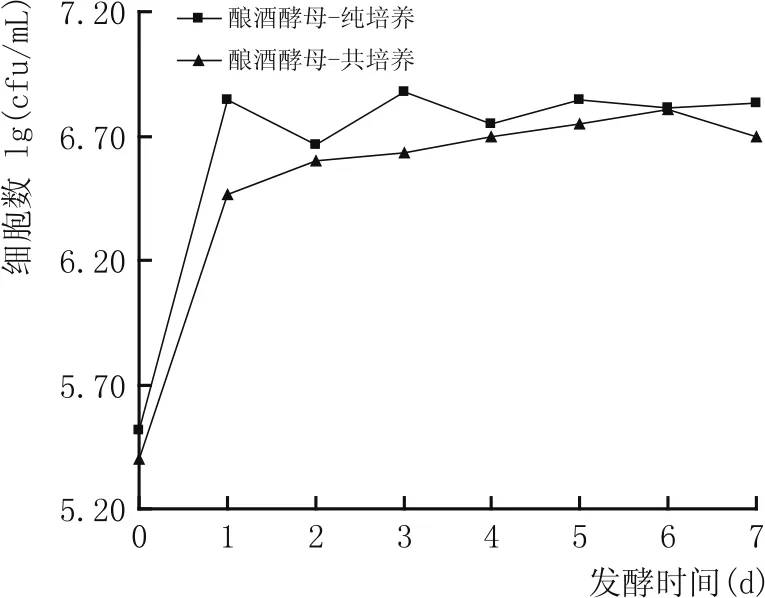
图2 纯培养及共培养体系中酿酒酵母细胞总数的变化
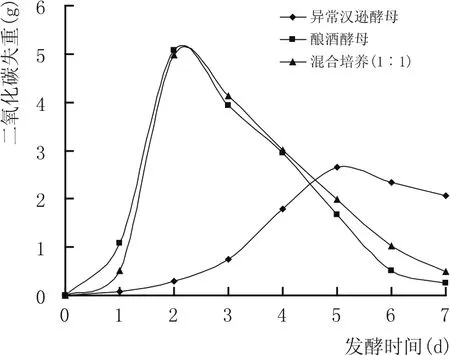
图3 纯培养及共培养体系中酵母发酵力的变化
纯培养及共培养发酵过程中两种酵母细胞数量的动态变化过程见图1、图2。由于共培养发酵时两种酵母竞争利用碳源[10],酿酒酵母优先利用葡萄糖而迅速增殖,异常汉逊酵母营养不足导致其生长缓慢,故共培养发酵时酿酒酵母数量较高;当异常汉逊酵母单独培养时,由于没有生长所需营养物质的竞争压力,异常汉逊酵母能够较好的繁殖并获得较高的细胞水平;此外,当异常汉逊酵母和酿酒酵母在共培养体系中发酵时,由于营养物质和生存空间的限制,各自的最大生物细胞总量都低于单菌种纯培养的水平。
当酿酒酵母与非酿酒酵母混合发酵时,非酿酒酵母会抑制酿酒酵母的发酵性能。图3结果表明,酿酒酵母单菌种发酵整个系统的发酵力最强,而共培养发酵整个系统的发酵力与酿酒酵母单菌种培养相近但相对略低,异常汉逊酵母单菌种培养发酵性能相对最差。
2.2 不同接种比例对共培养体系中异常汉逊酵母生长及发酵力的影响
由于等比例接种时,酿酒酵母表现出对异常汉逊酵母较强的抑制作用。因此,通过降低酿酒酵母的接种量来研究不同接种比例条件下酿酒酵母对异常汉逊酵母生长的作用及酵母发酵力的影响。结果见图4、图5(注:对照是指异常汉逊酵母的纯培养;接种比例为异常汉逊酵母与酿酒酵母的接种浓度之比)。
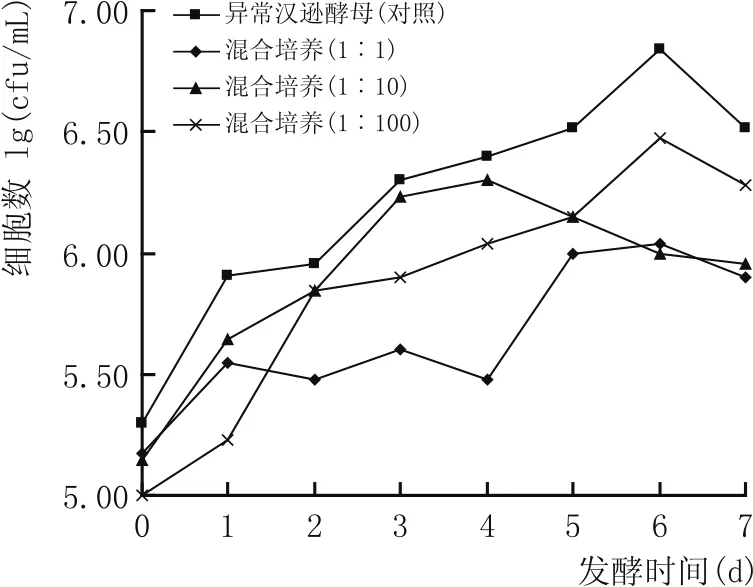
图4 不同接种比例对共培养体系中异常汉逊酵母生长量变化的影响
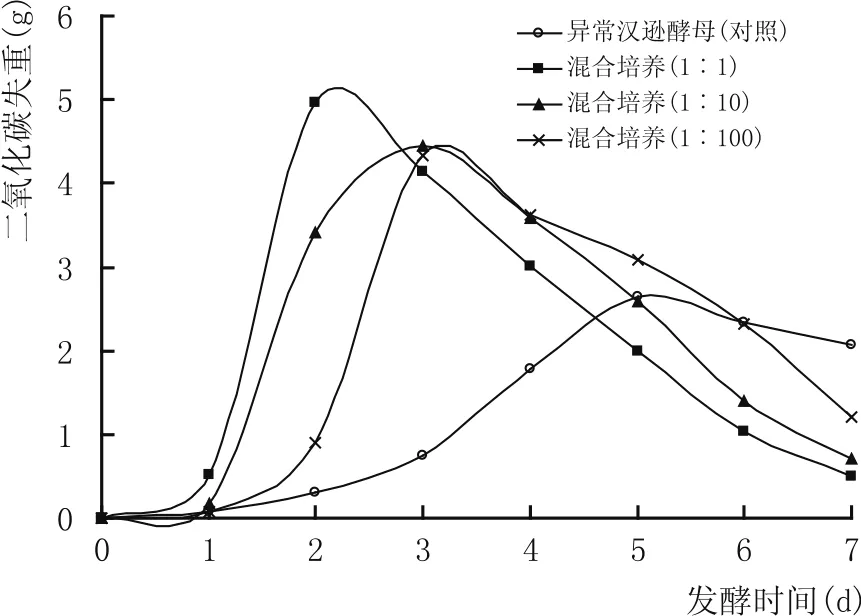
图5 不同接种比例对共培养体系中酵母发酵力变化的影响
由于酿酒酵母对异常汉逊酵母的抑制作用,因此,降低酿酒酵母的接种浓度,研究了不同接种比例对共培养体系中酵母生物量及发酵力的影响。由图4可知,即使将酿酒酵母的接种量降低100倍,共培养体系中异常汉逊酵母的生长仍会受到很强的抑制作用。导致这一现象的原因可能是由于酵母的快速增殖而导致发酵环境呈酸性[11],从而导致异常汉逊酵母生长受抑制。图5结果表明,随着酿酒酵母的接种量降低倍数增加,共培养发酵整个系统的发酵力也随之降低,但都强于异常汉逊酵母单菌种培养的发酵力,说明酿酒酵母对共培养发酵整个系统的发酵力影响大于异常汉逊酵母。
2.3 不同接种方式对共培养体系中酵母菌生物量变化及发酵力的影响
当非酿酒酵母与酿酒酵母混合发酵时,因为其不耐酒精及对营养物质的低竞争力等原因,其生物细胞会在接种的3~4 d后出现大量衰亡,而其过早衰亡对苹果白兰地香气形成的贡献就很有限。因此,本试验为了延长非酿酒属酵母的生长时间,在接种顺序上进行了对比试验,研究了不同接种方式对共培养体系中酵母菌生物量变化及发酵力的影响,结果见图6、图7。
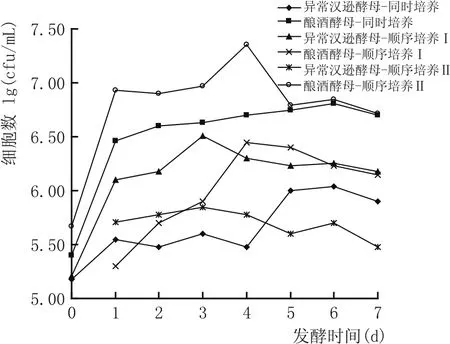
图6 不同接种方式对共培养体系中酵母生长量变化的影响
由图6结果可以看出,同时接种与顺序培养Ⅱ体系中的异常汉逊酵母与酿酒酵母的生长规律相近,两个培养体系中酿酒酵母的生物细胞量都在发酵前两天迅速增殖,而异常汉逊酵母都呈现生物细胞量下降的趋势,说明在酿酒酵母强发酵力的体系中,非酵母属酵母的生长确实受到抑制;而先接种异常汉逊酵母的顺序培养Ⅰ体系中,异常汉逊酵母能在发酵前期迅速增殖,之后随着发酵进行及酿酒酵母的接入,异常汉逊酵母生物细胞量开始下降。这可能与混合发酵体系中营养物质的竞争效应、有毒物质的形成浓度[12-14]以及细胞的群体感应[15]等因素有关,这从生物量的角度说明混合培养发酵时以非酵母属酵母先接种、培养一段时间后再接入发酵力强的酿酒酵母的方式是非常必要的。而图7结果表明,顺序培养Ⅰ体系的发酵力明显弱于同时培养与顺序培养Ⅱ体系的发酵力,说明酿酒酵母的接种方式对共培养体系的发酵力影响大于异常汉逊酵母。

图7 不同接种方式对共培养体系中酵母发酵力变化的影响
2.4 酿酒酵母接种量对发酵过程中异常汉逊酵母生长及发酵力的影响
2.4.1 同时培养方式下酿酒酵母接种量对异常汉逊酵母生长及发酵力的影响
本研究就酿酒酵母初始接种量对发酵过程中异常汉逊酵母生长及发酵力的影响开展试验,采用逐渐提高酿酒酵母接种量的方式,在同时培养条件下研究非酿酒酵母与酿酒酵母在3种初始接种量下它们的相互作用。结果见图8、图9。
由图8结果可以看出,3种酿酒酵母接种量方式的发酵体系中,尽管异常汉逊酵母的接种量也在随着增加,但是异常汉逊酵母生物细胞量却随着酿酒酵母接种量的增加而降低,说明和纯培养相比较,共培养体系中异常汉逊酵母的生长同样受到酿酒酵母的抑制;而图9结果表明,共培养体系的发酵力随着酿酒酵母接种量的增加而增加;纯培养体系的发酵力随着异常汉逊酵母接种量的增加而增加,但整体发酵能力低于对应的共培养体系。
2.4.2 顺序培养方式下酿酒酵母接种量对异常汉逊酵母生长及发酵力的影响
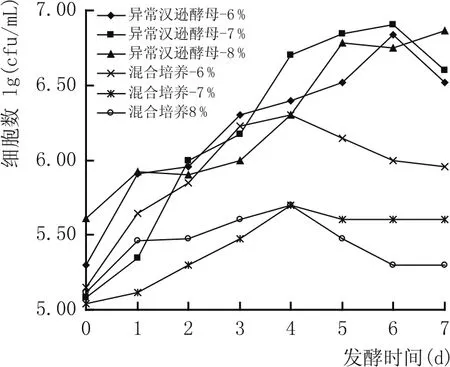
图8 同时培养体系中不同接种量对异常汉逊酵母生长量变化的影响
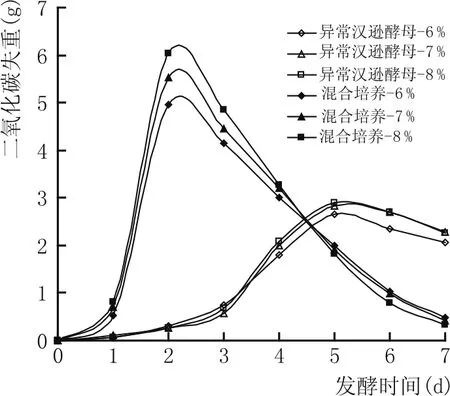
图9 同时培养体系中不同接种量对酵母发酵力变化的影响
本研究在顺序培养方式下,采用逐渐提高酿酒酵母的接种量的方式,研究非酿酒酵母与酿酒酵母在3种初始接种量下的相互作用。结果见图10、图11。
图10、图11结果表明,顺序培养方式下异常汉逊酵母生长及酵母发酵力的变化规律与同时培养方式下的相似,但就生物细胞量及发酵力而言,顺序培养方式下的异常汉逊酵母的生物细胞量与对应的发酵力大小都高于同时培养方式下相对应的量。
3 结论
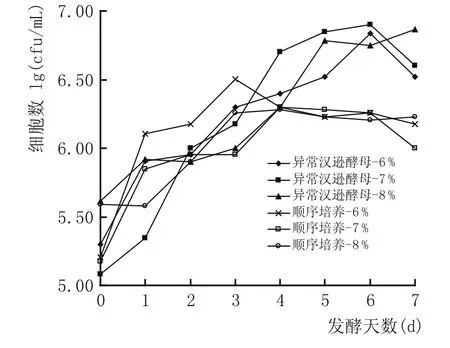
图10 顺序培养体系中不同接种量对异常汉逊酵母生长量变化的影响
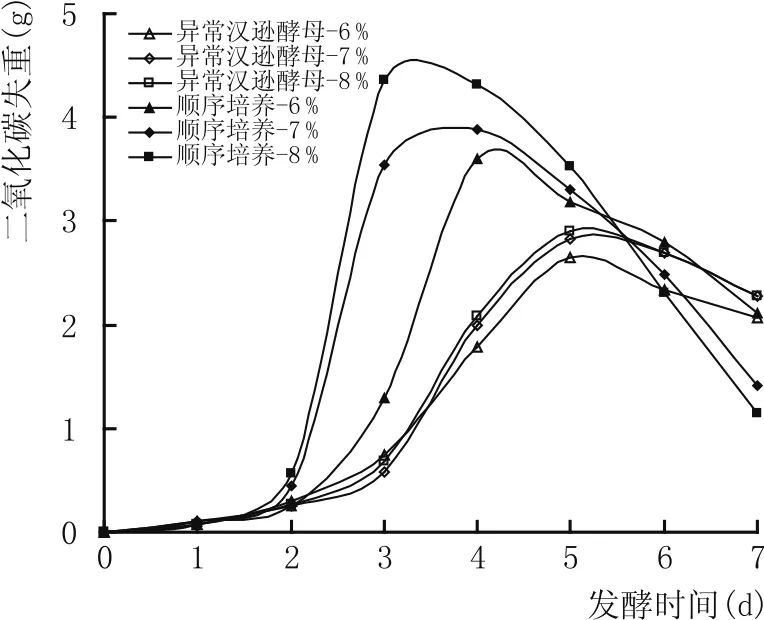
图11 顺序培养体系中不同接种量对酵母发酵力的影响
3.1 共培养发酵体系中,异常汉逊酵母的生长受到了酿酒酵母生长的抑制,其最大细胞生物总量显著低于单菌种纯培养的水平,而异常汉逊酵母对酿酒酵母的生物量及发酵力的影响不明显。
3.2 共培养发酵时以异常汉逊酵母先接种、培养一段时间后再接入发酵力强的酿酒酵母的方式是非常必要的,但对于发酵力而言,酿酒酵母的接种方式对共培养体系发酵力的影响大于异常汉逊酵母。
3.3 本研究只是针对酿酒酵母与异常汉逊酵母相互作用特征方面做了研究,而从分子水平对酿酒酵母与异常汉逊酵母间相互作用机制的相关研究还需进一步开展。
参考文献:
[1] VILJOEN B C.The interaction between yeasts and bacteria in dairy environments[J].Int j food microbiol,2001,69(1):37-44.
[2]DOMIZIO P,ROMANI C,COMITINI F,et al.Potential spoilage non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J].Ann microbiol,2011,61(1):137-144.
[3] Andorrà I,Berradre M,Rozès N,et al.Effect of pure and mixed cultures of the main wine yeast species on grape must fermentations[J].Eur Food Res Technol,2010,231(2):215-224.
[4] 黄洁,宋纪蓉,张建刚.苹果白兰地生产工艺的研究[J].西北大学学报(自然科学版),2001,31(2):131-134.
[5]RODRÍGUEZ M E,LOPES C A,BARBAGELATA R J,et al.Influence of Candida pulcherrima Patagonian strain on alcoholic fermentation behaviour and wine aroma[J].Int j food microbiol,2010,138(1/2):19-25.
[6]COMITINI F,GOBBI M,DOMIZIO P,et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae[J].Food microbiol,2011,28(5):873-882.
[7]CIANI M,COMITINI F,MANAUS I,et al.Controlled mixed culture fermentation:a new perspective on the use of non-Saccharomyces yeasts in winemaking[J].FEMS Yeast res,2010,10(2):123-133.
[8] 中华人民共和国卫生部.食品安全国家标准食品微生物学检验菌落总数测定标准:GB 4789.2—2010[S].北京:中国标准出版社,2010.
[9] 唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学通报,2012,39(7):921-930.
[10]ANDORRÀ I,BERRADRE M,MAS A,et al.Effect of mixed culture fermentations on yeast populations and aroma profile[J].LWT-Food sci technol,2012,49(1):8-13.
[11] 凌杰.白酒酿造中地衣芽孢杆菌与酿酒酵母的相互作用及应用研究[D].无锡:江南大学,2013.
[12] FLEET G H.Yeast interactions and wine flavour[J].Intj food microbiol,2003,86(1/2):11-22.
[13]ALBERGARIA H,FRANCISCO D,GORI K,et al.Saccharomyces cerevisiae CCMI 885 secretes peptides that inhibit the growth of some non-Saccharomyces wine-related strains[J].Appl microbiol biotechnol,2010,86(3):965-972.
[14]BRANCO P,FRANCISCO D,CHAMBON C,et al.Identification of novel GAPDH-derived antimicrobial peptides secreted by Saccharomyces cerevisiae and involved in wine microbial interactions[J].Appl microbiol biotechnol,2014,98(2):843-853.
[15]SMID E J,LACROIX C.Microbe–microbe interactions in mixed culture food fermentations[J].Curr opin biotechnol,2013,24(2):148-154.
Interaction between Saccharomyces cerevisiae and Hansenula anomala during Apple Brandy Fermentation
ZENG Chaozhen,KANG Sanjiang,LI Mingze,ZHANG Jihong,ZHANG Haiyan and ZHANG Fang
(Agricultural Product Storage and Processing Research Institute,Gansu Academy of Agricultural Sciences,Lanzhou,Gansu 730070,China)
The co-culture fermentation systems of Saccharomyces cerevisiae and Hansenula anomala for Fuji apple juice had been constructed.The change in biomass and fermenting power in different systems was compared by using mixed inoculation or sequential inoculation of the two yeast strains.Besides,the interaction between the two yeast strains was analyzed.The results suggested that the growth of Hansenula anomala was inhibited by Saccharomyces cerevisiae in the co-culture system,and the inoculation method of Saccharomyces cerevisiae had greater effects on the fermenting power than that of Hansenula anomala.
apple brandy;Saccharomyces cerevisiae;Hansenula anomala;mixed fermentation;interaction
TS262.38;TS261.1;TS261.4
:A
1001-9286(2017)08-0032-06
10.13746/j.njkj.2017111
现代农业产业技术体系建设专项资金资助(CARS-28);甘肃省农业生物技术研究与应用开发项目(GNSW-2016-20);甘肃省2015年度“陇原青年创新人才扶持计划”项目。
2017-04-27
曾朝珍(1981-),男,助理研究员,硕士,研究方向为食品科学。
康三江(1977-),男,研究员,本科,研究方向为果蔬贮藏加工技术。
优先数字出版时间:2017-06-23;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170623.1517.011.html。

