依据每搏变异指数调控冠心病患者术中的液体管理
秦东泽 梁法禹 张 涌 郭建军 郭林静 韩清华
(山西医科大学第一医院心胸外科,山西 太原 030001)
依据每搏变异指数调控冠心病患者术中的液体管理
秦东泽 梁法禹 张 涌 郭建军 郭林静 韩清华1
(山西医科大学第一医院心胸外科,山西 太原 030001)
目的 探究每搏变异(SVV)用于非体外冠脉搭桥手术(OPCABG)患者的容量管理中,指导输注量与血流动力学及内环境的稳定关系。方法 择期行OPCABG患者160例随机分为SVV组(80例,依SVV值变化管理液体容量)与对照组(80例)。5个时间点采集心率(HR)与平均动脉压(MAP),即T0:患者入室时;T1:诱导15 min后;T2:诱导插管后60 min;T3:切皮后5 min;T4:拔管前。术后2、12、24和48 h测血浆白细胞介素(IL)- 6、IL- 10、肿瘤坏死因子(TNF)- α、血清皮质醇和C- 反应蛋白(CRP)浓度及SVV指数。结果 SVV组SVV在各时间点没有显著性变化,对照组 T1~T4时间点明显升高(P<0.05)。SVV组MAP在 T1~T4增高,对照组 T1~T4时间点明显降低(P<0.05)。对照组MAP在T1~T4均显著低于SVV组(P<0.05)。SVV组HR在 T1~T4降低,对照组 T1~T4明显升高(P<0.05)。两组T1~T4的炎性细胞因子均显著升高,对照组的炎性细胞因子在T1~T4均显著高于SVV组(P<0.05)。两组T1~T4皮质醇及CRP浓度均比T0显著升高。对照组的皮质醇和CRP在T1~T4显著降低(P<0.05)。对照组皮质醇及CRP在T2~T4均显著高于SVV组(P<0.05)。结论 SVV用于OPCABG中患者目标导向液体治疗,对维护平稳的血流动力学,并改善组织灌注和氧供需平衡有效。
每搏变异;冠心病;液体治疗;围术期
功能性血流动力学监测指标每搏量变异(SVV)已被证实其在预测容量治疗效果方面的优势。其理论基础是机械通气时呼吸对循环的影响,即间歇正压通气使右室前负荷减少和后负荷增加,这些变化导致右室每搏量的减少,并在呼吸周期的吸气相末期达到最小值。右室每搏量的减少使左室的前负荷在一个心动周期后也减少,这种变化使左室每搏量降低,并在呼气相达到最小值。故而,临床医师可以根据左室每搏量的变异程度来判断心室功能状态在一曲线上的位置,从而预测容量治疗效果。SVV是由单位时间内每搏量的最大值与最小值之差除以此段时间内每搏量的均值。研究证实利用此技术测量心排量的准确性〔1~3〕,但对于SVV测量在中预测容量治疗反应性方面的研究较少。本文探究SVV用于非体外冠脉搭桥手术(OPCABG)患者的容量管理中,指导输注量与血流动力学及内环境的稳定关系。
1 资料与方法
1.1 一般资料 山西医科大学第一医院2013年1月至 2015年6月择期行OPCABG患者160例。入组标准:年龄45~65岁;性别不拘;无肺肾等脏器并发症;美国麻醉医师学会(ASA)分级为Ⅱ级。排除标准:肝炎病毒及人类免疫缺陷病毒感染者;自身免疫性疾病患者;恶性肿瘤患者;各种精神疾患的患者;肝肾功能不全者。伦理学考量:患者签署参与研究的同意书;充分保障入选患者的医疗治疗和安全性;保护患者隐私;试验中遵循《渥太华工作组关于临床试验注册的声明》。
1.2 分组 采用随机数字表法分为SVV组(80例)与对照组(80例)。其中,SVV组男40例,女40例,年龄45~65岁,平均(54.33±9.42)岁;对照组男39例,女41例,年龄47~62岁,平均(56.25±9.83)岁。两组一般资料无显著差异(P>0.05)。
1.3 治疗方法 监测:两组入室后检测心电图、右手示指脉搏氧饱和度、左侧桡动脉穿刺置管有创动脉压(SVV组连接Vigileo/FloTrac系统监测相关指标)。于麻醉诱导后,右颈内静脉穿刺置入7F三腔中心静脉导管,监测中心静脉压。麻醉管理:开放外周静脉后分别以咪达唑仑0.3 mg/kg、罗库溴铵6 mg/kg、舒芬太尼2 μg/kg、依托咪酯0.1 mg/kg,静脉麻醉诱导,使脑电双频指数(BIS)维持40~50。行气管插管,机械通气。术中以丙泊酚、七氟烷、舒芬太尼及顺阿曲库铵静吸复合麻醉维持。呼吸管理:以间歇正压容量控制通气,潮气量8 ml/kg,调整呼吸频率以维持呼气末二氧化碳(CO2)低于40 cmH2O。血流动力学调控:以多巴胺2~5 μg·kg-1·min-1,去甲肾上腺素0.02~0.05 μg·kg-1·min-1及间羟胺0.25 mg单次静注(可重复),来维持动脉平均压(MAP)不低于60 mmHg,收缩压(SBP)不低于90 mmHg。当MAP>90 mmHg,SBP>135 mmHg,排除麻醉及镇痛不足后,尼卡地平0.25~1.25 μg·kg-1·min-1泵注,来控制血压到正常范围。如心率(HR)持续超过90次/min,可静脉泵注艾司洛尔10~50 μg·kg-1·min-1控制HR于50~70次/min。容量管理:两组于入手术室静脉开放后,以7 ml·kg-1·h-1补充醋酸复合电解质溶液。SVV组于机械通气后,以SVV值为参考指导容量治疗。当SVV≥11时,10 min内补充6%羟乙基淀粉注射液3 ml/kg,当SVV降至8~10,不再补充羟乙基淀粉,继续补充醋酸复合电解质溶液。当SVV<8时,停止补充晶体液,适当调整扩血管药尼卡地平及正性肌力药,降低心脏后负荷并改善心脏舒张收缩功能,待SVV值升高后,再按上述程序补充晶胶液。当胸骨劈开后,因SVV对容量反应受干扰,参考常规血流动力学及心脏状态,适当补充晶体液。当胸腔及闭合后继续参照SVV,进行上述容量治疗。对照组于机械通气后并颈内静脉置管后,参照中心静脉压(CVP)等常规监测指标补充晶胶体。维持CVP 7~10 mmHg、平均动脉压(MBP)>60 mmHg、HR<90次/min、尿量>0.5 ml·kg-1·h-1。当上述指标低于参考值时,特别CVP<7时,10 min内补充6%羟乙基淀粉注射液3 ml/kg,然后观察并评估上述指标。当CVP>10 mmHg同时停止补充胶体及晶体液。当CVP持续大于10 mmHg,并视术中心脏状态,适当调整尼卡地平及正性肌力药。
1.4 观察指标 ①在5个时间点采集HR与MAP,即T0:患者入室时;T1:诱导 15 min后;T2:诱导插管后60 min;T3:切皮后5 min;T4:拔管前。术后2、12、24和48 h测血浆白细胞介素(IL)- 6、IL- 10、肿瘤坏死因子(TNF)- α及血清皮质醇和C- 反应蛋白(CRP)浓度。②于麻醉诱导后胸骨劈开前及胸骨闭合后,分别以SVV对照常规检测指标MAP、CVP及HR指导容量治疗,维持血流动力学平稳和良好的组织灌注。分别记录麻醉诱导后、手术开始切皮、劈开胸骨、术中冠脉搭桥时(右冠状动脉,回旋支)、胸骨闭合后、术毕、转入重症监护治疗室(ICU)后4、12、24 h的血流动力学指标,包括MAP、CVP、HR。于麻醉诱导后及冠脉搭桥完成后及术毕时,并于转入ICU后4、12、24 h采动脉及中心静脉血,检测并记录血气分析,包括pH值、动静脉氧饱和度、乳酸、剩余碱(BE)等值。并于麻醉诱导后、劈开胸骨后、完成冠脉搭桥后及术毕时,记录容量补充总量及晶胶液体各自用量及血管活性药物使用种类和用量。对患者术前及术后48 h、第7天进行肾功能化验记录包括肌酐、尿素氮、β2微球蛋白。记录患者ICU呼吸机支持时间,ICU停留时间及总住院时间、术后并发症及不良事件。③经食道超声心动图(TEE)监测受试者手术结束时的指标:舒张末面积(EDA),收缩末面积(SDA),每搏面积(SA),整体每搏量(SA- T),心房所致的每搏量改变(SA- A),面积变化分数(FAC),晚期峰值充盈率(PFRa),峰值射血率(PER),心输出量(CO),左心室射血分数(LVEF),左心耳收缩末期面积(ESA)。
1.5 统计学处理 采用SPSS20.0统计软件进行χ2检验、方差分析。
2 结 果
2.1 两组SVV变化 与 T0比较,SVV组各时间点没有显著性变化;对照组 T1~T4明显升高(P<0.05)。见表1。
2.2 两组食道超声指标变化 SVV组术毕时食道超声指标FAC、PER、CO、LVEF显著优于对照组,差异有统计学意义(P<0.05)。见表2、图1。
2.3 两组血流动力学变化 MAP结果:与T0比较,SVV组T1~T4显著增高,对照组 T1~T4显著降低(P<0.05);对照组MAP T1~T4均低于SVV组(P<0.05)。HR:与T0比较,SVV组T1~T4显著降低,对照组 T1~T4显著升高(P<0.05);两组T1~T4差异显著(P<0.05)。见表1、表3。

表1 两组各时间点SVV、MAP变化
与T0比较:1)P<0.05;下表同

表2 两组食道超声指标变化
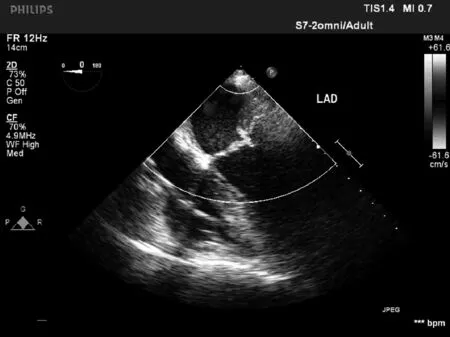
SVV组
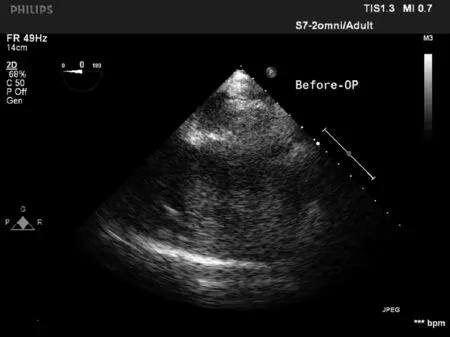
对照组
2.4 两组炎性因子变化 IL- 6、IL- 10及 TNF- α:两组T1~T4均显著升高。对照组的炎性细胞因子在T1~T4时间点均高于SVV组(P<0.05)。两组T1~T4差异显著(P<0.05)。见表3、表4。
2.5 两组血清皮质醇及CRP变化 两组T1~T4皮质醇及CRP浓度比T0显著升高(P<0.05)。对照组血清皮质醇及CRP T1~T4均显著高于SVV组(P<0.05)。见表5。

表3 两组各时间点HR、IL- 6水平变化

表4 两组各时间点IL- 10、TNF- α水平变化

表5 两组各时间点血清皮质醇、CRP水平变化
3 讨 论
OPCABG因暴露术野,方便血管吻合不可避免地会对患者跳动的心脏进行搬动、扭转及固定器的挤压。因患者多有心脏收缩及舒张功能受损,且于术前限制容量摄入而容易导致术中低血压。特别是心脏侧壁与下壁的血管暴露,更会加重血流动力学的恶化,造成包括心肌在内的多器官组织灌注减少,氧供需失衡,而导致术后并发症增加,延长术后监护室滞留及住院时间。因此维护血流动力学平稳,保障脏器组织有效灌注和良好的氧供尤为重要〔1~3〕。
临床经验多应用头低脚高位及容量补充提高前负荷,以稳定血流动力学状态,改善心脏的充盈和组织供氧〔4~6〕。然而,过度补充容量也会增加心脏负担,甚至导致心力衰竭和肺水肿。此外,当心脏移位时,在不改变前负荷状态下会增加心室充盈压〔7,8〕。如果之前不适当的补充容量,会使心脏功能进一步恶化。因此,能准确地判断容量状态并恰当进行液体治疗,是对麻醉医生的一个挑战。而合理的围术期容量管理是保障重要脏器组织灌注的基础〔9〕。早期目标导向治疗(GDT)概念的提出,即应用心输出量或相关的指标来指导液体治疗并应用正性肌力药物维护心脏功能〔10〕。
早期液体治疗对于“自由”与“限制”容量管理争论多年,有文献提示“限制性”液体治疗与容量不足之间很难把握,易导致组织低灌注〔11〕。依靠基础生命体征及尿量等不能发现全身组织低氧的出现〔12〕。随着动态心功能指标检测手段的不断完善,在对比CVP与肺动脉楔压(PAWP)等静态指标的研究中显示,动态指标(SVV等)能更为及时有效地反映容量治疗的心输出量改善〔13〕,进而指导目标导向液体治疗〔14〕。在改善全身组织灌注并维护全身组织氧供需平衡,减少危重患者并发症发病率和死亡率,并缩短重症监护室滞留和住院时间,SVV均能提供积极的帮助〔15〕,SVV在很多危重手术的术中管理亦有很多积极的验证研究〔16〕。
综上,SVV用于OPCABG中患者GDT液体治疗,对维护平稳的血流动力学,并改善组织灌注和氧供需平衡有效。此外,SVV可以降低OPCABG术中和术后并发症与不良事件发生率,并且减少ICU的停留时间。
1 Couture P,Denault A,Limoges P,etal.Mechanisms of hemodynamic changes during off- pump coronary artery bypass surgery〔J〕.Can J Anaesth,2002;49(8):835- 49.
2 Virmani S,Tempe DK.Anaesthesia for off- pump coronary artery surgery〔J〕.Ann Card Anaesth,2007;10(1):65- 71.
3 Lee JH,Jeon Y,Bahk JH,etal.Pulse- pressure variation predicts fluid responsiveness during heart displacement for off- pump coronary artery bypass surgery〔J〕.J Cardiothorac Vasc Anesth,2011;25(6):1056- 62.
4 Jans Ø,Tollund C,Bundgaard- Nielsen M,etal.Goal- directed fluid therapy:stroke volume optimisation and cardiac dimensions in supine healthy humans〔J〕.Acta Anaesthesiol Scand,2008;52(4):536- 40.
5 Nakajima Y,Mizobe T,Matsukawa T,etal.Thermoregulatory response to intraoperative head- down tilt〔J〕.Anesth Analg,2002;94(1):221- 6.
6 Chassot PG,van der Linden P,Zaugg M,etal.Off- pump coronary artery bypass surgery:physiology and anaesthetic management〔J〕.Br J Anaesth,2004;92(3):400- 13.
7 Preisman S,Kogan S,Berkenstadt H,etal.Predicting fluid responsiveness in patients undergoing cardiac surgery:functional haemodynamic parameters including the respiratory systolic variation test and static preload indicators〔J〕.Br J Anaesth,2005;95(6):746- 55.
8 Mathison M,Edgerton JR,Horswell JL,etal.Analysis of hemodynamic changes during beating heart surgical procedures〔J〕.Ann Thorac Surg,2000;70(4):1355- 60.
9 Waldron NH,Miller TE,Gan TJ.Perioperative goal- directed therapy〔J〕.J Cardiothorac Vascu Anesth,2014;28(6):1635- 41.
10 Pearse R,Dawson D,Fawcett T,etal.Early goal- directed therapy after major surgery reduces complications and duration of hospital stay.A randomised,controlled trial〔J〕.Crit Care,2005;9(6):R687- 93.
11 Wenkui Y,Ning L,Jianfeng G,etal.Resricted perioperative fluid administration adjusted by serum lactae level improved outcome after major elective surgery for gastrointestinal malignancy〔J〕.Surgery,2010;147(4):542- 52.
12 Rivers E,Nguyen B,Havstad S,etal.For the early goal- directed therapy collaborative group:early goal- directed therapy in the treatment of severe sepsis and septic shock〔J〕.N Engl J Med,2001;345(19):1368- 77.
13 Kumar L,Rajan S,Baalachandran R,etal.Outcomes associated with stroke volume variation versus central venous pressure guided fluid replacements during major abdominal surgery〔J〕.J Anaesthesiol Clin Pharmacol,2016;32(2):182- 6.
14 Kong YG,Kim JY,Yu J,etal.Efficacy and safety of stroke volume variation- guided fluid therapy for reducing blood loss and transfusion requirements during radical cystectomy:a randomized clinical trial〔J〕.Medicine (Baltimore),2016;95(19):e3685.
15 Benes J,Giglio M,Brienza N,etal.The effects of goal- directed fluid therapy based on dynamic parameters on post- surgical outcome:a meta- analysis of randomized controlled trials〔J〕.Crit Care,2014;18(5):584- 95.
16 Bacchin MR,Ceria CM,Giannone S,etal.Goal- directed fluid therapy based on stroke volume variation in patients undergoing major spine surgery in the prone position:a cohort study〔J〕.Spine (Phila Pa 1976),2016;41(18):E1131- 7.
〔2016- 12- 15修回〕
(编辑 王一涵)
山西省科技攻关项目(No.20130313016- 12)
韩清华(1965- ),女,教授,博士,主要从事冠心病研究。
秦东泽(1976- ),男,讲师,博士,主要从事冠心病研究。
R614.4
A
1005- 9202(2017)15- 3819- 04;
10.3969/j.issn.1005- 9202.2017.15.079
1 山西医科大学第一医院心内科

