Dickkopf-1沉默通过下调β-catenin水平抑制胃癌细胞侵袭及上皮-间充质转化*
孙 杰, 付立芳
(1山东医学高等专科学校中医学教研室, 2临沂市中医医院呼吸内科, 山东 临沂 276000)
Dickkopf-1沉默通过下调β-catenin水平抑制胃癌细胞侵袭及上皮-间充质转化*
孙 杰1△, 付立芳2
(1山东医学高等专科学校中医学教研室,2临沂市中医医院呼吸内科, 山东 临沂 276000)
目的: 探讨分泌蛋白Dickkopf-1 (DKK1)在人胃癌细胞中的表达及其对胃癌细胞侵袭能力的影响。方法: 以real-time PCR和Western blot法检测DKK1在人胃黏膜细胞(GES-1)和胃癌细胞(MKN-45和SGC-7901)中的表达水平;以RNA干扰法沉默DKK1,沉默效果以real-time PCR、Western blot及ELISA法验证;Transwell实验检测细胞侵袭能力,以丝裂霉素C抑制细胞增殖;real-time PCR及Western blot法检测细胞E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin)及β-连环蛋白(β-catenin)水平。结果: DKK1在MKN-45和SGC-7901细胞中的表达明显高于GES-1细胞,表明DKK1在胃癌细胞中表达显著升高;DKK1在MKN-45和SGC-7901细胞中被成功沉默后,细胞侵袭能力显著下降,并具有时间依赖性,同时伴随E-cadherin表达增高及N-cadhe-rin和vimentin表达下降,表明DKK1沉默能够显著抑制胃癌细胞侵袭和上皮-间充质转化(epithelial-mesenchymal transition,EMT);经外源性重组DKK1(rDKK1)转染肿瘤细胞后,进一步证实DKK1具有促胃癌细胞侵袭的作用,并可促进EMT进程;DKK1沉默通过下调β-catenin水平来实现其对胃癌细胞侵袭及EMT的抑制作用。结论: DKK1在人胃癌细胞中表达显著增高,且DKK1沉默能够通过下调β-catenin水平抑制胃癌细胞侵袭及EMT过程。
Dickkopf-1; 胃癌; 上皮-间充质转化; 细胞侵袭; β-连环蛋白
胃癌是全球最常见的消化道恶性肿瘤之一,具有较高的发病率和死亡率[1-2]。基于胃癌早期低诊断率的特点,越来越多的研究致力于寻找胃癌特异性血清肿瘤标志分子[3]。Dickkopf (DKK)是一组分泌型糖蛋白,通常由225~350个氨基酸残基组成,能够负性调控Wnt信号通路下游基因活性从而发挥促癌或抑癌作用[4-5]。目前,DKK1是DKK家族中被研究最多的蛋白,其被报道广泛参与调控多种癌症的侵袭和转移[4]。研究表明,DKK1在肝癌、肺癌、食管癌及胆管癌中发挥促侵袭作用,但在口腔鳞状细胞癌及黑色素瘤中作用则相反[4, 6]。近年研究发现,DKK1在胃癌患者血清及组织中显著高表达[7-8],但其对胃癌细胞侵袭的影响尚不明确。本研究旨在探讨人胃癌细胞中DKK1的表达,及其对胃癌细胞侵袭的影响及作用机制。
材 料 和 方 法
1 细胞和主要试剂
人胃黏膜上皮细胞株GES-1购自ATCC;人胃癌细胞株SGC-7901和MKN-45购自中国科学院上海细胞研究所。
DMEM培养基、RPMI-1640培养基、胎牛血清、青霉素、链霉素、RIPA裂解液、BCA试剂盒、PVDF膜、胰蛋白酶、LipofectamineTM2000、丝裂霉素C(mi-tomycin C,MMC)及结晶紫均购自Sigma;Trizol试剂盒购自Invitrogen;ECL显色试剂购自上海西唐生物科技有限公司;Transwell小室购自Corning;DKK1-siRNA及相应scramble-siRNA、β-catenin-siRNA及相应scramble-siRNA购自Thermo;重组人DKK1蛋白(recombinant DKK1,rDKK1)及其ELISA检测试剂盒购自R&D。
2 方法
2.1 细胞培养 GES-1细胞常规培养于DMEM培养基中,内含10%胎牛血清、1.5×105U/L青霉素及50 mg/L链霉素[9]。MKN-45细胞培养于RPMI-1640培养基中,内含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素[10]。SGC-7901细胞培养于DMEM培养基中,内含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素[11-12]。所有细胞均置于37 ℃、5% CO2相对饱和湿度的孵育箱中培养,取对数生长期的细胞进行实验。
2.2 Real-time PCR实验 细胞总RNA以Trizol试剂盒进行提取,操作按照说明书进行。以反转录试剂将5 μg RNA转录为cDNA,以cDNA为模板进行PCR扩增反应,β-actin为内参照。扩增条件为94 ℃ 5 min; 94 ℃ 30 s, 56 ℃ 45 s, 72 ℃ 50 s,循环40次[13]。反应结果以ABI 7500系统检测,并采用2-ΔΔCt法进行定量。引物由上海生工生物工程技术服务有限公司合成,详细序列见表1。

表1 实时定量PCR引物序列
2.3 Western blot实验 以RIPA裂解液裂解细胞,提取总蛋白。蛋白浓度以BCA法测定。取40 μg总蛋白并以10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)分离,将分离的蛋白质电转移至PVDF膜[14]。PVDF膜经PBS清洗后,与目的蛋白 I 抗于4 ℃孵育过夜,清洗后,继续与辣根过氧化物酶(horseradish peroxidase,HRP)标记的IgG II 抗孵育1.5 h,ECL显影液显影,β-actin为内参照[15]。抗体为兔抗人DKK1多克隆抗体(稀释度:1∶2 000)、兔抗人E-钙黏蛋白(E-cadherin)单克隆抗体(稀释度:1∶2 500)、兔抗人N-钙黏蛋白(N-cadherin)多克隆抗体(稀释度:1∶1 500)、兔抗人波形蛋白(vimentin)单克隆抗体(稀释度:1∶2 000)、兔抗人β-连环蛋白(β-catenin)单克隆抗体(稀释度:1∶1 500)、兔抗人β-肌动蛋白(β-actin)多克隆抗体(稀释度:1∶2 500),及HRP标记的山羊抗兔IgG II 抗(稀释度:1∶4 000)。所有抗体均购自Abcam。利用Gel-Pro 4.0软件对Western blot的条带进行量化分析。
2.4 RNA干扰法沉默DKK1表达 选取处于对数生长期的MKN-45细胞和SGC-7901细胞,以0.25%胰蛋白酶进行消化,并制备成细胞悬液。将细胞以每孔1×106个接种于6孔板后,置于37 ℃、5% CO2环境下培养至细胞融合达80%。2 nmol/L DKK1-siRNA和scramble-siRNA分别以LipofectamineTM2000转染至上述细胞中,并设置相应空白对照组。转染48 h后,分别以real-time PCR法和Western blot法验证DKK1基因沉默效果,Transwell实验检测细胞侵袭能力。继续培养48 h后,real-time PCR法和Western blot法检测目的基因及蛋白水平。
2.5 Transwell侵袭实验 收集各组细胞,分别重悬于无血清培养基中。选取24孔板(滤膜直径6.5 mm, 孔径8.0 μm)的Transwell小室进行细胞侵袭实验。小室上层以1 g/L Matrigel预包被后,接种5×104个细胞(约800 μL),加入MMC抑制细胞增殖。下层加入600 μL DMEM或RPMI-1640全培养液。常规培养24、48及72 h后,以棉拭子擦掉上层未侵袭细胞,侵袭细胞以0.1% 结晶紫染色30 min,PBS漂洗3次,于倒置显微镜下观察并计数侵袭细胞[16-17]。
为了验证DKK1对胃癌细胞侵袭的促进作用,将终浓度为0、20、40和60 μg/L 的人rDKK1蛋白依次分别加入内含MKN-45细胞和SGC-7901细胞的Transwell小室或6孔板中。rDKK1处理48 h后,检测细胞侵袭能力。
β-catenin-siRNA及其scramble-siRNA分别以LipofectamineTM2000转染至2种胃癌细胞中,转染48 h后验证β-catenin基因沉默效果。收集细胞进行Transwell实验,加入终浓度为60 μg/L的人rDKK1蛋白处理48 h,同时设置相应对照组,并检测细胞侵袭能力。
3 统计学处理
本研究实验均独立重复3次,数据以均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析,组间两两比较应用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 DKK1在人胃癌细胞中表达显著升高
Real-time PCR实验结果表明,DKK1在低分化胃癌细胞MKN-45和中分化胃癌细胞SGC-7901中的相对mRNA水平均显著高于GES-1细胞(P<0.05)。Western blot结果表明,DKK1在MKN-45细胞和SGC-7901细胞中的相对蛋白水平同样均显著高于GES-1细胞(P<0.05)。此外,DKK1在SGC-7901细胞中的mRNA和蛋白水平明显高于MKN-45细胞 (P<0.05)。本部分结果证实,DKK1在人胃癌细胞中的表达显著升高,并随癌细胞分化而加强,见图1。
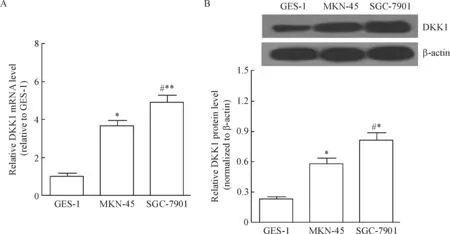
Figure 1.The mRNA (A) and protein (B) levels of DKK1 in human gastric carcinoma cells. Mean±SD.n=3.*P<0.05,**P<0.01vsGES-1;#P<0.05vsMKN-45.
图1 DKK1在人胃癌细胞中的水平
2DKK1基因沉默效果的验证
验证结果表明,DKK1的mRNA水平在DKK1-siRNA组中显著低于scramble-siRNA组和空白对照组,类似结果也体现于其蛋白表达水平上(P<0.05)。收集细胞培养上清液,以ELISA试剂盒检测DKK1蛋白水平,结果与DKK1 mRNA及 Western blot结果一致。本部分结果表明,2种胃癌细胞中DKK1基因沉默效果良好,能够满足后续实验要求,见图2。
3DKK1基因沉默抑制胃癌细胞侵袭
2种DKK1沉默细胞(DKK1-siRNA组)的侵袭力均显著低于DKK1未沉默细胞(scramble-siRNA组和空白对照组),且具有时间依赖性。72 h时,不同组MKN-45细胞和SGC-7901细胞侵袭的原始图片见图3。本部分结果显示,DKK1水平下调能够显著抑制胃癌细胞的侵袭,反映出其具有促胃癌细胞侵袭的作用。
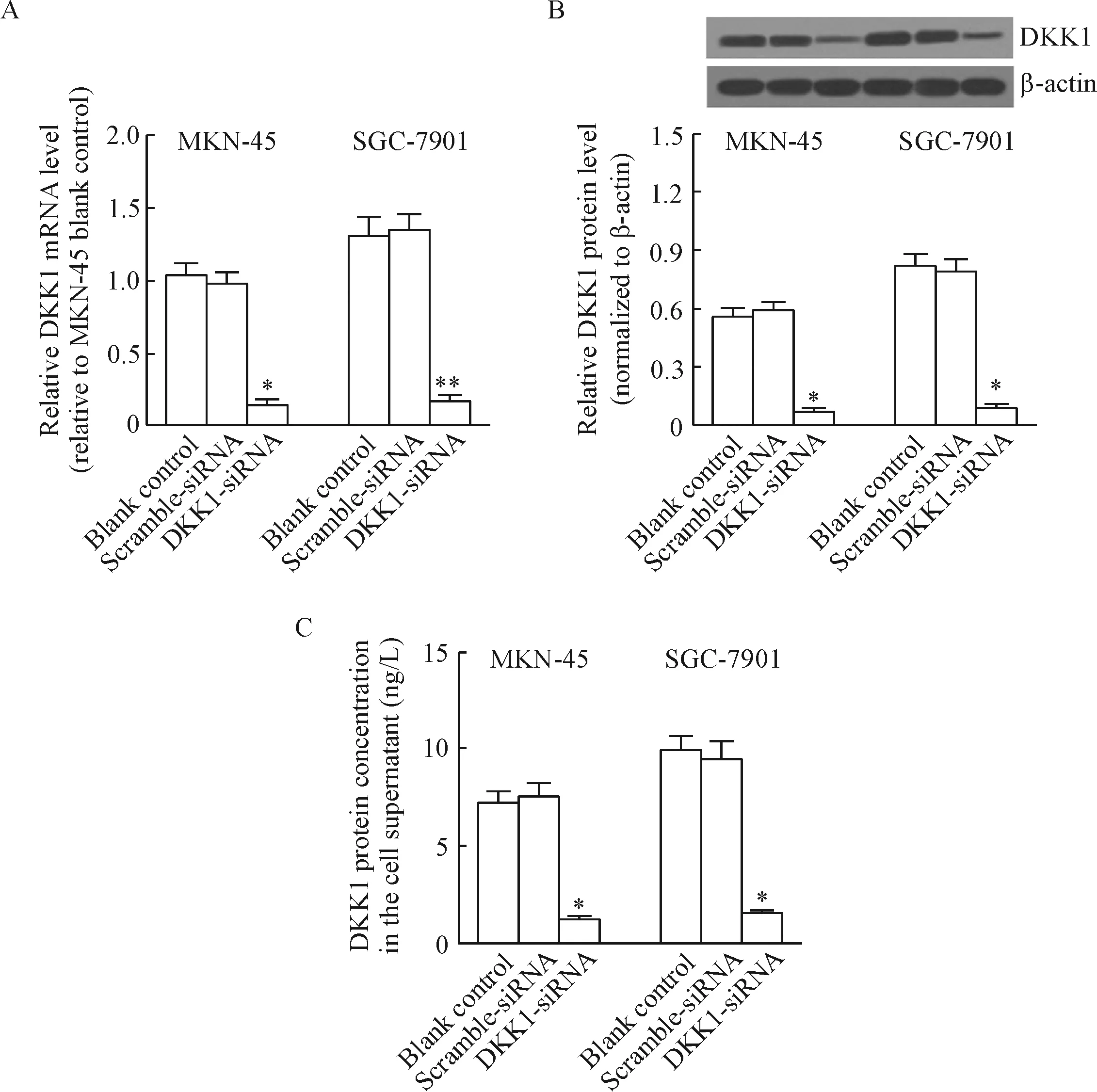
Figure 2.The expression of DKK1 at mRNA and protein levels. A: the relative mRNA level of DKK1 in the cells; B: the relative protein level of DKK1 in the cells; C: the protein concentration of DKK1 in the cell supernatant. Mean±SD.n=3.*P<0.05,**P<0.01vsscramble-siRNA group.
图2 DKK1 mRNA及蛋白水平
4DKK1基因沉默调节细胞EMT过程
Real-time PCR实验结果发现,DKK1沉默后,2种胃癌细胞中E-cadherin的mRNA水平显著升高,N-cadherin及vimentin的mRNA水平显著下降。类似变化也出现在相应分子蛋白表达水平上。本部分结果证实,DKK1基因沉默能够显著抑制细胞的EMT过程,见图4。
5 外源性DKK1促进胃癌细胞侵袭及EMT过程
MKN-45和SGC-7901细胞侵袭力随rDKK1剂量增加而增强;同时,伴随剂量依赖性的E-cadherin的mRNA水平下降,及N-cadherin和vimentin的mRNA水平上升。此外,SGC-7901细胞在40 μg/L rDKK1和60 μg/L rDKK1作用下侵袭力显著强于MKN-45细胞(P<0.05)。以不同浓度rDKK1处理两种细胞48 h后,MKN-45细胞和SGC-7901细胞侵袭的图片见图5。本部分结果验证,DKK1具有促进胃癌细胞侵袭及EMT转化的作用。
6DKK1沉默通过降低β-catenin水平发挥抑制侵袭作用
为了探讨DKK1沉默是否通过下调β-catenin水平影响了胃癌细胞的侵袭力,本研究继续检测了MKN-45细胞和SGC-7901细胞中β-catenin水平。DKK1沉默后,β-catenin的mRNA及蛋白水平在2种细胞中均显著下调(P<0.05),表明DKK1沉默抑制了胃癌细胞中β-catenin的表达。
另外,β-catenin沉默后MKN-45细胞和SGC-7901细胞的侵袭力显著低于未沉默组(P<0.05);同时在60 μg/L rDKK1作用下细胞侵袭力在β-catenin沉默的细胞中显著低于β-catenin未沉默的细胞(P<0.05)。类似结果也体现于EMT过程中。以上结果表明,DKK1沉默是通过下调β-catenin水平抑制了胃癌细胞的侵袭及EMT过程,见图6。

Figure 3.The cell invasion ability detected by Transwell assay. Mean±SD.n=3.*P<0.05,**P<0.01vsscramber-siRNA group.
图3 Transwell实验检测细胞侵袭力
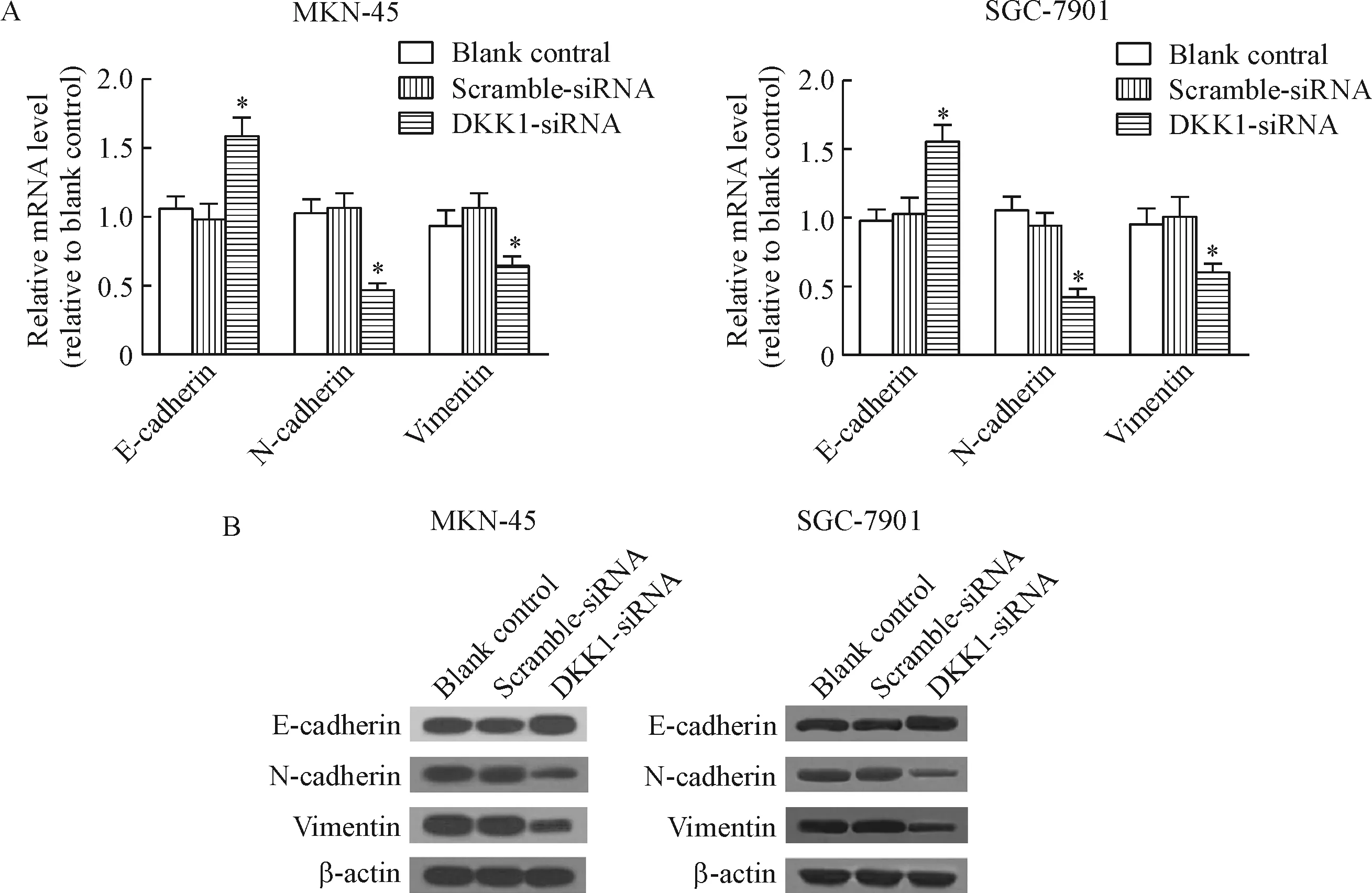
Figure 4.The changes of the mRNA (A) and protein (B) levels of EMT-related molecules. Mean±SD.n=3.*P<0.05vsscramble-siRNA group.
图4 EMT相关分子mRNA及蛋白水平
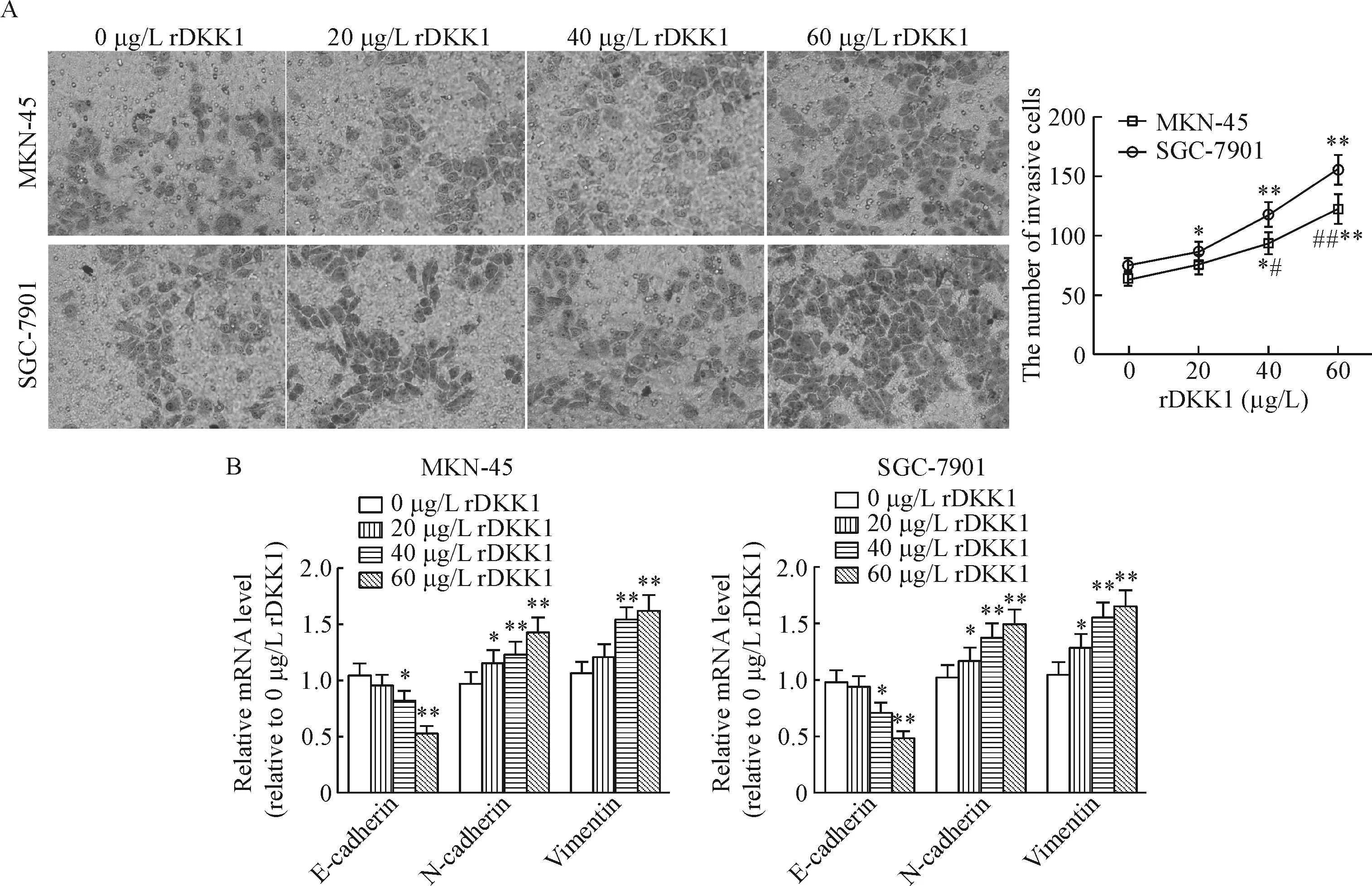
Figure 5.The influences of human rDKK1 on the invasion (A) and EMT (B) of gastric carcinoma cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μg/L rDKK1;#P<0.05,##P<0.01vsSGC-7901.
图5 人重组DKK1对胃癌细胞侵袭及EMT转化的影响
讨 论
DKK1是一种有力的经典Wnt/β-catenin信号通路的抑制剂,其一方面能在细胞外与Wnt竞争性结合LRP5/LRP6辅助受体抑制Wnt信号[6],另一方面能与LRP5/LRP6、Kremen 1/2聚合为三聚体,通过快速诱导细胞内吞以减少胞膜上的LRP5/LRP而阻断Wnt信号向胞内传递[7]。Wnt信号通路在癌症发生发展过程中发挥重要作用,因此DKK1与癌症的发生发展密切相关。研究表明,DKK1 在多数癌症如肝癌、肺癌及食管癌中发挥促侵袭作用,但在口腔鳞状细胞癌及黑色素瘤中则发挥相反作用[4],然而其在胃癌侵袭中的作用尚不明确。
Lee等[18]评估了153例胃癌患者和173例健康志愿者血清中DKK1的浓度,发现其在胃癌患者血清中的浓度显著高于健康志愿者。本研究表明,胃癌细胞中DKK1表达水平显著高于胃正常细胞,与其在血清中的检测结果一致,这也预示着DKK1可能与胃癌的发展进程有一定的相关性。深入研究发现,DKK1沉默显著抑制了胃癌细胞侵袭及EMT过程,表明DKK1能够促进胃癌的侵袭,在胃癌的发展中具有重要的调控作用。
在肿瘤侵袭过程中,EMT是除肿瘤转移基因、血管生成及细胞外基质降解外的另一重要影响因素[19]。该过程新形成的细胞具有间质细胞的形态学和转移特性,能够诱使细胞发生转移和侵袭[20]。本文研究发现, 外源性DKK1促进胃癌细胞侵袭的作用与EMT过程密切相关。Yao[21]等研究发现非小细胞肺癌(non-small cell lung carcinoma,NSCLC)中,DKK1促进的血管生成拟态也与EMT过程有紧密关联。
β-catenin是由位于染色体3p21-22的CTNNB1基因编码的,具有介导细胞间黏附及信号转导等多重功能的重要分子[22]。β-catenin在多种癌症细胞的增殖、凋亡及侵袭转移中扮演重要角色,例如其能削弱骨肉瘤细胞的侵袭能力[23],加强肺癌细胞的增殖能力等[24]。报道指出,β-catenin基因沉默的胃癌细胞表现出较弱的侵袭能力[25]。研究发现,DKK1和β-catenin在胃癌组织中表达呈正相关[26-27],但两者在胃癌中是否存在调控关系尚不明确。本研究检测发现,β-catenin在DKK1沉默的胃癌细胞中表达显著下调,明确了DKK1对β-catenin的正调控作用。应用β-catenin-siRNA或/和rDKK1联合处理细胞发现,rDKK1诱导的胃癌细胞侵袭力的增强并未在β-catenin沉默的细胞中检测到,表明DKK1是通过调控β-catenin表达影响了胃癌细胞的侵袭力。此外,本研究也检测到β-catenin沉默胃癌细胞侵袭力的整体下降,与潘安萍[25]的研究结果一致。
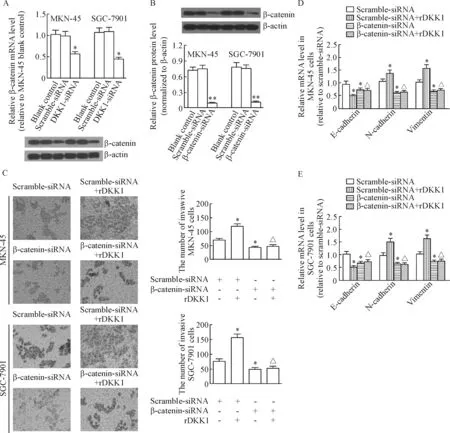
Figure 6.Influences of human rDKK1 on the invasion and EMT of β-catenin-silencing gastric carcinoma cells. A: the mRNA and protein levels of β-catenin inDKK1-silencing cells; B: the protein level of β-catenin in β-catenin-silencing cells; C: the effects of rDKK1 (60 μg/L) on invasive ability of MKN-45 and SGC-7901 cells; D: the effects of rDKK1 on the mRNA levels of EMT-related genes in the MKN-45 cells; E: the effects of rDKK1 on the mRNA levels of EMT-related genes in the SGC-7901 cells. Mean±SD.n=3.*P<0.05,**P<0.01vsscramble-siRNA;△P<0.05vsscramble-siRNA+rDKK1.
图6 人重组DKK1对β-catenin沉默胃癌细胞侵袭及EMT的影响
E-cadherin与EMT过程密切相关,是上皮细胞黏连的主要分子,其通过α-catenin、β-catenin及γ-catenin组成的复合物锚定在细胞骨架;当β-catenin积聚转入核内后,E-cadherin会失去锚定而活动到其它区域,使细胞间失去相互黏附而移动力增强,发生侵袭及EMT过程[28]。因此,rDKK1对胃癌细胞的促侵袭作用,除了与rDKK1对E-cadherin表达的负调控有关,还与DKK1对β-catenin表达的正调控有关,可能表现为DKK1使β-catenin水平增加并积聚而入核,导致E-cadherin失去锚定复合物,致使细胞间黏附减弱,加速了细胞侵袭及EMT过程。
综上所述,本研究发现DKK1在胃癌细胞中表达显著上升。DKK1沉默能够通过下调β-catenin表达水平来抑制胃癌细胞侵袭及EMT过程。
[1] 邹文斌, 李兆申. 中国胃癌发病率及死亡率研究进展[J]. 中国实用内科杂志, 2014, 34(4):408-415.
[2] 陈淑芬, 侯婧瑛, 吴淑云, 等. IFN-γ上调人胃癌细胞株PD-L1表达[J]. 中国病理生理杂志, 2013, 29(11):1952-1956.
[3] 王 洋, 王 欢, 莫佳美, 等. 血清肿瘤标志物在胃癌诊断中的价值[J]. 现代肿瘤医学, 2014, 22(4):883-885.
[4] 黄晓红. DKK-1与肿瘤的研究进展[J]. 成都医学院学报, 2014, 9(3):366-369.
[5] 曾庆哲, 张浩清, 杨瑞青. Dickkopf-1在肺癌相关恶性胸腔积液中的表达和临床意义[J]. 中国医药导报, 2016, 13(8):108-111.
[6] 彭裕辉, 许镒洧, 谢剑君. 血清DKK1在肿瘤临床应用的价值[J]. 癌变·畸变·突变, 2014, 26(1):79-81.
[7] 蔡靓羽, 尹卫娟, 徐敏逸. 分泌蛋白 DKK1 (Dickkopf-1)在胃癌患者血清及组织中的表达及其意义[J]. 中国现代医学杂志, 2014, 24(6):1-8.
[8] 马 刚, 戴伟杰, 严 伟, 等. Dickkopf-1在胃癌组织中的表达及其临床意义[J]. 中华消化杂志, 2015, 35(12):846-848.
[9] 蒋 虹, 杨生玺, 张晓岩, 等. 不同程度低氧对体外培养人胃粘膜上皮细胞株[J]. 青海医学院学报, 2012, 33(3):175-178.
[10]桂牧微, 魏品康, 陆 烨, 等. 消痰散结方药物血清对人胃癌 MKN-45 细胞增殖和凋亡的影响[J]. 中西医结合学报, 2010, 8(3):250-255.
[11]李玉英, 赵淑娟, 白崇智, 等. 苦荞异槲皮苷对人胃癌细胞SGC-7901增殖及凋亡的影响[J]. 食品科学, 2014, 35(3):193-197.
[12]张伟丽, 陈 超.HOXB7基因沉默对人胃癌细胞活力、迁移和侵袭的影响[J]. 中国病理生理杂志, 2016, 32(10):1824-1829.
[13]曾 亚, 刘 玮, 王 赛. 幽门螺杆菌诱导人胃黏膜细胞 GES-1过表达 COX-2 的研究[J]. 实用预防医学, 2012, 19(6):838-840.
[14]苏 婷, 赖铭裕, 农云翠. 慢病毒介导的GOLPH3基因沉默对人胃癌SGC-7901细胞增殖、侵袭和迁移能力的影响[J]. 中国病理生理杂志, 2014, 30(5):815-819.
[15]徐群芳, 谈文龙, 赵 锐. 转化生长因子β诱导肿瘤微环境改变促进胃癌 NCI-N87 细胞上皮间充质转化[J]. 国际药学研究杂志, 2014, 41(6):686-692.
[16]王显艳, 高 峰, 赵春明, 等. miR-140在人胃癌组织中的表达及对SGC-7901胃癌细胞功能的影响[J]. 中国病理生理杂志, 2016, 32(4):651-657.
[17]刘 骏, 周建奖, 赵 艳, 等. 胃泌素促进胃癌细胞的迁移和侵袭[J]. 中国病理生理杂志, 2013, 29(4):730-733.
[18]Lee HS, Lee HE, Park DJ, et al. Clinical significance of serum and tissue Dickkopf-1 levels in patients with gastric cancer[J]. Clin Chim Acta, 2012, 413(21-22):1753-1760.
[19]伊日贵. 肿瘤侵袭转移机制研究进展[J]. 中华实用诊断与治疗杂志, 2014, 28(10):937-939.
[20]冯和林, 郑丽华. 上皮间质转化的分子机制研究进展[J]. 实用癌症杂志, 2013, 28(1):105-110.
[21]Yao L, Zhang D, Zhao X, et al. Dickkopf-1-promoted vasculogenic mimicry in non-small cell lung cancer is associated with EMT and development of a cancer stem-like cell phenotype[J]. J Cell Mol Med, 2016, 20(9):1673-1685.
[22]韩 涛, 丁 劲, 王红阳. β-catenin 信号分子的生物学功能及其在肝癌中的研究进展[J]. 中国生物工程杂志, 2011, 31(9):96-102.
[23]罗光金, 康 权, 毕 杨, 等. β-catenin 过表达对骨肉瘤细胞 TE85 迁移、侵袭及凋亡的影响[J]. 基础医学与临床, 2014, 34(11):1491-1496.
[24]刘树立, 徐洪涛, 杨连赫, 等. Axin过表达下调β-catenin和TCF-4表达并抑制肺癌BE1细胞的增殖和侵袭[J]. 中国肺癌杂志, 2009, 12(4):277-282.
[25]潘安萍. 沉默β-catenin表达对人胃癌细胞生物学行为的影响[D]. 南昌: 南昌大学第一附属医院, 2014.
[26]路三军, 杨学丽, 桂洪武, 等. 近端胃腺癌中DKK-1和β-catenin的表达及其相关性[J]. 中国肿瘤临床, 2013, 40(17):1038-1041.
[27]杨学丽, 路三军, 魏 娉, 等. GSK-3β、DKK-1、β-catenin 在近端胃癌中的表达及临床意义[J]. 现代中西医结合杂志, 2015, 24(24):2646-2658.
[28]王卫杰, 周家华, 张丽华. 胃癌中上皮-间质转化路径及相关因子的研究进展[J]. 临床与实验病理学杂志, 2014, 30(2):193-196.
(责任编辑: 林白霜, 罗 森)
Dickkopf-1 silencing inhibits invasion and epithelial-mesenchymal transition in gastric carcinoma cells by down-regulating β-catenin
SUN Jie1, FU Li-fang2
(1DepartmentofTraditionalChineseMedicine,ShandongMedicalCollege,2DepartmentofRespiratoryMedicine,ChineseMedicineHospitalinLinyiCity,Linyi276000,China.E-mail:jsunsd@163.com)
AIM: To explore the expression of Dickkopf-1 (DKK1) in human gastric carcinoma cells, and the influences ofDKK1 gene silencing on cell invasion. METHODS: The levels of DKK1 in the human gastric mucosa cell line GES-1 and gastric carcinoma cell lines MKN-45 and SGC-7901 were detected by real-time PCR and Western blot.DKK1 gene was silenced by RNA interference, which was verified by real-time PCR, Western blot and ELISA. The cell invasion ability was determined by Transwell assay, and the cell proliferation was inhibited by mitomycin C. The levels of E-cadherin, N-cadherin, vimentin and β-catenin were determined by real-time PCR and Western blot. RESULTS: The expression of DKK1 was significantly higher in MKN-45 cells and SGC-7901 cells than that in GES-1 cells, indicating that DKK1 expression was obviously increased in gastric carcinoma cells. After successful silencing ofDKK1 gene in the MKN-45 cells and SGC-7901 cells, the cell invasion ability was markedly decreased in a time-dependent pattern with increased expression of E-cadherin and decreased expression of N-cadherin and vimentin, indicating thatDKK1 silencing dramatically inhibited gastric carcinoma cell invasion and epithelial-mesenchymal transition (EMT). The introduction of exogenous recombinant DKK1 (rDKK1) demonstrated the promoting effect of DKK1 on gastric carcinoma cell invasion and EMT. In addition, the inhibitory effects ofDKK1 silencing on gastric carcinoma cell invasion and EMT were fulfilled by down-regulating β-catenin. CONCLUSION: The expression of DKK1 is significantly increased in human gastric carcinoma cells. Silencing ofDKK1 markedly inhibits gastric carcinoma cell invasion and EMT by down-regulating β-catenin.
Dickkopf-1; Gastric carcinoma; Epithelial-mesenchymal transition; Cell invasion; β-catenin
1000- 4718(2017)08- 1428- 08
2016- 09- 30
2017- 05- 31
山东省教育厅课题(No. J13LK56);临沂市科技发展计划项目(No. 20151505)
R730.23; R735.2
A
10.3969/j.issn.1000- 4718.2017.08.014
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0539-8052575; E-mail: jsunsd@163.com

