受体酪氨酸激酶Axl高表达促进鼻咽癌临床进展*
贾亚楠, 李汝佳, 王可可, 雷 洪, 哈艳平, 王思思, 廖晓敏, 揭 伟, 申志华△
(广东医科大学基础医学院 1病理生理教研室, 2病理学系, 广东 湛江 524023; 3广东医科大学附属医院病理诊断与研究中心, 广东 湛江 524001)
受体酪氨酸激酶Axl高表达促进鼻咽癌临床进展*
贾亚楠1, 李汝佳2, 3▲, 王可可2, 3, 雷 洪2,3, 哈艳平2, 3, 王思思2, 3, 廖晓敏2, 3, 揭 伟2, 3, 申志华1△
(广东医科大学基础医学院1病理生理教研室,2病理学系, 广东 湛江 524023;3广东医科大学附属医院病理诊断与研究中心, 广东 湛江 524001)
目的: 探讨受体酪氨酸激酶anexelekto (Axl)在鼻咽癌(nasopharyngeal carcinoma,NPC)中的表达及意义。方法: 采用免疫组化法检测78例NPC和32例鼻咽黏膜慢性炎中Axl的表达,分析Axl蛋白表达与NPC患者临床参数的相关性。常规培养NPC细胞,免疫荧光法检测不同分化NPC细胞系CNE1、CNE2Z及C666-1中Axl的蛋白表达情况。应用Axl特异性抑制剂TP-0903处理CNE1和C666-1细胞,CCK-8实验检测细胞的活力,流式细胞术检测细胞周期的分布,qPCR检测Axl和增殖细胞核抗原(PCNA)的mRNA表达,Western blot检测Axl及p-Axl蛋白的表达。结果: Axl蛋白定位于胞膜和胞质。NPC中Axl高表达阳性率显著高于鼻咽黏膜慢性炎(P<0.01)。Axl高表达与患者年龄、性别及M分期无关,与临床分期、T分期和N分期呈正相关(P<0.05)。Axl在高分化CNE1细胞中低表达,在低分化CNE2Z细胞和未分化C666-1细胞中表达水平明显增高。TP-0903呈浓度和时间依赖性抑制NPC细胞的活性,2 nmol/L TP-0903即具有显著抑制效应,能阻滞细胞周期于G0期,在降低Axl活性的同时也显著抑制PCNA的表达。结论: Axl高表达可促进NPC的临床进展;TP-0903显著抑制NPC细胞的增殖,提示Axl可能在NPC靶向治疗中具有一定的价值。
鼻咽癌; Anexelekto; TP-0903; 细胞增殖; 细胞周期
材 料 和 方 法
1 主要抗体及试剂
兔抗人Axl和p-Axl (Tyr698+Tyr702+Tyr703)的 I 抗(北京博奥森);鼠抗人增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)及GAPDH的I 抗(Cell signaling);HRP-、FITC-、PE-标记的II抗(武汉三鹰);免疫组化PV9000试剂盒及DAB试剂盒(北京中杉金桥);TP-0903(纯度>98%;MCE);RNA抽提试剂盒及逆转录试剂盒(Invitrogen);实时荧光定量PCR试剂盒(Roche);qPCR引物由上海生工公司合成;RPMI-1640培养基、胎牛血清(fetal bovine serum,FBS)均购自Hyclone;碘化丙啶(propidium iodide,PI)、RNaseA及DAPI染液(Sigma);蛋白酶及磷酸酶抑制剂、RIPA缓冲液、BCA及CCK-8试剂盒(碧云天);ECL发光剂及PVDF膜(Thermo Scientific)。
2 临床标本
78例NPC及32例鼻咽黏膜慢性炎(nasopharyngeal chronic inflammation,NPI)患者的石蜡包埋组织来自2014~2015年广东医科大学附属医院病理中心保存的标本。所有NPC患者均为首次就诊,未接受任何治疗,组织学类型均为非角型未分化性癌,采用pTNM系统(AJCC/UICC 2002)进行分类。78例NPC中,男性42例,女性36例,中位年龄46岁。32例NPI为同期标本,其中男性18例,女性14例,中位年龄44岁。临床人体标本的使用符合广东医科大学附属医院有关伦理学规定(批件编号为PJ2014028)。
3 主要方法
3.1 免疫组织化学染色 采用免疫组化PV9000试剂盒检测临床人体标本中Axl蛋白的表达。4 μm厚石蜡切片脱蜡至水,经热抗原修复后滴加0.3% H2O2阻断内源性过氧化物酶,室温孵育20 min,PBS洗3 min、3次;滴加3% BSA-PBS封闭非特异性位点,室温孵育30 min;滴加抗Axl抗体(1∶50稀释),4 °C冰箱孵育过夜,PBS洗2 min、3次;滴加反应增强液,室温孵育20 min,PBS洗2 min、3次;滴加辣根酶标记羊抗兔/鼠IgG,室温孵育30 min,PBS洗2 min、3次;DAB显色,苏木精复染胞核;结果由2名独立病理学专家判断。显微镜下充分阅读完整张切片,选择切片上、中、下(左、右各3)共6个典型视野进行结果判断(Axl蛋白定位于胞膜和胞质),按阳性细胞数评分:无阳性细胞为0分,<10%为1分,≥10%但<50%为2分,≥50%为3分;按显色程度评分:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。总分数 = 染色强度评分×阳性细胞数评分,总分数≥4分定义为Axl高表达。
3.2 细胞培养 高分化CNE1细胞、低分化CNE2Z细胞及未分化C666-1细胞由我室保存并参照既往方法进行体外培养[11-14]。简言之,NPC细胞接种于直径6 cm的培养皿中,用含10% FBS、1×105U/L青霉素及0.1 mg/L链霉素的RPMI-1640培养,隔日换液,取对数生长期细胞用于相关实验。
小偷又接连刺了她几刀,刀刀见血。她倒下了,小偷夺门而逃。他傻了一般,站在那儿一动不动。老半天,他才好像突然清醒了。他跑过去抱起她,摇晃着她的身子喊,我不是人,为什么替我挡刀啊!
3.3 免疫荧光染色 将CNE1细胞、CNE2Z细胞及C666-1细胞接种于无菌玻璃盖片制备细胞爬片。取出细胞爬片,参考既往采用的间接免疫荧光法[15]检测3种细胞中Axl蛋白的表达。Axl抗原定位以FITC-标记的IgG显示,DAPI复染胞核,激光共聚焦显微镜(TCS SP5 II;Leica)下观察并拍照。
3.4 CCK-8检测细胞活力 分别将Axl低表达CNE1细胞和Axl高表达的C666-1细胞接种于96孔板(每孔3 000个),贴壁过夜后通过CCK-8实验检测TP-0903处理前后细胞的活力。细胞分为正常对照(control)组(正常细胞加入完全培养液培养)、TP-0903组[完全培养液中加TP-0903(DMSO溶解,终浓度为1、2、5 nmol/L)]和DMSO组[完全培养液中加DMSO(体积分数<0.3%)]。于培养时点0 h、24 h、48 h用酶标仪读取450 nm处吸光度(A)值,分析细胞活力。每组做6个复孔。
3.5 qPCR检测细胞Axl及PCNA的mRNA表达 CNE1细胞和C666-1细胞接种于6孔板,分为TP-0903(2 nmol/L)及DMSO组,48 h后收获细胞并提取总RNA,取500 ng总RNA逆转录为cDNA。qPCR反应引物序列如下:Axl(NM_021913.4)正义链为5’-GCT GCC TGT GTC CTC ATC TT-3’,反义链为5’-CAG CTC TTC ACT GAT GCC CA-3’;PCNA(NM_002592.2)正义链为5’-CTG ACA AAT GCT TGC TGA CC-3’,反义链为5’-CTA GCT GGT TTC GGC TTC AG-3’;β-actin正义链为5’-TGA CGT GGA CAT CCG CAA AG-3’,反义链为5’-CTG GAA GGT GGA CAG CGA GG-3’。采用LightCycler480 PCR仪(Roche)进行PCR循环,总反应体系20 μL,包括10 μL SYBR Green I PCR Master Mix, 0.4 μL 正义链引物 (10 μmol/L), 0.4 μL 反义链引物 (10 μmol/L), 2 μL cDNA 和 7.2 μL dH2O。PCR 扩增条件为95 °C 5 min;95 °C 15 s、60 °C 60 s,50个循环。目标基因的表达量用2-ΔΔCt表示。
3.6 Western blot检测Axl及p-Axl的水平 CNE1细胞和C666-1细胞接种于6 cm培养皿,分组同3.4,48 h后用含蛋白酶及磷酸酶抑制剂的冷PBS洗涤细胞,RIPA缓冲液裂解收获总蛋白,BCA法定量后取50 μg蛋白用于SDS聚丙烯酰胺凝胶电泳分离,目标蛋白转印至PVDF膜,经脱脂奶粉封闭后分别加入Ⅰ抗(Axl,1∶200; p-Axl,1∶200;GAPDH,1∶500)4 °C过夜孵育,TBST洗涤,羊抗兔HRP-标记的IgG II抗(1∶3 000)室温孵育2 h,ECL发光后获得目的蛋白的条带,胶片经凝胶成像系统扫描、拍照。以GAPDH为内参照,分析Axl及p-Axl的水平变化,以p-Axl/Axl代表Axl蛋白活性。实验重复3次。
3.7 细胞周期分析 CNE1细胞和C666-1细胞接种于6孔板,分组同3.4,48 h后上述各组细胞经0.25%胰酶消化、PBS洗涤、75%冷乙醇过夜固定,离心弃去固定液,PBS 洗涤1 次后收集细胞于流式管,每管细胞样品中加入1 mL PI染色液(含有100 mg/L RNase A 和5 mg/L PI),缓慢并充分重悬细胞,避光室温孵育30 min,随后用流式细胞仪(BD FACS Canto II)在488 nm激发波长下检测红色荧光和光散射情况,并用Flowjo 软件分析细胞周期分布。每组设3个复孔。
4 统计学处理
临床计数资料采用χ2检验,体外实验计量数据以均数±标准差(mean±SD)表示,用GraphPad Prism 6软件行单因素方差分析,两两比较采用Student-Newman-Keuls 检验。以P<0.05为差异有统计学意义。
结 果
1 NPC临床标本中Axl蛋白的免疫组化检测结果
典型的Axl高表达为肿瘤细胞胞质及胞膜呈现棕黄色阳性信号。78例NPC中Axl高表达46例(59.0%),显著高于NPI组(12.5%)(P<0.01)。进一步分层研究显示,NPC中Axl高表达与患者年龄及性别无关,但与临床分期、T分期和N分期均呈正相关(P<0.05)。本组NPC样本M1期中Axl高表达为12例(70.6%),但与M0期(55.7%)相比较,差异无统计学意义,见图1、表1。

Figure 1.The expression of Axl protein in clinical samples. The method of mmunohistochemistry was used to detect Axl protein expression in the patients with NPC and NPI, Axl protein antigens were colorized by DAB(×200). A: the Axl protein in the NPI was negative expression; B: low level of Axl protein in NPC; C: high level of Axl protein in NPC; D: blank control.
图1 免疫组化检测临床标本中Axl蛋白的表达
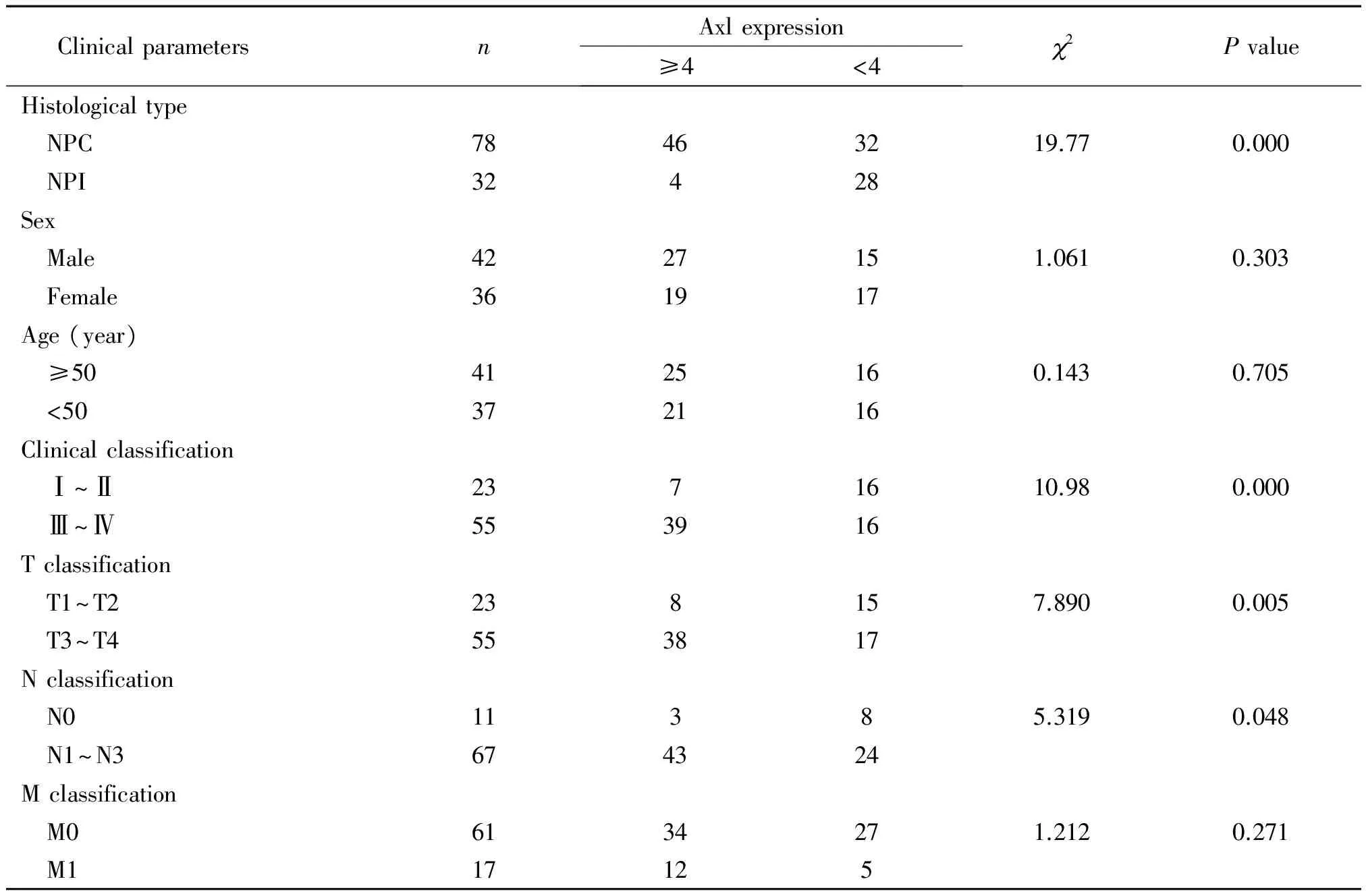
表1 临床标本中Axl蛋白的表达及与患者临床参数的相关性
NPC: nasopharyngeal carcinoma; NPI: nasopharyngeal chronic inflammation.
2 Axl表达与NPC细胞分化呈负相关
采用免疫荧光法检测不同分化状态NPC细胞中Axl的蛋白表达。结果显示,高分化CNE1细胞中Axl呈低水平表达,低分化CNE2Z细胞及未分化C666-1细胞中Axl表达水平较高,以C666-1细胞染色强度最强(图2)。后续实验选择CNE1和C666-1为TP-0903干预对象。
3 TP-0903抑制NPC细胞的增殖活性
CCK-8实验结果显示,TP-0903呈浓度和时间依赖性抑制NPC细胞的活力,2 nmol/L TP-0903即具有显著的细胞活力抑制作用(P<0.01)。qPCR结果显示,2 nmol/L TP-0903能显著抑制CNE1细胞和C666-1细胞中Axl和PCNA的mRNA水平(P<0.05)。进一步的Western blot结果显示,TP0903显著降低了NPC细胞中Axl蛋白的活性,即p-Axl/Axl比值显著降低,见图3。
4 TP-0903对NPC细胞形态的影响
DMSO处理NPC细胞48 h,其形态学未见明显异常改变。CNE1细胞以多角形为主,C666-1细胞以多角形及短梭形为主。而TP-0903处理48 h后,CNE1和C666-1细胞密度均明显下降。CNE1和C666-1细胞中大部分残存细胞形态变为梭形,伪足增多,类似上皮间叶样转化形态,部分细胞胞质中出现空泡,见图4。
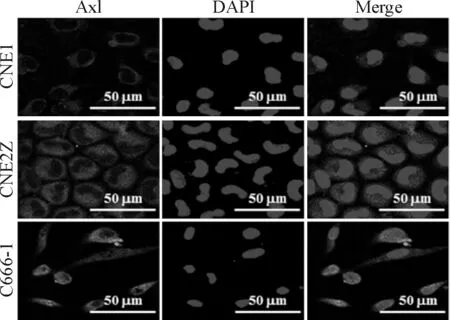
Figure 2.The method of immunofluorescent staining was used to observe Axl protein expression in well differentiated CNE1, poorly-differentiated CNE2Z and undifferentiated C666-1 cells. Axl protein antigens were colorized by FITC-coupled IgGs, and nuclei were stained by DAPI.
图2 免疫荧光法检测不同分化状态NPC细胞中Axl蛋白的表达
5 TP-0903阻滞NPC细胞周期进展
用Flowjo 软件分析细胞周期变化,与DMSO组相比,无论是CNE1细胞还是C666-1细胞均表现为G1期比例升高,差异具有统计学显著性(P<0.05),G2/M期与S 期细胞比例都明显下降,差异具有统计学显著性(P<0.05 ),见图5。
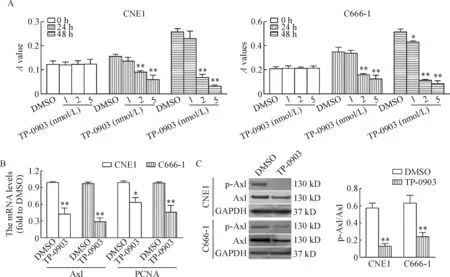
Figure 3.TP-0903 suppressed Axl activity and inhibited the proliferation of NPC cells. A: well differentiated CNE1 cells and undifferentiated C666-1 cells were treated with TP-0903 (1, 2, 5 nmol/L) and DMSO for 0 h, 24 h and 48 h, and then CCK-8 assay was performed; B: PCR methods was used to examine the mRNA expression of Axl and PCNA in the CNE1 cells and C666-1 cells that treated with TP-0903 (2 nmol/L) and DMSO; C: Western blot was used to examine the total Axl and p-Axl expression in the CNE1 cells and C666-1 cells that treated with TP-0903 (2 nmol/L) and DMSO. Mean±SD.n=3.*P<0.05,**P<0.01vsDMSO group.
图3 TP-0903抑制NPC细胞中的Axl活性及细胞增殖

Figure 4.The representative morphological images of the NPC cells exposed to TP-0903. Well differentiated CNE1 cells and undifferentiated C666-1 cells were planted onto 6-well plates at 5×104per well. After 1 night recovery, the media was changed into completed medium with TP-0903 (2 nmol/L) or DMSO (0.2%) for 48 h, then the cells were photographed under light field.
图4 TP-0903处理NPC细胞后的形态变化
讨 论
Axl为受体酪氨酸激酶TAM亚家族一员,已有的研究提示Axl高表达与多种人类肿瘤的临床进展正相关,这在食管鳞癌[5]、结肠癌[16]、肺癌[6]、恶性胸膜间皮瘤[17]、肾癌[18],乳腺癌[4]及骨肉瘤[2]等恶性肿瘤中均得到证实。Axl可能是肿瘤治疗的一个潜在有价值的靶点,为此,针对Axl激酶抑制剂及单克隆抗体的研究正受到研究人员的重视[19-21]。
NPC是一种具有地域分布特征的鼻咽黏膜上皮源性恶性肿瘤,在我国广东省多发,其病因及发病机制复杂[22]。为分析Axl在NPC中的表达情况,本研究首先对78例临床NPC及32例NPI对照组织样本中进行Axl蛋白的免疫组化检测,结果显示,NPC中Axl高表达阳性率为59.0%,显著高于对照组的12.5%。进一步分层研究显示,NPC中Axl高表达与患者年龄及性别无明显相关,但与临床分期、T分期和N分期均呈正相关关系。尽管本组NPC样本M1分期中Axl高表达阳性率为70.6%,但与M0组相比较,差异却无显著性意义,这可能与NPC总体样本数不大有关。总体上,本组NPC中Axl高表达与肿瘤的临床进展存在正相关性。陈广理等[9]通过RT-PCR技术检测了一组小样本NPC及对照组织中Axl mRNA的表达,发现NPC中Axl mRNA丰度大于对照组,提示Axl表达升高与NPC具有关联性。Jiang等[10]亦检测了一组NPC及对照组织中Axl mRNA及蛋白表达,发现Axl高表达与NPC临床进展及转移等生物学行为有关。本研究结论与上述两组的报道相似,预示了靶向干预Axl在NPC治疗中可能具有一定的价值。
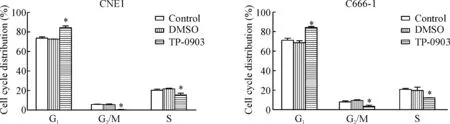
Figure 5.The cell cycle distribution of the NPC cells after TP-0903 treatment. Well differentiated CNE1 cells and undifferentiated C666-1 cells were treated with TP-0903 (2 nmol/L) and DMSO (0.2%) for 48 h, and then the cells were harvested and subjected to cell cycle analysis. Mean±SD.n=3.*P<0.05vsDMSO.
图5 TP-0903处理NPC细胞后细胞周期的变化
为探讨靶向干预Axl对NPC细胞的影响,本研究进一步体外对不同分化状态NPC细胞系进行Axl蛋白表达的检测,结果发现Axl蛋白表达与NPC分化状态呈负相关,即高分化CNE1细胞中低水平表达,而低分化CNE2Z细胞及未分化C666-1细胞中表达明显升高。随后,采用Axl特异性抑制剂TP-0903分别处理CNE1细胞和C666-1细胞,CCK-8实验结果证实TP-0903以浓度和时间依赖方式显著抑制NPC细胞的活力,提示基于TP-0903靶向抑制Axl对NPC增殖具有明显的效果。当前,针对Axl小分子抑制剂的研究正受到重视[7,19, 21],一些抑制剂如4SC-203、S49072已进入I期临床实验,而一些抑制剂如R428、MGCD-265、gilteritinib等进入II期临床实验。TP-0903是一种新的嘧啶衍生物,目前仅在白血病治疗中有1例临床前研究的报道[8],但其效果值得肯定。本研究首次将TP-0903应用在NPC上。本研究发现,2 nmol/L TP-0903处理NPC细胞48 h,残留的细胞即出现上皮间叶转化样形态改变,部分细胞胞质出现空泡甚至出现细胞溶解,当浓度大于10 nmol/L时NPC细胞全部溶解而死亡,初步显示NPC中的IC50将显著小于其推荐值(27 nmol/L)。至于TP-0903处理诱导NPC细胞出现上皮间叶样转化的机制及意义如何,有待于后续研究。我们注意到在2 nmol/L时,TP-0903不仅影响NPC中Axl mRNA丰度,也影响其蛋白的表达和活性,同时也显著降低了PCNA的表达,这与CCK-8的结果是一致的。进一步的细胞周期分布提示经TP-0903处理后,表现为G2/M和S期比例下降,G1期比例升高,细胞生长受抑制。本研究发现TP-0903不仅影响Axl的表达,也可抑制其蛋白活性(p-Axl的表达),这一点与既往的报道不一致[23],其确切机制有待于进一步探讨。
关于Axl在肿瘤组织中激活的机制非常复杂,吴彦君等[24]总结为5种机制,其中通过配体结合如GAS6介导受体同源二聚化是其经典活化机制。Axl 受体二聚体进行自磷酸化,使其受体细胞内激酶域酪氨酸残基Y779、Y821 和Y866 磷酸化,继而激活下游信号。NPC细胞中Axl如何激活尚不清楚。本研究纳入3个NPC细胞系,C666-1细胞中Axl表达最高,考虑到C666-1细胞中EB病毒感染呈阳性,后续将可能探讨EB病毒的感染与Axl的激活存在关联性。
总之,本研究结果提示Axl高表达促进NPC的临床进展;TP-0903抑制Axl并明显拮抗NPC细胞增殖,提示基于Axl靶点治疗NPC具有潜在的临床价值。
[1] Axelrod H, Pienta KJ. Axl as a mediator of cellular growth and survival [J]. Oncotarget, 2014, 5(19):8818-8852.
[2] Han J, Tian R, Yong B, et al. Gas6/Axl mediates tumor cell apoptosis, migration and invasion and predicts the clinical outcome of osteosarcoma patients[J]. Biochem Biophys Res Commun, 2013, 435(3):493-500.
[3] 陈立婷, 卢萍, 孙宇辉. Gas6/Axl信号通路与肿瘤关系的研究进展[J]. 现代肿瘤医学, 2016, 24(19):3165-3168.
[4] 张明帅, 朱丽萍, 欧江华, 等. Axl及其配体在乳腺癌组织中的表达及临床意义[J]. 临床肿瘤学杂志, 2014,19(1):29-33.
[5] Hsieh MS, Yang PW, Wong LF, et al. The AXL receptor tyrosine kinase is associated with adverse prognosis and distant metastasis in esophageal squamous cell carcinoma[J]. Oncotarget, 2016,7(24):36956-36970.
[6] Wu Z, Bai F, Fan L, et al. Coexpression of receptor tyrosine kinase AXL and EGFR in human primary lung adenocarcinomas[J]. Hum Pathol, 2015, 46(12): 1935-1944.
[7] 安 然, 胡 博, 郎小玲, 等. 靶向Axl 药物在癌症治疗中的研究进展[J]. 国际药学研究杂志, 2016, 43(3):420-424.
[8] Patel V, Keating MJ, Wierda WG, et al. Preclinical combination of TP-0903, an AXL inhibitor and B-PAC-1, a procaspase-activating compound with ibrutinib in chronic lymphocytic leukemia[J]. Leuk Lymphoma, 2016, 57(6):1494-1497.
[9] 陈广理, 龚树生, 陈 沛. 鼻咽癌中Axl及其配体GAS6的表达研究[J]. 中华实用诊断与治疗杂志, 2015, 29(4):341-343.
[10]Jiang C, Zhou L, Wang H, et al. Axl is a potential cancer prognostic marker for the migration and invasion of nasopharyngeal carcinoma[J]. Adv Clin Exp Med, 2016, 25(3):531-537.
[11]Jiang H, Gao M, Shen Z, et al. Blocking PI3K/Akt signaling attenuates metastasis of nasopharyngeal carcinoma cells through induction of mesenchymal-epithelial reverting transition[J]. Oncol Rep, 2014, 32(2):559- 566.
[12]Shen Z, Zeng Y, Guo J, et al. Over-expression of the special AT rich sequence binding protein 1 (SATB1) promotes the progression of nasopharyngeal carcinoma: association with EBV LMP-1 expression[J]. J Transl Med, 2013, 11:217.
[13]Shen Z, Jiang X, Zeng C, et al. High expression of ubiquitin-conjugating enzyme 2C (UBE2C) correlates with nasopharyngeal carcinoma progression[J]. BMC Cancer, 2013, 13:192.
[14]Wu Y, Shen Z, Wang K, et al. High FMNL3 expression promotes nasopharyngeal carcinoma cell metastasis: role in TGF-β1-induced epithelia-to-mesenchymal transition[J]. Sci Rep, 2017, 7:42507.
[15]王可可, 邓雅妍, 赖建鸿, 等. 落新妇苷对高糖刺激的血管内皮细胞SDF-1α表达的影响[J]. 中国病理生理杂志, 2016, 32(4):610-617.
[16]Dunne PD, McArt DG, Blayney JK, et al. AXL is a key regulator of inherent and chemotherapy-induced invasion and predicts a poor clinical outcome in early-stage colon cancer[J]. Clin Cancer Res, 2014, 20(1):164-175.
[17]Pinato DJ, Mauri FA, Lloyd T, et al. The expression of Axl receptor tyrosine kinase influences the tumour phenotype and clinical outcome of patients with malignant pleural mesothelioma[J]. Br J Cancer, 2013, 108(3):621-628.
[18]Rankin EB, Fuh KC, Castellini L, et al. Direct regulation of GAS6/AXL signaling by HIF promotes renal metastasis through SRC and MET[J]. Proc Natl Acad Sci U S A, 2014, 111(37):13373-13378.
[19]Myers SH, Brunton VG, Unciti-Broceta A. AXL inhibitors in cancer: a medicinal chemistry perspective[J]. J Med Chem, 2016, 59(8):3593-3608.
[20]Li Y, Ye X, Tan C, et al. Axl as a potential therapeutic target in cancer: role of Axl in tumor growth, metastasis and angiogenesis[J]. Oncogene, 2009, 28(39): 3442-3455.
[21]Leconet W, Larbouret C, Chardès T, et al. Preclinical validation of AXL receptor as a target for antibody-based pancreatic cancer immunotherapy[J]. Oncogene, 2014, 33(47):5405-5414.
[22]Cao SM, Simons MJ, Qian CN. The prevalence and prevention of nasopharyngeal carcinoma in China[J]. Chin J Cancer, 2011, 30(2):114-119.
[23]Park IK, Mundy-Bosse B, Whitman SP, et al. Receptor tyrosine kinase Axl is required for resistance of leukemic cells to FLT3-targeted therapy in acute myeloid leukemia[J]. Leukemia, 2015, 29(12):2382-2389.
[24]吴彦君, 孙明明, 习 宁. Axl激酶抑制剂的研究进展[J]. 中国新药杂志, 2016, 25(11):1225-1235.
(责任编辑: 林白霜, 余小慧)
High expression of Axl promotes clinical progression of nasopharyngeal carcinoma
JIA Ya-nan1, LI Ru-jia2, 3, WANG Ke-ke2, 3, LEI Hong2, 3, HA Yan-ping2, 3,Wang Si-si2, 3, LIAO Xiao-min2, 3, JIE Wei2, 3, SHEN Zhi-hua1
(1DepartmentofPathophysiology,2DepartmentofPathology,SchoolofBasicMedicalSciences,GuangdongMedicalUniversity,Zhanjiang524023,China;3PathologicalDiagnosisandResearchCentre,AffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang524001,China.E-mail:szh75@126.com)
AIM: To explore the expression and significance of receptor tyrosine kinase anexelekto (Axl) in nasopharyngeal carcinoma (NPC). METHODS: Immunohistochemistry was used to detect the Axl protein expression of 78 patients with NPC and 32 patients with nasopharyngeal chronic inflammation (NPI). The correlations between the Axl protein levels and the clinical parameters of NPC patients were analyzed. NPC cells were culturedinvitro, and the expression of Axl in well differentiated CNE1 cells, poorly-differentiated CNE2Z cells and undifferentiated C666-1 cells was detected by immunofluorescence staining. After treatment of the CNE1and C666-1 cells with Axl specific inhibitor TP-0903, CCK-8 assay was used to detect cell viability, flow cytometry was adopted to analyze the cell cycle distribution, qPCR was used to examine the mRNA levels of Axl and proliferating cell nuclear antigen (PCNA), and Western blot was used to examine the protein expression of Axl and p-Axl. RESULTS: Axl protein was localized in the cell membrane and cytoplasm. The rate of high expression of Axl in NPC was significantly higher than that in NPI (P<0.01). High Axl expression showed no correlations with NPC patients’ age, gender and M stage, while positively correlated with the clinical stage, T stage and N stage (P<0.05). Axl protein showed a low level in the CNE1 cells, but showed a high level in CNE2Z and C666-1 cells. TP-0903 inhibited cell viability in concentration and time dependent manners. TP-0903 at 2 nmol/L showed significant inhibitory effects, as evidenced by arresting the cell cycle at G0phase and reducing Axl activity and PCNA expression. CONCLUSION: High expression of Axl promotes the clinical progress of NPC.TP-0903 significantly inhibits the viability of NPC cells, suggesting that Axl may be a valuable target in the NPC treatment.
Nasopharyngeal carcinoma; Anexelekto; TP-0903; Cell proliferation; Cell cycle
1000- 4718(2017)08- 1386- 07
2016- 12- 01
2017- 04- 19
国家自然科学基金资助项目(No. 81402415);广东医科大学科研基金(No. Z2013004; No. M2013032);湛江市科技计划项目(No. 2013B01077)
R730.23
A
10.3969/j.issn.1000- 4718.2017.08.007
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0759-2388587; E-mail: szh75@126.com
▲并列第1作者

