靶向敲除WT1基因诱导人肺癌A549细胞凋亡
王晓明,范慧康,刘 旸,温得中
(1.吉林省人民医院 病理科,吉林 长春130021;2.吉林大学临床医学院,吉林长春130021;3.吉林大学基础医学院,吉林 长春130021)
*通讯作者
靶向敲除WT1基因诱导人肺癌A549细胞凋亡
王晓明1,范慧康2,刘 旸2,温得中3*
(1.吉林省人民医院 病理科,吉林 长春130021;2.吉林大学临床医学院,吉林长春130021;3.吉林大学基础医学院,吉林 长春130021)
WT1(Wilms’ Tumor Gene 1)基因是一种与癌症密切相关的基因,最早发现于肾母细胞瘤中[1]。WT1基因主要功能是调节RNA转录后加工的过程,同时具有抑制细胞分裂和分化的功能[3,4]。有研究表明,在乳腺癌、急性髓系白血病、恶性黑色素瘤等疾病中,WT1均存在异常高表达的情况,提示WT1可能是诱导肿瘤发生的一个重要因素,抑制/沉默WT1基因的表达,将有望控制相关肿瘤细胞的发生发展[5]。
CRISPR/Csa9技术是第三代基因编辑工具,其原理是通过gRNA引导,利用Cas9蛋白靶向切割基因组DNA,进而达到基因敲除的目的[6,7]。本研究利用CRISPR/Csa9技术,针对WT1基因的第一外显子区域设计gRNA,拟在人肺癌A549细胞中靶向敲除WT1基因,观察WT1基因敲除对A549细胞的生物学影响、在分子水平上进一步探索WT1基因与细胞凋亡的相关机制。
1 材料与方法
1.1 细胞株和主要试剂
人肺癌A549细胞和px459载体由北华大学医学检验学院免疫教研室提供并保存。DMEM培养基和胎牛血清购自美国HyClone公司。Bbs I,Solution I购自美国Thermo Scientific公司。Bcl-2,Bax,TP53,β-actin抗体均购自美国Santa Cruz公司。质粒试剂盒,DNA提取试剂盒,BCA定量试剂盒,嘌呤霉素,Trizol A+试剂,DH5α,2 × Taq Plus PCR Master Mix均购自北京天根公司。荧光定量试剂盒,反转录试剂盒购自杭州博日公司。蛋白提取试剂盒购自上海碧云天公司。细胞凋亡检测试剂盒购自北京凯基公司。测序样品送至吉林库美公司。
1.2 细胞培养
人肺癌A549细胞培养在含有10%胎牛血清的DMEM培养液中,待细胞长满后按1∶3传代,每48 h换液。待细胞融合度达到70%拟进行电转染、备用。
1.3 WT1敲除载体构建和转染
分析人的WT1序列(http://asia.ensembl.org/index.html):人的WT1基因有10个外显子,编码大约55 kDa的蛋白[2]。选择第一外显子区域,设计gRNA(http://crispr.mit.edu/),gRNA序列见表1。利用Solution I将gRNA连接到px459载体中,并在大肠杆菌中进行转化,获得的单克隆质粒,送公司进行Sanger测序。
实验设对照组和敲除组两组。待培养的A549细胞融合度达到70%,敲除组选择鉴定正确的质粒,进行电转染(BTX-ECM2001,电压:300v 脉冲长度:3 ms、脉冲次数:1次)。电转染后24 h,加入嘌呤霉素,对细胞进行筛选,培养5天后,收取细胞备用。对照组以空载体转染,其它条件同敲除组。
1.4 流式细胞术分析
选择Annexin V-FITC PI细胞凋亡检测试剂盒,流式细胞仪(BD)分别对收取的敲除组及对照组细胞样品进行凋亡检测分析,具体操作方法按说明书。
1.5 DNA提取及鉴定
利用基因组DNA提取试剂盒分别对收取的敲除组及对照组细胞样品进行提取,拟用于沉默WT1基因的鉴定,具体步骤参照试剂盒说明书。以基因组为模板,采用2 × Taq Plus PCR Master Mix进行扩增。具体条件如下:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,共计35个循环;72 ℃ 5 min。PCR产物进行琼脂糖凝胶电泳。紫外凝胶成像仪照相。WT1鉴定引物见表1。
1.6 RNA提取及qPCR分析
利用Trizol 法分别提取敲除组及对照组细胞样品的RNA,拟用于qPCR分析,具体操作方法见说明书。将提取好的RNA利用反转录试剂盒,参照其说明书,进行反转录实验。qPCR使用荧光定量试剂盒,进行扩增。反应程序采用三步法,具体条件为:①预变性,95 ℃,3 min;②变性为95 ℃,10 s,退火温度为59 ℃,15 s,延伸为72 ℃,30 s。共计40个循环。荧光信号采集设置在延伸步骤中的72 ℃。③绘制融解曲线,设置为55 ℃,30 s。共计81个循环。实验过程中,每一个待检测样品均重复检测三次,检测数据用于统计分析。凋亡相关基因引物见表1。采用2-ΔΔCT公式计算相对表达量。
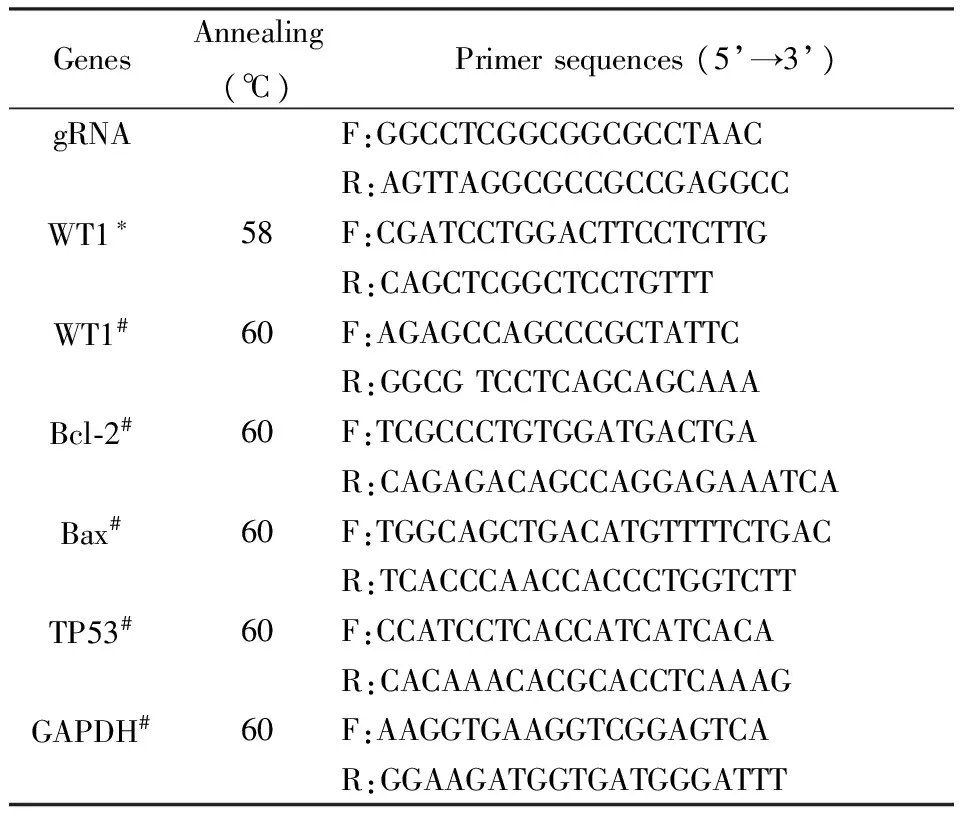
表1 gRNA和qPCR引物
注:*,用于DNA鉴定;#,用于qPCR。
1.7 蛋白提取及Western Blot分析
利用蛋白提取试剂盒分别对收取的敲除组及对照组细胞样品进行蛋白提取,拟用于WesternBlot分析,具体步骤参照试剂盒说明书。从样品中提取到的蛋白,利用BCA方法进行蛋白定量。配制12%丙烯酰胺凝胶,120 V,90 min,电泳,转膜、封闭、加入一抗(Bcl-2,Bax,P53)过夜、加入二抗,避光孵育1 h。以β-actin作为内参,曝光拍照。
1.8 统计学分析
2 结果
2.1WT1基因靶向敲除表达载体的构建及鉴定
选择人的WT1基因第一外显子区域,设计gRNA进行切割(图1A)。Sanger测序结果显示,3例细胞单克隆样品均有不同程度的碱基缺失(图1B)。凝胶电泳结果显示,对照组与WT1敲除组均出现的明显条带(图1C)。qPCR结果显示,与对照组相比,在A549细胞中,WT1敲除组表达显著降低(P<0.01)(表2)。
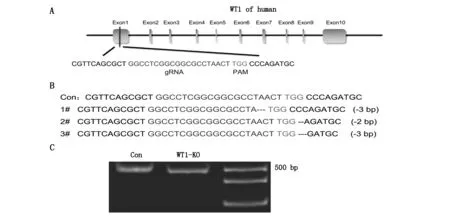
A schematic diagram of gRNA targeting the WT1 gene loci; B Sanger sequencing of WT1;
2.2 靶向敲除WT1基因后,对人肺癌A549细胞细胞凋亡的诱导
流式细胞仪分析显示,对照组的凋亡率为(9.23 ±0.6 %),WT1敲除组凋亡率为(16.2±0.4%),差异显著(P<0.01)(图2,表2)。
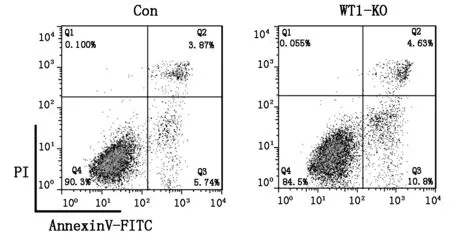
图2 细胞凋亡分析
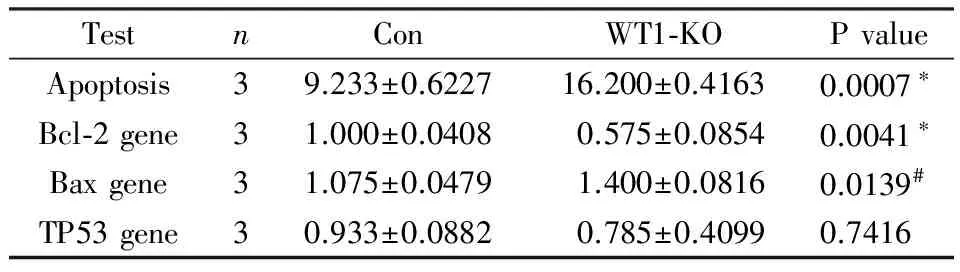
TestnConWT1⁃KOPvalueApoptosis39.233±0.622716.200±0.41630.0007∗Bcl⁃2gene31.000±0.04080.575±0.08540.0041∗Baxgene31.075±0.04791.400±0.08160.0139#TP53gene30.933±0.08820.785±0.40990.7416
*,P<0.01;#,P<0.05
2.3 相关凋亡基因和蛋白表达水平检测
qPCR结果显示,与对照组相比,WT1敲除组中Bcl-2的mRNA表达水平显著降低(P<0.01),Bax表达上升(P<0.05),而TP53表达差异并不显著(表2)。Western Blot结果显示,Bcl-2蛋白表达下降,Bax表达上升,TP53蛋白表达无变化(图3)。
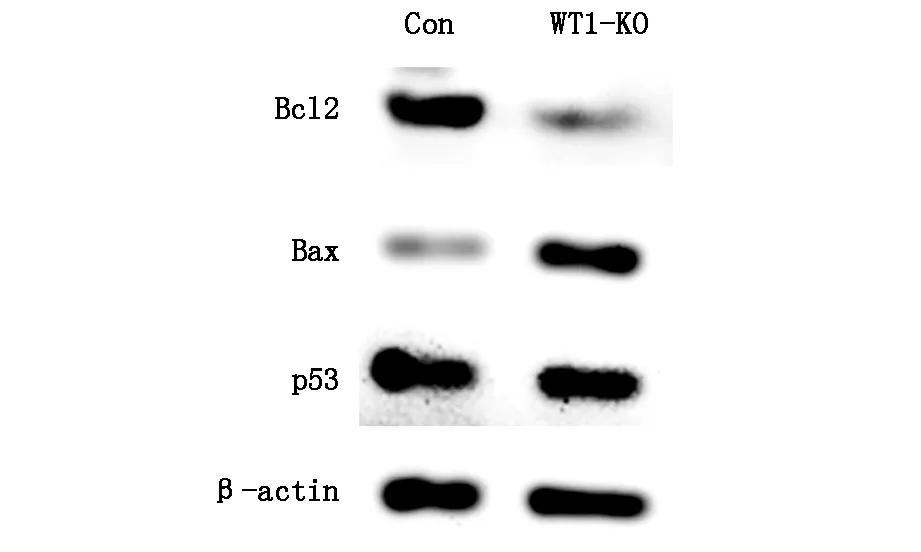
图3 Bcl-2,Bax,P53蛋白表达
3 讨论
WT1作为一种与癌症密切相关的基因,一直是医学研究的热点之一,在乳腺癌、急性髓系白血病、肾母细胞瘤等肿瘤疾病中呈高表达[8]。抑制其过表达,可干扰肿瘤细胞的生长并促进其凋亡。在以往的研究中,通常使用RNA干扰的方法沉默WT1的表达[9,10]。但RNA干扰的方法本质是在转录水平,也就是RNA水平进行干预,因此并不能完全沉默目的基因[11]。与此相反,CRISPR/Csa9技术是在基因组水平对WT1进行切割,这就导致WT1基因序列的改变,进而引起基因功能的丧失[12]。在本实验中,我们选择人肺癌A549细胞做为靶细胞,利用CRISPR/Csa9技术成功构建WT1基因靶向敲除表达载体,拟用于转染靶细胞,观察敲除靶基因WT1后,人肺癌A549细胞的生长发展情况。
在成功获得了低表达WT1基因的靶细胞后,流式细胞技术检测结果显示:在靶向敲除WT1基因后,人肺癌A549细胞凋亡显著。这一结果与之前在HepG2[14]和人脑胶质瘤细胞[15]的报道一致。
有学者研究报道,WT1的异常表达可能会影响Bcl-2/Bax的表达[13],这提示靶向敲除WT1基因后,A549细胞发生凋亡的机制可能与Bcl-2/Bax等凋亡相关基因的表达异常有关。qPCR及WesternBlot实验结果显示敲除WT1后,A549细胞Bcl-2表达下降、Bax表达上升,但TP53并没有变化。这提示靶向敲除WT1会影响凋亡基因Bcl-2/Bax的表达变化,进而诱导肿瘤细胞发生凋亡。
综上所述,靶向敲除WT1基因会引起靶肿瘤细胞内Bcl-2/Bax表达发生变化,进而诱导细胞凋亡。这为进一步研究WT1基因与肿瘤细胞的发生发展及肿瘤治疗提供了一定的实验依据。
[1]Stiller CA,Parkin DM.International variations in the incidence of childhood renal tumours[J].British journal of cancer,1990,62:1026.
[2]Morrison AA,Viney RL,Ladomery MR.The post-transcriptional roles of WT1,a multifunctional zinc-finger protein[J].Biochim Biophys Acta,2008,1785:55.
[3]安培培.WT1基因对猪肾成纤维细胞和睾丸细胞的凋亡及发育基因表达影响的研究 [D].吉林大学,2013.
[4]齐晓伟.WT1在乳腺癌进展中的作用及机制研究 [D].第三军医大学,2012.
[5]万鼎铭,边志磊,刘延方等.急性髓系白血病患者骨髓WT1基因的表达与预后的关系[J].郑州大学学报,2014,49(3):386.
[6]Shalem O,Doench JG,Zhang F,et al.Genome-scale CRISPR-Cas9 knockout screening in human cells[J].Science,2014,343(6166):84.
[7]Sessions JW,Alder JK,Jensen BD,et al.CRISPR-Cas9 directed knock-out of a constitutively expressed gene using lance array nanoinjection [J].SpringerPlus,2016,5(1):1521.
[8]Charlton J,Pritchard-Jones K.WT1 Mutation in Childhood Cancer[J].Methods in molecular biology,2016,1467:1.
[9]Li X,Nylander K,Li A,et al.Wilms' tumor gene 1 regulates p63 and promotes cell proliferation in squamous cell carcinoma of the head and neck [J].BMC Cancer,2015,15:342.
[10]周 静,袁伟杰,谢院生,等.siRNA沉默WT1对小鼠细胞Wnt/β-catenin和nephrin表达的影响[J].中国病理生理杂志,2013,29(2):219.
[11]Jing Z,Wei-jie Y,Yi-Feng ZG.Down-regulation of Wt1 activates Wnt/beta-catenin signaling through modulating endocytic route of LRP6 in podocyte dysfunction in vitro [J].Cell Signal,2015,27(9):1772.
[12]Martin F,Pinedo-Gomez J,Benabdellah K,et al.Biased and Unbiased Methods for the Detection of Off-Target Cleavage by CRISPR/Cas9:An Overview[J].Int J Mol Sci,2016,17(9).pii:E1507.
[13]Mazzei L,Benardon ME,Manucha W,et al.WT-1 mRNA expression is modulated by nitric oxide availability and Hsp70 interaction after neonatal unilateral ureteral obstruction [J].Biocell,2010,34(3):121.
[14]Lv L,Li J,Gong J,et al.WT1-AS promotes cell apoptosis in hepatocellular carcinoma through down-regulating of WT1 [J].J Exp Clin Cancer Res,2015,34:119.
[15]Schittenhelm J,Meyermann R,Beschorner R,et al.WT1 expression in normal and neoplastic cranial and peripheral nerves is independent of grade of malignancy [J].Cancer biomarkers :section A of Disease markers,2010,7(2):73.
1007-4287(2017)08-1433-04
王晓明(1978-),吉林省人民医院病理科,助理研究员、医学硕士。
2016-07-19)

