原发性脑内淋巴瘤的MRI表现及病理对照
李小帅,于绍楠,邢 洁,崔 璐
(吉林大学中日联谊医院,吉林 长春130033)
原发性脑内淋巴瘤的MRI表现及病理对照
李小帅,于绍楠,邢 洁,崔 璐*
(吉林大学中日联谊医院,吉林 长春130033)
原发性脑内淋巴瘤是指仅发生于脑内的恶性淋巴瘤,而全身其他部位未发现淋巴瘤。该病较为罕见,约占原发性脑内恶性肿瘤的6.2%[1]。近年来,该病的发病率呈逐年上升趋势。由于缺乏特异性的临床表现及实验室检查,临床上原发性脑内淋巴瘤常常容易误诊。本文收集近几年我院16例术后经病理证实的原发性脑内淋巴瘤,分析其临床症状及影像学表现,旨在提高对本病的术前诊断能力。
1 资料与方法
1.1 一般资料 我院2009年9月-2016年10月经手术病理证实的16例原发性脑内淋巴瘤患者,男10例,女6例,年龄45-78岁。经手术病理证实14例为弥漫性大B细胞淋巴瘤,1例为T细胞淋巴瘤,1例为Burkitt淋巴瘤。临床症状主要表现为头痛、恶心、呕吐、肢体无力、行走不稳、记忆力减退,视物模糊等。所有患者术前均于我院行MRI检查,术后均行病理学检查明确肿块性质,MRI检查时均未行化疗或放疗等治疗。
1.2 术前MRI影像学检查
1.2.1 MRI常规扫描 采用GE Signa 1.5T、3.0T超导MR系统。T2WI:TR 3400ms,TE105ms;轴位、矢状位T1WI:TR 400ms,TE20ms;增强扫描采用SE T1WI序列:TR 400ms,TE20ms;对比剂使用Dd-DTPA,剂量为0.1 mmol/kg。
1.2.2 MRS检查 1H-MRS扫描采用单、多体素波谱成像,选择肿瘤最大层面作为MRS定位层面,感兴趣区包括肿瘤实质、瘤周及对侧正常脑组织。运用MRS专用头线圈,采用点解析序列(PRESS)(TR=1500ms,TE=135ms)扫描,在波谱定位图上选择横轴位T1WI明显强化区域作为感兴趣区,然后采集波谱。
1.3 影像资料分析 由高年资放射医师对影像资料进行分析,观察肿瘤的部位、数目、形态、信号特征、强化方式、瘤周水肿、有无囊变、出血、坏死等表现。肿瘤信号高低以脑灰质信号作为参照;肿瘤水肿程度按照标准分为3类:水肿<肿瘤直径1/2的为轻度,肿瘤直径1/2≤水肿<肿瘤直径的为中度,水肿≥肿瘤直径的为重度[2]。
2 结果
本组均为误诊病例,其中误诊为胶质瘤10例,转移瘤6例,均行手术治疗。术后病理证实14例为弥漫性大B细胞淋巴瘤(图1),1例为T细胞淋巴瘤,1例为Burkitt淋巴瘤。
2.1 病变分布与大小 16例患者中单发者14例(88%),多发者2例(12%),脑内共有18个病灶,幕上17个,幕下1个。幕上病灶多位于脑实质深部或中线区域,其中额叶7个、顶叶4个、颞叶2个,枕叶1个,胼胝体2个,基底节区1个;幕下病灶位于小脑半球1个。病灶最大位于胼胝体。
2.2 病变形态 16例18个病灶以结节状、团块状为主,位于胼胝体的病灶呈蝶形。
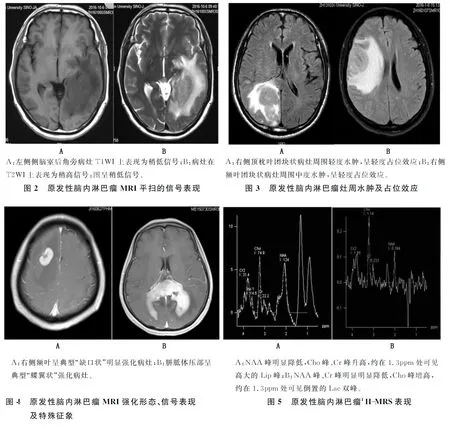
2.3 MRI信号特点及增强特征 本文16例均进行了MRI平扫及增强扫描。T1WI:11个病灶呈较低信号,7个病灶呈等信号;T2WI:9个病灶呈等信号,9个呈稍高信号;T2Flair:病灶多呈等信号,其中3个病灶因内有囊变坏死而信号不均;DWI多呈高信号,ADC图多呈稍低信号。16例18个病灶MRI增强扫描均为明显强化,病灶呈团块状强化8个,结节状强化6个,不规则斑片状强化4个;其中6个病灶呈“缺口状”强化,3个病灶呈“尖角状”强化,2个病灶呈“蝶翼状”强化。18个病灶周围均有水肿现象,其中轻度水肿9个,中度水肿5个,重度水肿4个。见图2-4。
2.4 MRS 16例患者中11例行三维多体素1H-MRS检查,共检出11个病灶。肿瘤实质区的N-乙酰天门冬氨酸(NAA)峰明显降低,胆碱(Cho)峰、肌酐(Cr)峰升高,肿瘤实质区代谢比率为Cho/Cr=4.85±0.51,Cho/NAA=4.61±0.18,NAA/Cr=1.55±0.32,均可见高大的Lip峰,其中6个病灶出现Lac峰。见图5。
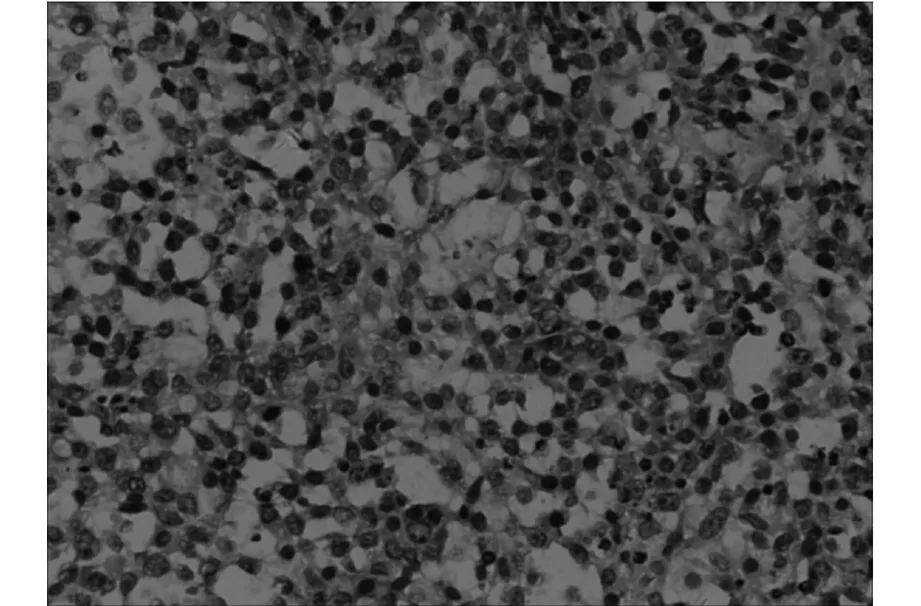
肿瘤细胞体积较大,核仁明显,核分裂像多见。
3 讨论
原发性脑内淋巴瘤为仅发生于脑内的恶性淋巴瘤。近年来,在免疫缺陷者和免疫功能正常者中,原发性脑内淋巴瘤的发病率均有所增加[3]。原发性脑内淋巴瘤绝大多数为弥漫性大B细胞淋巴瘤,小部分来源于低级别B细胞淋巴瘤(8%)、T细胞淋巴瘤(2%-3%)、Burkitt淋巴瘤(5%)[4,5]。本文14例患者经术后病理证实为弥漫性大B细胞淋巴瘤,1例为T细胞淋巴瘤,1例为Burkitt淋巴瘤与文献报道一致。原发性脑内淋巴瘤可发生于各个年龄段,随着年龄的增长,发病率呈增高趋势。目前,诊断明确的原发性脑内淋巴瘤的治疗以大剂量甲氨蝶呤化疗为基础,同时可联合放疗、单克隆抗体及自体造血干细胞移植等[6]。
目前,原发性脑内淋巴瘤的病因还不是很明确,大多认为其组织来源可能是脑血管周围未分化的多潜能间叶细胞转化[7]。原发性脑内淋巴瘤可发生于中枢神经系统的任意部位,易侵犯大脑半球、基底节区、胼胝体、丘脑,少数亦可发生于小脑、脑干、脑室等,以单发为主,亦可多发,病灶多位于幕上。本组病例仅有1个病灶位于幕下,其余均位于幕上;14个病灶位于大脑半球,且大多位于额叶,最大的病灶位于胼胝体。
原发性脑内淋巴瘤病理上,肿瘤细胞排列紧密、核浆比例较高、丰富的纤维组织等决定了脑内淋巴瘤的信号特点。原发性脑内淋巴瘤在T1WI多呈等或稍低信号,T2WI多呈等或稍高信号,Flair多呈等信号,DWI多呈稍高信号,ADC图多呈等信号。原发性脑内淋巴瘤虽为乏血供肿瘤,但是囊变、坏死较为少见。其原因可能为肿瘤细胞浸润于血管周围的网状纤维之间,围绕血管呈环状排列,并浸润血管壁进入血管腔内,进而破坏血脑屏障,这可使其氧供充足,因而较少引起囊变、坏死[8]。有文献报道称,发生于免疫缺陷者的淋巴瘤更易发生囊变、坏死、出血、钙化[9]。由于血脑屏障破坏,造影剂外露,增强扫描病灶多呈明显均匀强化[10]。Zhang S[11]等认为发生于免疫功能正常者的脑内淋巴瘤多成结节状或团块状强化,而免疫缺陷者多成环形强化。本组患者均为免疫功能正常者,且病灶绝大多呈结节状或团块状强化,这与文献报道一致。其中部分病灶可见典型的“缺口状”强化及“尖角状”强化;位于胼胝体的病灶呈典型的“蝴蝶翼状”强化。以上这些典型征象均有利于脑内淋巴瘤的定性诊断。
MRS可在活体上对组织器官的生化代谢物进行半定量的评估,因此可以反映肿瘤代谢方面的信息。其中,常用的指标有Cho、NAA、Cr及Cho/Cr、Cho/NAA、Lip/Cr代谢比率,乳酸(Lac)峰和脂质(Lip)峰。NAA主要存在于神经元内,其含量多少与神经元及轴突数量有关,反映了神经元的功能状态。本研究显示NAA 峰减低,表明了这些病例神经元的损伤或消失。Cho 是细胞膜磷脂代谢成分之一,是反映细胞膜代谢的标志。肿瘤细胞增生、细胞密度增高,从而细胞膜生物合成及磷脂胆碱更新加快,导致Cho峰升高。Lac为无氧代谢标志物,其含量升高常代表肿瘤生长旺盛。由于脑内淋巴瘤为乏血供肿瘤,肿瘤内部血液供应不足,糖酵解明显增加,从而出现Lac峰。Lip峰是由于淋巴细胞和巨噬细胞细胞膜成分更新加快引起的[12]。NAA/Cr、NAA/Cho比率降低反映肿瘤细胞增殖及神经轴的损伤,在脑内淋巴瘤较为常见[13]。有文献称,肿瘤实质区域NAA峰降低、Cho/NAA比率增高,出现高大的Lip峰、Lac峰是脑内淋巴瘤较为特征性的表现[14],而且存在Lip峰、Lac峰的患者预后较差[15]。本组MRS检查的11个病灶,肿瘤实质区均出现典型降低的NAA峰,Cho/NAA比率增高,高大的Lip峰,其中6个病灶出现Lac峰。而对于起源于脑血管内的淋巴瘤,中等高的Lip峰,Cho/Cr比率降低是其特征性的表现[16]。本组16 例患者分别误诊为胶质瘤及转移瘤,因此,需要与脑内淋巴瘤相互鉴别。胶质瘤多表现为长T1、长T2信号,其浸润性生长常导致肿瘤边界欠清。低级别胶质瘤增强扫描多呈轻度强化,囊变、坏死少见,周围水肿较轻;高级别胶质瘤出血、囊变、坏死多见,因此信号不均匀,增强扫描以斑片状、不规则花环形强化多见,水肿明显。而脑内淋巴瘤增强扫描多呈明显均匀强化;在1H-MRS中,胶质瘤与脑内淋巴瘤均可表现现为NAA峰降低,Cho峰增高,但在脑内淋巴瘤中,MRS可出现高大的Lip峰,并且Cho/Cr比率明显高于胶质瘤[17]。Raizer[15]等认为淋巴瘤中Lac/Lip峰显著增高有助于与胶质瘤相鉴别。转移瘤多发生于脑灰白质交界区,MRI上T1WI多呈低信号,T2WI多呈高信号,增强扫描呈环形或结节状强化,一般边界清楚,病灶内常有坏死,病灶周围水肿及占位效应明显,“小病灶大水肿”是其较典型特点。且转移瘤常可见原发脑外肿瘤病史,常以多发为主。而脑内淋巴瘤常位于大脑半球脑白质深部,多呈等长T1、等长T2信号影,坏死少见,增强扫描呈明显均匀强化,水肿程度较轻。
综上所述,原发性脑内淋巴瘤在常规MRI及MRS上具有一定特征性影像学表现,结合多序列扫描及临床综合分析,可以提高诊断准确性。
[1]Ostrom QT,Gittleman H,Farah P,et al.CBTRUS statistical report:Primary b-rain and central nervous system tumors diagnosed in the United States in 2006-2010[J].Neuro Oncol,2013,15(Suppl 2):ii1.
[2]杨柳青,张 磊,王光宪,等.原发性脑内淋巴瘤 MRI 表现与病理结果的关系[J].解放军医学院学报,2016,37(7):761.
[3]Bhagavathi S,Wilson JD.Primary central nervous system lymphoma[J].Arch Pathol Lab Med,2008,132:1830.
[4]Ferreri AJ,Marturano E.Primary CNS lymphoma[J].Best Pract Res Clin Haematol,2012,25(1):119.
[5]Louis DN,Ohgaki H,Wiestler OD,et al.Tumours of the haematopoietic system,malignant lymphomas[A].In:Louis DN,Ohgaki H,Wiestler OD,Cavenee WK,eds.WHO Classification of Tumours of the Central Nervous System[C].Vol 1.4thed.Lyon:IARC;2007:188-196.
[6]Patrick LB,Mohile NA.Advances in Primary Central Nervous System Lymphoma[J].Curr Oncol Rep,2015,17(12):60.
[7]徐 成,杜崇禧,贺业新,等.颅内原发性中枢神经系统淋巴瘤的MRI表现[J].实用医学影像杂志,2009,10(3):141.
[8]王继伟,郑红伟,祁佩红,等.原发性脑内淋巴瘤的影像表现及病理对照[J].中国CT和MRI杂志,2013,11(4):8.
[9]Kim DS,Na DG,Kim KH,et al.Distinguishing tumefactive dem-yelinating lesions from glioma or central nervous system lymphoma:added value of unenhanced CT compared with conventional contrast-enhanced MR imaging[J].Radiology,2009,251(2):467.
[10]Gliemroth J,Kehler U,Gaebel C,et al.Neuroradiological findings in primary cerebral lymphomas of non-AIDS patients[J].Clin Neurol Neurosurg,2003,105(2):78.
[11]Zhang S,Li H,Zhu R,et al.Application value of magnetic resonance imaging in diagnosing central nervous system lymphoma[J].Pak J Med Sci,2016,32(2):389.
[12]Harting I,Hartmann M,Jost G,et al.Differenting primary central nervous system ly-mphoma from glioma in human using localized proton magnetic resonance spectros-Copy[J].Neurosci Lett,2003,342:163.
[13]Taillibert S,Guillevin R,Mnuel C,et al.Brain lymphoma:Usefullness of the ma-gnetic resonance spectroscopy[J].J Neurooncol,2008,86:225.
[14]陈 峰,刘 涛,李建军,等.原发性颅内B细胞淋巴瘤磁共振弥散加权成像与1H-MRS表现的相关性[J].武汉大学学报,2014,35(3):398.
[15]Raizer JJ,Koutcher JA,Abrey LE,et al.Pro-Ton magnetic resonance spectroscopy in immunocompetent patients with primary central nervous system lymphoma[J].J Neurooncol,2005,71(2):173.
[16]Kawai N,Okada M,Haba R,et al.Insufficiency of PET and MR spectroscopy in the diagnosis of intravascular lymphoma of the central nervous system[J].Case Rep Oncol,2012,5(2):339.
[17]Choi YS,Lee HJ,Ahn SS,et al.Primary central nervous system lymphoma and at-ypical glioblastoma:differentiation using the initial area under the curve derived from dynamic contrast-enhanced MR and the apparent diffusion coefficient[J].Eur Radiol,2017,27(4):1344.
国家自然科学基金青年科学项目(80151459);吉林省科技厅科技发展计划项目(140520020JH);吉林省教育厅十三五科学技术研究项目[吉教科合字(2016)第467号]
1007-4287(2017)08-1311-04
2017-05-12)
*通讯作者

