一线用药的EGFR抑制剂治疗临床选择型非小细胞肺癌有效性的系统评价
田春琴 赵新汉 耿会生 崔立春 王旋 杜建飞
·论著·
一线用药的EGFR抑制剂治疗临床选择型非小细胞肺癌有效性的系统评价
田春琴1,2赵新汉1耿会生3崔立春2王旋2杜建飞2
目的系统评价并对比表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)与化疗对一线治疗临床选择型NSCLC患者的疗效。方法自PubMed、Cochrane library、EMBASE中检索相关的主题词及自由词,收集EGFR-TKIs与化疗相比一线治疗临床选择型NSCLC疗效的随机对照研究文献(randomized controlled trials, RCT)。按纳入标准及排除标准筛选文献,采用cochrane偏倚风险评估表对纳入文献进行质量评价,自纳入文献中提取有效数据,应用RevMan 5.3.5和STATA 12.0分析并对比临床选择型NSCLC患者在EGFR-TKIs治疗中的疗效。采用敏感性分析和发表偏倚分析评价结果的稳定性和可靠性。结果共纳入5篇RCT文献,共1 719例患者,Meta 分析结果显示:对于临床选择型(亚裔、腺癌、不吸烟)的NSCLC患者:一线EGFR-TKIs(吉非替尼)治疗与化疗相比,总生存期(overall survival, OS)、无进展生存期(progress free survival, PFS)、相对危险度(risk ratio, RR)无明显差异;EGFR-TKIs联合化疗的一线治疗与单纯化疗相比,OS、PFS、RR无明显差异。结论对比化疗,选择型NSCLC患者一线EGFR-TKIs治疗无获益。
非小细胞肺癌; 表皮生长因子受体抑制剂; 化疗; 随机对照试验
全球癌症发病的最新统计资料显示肺癌发病率和死亡率仍呈逐年上升趋势,肺癌的发病率和死亡率已居我国恶性肿瘤的第一位[1]。非小细胞肺癌(non-small-cell lung cancer, NSCLC)占所有肺癌的80%~85%,大约30%~40%的NSCLC诊断时已属于晚期[2〗。Ⅳ期未治的非小细胞肺癌平均生存时间仅4~6个月,长期存活率也非常低,晚期NSCLC由于治疗手段有限,5年生存率不超过15%,对晚期NSCLC的治疗是目前最为活跃的临床研究领域之一。
对于表皮生长因子受体(epithelial growth factor receptor, EGFR)抑制剂治疗NSCLC患者的临床效果,国内外有各种相关报道。本研究将EGFR酪氨酸激酶抑制剂(EGFR-TKIs)(吉非替尼、厄洛替尼、阿法替尼、达克替尼和埃克替尼)治疗NSCLC的有效性作为评价指标,系统评价EGFR-TKIs一线治疗临床选择型NSCLC患者的疗效,以期为临床医生合理用药提供真实可靠的依据。
资料和方法
一、研究对象
临床选择型NSCLC患者是指与EGFR基因突变的危险因素(如:亚洲国籍、腺癌、女性、吸烟、年龄等)相关而被纳入EGFR基因突变可能性高的NSCLC患者。确诊的NSCLC患者,已进行组织学或者细胞学病理检测,证实为鳞状细胞癌、腺癌、混合癌、大细胞未分化癌、细支气管肺泡癌等各病理类型,而且NSCLC患者分期应以TNM分期系统中的ⅢB期和Ⅳ期为主,可以包括少量的新辅助化疗的低分期NSCLC患者。研究中包含有各个患者的美国东部肿瘤协作组(ECOG)制定的活动状态评分或者WHO活动状态评分报告。
对患者年龄、性别构成比不做限定,对研究中无论患者在化疗前是否已进行过手术切除治疗或者进行放射治疗也不限定,但是在化疗或者EGFR抑制剂靶向治疗过程中不能同时伴有放射或者其他治疗方案。以上这些信息在所要比较的两组内应基本均等,以保证研究基线资料的均衡。
二、临床试验的纳入标准
研究纳入的标准依据PICOS原则制定,即P:patients/participates,研究对象;I:intervention,干预措施;C:Comparsion,对照措施;O:outcomes,结果;S:study,研究类型。
三、干预措施
患者被随机入组后,按照不同的治疗方案进行干预: ①一线用药的EGFR抑制剂对比化疗药物治疗临床选择型NSCLC患者的研究:试验组为EGFR抑制剂干预,对照组为常规化疗干预;②作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者的研究:试验组为EGFR抑制剂+化疗干预,对照组为常规化疗干预。分析结果指标:无进展生存期、总体生存期、客观反应率。
四、 研究设计
需要纳入的研究应为EGFR抑制剂治疗NSCLC患者的随机对照试验(randomized controlled trial, RCT),不论方法学质量。
1. 文献检索策略: 英文数据库PubMed、Cochrane library、EMBASE采用主题词结合自由词的检索策略:epidermalgrowthfactorreceptor,“Receptor,EpidermalGrowthFactor”,gefitinib,erlotinib,afatinib,dacomitinib,icotinib,“Chemotherapy,Adjuvant”,“Chemotherapy,Cancer,RegionalPerfusion”,Chemotherapy,nosmallcelllungcancer,“Carcinoma,Non-Small-CellLung”,“LungNeoplasms”,randomizedcontrolledtrial*,clinicaltrial*,randomallocat*,random*,double-blind*,single-blind*。为减少文献漏检以Google Schoolar辅助检索,同时对纳入文献的参考文献进行检查,以尽查全。
2. 文献的纳入: 通过上述途径检索文献后,通过阅读题目和摘要初步判断文献是否和本次研究相关,留取符合及可能符合的文献资料,然后独立阅读研究的文题、摘要,排除明显不符合纳入标准的文献后,进一步对可能符合的研究阅读全文,最后判断是否符合纳入标准。纳入文献后需提取资料,主要包括:①一般信息:文题、作者、发表年限、出处;②研究特征:每个研究所纳入对象的一般情况、各组患者的基线情况和具体的干预措施;③最后的结果测量指标等。
3. 纳入文献的质量评价: 通过以上方法纳入文献后对试验的设计方案进行评价,评价标准参考Cochrane协作网RCT的风险偏倚评估量表进行。
4. 数据的提取与分析
(1) 资料提取:按照基线资料表中的内容,提取相关信息:文献的一般资料,包括文献的作者,发表日期;文献的研究特征,包括RCT的设计方案、研究对象的一般特征、干预措施;结局指标:无进展生存期、总体生存期和客观反应率。
(2) 数据分析方法:提取得到的数据采用RevMan 5.3.5(Cochrane Collaboration)和STATA 12.0(Stata Corp, College station, TX)进行分析处理。采用I2对纳入的各RCT间的异质性进行检验。以往的研究在合并时,通常情况下如果I2<50%,则认为研究的各RCT之间异质性较小,采用固定效应模型(fixed effects model)对数据进行分析;若I2>50%,在排除方法学和临床异质性后选择随机效应模型(random effects model)合并效应量,或者采用亚组分析减小异质性。为了确定EGFR抑制剂确实有效,本研究在合并过程中主要选择随机效应模型,因为其可信区间宽,更不容易得到有差异的结果,如若随机效应模型能检测到差异,固定效应模型也必能检测到差异。
本研究所纳入的文献均为RCT,考虑到结果的易解释性,提取数据主要为风险比(Hazard Ratio,HR)和相对危险度(risk ratio,RR)。对HR检验采用倒方差分析,对RR检验采用M-H法分析,当P<0.05时可认为差异有统计学意义。分析的结果采用国际通用的森林图表示。发表偏倚采用漏斗图检测,图示中的点代表纳入的RCT,如果漏斗图两侧基本对称,则认为受发表偏倚影响较小。反之,则可能受发表偏倚影响较大。同时,为检验合并效应量的真实可靠程度,本研究对有差异的统计结果进行了敏感性检验。若结果仍相同,则认为结果分析结果可靠,若结果不同,则可能与混杂因素有关。
结 果
一、检索流程和检索结果
初检各数据库总计356篇文献,通过阅读标题、摘要,排除重复、综述、非RCT共计281篇,初步纳入75个RCT,经详细阅读全文后排除与纳入条件不相符的47个研究,剩余28篇RCT,再排除6篇未报道感兴趣指标的、17篇非本组的研究后,最终纳入5篇RCT,具体分类见图 1。
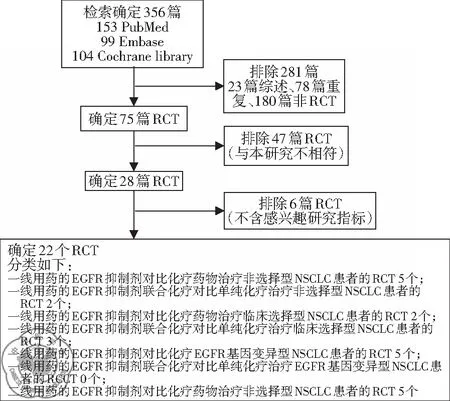
图1 检索流程
二、 作为一线用药的EGFR抑制剂对比化疗治疗临床选择型NSCLC患者的疗效
1. 纳入文献的一般情况: 该部分共纳入2个RCT[2-3],均为英文文献,采用的EGFR抑制剂为吉非替尼,具体基线资料,见表1。

表1 纳入Meta分析的2项研究的基本资料

表2 作为一线用药的EGFR抑制剂对比化疗治疗临床选择型NSCLC患者的方法学偏倚
2. 纳入文献的方法学偏倚: 作为一线用药的EGFR抑制剂对比化疗治疗临床选择型NSCLC患者的方法学偏倚,见表2。
3. Meta分析结果: 2012年,Han等[3]研究报道了1年内患者无进展生存期、总体生存期、客观反应率。无进展生存期结果提示:相比单纯化疗,吉非替尼并不能增加临床选择型NSCLC患者的无进展生存期(HR=1.198;95CI%:0.944-1.520;P=0.138)和总体生存期(HR=0.932;95CI%:0.716-1.213;P=0.604),也不能提高临床选择型NSCLC患者的客观反应率(RR=1.455;95CI%:0.929-2.278;P=0.101)。同样,2011年Fukuoka等[3]也指出:吉非替尼并不能增加临床选择型NSCLC患者的总体生存期(HR=0.90;95CI%:0.79-1.02;P=0.109)。
上述2个研究均报道了治疗后患者的总体生存期,合并时其异质性为(P=0.82,I2=0%),选用随机效应模型合并HR值后发现:相比单纯化疗,吉非替尼并不能延长选择型NSCLC患者的总体生存期(HR=1.06;95CI%:0.91-1.24;P=0.43),见图2。

图2 作为一线用药的EGFR抑制剂对比化疗治疗临床选择型NSCLC患者总体生存期的森林图
EGFR-TKIs作为一线药物治疗临床选择型NSCLC患者,通过对无进展生存期、总体生存期的HR值和客观反应率的RR值进行合并发现:EGFR抑制剂与单纯化疗相比,总体上并不能增加选择型NSCLC患者的生存期,也不能提高该类患者的客观反应率。
三、作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者的疗效
1. 纳入文献的一般情况: 该部分有3项RCT[4-6]符合纳入条件,均为英文文献,采用的EGFR抑制剂为厄洛替尼和吉非替尼,化疗药物选择培美曲塞+顺铂、吉西他滨、紫杉醇+卡铂,具体的基线资料,见表3。
2. 纳入研究的方法学偏倚: 我们采用Cochrane手册推荐的评价标准对纳入的RCT进行了偏倚分析,具体见表4。其中大多数研究均没有详细报告随机序列的产生方法,亦未报道分配隐藏和盲法的实施情况,但对退出人员的报告较为清楚详细。此外,评价后出现选择性偏倚和其他偏倚的风险均较小。总体上,在此部分纳入的3个RCT质量不高。
3. Meta分析结果
(1)无进展生存期: 3个研究均报道了治疗后患者的无进展生存期,共有3组数据,按照吉非替尼和厄洛替尼将其归类发现:吉非替尼联合化疗亚组异质性为(P=0.16,I2=48%)。本研究选择随机效应模型合并HR值后发现:吉非替尼联合化疗亚组不能延长临床选择型NSCLC患者的无进展生存期(HR=0.75;95CI%:0.44-1.30;P=0.31),厄洛替尼联合化疗亚组也不能起到这样的效果(HR=1.30;95CI%:0.63-2.68;P=0.48),总体上结果提示EGFR抑制剂不能延长临床选择型NSCLC患者的无进展生存期(HR=0.87;95CI%:0.56-1.36;P=0.54),具体结果见图3。

图3 作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者无进展生存期的森林图

表3 作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者RCT基线资料

表4 作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者RCT的方法学偏倚
(2)总体生存期:只有Choi等[7]2013报道了治疗后患者的总体生存期,吉非替尼亚联合化疗不能延长临床选择型NSCLC患者的总体生存期(HR=0.95;95CI%:0.58-1.56;P=0.84),具体结果见图 4。
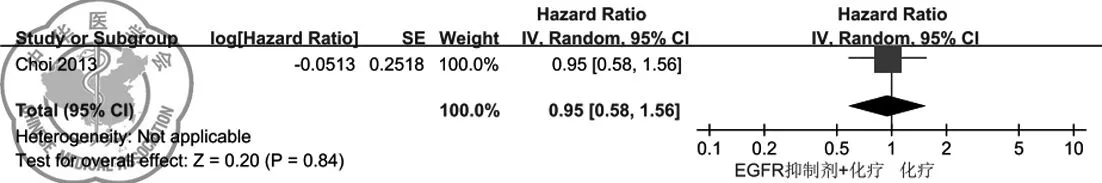
图4 作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者总体生存期的森林图
(3)客观反应率:有2个RCT报道了治疗后患者的客观反应率[5,7],按照吉非替尼和厄洛替尼将其归类发现:吉非替尼联合化疗亚组(RR=1.11;95CI%:0.66-1.86;P=0.70)和厄洛替尼联合化疗亚组(RR=0.54;95CI%:0.05-5.59;P=0.60)均不能提高临床选择型NSCLC患者的客观反应率,总体上结果提示EGFR抑制剂也不能提高临床选择型NSCLC患者的客观反应率(RR=1.07;95CI%:0.65-1.76;P=0.79),结果见图 5。
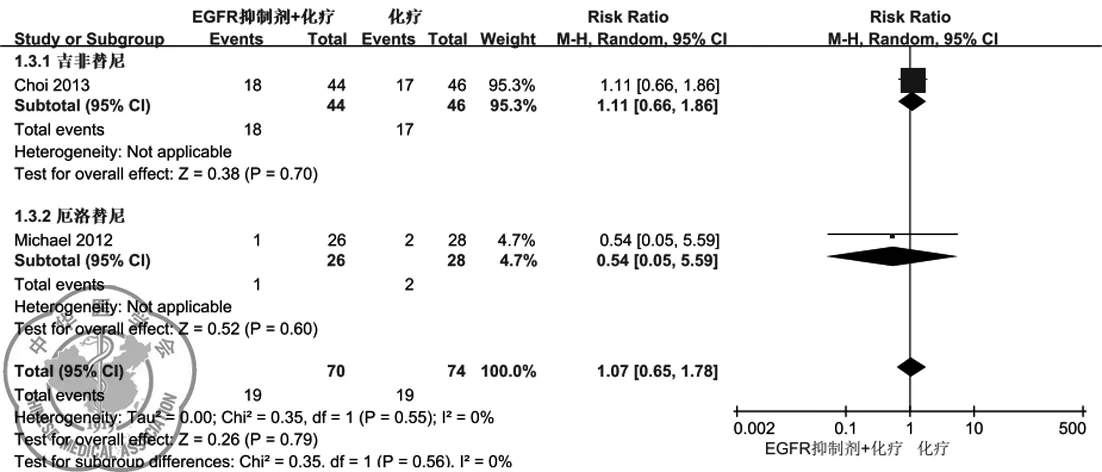
图5 作为一线用药的EGFR抑制剂联合化疗对比单纯化疗治疗临床选择型NSCLC患者客观反应率的森林图
EGFR-TKIs联合化疗与作为一线药物治疗临床选择型NSCLC患者,通过对无进展生存期、总体生存期的HR值和客观反应率的RR值进行合并发现:EGFR抑制剂联合化疗与单纯化疗相比,总体上并不能增加床选择性NSCLC患者的生存期,也不能提高该类患者的客观反应率。
讨 论
21世纪在肺癌治疗的领域达成的共识是传统治疗模式已经进入了一个平台期,肺癌的治疗急需寻找新的突破。随着分子生物学及遗传学的发展,分子靶向药物的研发与应用为 NSCLC 的治疗开启了一条新途径,逐渐成为晚期非小细胞肺癌的希望。
随着对肿瘤分子生物学的不断深入研究,人们对肿瘤的发生和发展的信号转导通路认识越来越清晰,针对肿瘤细胞信号转导通路的靶向治疗药物逐渐成为人们研究的热点。分子靶向治疗肺癌已取得了重大突破,以表皮生长因子受体酪氨酸激酶为靶点的EGFR-TKIs成为晚期NSCLC治疗的主要手段。
EGFR 通路是促进肿瘤细胞增殖和侵袭的关键信号转导通路,针对该信号通路进行干预成为一个有前途的肺癌治疗策略。其中,特别是 EGFR-TKIs的上市,为晚期 NSCLC 患者带了福音。EGFR-TKIs靶向于表皮生长因子受体,其通过竞争性与 EGFR-TKIs 催化区域的 Mg-ATP 位点结合,抑制EGFR细胞内酪氨酸激酶区域的自身磷酸化,阻断表皮生长因子受体下游信号传递,从而抑制肿瘤细胞的增殖、侵袭及转移 ,它们与 ATP 位点的结合是非共价键结合,属于可逆性 TKIs[8]。因EGFR-TKIs具有特异性强、疗效显著、不良反应小等优点,已逐步成为 NSCLC 重要治疗手段手段之一,并被推荐为晚期NSCLC化疗失败后的标准治疗方案。EGFR-TKIs的应用为NSCLC患者提供了更多的治疗机会,极大的改变了晚期NSCLC的预后。
由于EGFR-TKIs 药物有其特定的靶点,故不能使所有 NSCLC 患者均从中获益。2004年,Lynch等[9]和 Paez等[10]相继发表了关于 EGFR-TKIs获益人群的报道,结果显示:存在 EGFR 基因突变的患者,接受 EGFR-TKIs治疗的有效率可高达 70%~80%,而无EGFR基因突变的有效率不到10%。其后,日本及我国等亚洲学者也相继发表了该方面的报道,研究中发现 EGFR 基因突变与种族、性别、吸烟情况、肿瘤病理类型相关,其中亚裔、女性、非吸烟、腺癌患者的突变率最高,可高达 60%[10-11]。基于以上研究结果,针对经 EGFR基因突变检测筛选后的人群进行的大规模临床研究,均取得了显著的治疗效果。
本研究Meta 分析结果发现:相比化疗,作为一线用药的EGFR抑制剂无论是否联合化疗应用于临床选择型NSCLC患者均不能起到有效的治疗作用。
TAILOR是一项大型多中心RCT研究[13],其中肺腺癌占69%、不吸烟占22%,在这些优势人群中,化疗带来的获益明显大于厄洛替尼,因此,临床病理学特征仅作为肺癌患者选择治疗策略的参考,而不是主要依据,故不推荐根据临床特征来选择应用EGFR-TKIs。决定肺癌患者接受化疗还是靶向治疗的主要因素是EGFR突变状态。Kris等[14]研究显示:亚裔晚期肺腺癌患者EGFR敏感突变率可达51.4%,故而,应针对此类患者行EGFR基因检测,从而指导肺癌的个体化精确治疗。
本研究存在的局限性:①每个部分纳入研究过少,而且有些研究为Ⅱ期临床试验;②不同人种、年龄、性别、NSCLC的病理可能都是混杂因素,但是研究有限、不能对这些混杂因素进行区分,也不能采用Meta回归分析来探寻混杂因素;③EGFR抑制剂包括很多药物,其中常用的为吉非替尼、厄洛替尼等,其他的阿法替尼、达克替尼和埃克替尼研究甚少。不同药物的作用机理也稍有不同,限制了本研究结论。尚需多国、多中心的高质量、大样本的随机临床对照试验,才能进一步验证 EGFR-TKIs 作为一项方案治疗NSCLC 患者的疗效。
本研究纳入的研究均为近年来具有代表性的、高质量的 RCT,纳入文献无明显发表偏倚,得到的结果有一定论证强度。
尽管对EGFR-TKIs治疗非小细胞性肺癌有效性的系统评价研究取得了一些进展,但是肺癌的靶向治疗仍面临许多挑战,例如:①大多数肿瘤的发生机制复杂,其调控系统是一个复合的、多因素交叉的复杂网络,仅仅应用针对一两个靶点的药物很难达到根治肿瘤的目的,多数分子靶向药物的有效率也仅为10%左右;②正确、高效解读NGS提供地大量基因组信息,挑选、验证、鉴定具有决定性作用的肺癌驱动基因,目前仍面临挑战;③我国目前驱动基因的检测率仅33%左右,EGFR敏感突变的NSCLC患者仅有59%享受到靶向治疗的奇效,主要原因与有无合适的临床标本、医师的认识水平、患者的意愿和经济状况、医院的管理等密切相关,个体化精准治疗任重而道远;④晚期肺癌诊疗策略的选择、耐药性的监测方面,“液态活检”将发挥重要作用,但尚需进一步解决遇到的困难,才能使其真正应用到临床实践中;⑤肺鳞癌驱动基因扩增、突变和多个信号通路异常,其遗传学改变远比腺癌复杂,需要联合不同作用机制的药物来打破信号通路分子网络,进而才能获取较为理想的疗效;⑥可能因缺乏相应的预测疗效的生物标志物、主次不清的多靶点、获益人群不明确等因素,多数多靶点TKIs疗效不佳,尚需进一步的研究解决上述问题,以期实现EGFR-TKIs疗效的最大化;⑦肿瘤在发生、发展的初期可能源于单一基因突变,随着肿瘤细胞的不断增殖,可能发生新的基因突变并耐药,多项研究提示多靶点药物的使用、靶向药物的联合、靶向与化疗的联合等都有助于克服耐药,最终使患者最大程度的获益,但仍需不断研究克服继发耐药的策略;⑧分子靶向药物的研究和开发存在巨大风险;⑨分子靶向药物的潜在和长期毒性也不容忽视。
1 钱桂生. 肺癌不同病理类型发病率的变化情况及原因[J/CD]. 中华肺部疾病杂志(电子版), 2011, 4(1): 1-6.
2 杨玲, 李连弟, 陈育德, 等. 中国肺癌死亡趋势分析及发病、死亡的估计与预测[J]. 中国肺癌杂志, 2005, 8(4): 274-278.
3 Han JY, Park K, Kim SW, et al. First-SIGNAL: first-line single-agent iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung[J]. J Clin Oncol, 2012, 30 (10): 1122-1128.
4 Fukuoka M, Wu YL, ThongprasertS, et al. Biomarker analyses and final overall survival results from a phase Ⅲ, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol, 2011, 29(21): 2866-2874.
5 Michael M, White SC, Abdi E, et al. Multicenter randomized, open-label phase II trial of sequential erlotinib and gemcitabine compared with gemcitabine monotherapy as first-line therapy in elderly or ECOG PS two patients with advanced NSCLC[J]. Asia Pac J Clin Oncol, 2015, 11(1): 4-14.
6 Liang J, Ahn M, Kang J, et al. First-line treatment (txt) with pemetrexed-cisplatin (PC), followed sequentially by gefitinib (G) or pemetrexed, in Asian, never-smoker (n/smkr) patients (pts) with advanced NSCLC: An open-label, randomized phase Ⅱ trial[J]. J Clin Oncol, 2010, 28, 7591.
7 Choi YJ, Kim SW, Lee DH, et al. Paclitaxel/carboplatin (pc) intercalated with gefiinib or paclitaxel/carboplatin (pc) for advanced non-small cell lung cancer (nsclc) in selected population who were smoker or wild-type EGFR: randomized phase ii study[J]. J Clin Oncol, 2013, 31(15):e19079.
8 Arteaga CL. ErbB-targeted therapeutic approaches in human cancer[J]. Exp Cell Res, 2003, 284(1): 122- 130.
9 Lynch TJ, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J]. N Engl J Med, 2004, 50(21): 2129-2139.
10 Paez JG, Janne PA, Lee JC, et al. EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy[J]. Science, 2004, 304(5676): 1497-1500.
11 Kosaka T, Yatabe Y, Endoh H, et al. Mutations of the epidermal growth factor receptor gene in lung cancer: biological and clinical implications[J]. Cancer Res, 2004, 64(24): 8919-8923.
12 Rizvi NA, Rusch V, Pao W, et al. Molecular characteristics predict clinical outcomes: prospective trial correlating response to the EGFR tyrosine kinase inhibitor gefitinib with the presence of sensitizing mutations in the tyrosine binding domain of the EGFR gene[J]. Clin Cancer Res, 2011, 17(10): 3500-3506.
13 Garassino MC, Martelli O, Broggini M, et al. Erlotinib versus docetaxel as second-line treatment of patients with advanced non-small cell lung cancer and wild-type EGFR tumours (TAILOR): a randomized controlled trial[J]. Lancet Oncol, 2013, 14(10): 981-988.
14 Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J]. JAMA, 2014, 311(19): 1998-2006.
(本文编辑:王亚南)
田春琴,赵新汉,耿会生,等. 一线用药的EGFR抑制剂治疗临床选择型非小细胞肺癌有效性的系统评价[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(4): 450-456.
System evalution on effectiveness of EGFR-TKIs compared with chemotherapy in treatment of clinical-selected non-small-cell lung carcinoma
TianChunqin1,2,ZhaoXinhan1,GengHuisheng3,CuiLichun2,WangXuan2,DuJianfei2.
1OncologyDepartmentofXi′anjiaotonguniversityfirstaffiliatedhospital,xian710061China;2OncologyDepartmentoftheInternationalcooperationChang′anHospital,Xi′anChina710016;3RadiotherapyCentreDepartmentoftheInternationalcooperationChang′anHospital,xi′an710016China
Correspondingauthor:TianChunqin,Email: 327328758@126.com
Objective To analyze the effectiveness of epithelial growth factor receptor-TKIs(EGFR-TKIs) compared with chemotherapy on the clinical-selected patients. Method Randomized controlled trials(RCT) evaluating the effectiveness of EGFR-TKIs compared with chemotherapy as first line treatment of the clinical-selected NSCLC were obtained from PubMed, the Cochrane library and EMBASE. All literatures were assessed by the inclusion and exclusion criteria, quality assessment and data abstraction. The Meta analysis was performed by RevMan 5.3.5 (Cochrane Collaboration) and STATA 12.0 (STATA Corp, College station, TX) software and was contrasted in EGFR TKIs-treatment of the clinical-selected NSCLC patients curative effect. The stability and reliability were evaluated by sensitivity analysis and publication bias analysis. Results A total of 5 trials with 1 719 patients were included in the meta-analysis. The RR, PFS and OS of clinical-selected NSCLC patients treated with EGFR-TKIs alone or EGFR-TKIs in combination with chemotherapy as first-line therapy didn′t significantly increased compared with that of the patients treated with chemotherapy. Conclusion EGFR-TKIs therapy as first-line treatment was not suit for clinical-selected NSCLC patients.
Non-small-cell lung carcinoma; Epidermal growth factor receptor; Chemotherapy; Randomized controlled trial
10.3877/cma.j.issn.1674-6902.2017.03.018
710061 西安,西安交通大学第一附属医院肿瘤科1710016 西安,国际合作长安医院肿瘤科2710016 西安,国际合作长安医院放疗中心3
田春琴, Email: 327328758@126.com
R563
A
2016-06-24)

