山奈酚羟基糖基化对其与猕猴桃糖蛋白相互作用的影响
崔文慧,王岸娜,吴立根
河南工业大学粮油食品学院 (郑州 450001)
山奈酚羟基糖基化对其与猕猴桃糖蛋白相互作用的影响
崔文慧,王岸娜,吴立根*
河南工业大学粮油食品学院 (郑州 450001)
通过多种方法研究了猕猴桃糖蛋白GP2与山奈酚、山奈酚-3-o-芸香糖苷之间的相互作用。确定其作用的荧光猝灭机理、猝灭率、结合常数和结合位点数;探究两种多酚对蛋白质二级和三级构象的改变。对两种多酚与糖蛋白的相互作用进行比较,研究山奈酚羟基糖基化对其与猕猴桃糖蛋白相互作用的影响。
糖蛋白;山奈酚;羟基糖基化;相互作用
猕猴桃因其具有较高的营养成分和抗氧化能力,被认为是极具利用价值的水果[1]。猕猴桃果实含有17种氨基酸,包括除色氨酸外的人体必需的7种氨基酸,其中蛋白质含量0.86%~1.85%、总氨基酸含量10.74~17.94 mg/g[2]。猕猴桃含有大量的多酚和维生素C,食用猕猴桃可以预防心脑血管和神经性等多种疾病的发生。山奈酚(Kaempferol)属于多酚中的黄酮类化合物,主要来源于植物山奈的根茎,人们已经从茶叶,椰子和其他绿色植物中提取出其纯品[3-4]。研究发现,山奈酚对肺癌、前列腺癌及胶质母细胞瘤具有较好的抑制作用[5]。大多数多酚类化合物都与葡萄糖或鼠李糖结合成苷,部分以游离状态或与鞣质结合的形式存在。山奈酚-3-o-芸香糖苷(Kaempferol-3-o-rutinoside)是山奈酚中一个羟基上的氢原子被芸香糖苷取代而成的山奈酚的双糖苷,目前对其研究较少。
多酚与糖蛋白的相互作用在食品生产和加工中较为常见,并且因为二者的相互作用会影响蛋白质和多酚的特性,因此受到了较高关注。然而,多酚的种类较为丰富,其不同的结构,对二者的相互作用会产生不同的影响。实验通过研究山奈酚-3-o-芸香糖苷和其苷元山奈酚分别与猕猴桃糖蛋白的相互作用,进而对多酚羟基糖基化对其与猕猴桃糖蛋白相互作用的影响进行分析。
1 材料与方法
1.1 试验材料
猕猴桃糖蛋白GP2(实验室自行提取),磷酸二氢钠、磷酸氢二钠、蒸馏水、无水乙醇、山奈酚(纯度≥98%,分子量286,成都普菲德生物技术有限公司)、山奈酚-3-o-芸香糖苷(纯度≥98%,分子量595,成都普菲德生物技术有限公司)。
溶液配制:糖蛋白GP2浓度为1.0×10-5mol/L;设置糖蛋白GP2与多酚浓度比为1/0,1/1,1/3,1/5,1/10,1/30,1/60。
1.2 仪器与设备
HH-4数显恒温水浴锅,江苏省金坛市友联仪器研究所;HZT-B5000电子天平,华腾科学仪器有限公司;pHS-25数显pH计,上海精密科学仪器有限公司;WQF-510傅里叶广红外光谱仪,天津天光有限公司;BT-1600图像颗粒分布系统,丹东市百特仪器有限公司;759MC紫外可见分光光度计,上海菁华科技仪器有限公司;Cary Eclipase荧光分光光度计,美国VARIAN。
1.3 试验方法
1.3.1 荧光光谱测定
荧光光谱法是研究蛋白类大分子和特异性小分子等相互作用的应用最多的一种手段,蛋白质分子中的色氨酸残基(348 nm附近)、酪氨酸残基(303 nm附近)和苯丙氨酸残基(282 nm附近)能发生荧光使其具有内源荧光[6],特异性分子加入后其荧光强度将发生变化,再根据有关方程可以求出二者的相关参数。
在温度310 K下,扫描两组溶液的荧光光谱。设置激发280 nm,范围290~440 nm扫描猝灭光谱;设置激发和发射波长差值Δλ=15 nm、60 nm,范围240~320 nm扫描其同步荧光光谱。
1.3.2 傅里叶变换红外光谱测定
对于傅立叶变换红外光谱,大多氨基酸残基都是发色团,蛋白和多糖的主链肽键会产生酰胺带的振动谱带,常用的分析蛋白二级结构的是酰胺Ⅰ带(1 700~1 620 cm-1),在酰胺Ⅰ带的谱图中,1 610~1 640 cm-1范围为β-折叠结构、1 640~1 665 cm-1范围为无规则卷曲结构、1 650~1 658 cm-1范围为α-螺旋结构、1 660~1 695 cm-1范围为β-转角结构[7-8]。近年红外光谱技术已发展成熟,为研究蛋白等大分子的结构功能提供了方便有效的手段。
在环境温度下收集样品的红外光谱。测量在中红外区域(4 000~400 cm-1)中进行。干燥溴化钾作为本底,扫描16次,分辨率为4 cm-1。
1.3.3 数据分析
运用Origin92,PeakFit v4.12等软件进行数据处理。
2 结果与讨论
2.1 荧光光谱法研究
2.1.1 山奈酚、山奈酚-3-o-芸香糖苷对GP2内源荧光的淬灭类型

图1 山奈酚、山奈酚-3-o-芸香糖苷对猕猴桃糖蛋白GP2荧光猝灭光谱
荧光光谱法是研究药物小分子与生物大分子之间作用的应用较为广泛的实验技术。本实验使用此方法定量的研究山奈酚和山奈酚-3-o-芸香糖苷在磷酸盐缓冲液中与猕猴桃糖蛋白GP2的结合。在350 nm附近,蛋白质分子中色氨酸(Trp)的荧光强度最大[9],选择此处进行计算,并且山奈酚和山奈酚-3-o-芸香糖苷不会产生荧光。图1可以看出,两种多酚均可以使猕猴桃糖蛋白GP2的荧光发生猝灭,并且,随着浓度的增大,猝灭程度依次增强。这表示两种多酚都与猕猴桃糖蛋白GP2发生了结合,并且改变了其结构。

图2 山奈酚、山奈酚-3-o-芸香糖苷对GP2的荧光猝灭相对变化
在310 K时, 山奈酚和山奈酚-3-o-芸香糖苷对GP2的猝灭状况如图2。在较高浓度范围下,同浓度的山奈酚-3-o-芸香糖苷更强地猝灭了GP2的内源荧光,即山奈酚母核羟基的糖基化增加了其对糖蛋白GP2内源荧光的猝灭,山奈酚-3-o-芸香糖苷与色氨酸基团的相互作用比山奈酚更强。
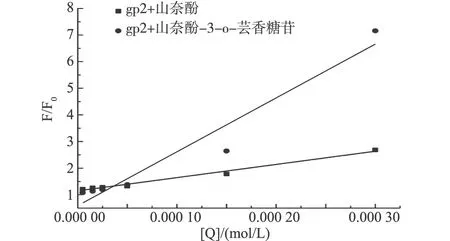
图3 山奈酚、山奈酚-3-o-芸香糖苷猝灭GP2内源荧光的Stern-Volmer曲线
荧光猝灭过程被认为有动态猝灭和静态猝灭两种。假定两种多酚对GP2内源荧光的猝灭为动态淬灭过程,用式(1)Stem-Volmer方程式和图3计算猝灭过程速率常数Kq,根据文献数据,生物高聚物的不同猝灭剂的最大分散碰撞常数是2.0×1010L/mol·s。以此来判断其猝灭类型。
F0/F=1+Kqτ0[Q]=1+Ksv[Q]
(1)
计算得到表1, 山奈酚和山奈酚-3-o-芸香糖苷对GP2的双分子猝灭速率常数Kq分别比2.0×1010L/mol·s大1~2个数量级,这说明GP2内源荧光的猝灭不完全是由动态猝灭引起的,而是形成了复合物引起的,即静态猝灭过程或者是动静态联合猝灭。
表1 山奈酚、山奈酚-3-o-芸香糖苷与GP2相互作用的动态猝灭常数Ksv、猝灭速率常数Kq

项目Ksv/(104L/mol)Kq/(1012L/mol·s)山奈酚0.496±0.0020.496±0.002山奈酚-3-o-芸香糖苷2.019±0.0022.019±0.003
2.1.2 山奈酚、山奈酚-3-o-芸香糖苷与GP2相互作用作用的表观结合常数及结合位点数
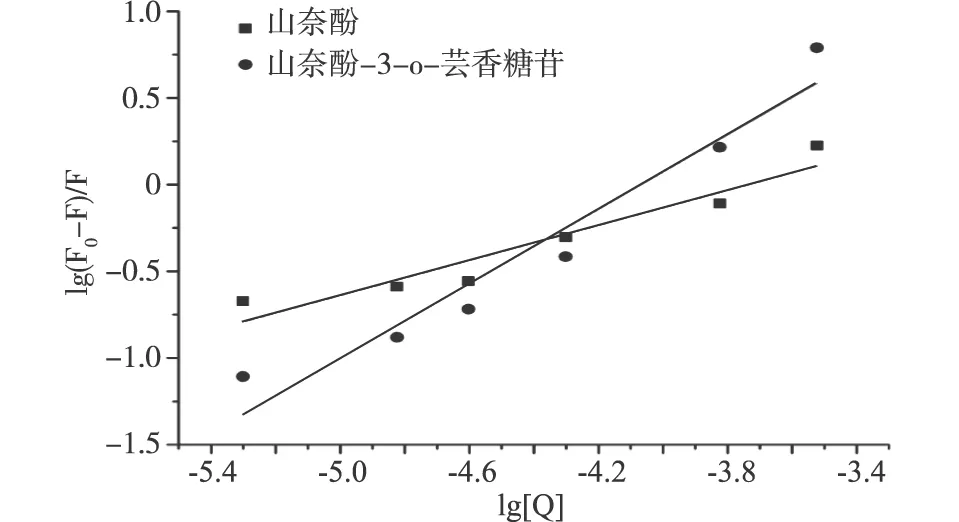
图4 山奈酚、山奈酚-3-o-芸香糖苷与糖蛋白GP2相互作用的双对数曲线图
静态猝灭过程可用式(2)计算有关结合参数,作图4,分别根据两条双对数曲线的斜率和截距,得到山奈酚、山奈酚-3-o-芸香糖苷与糖蛋白GP2相互作用的结合常数和结合位点数,表2所示。
lg [(F0- F)/F]=lgKa+nlg [Q]
(2)
表2 山奈酚、山奈酚-3-o-芸香糖苷与糖蛋白GP2相互作用的结合位点数n、结合常数Ka

项目nKa/(L/mol)山奈酚0.506±0.0020.773×102±0.002山奈酚-3-o-芸香糖苷1.074±0.0022.330×104±0.003
经计算山奈酚和山奈酚-3-o-芸香糖苷的表观结合常数分别为77.321和2.331×104L/mol。山奈酚-3-o-芸香糖苷的表观结合常数比山奈酚大3个数量级。两种物质的结合位点数为0.506与1.074,可认为二者与GP2只有1个结合位点。
2.2 同步荧光光谱法研究
实验采用固定波长差的同步荧光光谱来研究蛋白质构象的变化。当发射波长和激发波长的差值为15 nm时,图谱显示出酪氨酸残基的吸收峰,当差值为60 nm时,显示的为色氨酸残基的特征峰[11]。
图5所示,随着山奈酚浓度的升高,色氨酸残基和酪氨酸残基的荧光吸收峰都依次降低,色氨酸残基的最大荧光波长发生明显红移,而酪氨酸残基无明显变化,说明糖蛋白GP2的构象发生了改变,疏水性降低,肽链变得更加伸展,并且表明山奈酚与糖蛋白GP2相互作用的结合位点偏向于色氨酸。
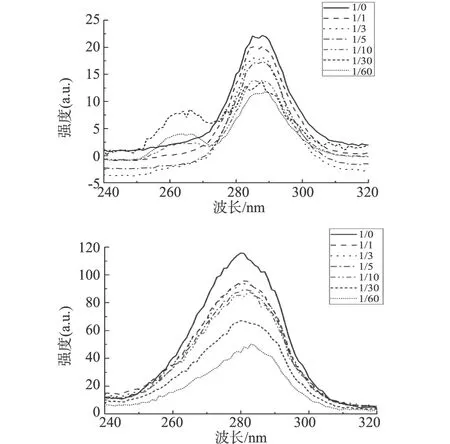
注:依次为Δλ=15、60 nm。 图5 310 K山奈酚与糖蛋白GP2相互作用的同步荧光光谱
图6所示,随着山奈酚-3-o-芸香糖苷浓度的升高,色氨酸残基和酪氨酸残基的荧光吸收峰都依次降低,色氨酸残基则出现了明显的红移,表明糖蛋白GP2的构象变化,色氨酸残基附近的疏水性降低,肽链伸展,可能是由于山奈酚-3-o-芸香糖苷与糖蛋白GP2相互作用的结合位点偏向于色氨酸。
2.3 傅里叶变换红外光谱法研究
通过傅里叶变换红外光谱法量化多酚类型和性质对猕猴桃糖蛋白GP2二级结构的影响。在蛋白质的二级结构的研究中,α-螺旋结构表现了蛋白质分子的致密性,其它结构反映了蛋白质分子的松散性,如β-折叠、β-转角、无规则卷曲等[12]。猕猴桃糖蛋白GP2二级结构含量的定量分析示于表3中。糖蛋白GP2的二级结构组成为15.1%α-螺旋,37.1% β-折叠,28.9%β-转角和16.3%无序结构。糖蛋白GP2与山奈酚结合后,浓度对结果的影响没有明显的规律。在浓度比为1/5时,α-螺旋和β-折叠增加到最大,β-转角和无序结构含量最低,表明在此浓度下,糖蛋白GP2的二级结构变化最大。糖蛋白GP2与山奈酚-3-o-芸香糖苷结合后,在浓度比为1/60时,β-折叠和无规卷曲程度最大。
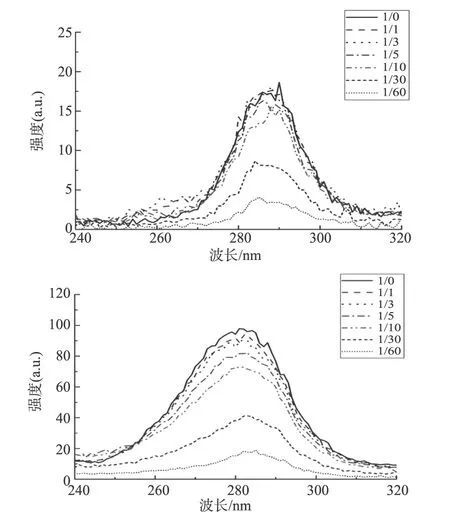
注:依次为Δλ=15、60 nm。 图6 310 K山奈酚-3-o-芸香糖苷与糖蛋白gp2相互作用的同步荧光光谱
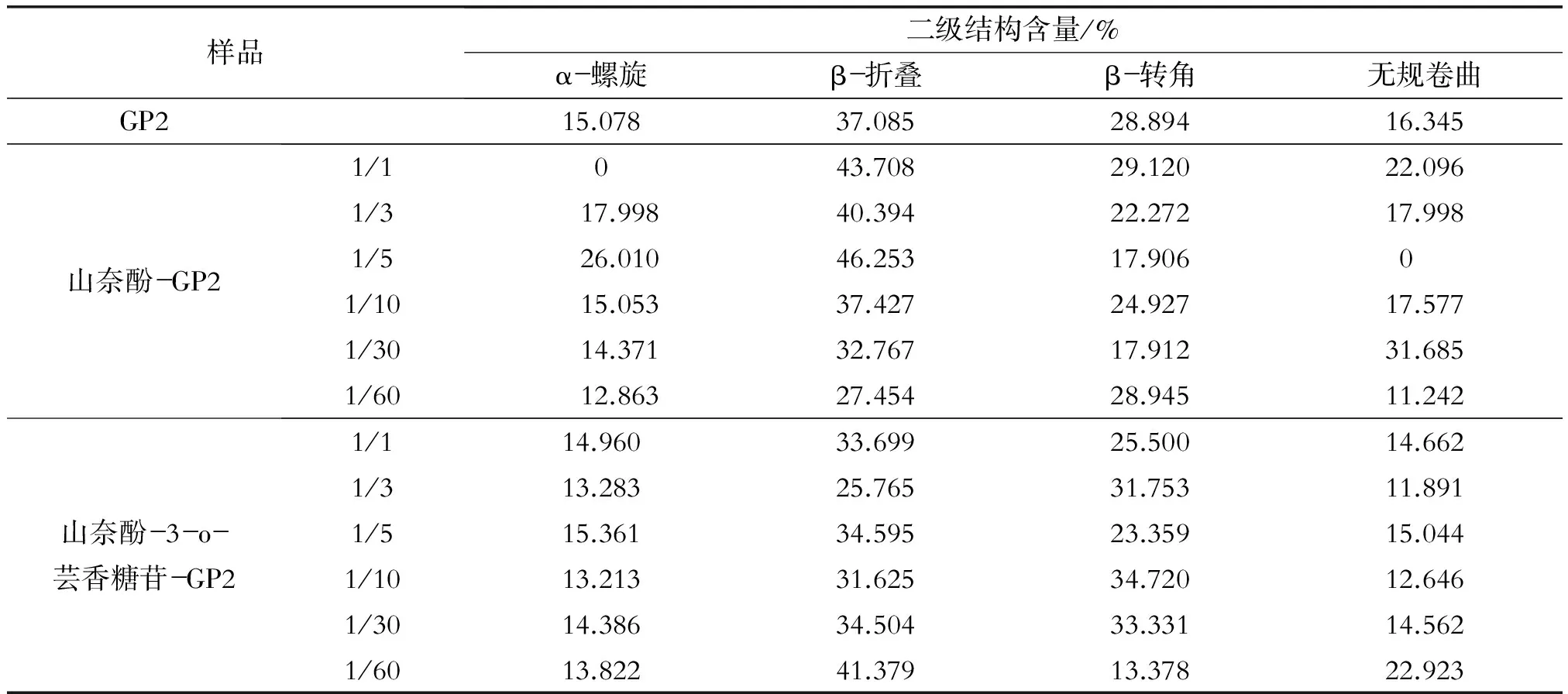
表3 山奈酚、山奈酚-3-o-芸香糖苷与糖蛋白GP2的二级结构分析
3 结论
实验研究了山奈酚、山奈酚-3-o-芸香糖苷和猕猴桃糖蛋白GP2的相互作用,研究表明,山奈酚、山奈酚-3-o-芸香糖苷都使糖蛋白GP2发生了荧光猝灭,类型为静态猝灭或动静态联合猝灭;相比山奈酚,山奈酚-3-o-芸香糖苷和GP2有更大的结合常数。两者与GP2均只有一个结合位点,结合位点都偏向与酪氨酸;两者都引起了糖蛋白GP2构象上的变化,并且反应的浓度比对GP2的二级结构有较大影响。该实验结果有助于从分子层面上解析探索多酚与糖蛋白之间的相互作用,以及二者相互作用与多酚结构的关系,为其更好的利用提供价值。
[1] Kaya A, Aydin O,Kolay I S. Effect of different drying conditions on the vitamin C (ascorbic acid) contend of Hayward Kiwifruits (Actinidia delicious Planch) [J].Food and Bioproducts Processing,2010,88(2-3):165-173.
[2] 赵金梅,高贵田,薛 敏,等.不同品种猕猴桃果实的品质及抗氧化活性[J].食品科学,2014,35(9):118-122.
[3] Xu W, Liu J, Li C, et al. Kaempferol-7-O-D-glucoide(KG) isolated from Smilax china L. rhizome induces G2/M phasearrest and apoptosis on HeLacellsin a p53-independent manner[J].Cancer Letters,2008,264(2):229-240.
[4] Bandyopadhyay S, Romero J R, Chattopadhyay N. Kaempferol and quercetin stimulate granulocyte-macrophage colony-stimulating factor ecretion inhuman prostate cancer cells[J].Mol Cell Endocrinol,2008,287(1/2):57-64.
[5] Zhang Y, Chen A Y, Li M, et al. Ginkgo biloba extract kaempferol inhibits cell proliferation and induces apoptosis in pancreatic cancer cells [J]. J Surg Res, 2008,148(1):17-23.
[6] Kim D, Park J, Kim J, et al. Flavonoids as mushroom tyrosinase inhibitors: A fluorescence quenching study [J]. J Agric Food Chem, 2006, 54: 935-941.
[7] Maiti T K, Ghosh K S, Samanta A, et al. The interaction of silibinin with human serum albumin: A spectroscopic investigation[J]. Journal of Photochemistry and Photobiology A: Chemistry, 2008, 194: 297-307.
[8] Su Y L, Xu Y Z, Yang L M, et al. Spectroscopic studies of the effect of the metal ions on the structure of mucin[J]. Journal of Molecular Structure, 2009, 920: 8-13.
[9] Nahid Shahabadi, Maryam Maghsudi, ZahraKiani, et al. Multi spectroscopic studies on the interaction of 2-tert-butylhydro-quinone (TNHQ), a food additive, with bovine serum albumin [J]. Food Chemistry, 2011, 124:1063-1068
[10] Jiang C Q, Gao M X, Meng X Z. Study of the interaction between daunorublein and human serum albumin, and the determination of daunorubicin in blood serum samples [J].SpectrochimActa,Part A,2003,59:1605-1610.
[11] 刘旭阳.光谱法研究抗生素类药物与牛血清白蛋白的相互作用[D].保定:河北大学,2014.
[12] 吴克刚,周华丽,柴向华,等. 光谱法研究芳樟醇与牛血清白蛋白的相互作用[J]. 现代食品科技,2015(12):141-148.
Effect on hydroxylation of karethapine on its interaction with kiwi glycoprotein
Cui Wenhui, Wang Anna, Wu Ligen*
School of Food Science and Technology, Henan University of Technology (Zhengzhou 450001)
The interaction between kiwifruit glycoprotein GP2 and kaempferol, kaempferol-3-o-rutanoside was studied by a variety of methods. The fluorescence quenching mechanism, the quenching rate, the binding constant and the number of binding sites were determined. The changes of secondary and tertiary conformations of two polyphenols were explored. The effects of the glycosylation of kaempferol on the interaction between the two polyphenols and the glycoprotein were studied.
glycoprotein; kaempferol; hydroxyl glycosylation; interaction
2017-03-15
国家自然科学基金(项目编号:31201294);粮食公益性行业科研专项(项目编号:201313011);河南省省属高校基本科研业务费专项资金资助(项目编号:2014YWJC05)。
崔文慧,女,1993年出生,硕士研究生,研究方向为食品科学。
*通讯作者:吴立根,男,1969年出生,副教授,研究方向为食品加工与营养。
TS201
A
1672-5026(2017)04-031-05

