腹腔镜辅助达芬奇手术系统治疗直肠癌的临床体会(附268例报告)
张 成,高广荣,李 达,单永琪,吕 赤,李 瑾,蒋会勇,张雪峰
(沈阳军区总医院,辽宁 沈阳,110840)
腹腔镜辅助达芬奇手术系统治疗直肠癌的临床体会(附268例报告)
张 成,高广荣,李 达,单永琪,吕 赤,李 瑾,蒋会勇,张雪峰
(沈阳军区总医院,辽宁 沈阳,110840)
目的:探讨达芬奇机器人手术系统联合腹腔镜直肠癌根治术的可行性、安全性及近期疗效。方法:回顾分析2011年5月至2016年5月为268例直肠癌患者行达芬奇机器人手术系统联合腹腔镜手术的临床资料,系统分析手术方法、术式选择、并发症及术后近期恢复情况。结果:267例完成达芬奇机器人手术系统联合腹腔镜手术,1例中转开腹。199例采用前切除术(Dixon),57例行经腹会阴联合切除术(Miles),12例行远端闭锁近端造口术(Hartmann),手术时间分别为(193±33) min、(181±37) min与(173±24) min,术中出血量分别为(27±8) ml、(36±10) ml与(29±12) ml。未行术前新辅助放化疗的患者平均清扫淋巴结(15.4±4.1)枚,行术前新辅助放化疗的患者平均(11.2±2.8)枚。直肠远切缘平均(3.5±0.8) cm,均为阴性;环周切缘5例阳性。术后排气时间平均(3.0±0.8) d,拔除尿管时间平均(3.0±0.6) d。术后发生吻合口瘘6例、肠梗阻10例、手术相关性感染12例,无围手术期死亡病例。结论:达芬奇机器人手术系统联合腹腔镜用于直肠癌根治术安全、可行。
直肠肿瘤;达芬奇机器人系统;腹腔镜检查;安全性;可行性;近期疗效
近期研究显示腹腔镜直肠癌手术与开腹直肠癌手术具有相似的外科疗效及肿瘤学结局[1],因此目前已得到广泛应用。达芬奇手术系统由于更具操作优势,已广泛应用于泌尿外科、妇产科、腹部肿瘤外科手术[2-4]。但由于达芬奇手术系统操作方向相对固定、机械臂活动范围有限,因此对于操作范围广泛的腹盆腔手术,存在一定的局限性。自2011年5月开始沈阳军区总医院胃肠外科应用达芬奇手术系统联合腹腔镜施行直肠癌外科手术,兼顾了两者的技术优势,至2016年5月共完成268例直肠癌根治手术,临床疗效较好,现将结果报道如下。
1 资料与方法
1.1 临床资料 本组268例患者中男151例,女117例,平均(60.8±11.3)岁;183例体重指数>25 kg/m2,85例为25~30 kg/m2。76例患者肿瘤下缘距肛缘距离<6 cm,89例为12~18 cm;ASA评分1~2级252例,3级16例;术前32例接受新辅助放化疗,35例有手术史。患者均获知情同意并填写手术同意书。病例纳入标准:(1)术前经纤维结肠镜及病理检查证实直肠癌,诊断明确,肿瘤距肛缘18 cm内,通过CT、MRI或直肠腔内超声行cTNM分期;(2)无肝、肺、腹腔等远处转移(部分单发肝转移病例经多学科讨论后也纳入手术);(3)心、肺、脑等重要脏器功能良好,无手术禁忌证。病例排除标准:(1)术前评估发现肿瘤多发远处转移不适合手术;(2)肿瘤合并急性梗阻、穿孔或因侵犯邻近脏器而需联合脏器切除;(3)直肠癌术后复发;(4)体弱无法耐受长时间气腹或腹腔内广泛粘连。
1.2 手术方法 采用气管插管静脉复合麻醉,患者取截石位,臀部垫高。
1.2.1 Trocar位置 采用4孔法施术:耻骨联合上18 cm(或脐上3 cm)水平偏右3 cm处开放法入腹,穿刺12 mm Trocar作为观察孔(C点),气腹压力维持在12 mmHg;右侧髂前上棘与脐连线中点水平偏右2~3 cm处(与观察孔距离大于8 cm)穿刺8 mm Trocar,作为1号机械臂的主操作孔(A点);观察孔水平偏左10 cm处穿刺8 mm Trocar,作为2号机械臂的副操作孔(B点);主操作孔与观察孔连线中点外上2 cm处穿刺12 mm Trocar,作为辅助操作孔(D点),用于助手冲洗、牵拉、夹持及切割闭合等操作(图1)。
1.2.2 腹腔镜下准备 腹腔镜探查腹盆腔,了解肝脏、肠系膜根部、盆底腹膜等有无转移。分离粘连,了解直肠肿瘤的局部解剖情况,判定是否适合行达芬奇手术。确定可行达芬奇手术后,将患者体位调整为臀高右倾位,以将小肠推至右上腹为度。左侧脐与髂前上棘连线中点处刺入荷包针,腹腔镜下穿过直肠乙状结肠交界处系膜无血管区后重新于原位刺出腹壁。通过调节荷包线松紧度,可充分显露直肠-乙状结肠系膜与后腹膜的返折处。女性患者需经腹壁穿刺悬吊子宫,以利盆底腹膜返折的显露(图2)。
1.2.3 达芬奇系统的操作 机械臂塔对好“甜蜜点”后,从观察孔与左侧髂前上棘连线方向推入。1臂连接单极电凝剪或超声刀,2臂连接双极电凝抓钳,助手根据手术需要进行牵拉、吸引及夹持。采用中央入路,于骶骨岬水平乙状结肠系膜与后腹膜的移行处切开后腹膜,沿Toldt筋膜间隙游离乙状结肠系膜。向上游离至肠系膜下血管根部,清除周围的淋巴结及脂肪组织,妥善保护上腹下神经丛,常规分离并保护左结肠血管后切断肠系膜下动脉(图3)。向外游离乙状结肠系膜至侧腹膜,妥善保护腹膜后神经丛、生殖血管及左侧输尿管。于胰腺下缘结扎并切断肠系膜下静脉,裁剪乙状结肠系膜达预定切断线(距肿瘤至少10 cm,新辅助放化疗的患者尽量切除可能受放射的肠管)。向下于骶前壁脏层筋膜间隙按全直肠系膜切除术(total mesorectal excision,TME)原则游离直肠及其系膜。直肠前的解剖在Denonvillier筋膜前进行,解剖两侧壁注意保护盆丛神经、血管神经束。距肛缘大于12 cm的肿瘤,游离直肠系膜达肿瘤远端5 cm水平。距肛缘小于12 cm的肿瘤,游离直肠系膜达盆底肌水平。采用电凝剪或超声刀裸化直肠,遇主干血管则采用Hem-o-lok夹闭后切断。裸化直肠后,高位直肠癌距肿瘤远端5 cm处用镜下Endo-GIA切闭,中低位直肠癌距肿瘤远端2~3 cm处切断,无法保肛者行Miles术。
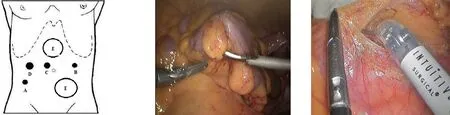
图1 Trocar位置示意图(C观察孔; 图2 乙状结肠及子宫悬吊 图3 肠系膜下动脉根部解剖 A主操作孔B副操作孔;D辅 助操作孔;E可能增加Trocar 区域)
1.2.4 腹腔镜操作 如果患者乙状结肠较短估计吻合有张力或术前行新辅助放化疗,此时在腹腔镜下切开降结肠外侧腹膜并切断脾结肠韧带、胃结肠韧带左半,以彻底游离降结肠、结肠脾曲。如果需要,此时可在上腹剑突下或左下腹穿刺5 mm Trocar,以利左半结肠的显露。
1.2.5 标本的取出 (1)不做预防性造口的患者,经下腹横切口;(2)拟行预防性造口的患者,经右下腹纵切口;(3)Miles术的患者,经会阴部切口;(4)Hartmann手术的患者,经左侧脐与髂前上棘连线中内1/3切口;(5)部分病灶小、病期早的病例经直肠或阴道后壁切口的自然孔道。
1.2.6 肠道重建 消化道重建在腹腔镜下进行,采用直肠(肛管)乙状结肠端端吻合。
2 结 果
2.1 手术方式 199例行直肠前切除术(其中高位前切除89例、低位前切除92例、括约肌间切除18例),Miles术57例,Hartmann术12例。低位前切除实施预防性末段回肠造口29例;需要游离结肠脾曲11例。镜下双吻合177例;达芬奇手术系统直接缝合22例。联合肝脏切除6例。因术中出血并气腹机故障,中转开腹1例。
2.2 手术结果 手术时间平均(188±41) min,其中前切除平均(193±33) min,Miles术平均(181±37) min,Hartmann术平均(173±24) min,纯达芬奇系统操作时间平均(72±30) min。前切除术术中出血量平均(27±8) ml,Miles术平均(36±10) ml,Hartmann术平均(29±12) ml。
术后排气时间平均(3.0±0.8) d,拔除尿管时间平均(3.0±0.6) d,术后平均住院(9.0±2.8) d。术后发生吻合口瘘6例,肠梗阻10例,手术相关性感染12例,均经保守治疗痊愈;1例患者因提肛肌断端出血于术后当日开腹止血,另有1例患者因吻合口出血于术后第2天行内镜下止血。
2.3 病理结果 术后远切缘平均(3.5±0.8) cm,未行术前新辅助放化疗者淋巴结数量平均(15.4±4.1)枚,行术前辅助放化疗者平均(11.2±2.8)枚,环周切缘阳性5例,肿瘤T分期中,Tx期15例(5.6%),Tis期11例(4.1%),T1期27例(10.1%),T2期54例(20.1%),T3期139例(51.9%),T4期22例(8.2%)。
3 讨 论
出于对腹腔镜手术肿瘤安全性的担忧,腹腔镜直肠癌手术一直存有争议[5-6]。但随着COLOR Ⅱ研究结果的发表,这一争论已逐渐平息[1]。研究结果显示,在术后局部复发率、无病生存率、总体生存率方面腹腔镜与开腹直肠癌手术疗效相似。良好的治疗结果是以规范化的手术为前提的,虽然目前腹腔镜直肠癌根治术已成为直肠癌治疗的标准术式,但在腹腔镜下真正做到标准的TME在技术上还是很困难的[7]。达芬奇机器人手术系统的出现不但为直肠癌的微创治疗提供了新的选择,而且在技术上降低了镜下规范化TME的难度。
与腹腔镜的二维视野及筷子效应相比,达芬奇手术系统具有许多腹腔镜手术无法比拟的技术优势:10~15倍放大的高清3维视野、仿真机械手腕具有7个自由度且可540°旋转、消除手的震颤及稳定的自控制镜头,这使得达芬奇系统的操作更为精准、灵活[8]。我们体会,精准不但体现在对肠系膜下动脉根部的廓清及血管神经束的保护方面,还体现在对两侧盆壁壁脏层筋膜间隙的解剖及邓氏筋膜分离等TME难点的处理方面,尤其分离直肠系膜侧壁的过程中,不必像腹腔镜手术那样钝锐结合操作,可直接锐性分离。精准的锐性分离不但保证了TME的质量,降低了环周切缘阳性发生率,还加快了手术速度。目前我们团队达芬奇镜下操作时间基本在50 min内,远低于腹腔镜的手术时间。操作灵活体现在达芬奇手术可在狭窄的盆腔内完成腹腔镜下无法完成或很难完成的动作,我们为22例患者完成了经肛门取出标本后直接镜下端端手工吻合[9],器械吻合后常规浆肌层缝合加固吻合口并内翻缝合消除两侧的“狗耳朵”,Miles或Hartmann术后常规缝合关闭盆底腹膜。这些操作降低了术后发生吻合口狭窄、吻合口瘘、粘连性肠梗阻的几率,保证了手术的安全。
达芬奇系统虽然具有诸多优势,但也存在不足,手术方向相对固定、不适宜大范围的操作是其弊端之一。目前解决这一问题的方法有两种:手术车两次进入的全达芬奇手术及达芬奇腹腔镜杂交手术[10-11]。我们认为后者更为合理,其一,达芬奇系统的优势在于淋巴结廓清与TME,而不在脾曲的游离;其二,可充分发挥腹腔镜操作灵活的特点;其三,国人真正需要进行脾曲游离的较少;其四,患者体表面积相对较小,安放多枚Trocar后容易相互冲突;最后,符合卫生经济学要求及中国国情。我们采用的Trocar布局能满足大部分患者的需求,如果需要进行脾曲游离,还可通过增加5 mm Trocar解决。本组仅11例(4.1%)需要进行脾曲游离,这一比例与韩国学者的研究相似[12-13],这可能与东方人BMI指数较低有关[11]。
手术时间较长曾是达芬奇手术的缺点之一,但我们体会固定团队经过50例左右的磨合后可实现熟悉设备、熟练配合。本组手术时间从前100例的240 min提高至180 min,真正达芬奇镜下操作时间目前已控制在50 min左右。总体而言,我们体会达芬奇手术出血量少、术后疼痛轻微、胃肠与膀胱功能恢复快,而且手术并发症发生率、中转开腹率、吻合口瘘发生率较低,完全可与腹腔镜手术相媲美,甚至优于腹腔镜手术[14-15]。我们认为由于达芬奇系统提供的立体清晰的视野及精准灵活的工具实现了最小应激状态下的精准手术,这一优势是目前开腹手术、腹腔镜手术都无法实现的。
规范标准的手术是实现肿瘤学良好结局的前提,本研究在淋巴结清扫数量、肿瘤远切缘距离、局部复发率等肿瘤学指标方面取得了与腹腔镜手术、开腹手术相似的治疗结果,进一步表明达芬奇手术系统行直肠癌根治术在肿瘤学方面是安全的。我们还选择性地施行了6例直肠癌根治联合肝转移瘤切除术,肝转移瘤分别采用达芬奇或腹腔镜手术的方式切除,近期疗效较好。
综上所述,我们认为达芬奇手术系统与腹腔镜手术联合应用可充分发挥各自的技术优势,实现直肠癌手术的精准、高效。随着达芬奇手术系统的灵巧化、国产化,相信机器人直肠癌手术应是未来的发展趋势。
[1] Bonjer HJ,Deijen CL,Haglind E,et al.A Randomized Trial of Laparoscopic versus Open Surgery for Rectal Cancer[J].N Engl J Med,2015,373(2):194.
[2] Parsons JK,Messer K,Palazzi K,et al.Diffusion of surgical innovations,patient safety,and minimally invasive radical prostatectomy[J].JAMA Surg,2014,149(8):845-851.
[3] Morelli L,Perutelli A,Palmeri M,et al.Robot-assisted surgery for the radical treatment of deep infiltrating endometriosis with colorectal involvement:short- and mid-term surgical and functional outcomes[J].Int J Colorectal Dis,2016,31(3):643-652.
[4] Yoo HN,Kim TJ,Lee YY,et al.Single-site robotic surgery in gynecologic cancer:a pilot study[J].J Gynecol Oncol,2015,26(1):62-67.
[5] Inomata M,Yasuda K,Shiraishi N,et al.Clinical evidences of laparoscopic versus open surgery for colorectal cancer[J].Jpn J Clin Oncol,2009,39(8):471-477.
[6] Feliciotti F,Guerrieri M,Paganini AM,et al.Long-term results of laparoscopic versus open resections for rectal cancer for 124 unselected patients[J].Surg Endosc,2003,17(10):1530-1535.
[7] Fernández Ananín S,Targarona EM,Martinez C,et al.Predicting the pathological features of the mesorectum before the laparoscopic approach to rectal cancer[J].Surg Endosc,2014,28(12):3458-3466.
[8] Suda K,Nakauchi M,Inaba K,et al.Minimally invasive surgery for upper gastrointestinal cancer:Our experience and review of the literature[J].World J Gastroenterol,2016,22(19):4626-4637.
[9] 张雪峰,吕赤,张成,等.手术机器人行直肠前切除并经肛门拖出直肠临床研究[J].中国实用外科杂志,2013,33(10):871-873.
[10] Park YA,Kim JM,Kim SA,et al.Totally robotic surgery for rectal cancer:from splenic flexure to pelvic floor in one setup[J].Surg Endosc,2010,24(3):715-720.
[11] Zawadzki M,Velchuru VR,Albalawi SA,et al.Is hybrid robotic laparoscopic assistance the ideal approach for restorative rectal cancer dissection?[J].Colorectal Dis,2013,15(8):1026-1032.
[12] Choi DJ,Kim SH,Lee PJ,et al.Single-stage totally robotic dissection for rectal cancer surgery:technique and short-term outcome in 50 consecutive patients[J].Dis Colon Rectum,2009,52(11):1824-1830.
[13] Koh DC,Tsang CBS,Kim SH.A new application of the four-arm standard da Vinci? surgical system:totally robotic-assisted left-sided colon or rectal resection[J].Surg Endosc,2011,25(6):1945-1952.
[14] 曾冬竹,石彦,雷晓,等.达芬奇机器人手术系统应用于直肠癌根治术101例的近期疗效观察[J].中华胃肠外科杂志,2013,16(5):451-454.
[15] Yang Y,Wang F,Zhang P,et al.Robot-assisted versus conventional laparoscopic surgery for colorectal disease,focusing on rectal cancer:a meta-analysis[J].Ann Surg Oncol,2012,19(12):3727-3736.
(英文编辑:柳悄然)
Clinical experience of laparoscopic-assisted da Vinci robotic surgical system in the treatment of rectal neoplasms:with a report of 268 cases
ZHANGCheng,GAOGuang-rong,LIDa,etal.
DepartmentofGeneralSurgery,theGeneralHospitalofShenyangMilitary,Shenyang110840,China
Objective:To investigate the feasibility,safety and short-term efficacy of hybrid method combined traditional laparoscopy with da Vinci robotic surgical system in rectal neoplasms radical operation.Methods:Retrospectively analysis was made on the clinical data of 268 patients who suffered from rectal neoplasms and underwent da Vinci robotic and laparoscopic radical operation from May 2011 to May 2016.Systematic evaluation was focused on operative procedure,operation selection,complications and short-term recovery.Results:The da Vinci robotic and laparoscopic operation was successful in 267 patients while one was converted to open procedure.The procedure included 199 anterior resections,57 abdominoperineal resections and 12 Hartmann.The mean operative time was (193±33)min,(181±37) min and (173±24) min respectively,and the mean blood loss was (27±8) ml,(36±10) ml and (29±12) ml.The mean number of harvested lymph nodes with or without preoperative neoadjuvant chemoradiotherapy was (11.2±2.8) and (15.4±4.1) respectively.The distal margin was (3.5±0.8) cm without residual cancer cells.Five patients possessed positive circumferential resection margin.Passage of first flatus was (3.0±0.8) d.The time of urinary catheter removed was (3.0±0.6) d.Anastomotic fistula (n=6),intestinal obstruction (n=10) and surgery related infection (n=12) were found without perioperative death.Conclusions:The da Vinci robotic surgical system and laparoscopy is a safe and feasible technique for radical operation of rectal cancer.
Rectal neoplasms;da Vinci robotic surgical system;Laparoscopy;Safety;Feasibility;Short-term curative effect
1009-6612(2017)07-0511-04
10.13499/j.cnki.fqjwkzz.2017.07.511
张雪峰,E-mail:cz1791@126.com
张 成(1971—)男,沈阳军区总医院普通外科主任医师,硕士研究生导师,主要从事胃肠肿瘤及创伤性休克方面的研究。
R735.3+7
A
2017-01-12)

